一种具有抗癌活性的五倍子酸衍生物及其应用的制作方法
本发明涉及一种化合物,更具体的讲涉及一种具有抗癌活性的五倍子酸衍生物及其应用。
技术背景
恶性肿瘤是目前严重威胁人类健康的一大疾病。近年来恶性肿瘤的治疗有了明显的进步,抗肿瘤药物研究经过40余年的努力已发展到一个新的阶段,其研究领域已远远超过传统的以核酸及其组成成分为靶点的细胞毒类药物。为寻找有新的作用机理及独特化学结构的细胞毒类药物人们一直在做着努力,最近人们认为治疗恶性肿瘤的药物应该是通过刺激肿瘤细胞凋亡来使其死亡,而不是象以前提出的且被广泛接受的作为一种生长抑制剂。此外,抗肿瘤药物应该对肿瘤细胞而不对正常细胞具有选择性。五倍子酸及其衍生物具有广泛的生物活性,并且对肿瘤细胞具有选择性作用,因此,其抗肿瘤作用日益受到人们的重视。
五倍子酸抗肿瘤作用机制人们做了大量的研究,得到一个共同的结论:五倍子酸抗肿瘤作用是通过诱导肿瘤细胞凋亡作用实现的。研究了五倍子酸对各种肿瘤细胞的细胞毒作用,HL-60RG,dRLh-84,Hela,PLC/PRF/5,KB的IC50分别为:5.4μg/ml,6.2μg/ml,6.1μg/ml,6.6μg/ml,和13.2μg/ml,而且细胞形态学和流式细胞术分析五倍子酸对这几种细胞均产生凋亡作用。五倍子酸在IC50为4.8~13.2μg/ml时,对原代培养的大鼠肝细胞和巨噬细胞不显细胞毒作用,对纤维母细胞和内皮细胞显示较小的细胞毒作用;当浓度超过20μg/ml时,五倍子酸与细胞dRLh-84作用6h后,细胞死亡。相关化合物结构研究显示五倍子酸的细胞毒作用不是酚类化合物所共有的,而是依赖于五倍子酸结构上特有的特征:3个相邻的酚羟基是主要的活性基团。在早幼粒细胞白血病HL-60RG的细胞培养中,五倍子酸与HL-60RG细胞接触几分钟后即增加其细胞内过氧化物水平,并且可被过氧化氢酶、超氧化物歧化酶或维生素C酸抑制。这揭示了细胞内ROS诱导了细胞凋亡。人胃癌KATOIII和人克隆腺癌COLO205细胞用五倍子酸处理后导致这两种细胞生长抑制和凋亡。五倍子酸诱导细胞凋亡的作用不依赖细胞周期,ROS的产生(如H2O2)和胞内Ca2+浓度上升可作为五倍子酸诱导细胞凋亡的共同信号,且细胞凋亡可被胞内抗氧化剂N-乙酰-L-半胱氨酸、过氧化氢酶和胞内Ca2+鳌合剂抑制。进一步的研究发现,五倍子酸使细胞内ROS呈剂量依赖性的增加,可能由胞外产生的超氧阴离子得到的H2O2内流,增加胞内H2O2水平,与胞内Ca2+一起使染色体DNA在核小体间断裂,而诱导细胞凋亡。另据报道五倍子酸诱导人口腔肿瘤细胞株HSC-2和HSG的凋亡,是以细胞核缩合,半胱氨酸蛋白酶caspase活化为特征。此外,五倍子酸具有抑制鼠肥大细胞瘤细胞P815、鼠黑色素瘤细胞B16和鼠淋巴瘤细胞L5178等转移性肿瘤细胞增殖的作用,IC50分别为6.5μg/ml,8.0μg/ml和3.6μg/ml,用50mg/kg的五倍子酸治疗静脉注射P815的DBA/2小鼠,发现小鼠肝内的肿瘤数量下降,在肝转移过程中升高的血清谷草转氨酶、谷丙转氨酶均降低,五倍子酸通过杀灭转移至肝脏的P815而抑制肥大细胞瘤的肝转移,从而延长了生存期。
五倍子酸对HL-60RG,dRLh-84,Hela,PLC/PRF/5和KB细胞的敏感性高于正常细胞(如原代培养的肝细胞、巨噬细胞、内皮细胞和纤维原细胞)。从大鼠原代培养的肝细胞和细胞浆中得到游离血清的条件培养液可阻止五倍子酸诱导的细胞凋亡,而在肝肿瘤细胞和肝癌细胞系如dRLh-84,PLL/PRF/5,HLE和HUH以及两种其它类型肿瘤细胞如Hela和KB中条件培养液和细胞浆内很少产生这种抑制活性,表明大量抑制剂的生成使正常细胞对五倍子酸不敏感。
五倍子酸在动物体内毒性实验中未见有明显的毒性作用。在急性毒性实验中,给予小鼠五倍子酸5g/kg,没有出现毒性和死亡的任何体征;在亚急性试验中,给予小鼠口服1g/kg的五倍子酸未显著改变血液学参数,且各种生化参数如SGOT,SGPT和许多血清组成如蛋白质、胆固醇、尿素和胆红素等都没有明显改变,表明五倍子酸没有蓄积毒性。另一研究给予F344大鼠含有5种浓度五倍子酸(0%,0.2%,0.6%,1.7%和5%)的食物,维持13周,研究五倍子酸的长期毒性,结果显示5%雌雄二治疗组与对照组比较,体重显著减轻。≥0.6%五倍子酸的雄性治疗组和5%五倍子酸的雌性治疗组的毒性作用包括血红蛋白浓度,血细胞比容和红细胞计数降低,网织细胞增加。5%五倍子酸治疗组组织病理学上出现脾髓外造血,血铁黄素沉积和充血,表明有溶血性贫血。此外,1.7%五倍子酸雌雄二治疗组发现大鼠肝小叶肥大,反映肝脏重量增加。目前的实验数据显示0.2%五倍子酸治疗组没有观察到不良反应。
技术实现要素:
在上述现有技术的基础上,本发明提供了一种具有抗癌活性的五倍子酸衍生物,其结构通式为:
其中R1为酸酐官能基团,R2为1,3,5-三甲基苯胺、2,4-二甲基苯胺、1-羟基苯并三唑、1-氯代苯并三唑或3-甲基吲哚官能基团中的一种。
所述R1为乙酸酐,R2为1,3,5-三甲基苯胺、2,4-二甲基苯胺、1-羟基苯并三唑、1-氯代苯并三唑、3-甲基吲哚或3-氯吲哚官能基团中的一种。
所述R1为正丁酸酐,R2为1,3,5-三甲基苯胺、2,4-二甲基苯胺、1-羟基苯并三唑、1-氯代苯并三唑、3-甲基吲哚或3-氯吲哚官能基团中的一种。
所述五倍子酸衍生物的结构式为:
所述五倍子酸衍生物的结构式为:
所述五倍子酸衍生物的结构式为:
所述五倍子酸衍生物的结构式为:
上述所述的具有抗癌活性的五倍子酸衍生物在制备治疗口腔癌药物中的应用。
本发明的有益技术效果是:本发明提供的五倍子酸衍生物对口腔癌细胞具有良好的活性,且选择性强,具有良好的临床应用价值。
附图说明
图1五倍子酸衍生物A的ESI-MS图谱;
图2五倍子酸衍生物B的ESI-MS图谱;
图3五倍子酸衍生物C的ESI-MS图谱;
图4五倍子酸衍生物D的ESI-MS图谱。
具体实施方式
实施例1反应中间体的制备
NaOH(13.2g,330mMol)分批加入300ml水中,磁力搅拌直到NaOH溶解,冰浴降温至0℃。五倍子酸(14.1g,75mMol)分批加入NaOH水溶液中,溶解之后,搅拌半小时,反应液体颜色加深变成深褐色。0℃下用恒压滴液漏斗,滴加醋酸酐(60ml,634mMol),醋酸酐在1个小时内滴加完毕之后,0℃下保温反应一小时,然后反应自然回复到室温,溶液颜色变浅,出现白色固体。用布氏漏斗过滤,固体用少量水洗一次。滤液用乙酸乙酯(3次100ml)萃取,有机相合并用无水硫酸钠干燥。有机相用旋转蒸发仪浓缩得到固体与前述过滤的固体合并,用200ml乙醇重结晶得到中间体1(15.2g,收率68%)。反应式如下:
NaOH(13.2g,330mMol)分批加入400ml水中,磁力搅拌直到NaOH溶解,冰浴降温至0℃。五倍子酸(14.1g,75mMol)分批加入NaOH水溶液中,溶解之后,搅拌半小时,反应液体颜色加深变成深褐色。0℃下用恒压滴液漏斗,滴加正丁酸酐(104ml,640mMol)),正丁酸酐一小时内滴加完毕之后,0℃下反应一小时,然后反应自然回复到室温,溶液颜色变浅,出现白色固体。用布氏漏斗过滤,固体用少量水洗一次。滤液用乙酸乙酯(3次100ml)萃取,有机相合并用无水硫酸钠干燥。有机相用旋转蒸发仪浓缩得到固体与前述过滤的固体合并,用200ml乙醇重结晶得到纯品的中间体2(17.1g,收率60%)。反应式如下:
实施例2五倍子酸衍生物的制备
将实施例1中的中间体1(3mMol)溶于30mlTHF中,分别加入3.3mMol的HOBT,3.3mMol的EDCI,3.3mMol的三乙胺,3.3mMol的2,4-二甲基苯胺,室温下搅拌15分钟之后,升温至50℃搅拌过夜。将反应液倾倒入含有150ml纯净水烧杯中。分液,水相加入乙酸乙酯50ml萃取三次。合并有机相,用无水硫酸钠干燥。有机相用旋转蒸发仪浓缩得到的粗品上层析柱,洗脱液浓度(乙酸乙酯:石油醚=1:4-6)梯度洗脱,五倍子酸衍生物A纯品0.51g(收率42%)。具体方式如下:
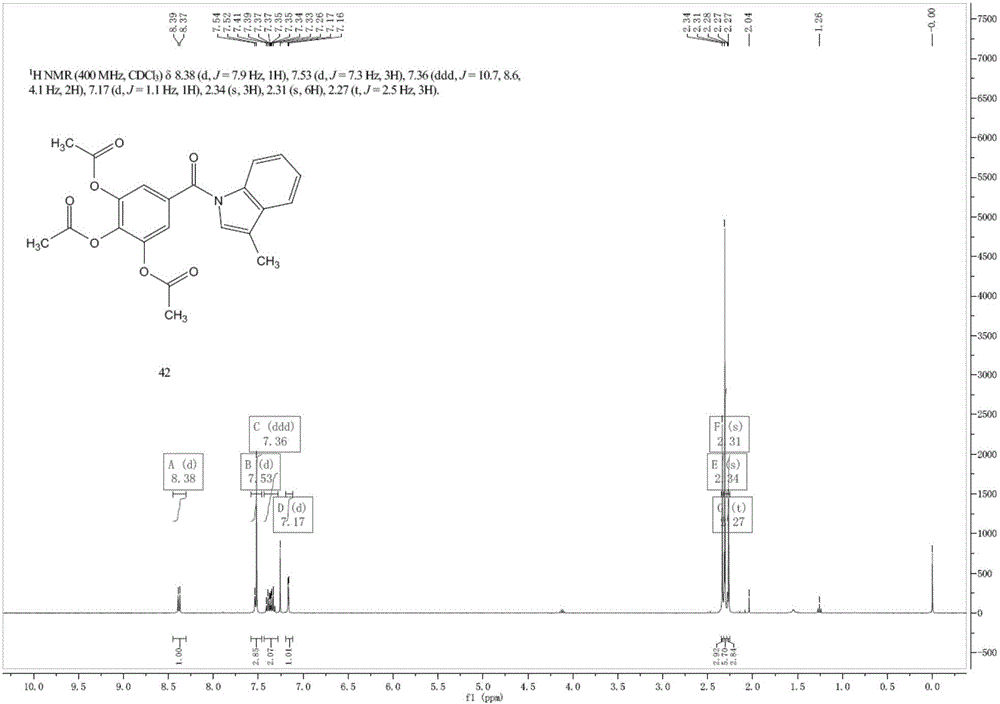
将实施例1中的中间体1(3mMol)溶于30mlTHF中,分别加入3.3mMol的HOBT,3.3mMol的EDCI,3.3mMol的三乙胺,3.3mMol的3-甲基吲哚原料,室温下搅拌15分钟之后,升温至50℃搅拌过夜。将反应液倾倒入含有150ml纯净水烧杯中。分液,水相加入乙酸乙酯50ml萃取三次。合并有机相,用无水硫酸钠干燥。有机相用旋转蒸发仪浓缩得到的粗品上层析柱,洗脱液浓度(乙酸乙酯:石油醚=1:4-6)梯度洗脱,得到0.60g五倍子酸衍生物B纯品(收率48.9%)。其反应式如下:
将实施例1中的中间体1(3mMol)溶于30mlTHF中,分别加入3.3mMol的HOBT,3.3mMol的EDCI,3.3mMol的三乙胺,3.3mMol的3-氯吲哚原料,室温下搅拌15分钟之后,升温至50℃搅拌过夜。将反应液倾倒入含有150ml纯净水烧杯中。分液,水相加入乙酸乙酯50ml萃取三次。合并有机相,用无水硫酸钠干燥。有机相用旋转蒸发仪浓缩得到的粗品上层析柱,洗脱液浓度(乙酸乙酯:石油醚=1-6:1-4)梯度洗脱,得到0.45g五倍子酸衍生物C(收率35.0%)纯品。其反应式如下:
将实施例1中的中间体2(3mMol)溶于30mlTHF中,分别加入3.3mMol的HOBT,3.3mMol的EDCI,3.3mMol的三乙胺,3.3mMol的原料,室温下搅拌15分钟之后,升温至50℃搅拌过夜。将反应液倾倒入含有150ml纯净水烧杯中。分液,水相加入乙酸乙酯50ml萃取三次。合并有机相,用无水硫酸钠干燥。有机相用旋转蒸发仪浓缩得到的粗品上层析柱,洗脱液浓度(乙酸乙酯:石油醚=1:4-6)梯度洗脱,得到0.81g五倍子酸衍生物D纯品(收率54.3%)。其反应式如下:
将上述合成获得的四种五倍子酸衍生物进行ESI-MS化学结构分析,具体如表1所述:
表1五倍子酸衍生物化合物结构分析
实施例3五倍子酸衍生物的活性考察
分别将口腔鳞癌细胞SCC-15、口腔鳞癌细胞CAL-27和口腔癌前病变细胞DOK株在37℃、5%CO2及饱和湿度环境下,含10%胎牛血清、100万单位青霉素、80万单位链霉素的RPMI 1640完全培养液中培养、传代(必要时冻存)。接种时以胰酶消化液(0.25%)消化,加细胞培养液吹打成单细胞悬液。细胞均按5-10×104细胞/ml接种,培养过夜后,加入活性物质,隔天换液。以95%乙醇处理的癌细胞及未经处理的癌细胞作为对照。
分别将口腔鳞癌细胞SCC-15、口腔鳞癌细胞CAL-27和口腔癌前病变细胞DOK接种于96孔培养板。分别加五倍子酸衍生物A、B、C、D及五倍子酸处理后,间隔一定时间,取出培养板,去除培养液,洗涤2-3次,每孔加100μl 0.2mg/ml MTT 37℃温育4h,去除MTT液,加200μl碱化DMSO(10%甘氨酸-NaOH缓冲液)37℃温育1h,并振荡,于酶标仪上570nm测定OD值。每次试验安排3孔,取平均值。试验重复3次以上,结果基本一致。
依照MTT法操作步骤,在同1块96孔板上将五倍子酸衍生物A、B、C、D及五倍子酸等5种活性物质按4种浓度作用于口腔鳞癌细胞SCC-15。培养板中,每1行都代表1种活性物质;每3列代表同1种浓度,从左向右依次为0.1、0.5、1.0和1.5mg/ml。依据MTT法作用原理,颜色的深浅可以反映出活细胞的多少,即颜色越深代表孔内活细胞越多,即活性物质对细胞的抑制率越低。因此,五倍子酸衍生物B和五倍子酸衍生物D对细胞生长具有明显的抑制作用(参见表2所示)。
参照上述方法,在同1块96孔板上将五倍子酸衍生物A、B、C、D及五倍子酸等5种活性物质按4种浓度作用于口腔鳞癌细胞CAL-27。五倍子酸衍生物C对细胞生长具有明显的抑制作用(参见表2所示)。
参照上述方法,在同1块96孔板上将五倍子酸衍生物A、B、C、D及五倍子酸等5种活性物质按4种浓度作用于口腔癌前病变细胞DOK。五倍子酸衍生物A对细胞生长具有明显的抑制作用(参见表2所示)。
表2 MTT法测定4种活性物质对癌细胞的作用
- 还没有人留言评论。精彩留言会获得点赞!