一种冻存外周血单个核细胞的高效复苏方法与流程
本发明涉及细胞冻存液技术领域,具体涉及一种冻存外周血单个核细胞的高效复苏方法。
背景技术:
免疫细胞(immune cell)是白细胞的俗称,包括淋巴细胞和各种吞噬细胞等,也特指能识别抗原、产生特异性免疫应答的淋巴细胞等。淋巴细胞是免疫系统的基本成分,在体内分布很广泛,主要是T淋巴细胞、B淋巴细胞受抗原刺激而被活化(activation),分裂、增殖、发生特异性免疫应答。T淋巴细胞是一个多功能的细胞群。除T淋巴细胞和B淋巴细胞外,还有一种淋巴细胞为自然杀伤细胞(natural killer cells,NK)。除淋巴细胞外,参与免疫应答的细胞还有浆细胞、粒细胞、肥大细胞、抗原呈递细胞及单核吞噬细胞系统的细胞。
外周血单个核细胞(peripheralblood mononuclear cell,PBMNC),即外周血中具有单个核的细胞,包括淋巴细胞、树突状细胞和其它少量细胞(造血干细胞等)。PBMNC是将白细胞进一步提取的、具有分化为更强大效应细胞的一部分。通过特定因子的诱导,PBMNC在体外可以分化为多种免疫细胞,如现在广泛应用于生物治疗的细胞因子诱导的杀伤细胞(cytokine induced killer,CIK),树突状细胞(dendritic cells,DCs)和自然杀伤细胞(NK)等细胞。
恶性肿瘤是一类严重危害人类健康的常见病、多发病。据世界卫生组织报告,每年全球癌症新发病例1000多万,死亡700多万,占总死亡人数的12%。我国恶性肿瘤的发病率亦是逐年上升,病死率居高不下,因此寻找一种能够有效治疗癌症、改善患者生活质量的治疗方法迫在眉睫。
肿瘤免疫治疗是一种新兴的肿瘤治疗模式,是依靠自身免疫抗癌的新型治疗方法。免疫系统是人体的防御体系,一方面发挥着清除细菌、病毒、外来异物的功能,另一方面消除体内衰老细胞以及发生突变的细胞。机体免疫系统和癌细胞相互作用的结果决定了癌症的最终演变。对于健康的人来说,其免疫系统的强大足以及时清除突变的癌细胞。但对于肿瘤病人来说,普遍存在免疫系统低下,不能有效地识别、杀灭癌症细胞;另一方面,癌症细胞大量增殖,会进一步抑制患者的免疫功能,而且,癌症细胞有多种机制来逃脱免疫细胞的识别与杀伤。
肿瘤的免疫治疗就是借助分子生物学技术和细胞工程技术,提高肿瘤组织的免疫原性,给机体补充足够数量的功能正常的免疫细胞和相关分子,激发和增强机体抗瘤免疫应答,提高肿瘤组织对机体抗肿瘤免疫效应的敏感性,在体内、外诱导肿瘤特异性和非特异性效应细胞和分子,达到最终清除肿瘤的目的。肿瘤免疫治疗是继手术、放疗和化疗之后的第四种肿瘤治疗方法。早在1985年,美国国家癌症中心就把肿瘤免疫治疗列为肿瘤综合治疗的第四大治疗模式。
2009年,我国卫生部正式将“自体免疫细胞治疗”纳入“第三类医疗技术”目录。
从1982年美国国立癌症研究院Steve Rosenberg团队采用过继性免疫淋巴因子活化的杀伤细胞治疗(LAK),到1991年自斯坦福大学发展出目前在我国肿瘤免疫治疗中广泛应用的细胞因子诱导的杀伤细胞治疗(CIK),有关肿瘤的免疫细胞治疗的临床探索经历了漫长的过程。然而这些传统的疗法对卵巢癌、结肠癌、乳腺癌等大多数肿瘤的治疗均未取得令人满意的疗效。其缺点是治疗的靶向性不够,疗效有待提高。随着肿瘤免疫学的发展,树突状细胞(Dendritic cell,DC)作为肿瘤治疗手段受到了越来越多的关注并被寄予厚望。DC是1973年Steinman和Cohn在小鼠脾脏发现的具有树枝状突起的独特形态细胞,并将之命名为树突状细胞。DC是连接先天性免疫和获得性免疫的桥梁,是人体内最活跃、功能最强的专职抗原递呈细胞(antigen presenting cells,APC),具有抗原提呈和激活初始型T细胞的功能。研究发现肿瘤抗原致敏DC再回输机体能刺激宿主免疫系统产生抗肿瘤免疫应答,因此负载肿瘤抗原的DC疫苗被认为是最具潜能的一种肿瘤免疫治疗手段。特别是2010年4月美国FDA批准了第一个自体细胞免疫治疗药物Sipuleucel-T,才出现了治疗性肿瘤疫苗的重大突破,此疫苗的批准极大地激励了DC疫苗的进一步开发。
目前,国内免疫学细胞治疗大多用患者患病后提取的免疫细胞,患者患病后的免疫细胞活性和扩增能力肯定比健康时的要差,治疗效果势必受到影响;健康人的免疫力逐年递减,因此,储存免疫细胞及保证免疫细胞复苏之后细胞活性、细胞生物功能尤为重要。
细胞冻存是细胞长期保存的主要方法之一。针对目前的健康人群提供了一项“免疫细胞生命银行”的保障,以及未来肿瘤免疫治疗过程中,有效错开放化疗疗程进行免疫细胞收集、储存、复苏与培养。利用冻存技术将细胞置于-196℃液氮中低温保存,可以使细胞暂时脱离生长状态而将其细胞特性保存起来,这样在需要的时候再复苏细胞用于实验。而且适度地保存一定量的细胞,可以防止因正在培养的细胞被污染或其他意外事件而使细胞丢种,起到了细胞保种的作用。
免疫细胞的复苏,直接影响后期免疫细胞的活率及生物活性。为了解决现有冻存复苏过程中水浴锅使用、PBMNC复苏后活率较低、复苏后细胞扩增能力不足、生物学功能(如有效杀伤细胞群体数目偏低、体外杀伤效力较低)不佳等技术问题特提出本发明。
技术实现要素:
为克服上述现有技术缺陷,本发明首先提供一种冻存外周血单个核细胞的复苏溶液,其组分包括AIM-V培养基、血清、Nuclease ultrapure,所述复苏溶液中血清的体积分数为5-20%,Nuclease ultrapure的含量为0.1-1U/mL;余量为AIM-V培养基。
优选地,所述复苏溶液中血清的体积分数为10%,和/或,所述复苏溶液中Nuclease ultrapure的含量为0.2U/mL。
所述AIM-V培养基、Nuclease ultrapure均为商品化产品,分别由GIBCO公司、Sigma公司提供。
所述血清优选为自体血清、胎牛血清、AB血清、血清替代物等中的一种,优选为自体血清。
当选择自体血清时,该自体血清可在分离PBMNC过程中制备。通常当制备冻存外周血单个核细胞时该自体血清作为废弃物处理。本发明将该自体血清作为上述复苏溶液的有效组分,既废物利用降低了成本,又减少了环境污染。因而,本发明采用自体血清具备实用性。
采用自体血清的另一个优点是:避免使用外源动物源性血清,减少后续治疗中潜在的过敏原的存在风险。
本发明还包括上述复苏溶液在冻存外周血单个核细胞的复苏中的应用。
本发明还提供一种冻存外周血单个核细胞的复苏方法,包括以下步骤:
1)将冻存的外周血单个核细胞转移至-80℃的冻存盒中,平衡0.5-5min后,再转入金属浴中融化细胞,所述金属浴温度为37-42℃;
2)将融化后的细胞转移至上述复苏溶液中洗涤至少2次,离心收集细胞。
上述复苏方法还包括将离心收集所得细胞检测细胞活率、细胞表型(可用FACS流式检测仪),检测细胞增殖倍数(将细胞重悬于含有质量分数为5%-10%自体血清的培养体系中培养)等常规操作步骤。
本发明所述冻存的外周血单个核细胞可按现有常规方法制备,本发明不做特别限定。
具体地,本发明还提供上述冻存的外周血单个核细胞的制备方法,包括以下步骤:
1)对获得的外周血单个核细胞进行清洗,纯化;所述外周血单个核细胞可采集自成人外周静脉血;
2)用冻存液重悬外周血单个核细胞,获得细胞悬液,使细胞含量达到2~3×107个/mL;
3)将步骤2)所得细胞悬液分装;例如分装至1.8mL冻存管中,每管装量1mL;
4)将分装后的细胞悬液留样待检,将分装后的其余细胞悬液(细胞冻存管)放入4℃预温的程序降温盒中,转移到-80℃冰箱暂时储存;
5)待留样的细胞悬液检测合格后,将步骤4)暂时储存的细胞悬液(细胞冻存管)冻存入库,长期保存。
所述细胞悬液的检测指标包括细菌、真菌、内毒素和支原体等。
在冻存的外周血单个核细胞的复苏时,若使用传统水浴方法会有污染风险。本发明采用金属浴,并严格控制金属浴温度和时间,既可以极大的降低污染风险,又因金属微珠的良好的导温效果,可加快冻存物品的快速平衡与升温,提高复苏效率。
在冻存的外周血单个核细胞的复苏过程中,伴随细胞的复苏细胞内各种酶开始行使功能。本发明应用Nuclease ultrapure可以消化、抑制消减复苏过程中恢复的各类DNA酶,保持细胞的原始性质,便于后期PBMNC应用于免疫细胞培养的定向分化。
采用本发明复苏溶液细胞复苏存活率高达90%以上。采用本发明方法冻存超过2000万个种类完整的免疫细胞,包含树突状细胞、自然杀伤(NK)细胞及T细胞等,可有效应用于多种免疫细胞疗法并可供多次治疗使用。储存及后期复苏培养过程中没有任何动物源血清或蛋白的添加,保障了临床应用的安全性及稳定性,大大降低应用后的副反应发生情况。
附图说明
图1为实验例成人PBMNC提取效率图;
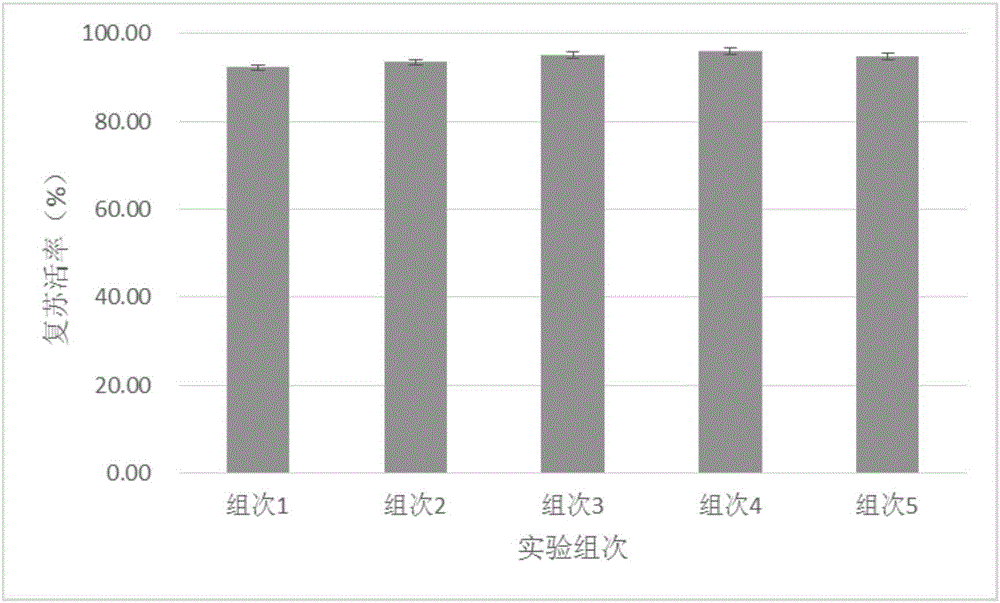
图2实验例成人PBMNC复苏活率图;
图3为实验例CIK诱导培养扩增倍数图;
图4为实验例CIK细胞体外杀瘤性实验图。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件,或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可通过正规渠道商购买得到的常规产品。
以下所述AIM-V培养基、Nuclease ultrapure均为商品化产品,分别由GIBCO公司、Sigma公司提供。以下实施例1-3所述自体血清由实验例所述方法制备。
实施例1
一种冻存外周血单个核细胞的复苏溶液,其组分包括AIM-V培养基、自体血清、Nuclease ultrapure,所述复苏溶液中血清的体积分数为10%,Nuclease ultrapure的含量为0.2U/mL;余量为AIM-V培养基。
实施例2
一种冻存外周血单个核细胞的复苏溶液,其组分包括AIM-V培养基、自体血清、Nuclease ultrapure,所述复苏溶液中血清的体积分数为5%,Nuclease ultrapure的含量为0.1U/mL;余量为AIM-V培养基。
实施例3
一种冻存外周血单个核细胞的复苏溶液,其组分包括AIM-V培养基、自体血清、Nuclease ultrapure,所述复苏溶液中血清的体积分数为20%,Nuclease ultrapure的含量为1U/mL;余量为AIM-V培养基。
实施例1-3所述复苏溶液的制备方法包括将各组分按配比混匀即可。
实施例4
一种冻存外周血单个核细胞的复苏方法,包括以下步骤:
一、对采集到的成人外周静脉血进行分离纯化,获得外周血单个核细胞;同时收集血清,即自体血清;
二、对得到的外周血单个核细胞进行清洗,纯化;
三、用冻存液重悬外周血单个核细胞进行稀释,使细胞悬液中细胞含量达到2~3×107个/mL;
四、将稀释后的细胞悬液分装至1.8mL冻存管中,每管添加1mL,并留样待检,将细胞冻存管放入4℃预温的程序降温盒中,转移到-80℃冰箱暂时储存;
五、预留的冻存细胞悬液进行细菌、真菌、内毒素和支原体等指标的检测,指标检测合格后,冻存入库做长期保存;
六、复苏时,将从冻存入库中取出的细胞转入预温至-80℃的冻存盒内后,平衡5min转入37℃金属浴融化;
七、将融化后的细胞转移至实施例1制备的复苏溶液中洗涤,检测细胞活率,之后将细胞重悬于含有质量分数10%自体血清的AIM-V培养体系中接种培养,即完成所述的长期储存成人外周血单个核细胞的复苏。
实施例5
本实施例与实施例4不同的是:步骤一中获得外周血单个核细胞之后留存的血清,56℃金属浴灭活30分钟,离心收集血浆上清液,每10mL分装一支,-80℃保存,备用;
实施例6
本实施例与实施例4不同的是:步骤二中对得到的外周血单个核细胞进行清洗,纯化的具体操作如下:用AIM-V溶液洗涤单个核细胞两次,收集最后一次洗涤的上清液,并进行细菌、真菌、支原体和内毒素检测,检测合格后,离心收集的细胞待用。其它与实施例4相同。
实施例7
本实施例与实施例4不同的是:步骤三中的冻存液配制如下:按细胞无血清培养基AIM-V、人自体血清和DMSO(二甲基亚砜)的体积比为8:1:1的比例混合而成。其它与实施例4相同。
实施例8
本实施例与实施例4不同的是:冻存液中的人自体血清质量分数至少为10%。其它与具体实施例4相同。
实施例9
本实施例与实施例4不同的是:步骤五中指标检测合格是指:细菌、真菌、支原体检测皆为阴性,内毒素含量不高于0.25EU/mL。其它与实施例4相同。
实施例10
本实施例与实施例4不同的是:该方法所用试剂为药用或GMP级别。其它与实施例4相同。
实施例11
本实施例与实施例4不同的是:步骤七中无血清培养体系中含有单克隆抗体和细胞因子;其中,单克隆抗体的在无血清培养体系中的浓度为500ng/mL。其它与实施例4相同。
实施例12
本实施例与实施例4不同的是:步骤七中无血清培养体系中细胞因子浓度:400-1000IU/mlGM-CSF、100~4000IU/mlIL-2、800-1000IU/mlIL-4、0.2~2ng/mlIL-12、500~2000IU/mlIFN-γ、100~1000ng/ml anti-CD3-McAb中的一种或多种任意比混合。其它与实施例11相同。
实施例13
本实施例与实施例4不同的是:步骤七中无血清培养体系中细胞因子浓度:100~1000ng/ml anti-CD3-McAb、500~2000IU/mlIFN-γ、0.5~4ng/mlIL-1α、1000~4000IU/mlIL-2和按任意比混合。其它与实施例4相同。
本发明内容不仅限于上述各实施例的内容,其中一个或几个具体实施例的组合同样也可以实现发明的目的。
通过以下例实验例验证本发明的效果:
1.PBMNC提取与自体血清获取:
自体血清获取:
1.1将成人外周静脉全血转移至50ml离心管,每管25ml。
1.2室温1800rpm,离心8分钟。
1.3取上层血浆至50ml离心管,灭活(56℃金属浴30min)。
1.4 4℃放置30min。
1.5 2800rpm离心8min,收集上清即血清,分装于3支15ml离心管中,一支4℃保存待用,两支-20℃保存备用。
提取PBMNC,即采用淋巴细胞分离液分离血细胞中的单个核细胞,并收集单个核细胞,包括以下步骤:
1.6按生理盐水:血细胞=1.5:1对已提取血浆的样本进行稀释,混匀。
1.7将稀释样本缓慢加在Ficoll(淋巴细胞分离液)液面上(方法:将离心管倾斜45°,在Ficoll液面上1cm处,缓慢注入稀释的血细胞,不要打乱液面界面),加入后终体积不超过45ml,室温2000rpm,20min。1.8用巴氏滴管缓慢提取Ficoll层与血浆层交界处白膜层细胞,按照二个离心管对应一个离心管进行漂洗的原则,将提取的白膜层细胞装入50ml离心管中。补充生理盐水至45ml,混匀,1600rpm,5min。
1.9弃上清,用生理盐水重悬,收集于一个50ml离心管中,补充生理盐水至45ml。1200rpm,10min。
1.10弃上清,再次添加生理盐水重悬至45mL,混匀,取0.5ml中层悬液至1.5mlEP管中计数,1000rpm,10min,即得PBMNC。
1.11计算PBMNC提取效率,结果见图1(成人PBMNC提取效率图)。
2.PBMNC冻存:
2.1细胞冻存液配方:按照细胞无血清培养基AIM-V培养基、人自体血清和DMSO(二甲基亚砜)体积比8:1:1的比例混合而成;
2.2冻存步骤:用配置好的细胞冻存液将收集的PBMNC混合均匀,并调整细胞浓度为2~3×107个/ml;
将细胞悬液分装到1.8ml冻存管中,并抽样进行病毒、细菌、真菌、支原体和内毒素检测,将细胞冻存管放入程序降温盒,-80℃暂时保存。待所有监测结果合格后,将细胞入库,封存在液氮中做长期保存。
3.PBMNC复苏:
3.1将液氮中取出的冻存管转入预温至-80℃的冻存盒内后,平衡5min后,快速转移至37℃-42℃金属浴锅中融化细胞;
3.2将融化后的细胞悬液转移至离心管中,并添加实施例1制备的复苏溶液,离心收集细胞,共进行两次清洗;
3.3复苏之后的细胞,进行细胞活力检测。结果见图2(成人PBMNC复苏活率图);
4.PBMNC复苏之后生物功能检测:包括培养为CIK细胞,检测扩增倍数,CIK培养之后流式检测效应细胞表面marker表达、体外杀伤活性的检测。
4.1CIK培养:用CIK培养基重悬细胞,并吹打均匀,使细胞充分分散开,接种于培养瓶中,并添加人自体血浆上清,使血浆浓度达到5%,并添加干扰素γ,使其终浓度为4000IU/ml;
CIK培养基成分:AIM-V培养基、“5%-10%自体血清”、400-1000IU/mL GM-CSF、100~4000IU/mL IL-2、800-1000IU/mL IL-4、0.2~2ng/mL IL-12、500~2000IU/mL IFN-γ、100~1000ng/mL anti-CD3-McAb。
接种24小时后,添加抗CD3抗体,使其终浓度为5μg/ml,添加白介素2,使其终浓度为2000IU/ml;
根据培养情况随时添加培养基(白介素2,1000IU/ml,自体血浆1%);
培养14天后收获细胞分别进行流式、细菌、真菌、革兰氏、支原体和内毒素检测。
CIK扩增倍数结果见图3(CIK诱导培养扩增倍数图);
CIK流式检测效应细胞结果见表1;
表1成人PBMNC复苏CIK培养流式检测结果
4.2CIK细胞体外杀伤效力检测(MTT法检测体外杀瘤实验):
体外杀瘤性实验的靶细胞为HepG2。HepG2的培养条件为10%FBS的RPMI-1640培养基,37℃,5%CO2。从本实验例“2.PBMNC冻存”中冻存的四个批次的样本中随机选取10组细胞,按照实验例“3.PBMNC复苏”、“4.1CIK培养”所述实验方法进行复苏和CIK的诱导培养,组别分别标记为1-10。将HepG2接种于96孔板中,每孔接种细胞5×103个。待HepG2完全贴壁后,取培养成熟的CIK,并离心获得细胞,采用10%FBS的RPMI-1640培养基将细胞沉淀重悬,并调整细胞密度为5×104(效应细胞:靶细胞为20:1)个/ml,每个组别选择5个孔,并做好标注,弃掉其中的培养基,添加重悬好的CIK细胞悬液,每孔添加200μl。并在6h采用MTT测其吸光值(OD570nm),并按照下述公式计算其杀瘤性:
杀伤率=[(空白组OD值-实验组OD值)/空白组OD值]×100%。
体外杀瘤性结果见图4(CIK细胞体外杀瘤性实验图)。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!