miRNA‑155及其抑制剂在DC‑CIK细胞培养方面的应用的制作方法
本发明属于免疫领域,涉及DC-CIK细胞的培养,具体涉及miRNA-155及其抑制剂在DC-CIK细胞培养方面的应用。
背景技术:
生物免疫疗法是通过从体外补充、诱导或活化机体内本来固有的生物应答调节系统,活化和调动具有细胞毒活性的生物活性细胞和细胞因子,以调整各种免疫杀伤性的生物反应。目前在免疫治疗方面研究应用较多的有淋巴因子激活的杀伤细胞、肿瘤浸润淋巴细胞、细胞因子诱导的杀伤(CIK)细胞、树突状细胞(DC)、共培养免疫(DC-CIK)细胞、自然杀伤细胞型的淋巴细胞,其中DC和CIK细胞是肿瘤免疫治疗的两个重要部分,它们之间的相互作用所诱发的免疫应答是免疫抑瘤效应的中心环节[王志华等,CIK细胞治疗癌症:国际临床试验的现状及展望,中国肿瘤生物治疗杂志,2013,20(2):129-137]。
DC首先在小鼠脾脏中发现,因其成熟时细胞表面伸出膜状或刺状突起而得名。DC的前体细胞为CD34+或CD14+细胞,存在于人骨髓、脐血中的CD34+或CD14+细胞,体外添加粒细胞-单核细胞集落刺激因子和肿瘤坏死因子α的培养条件下可发育成DC,DC主要分为髓系DC和淋巴系DC,髓系DC包括CD34+干细胞来源的DC、单核细胞衍生的DC等。DC是目前发现的功能最强的抗原呈递细胞,表面具有丰富的有助于抗原呈递的分子,如主要组织相容性复合体Ⅰ、Ⅱ,共刺激分子B7-1、B7-2,细胞黏附分子1、3以及淋巴细胞功能相关抗原1、3等,能有效激活初始T细胞,引发机体长生抗肿瘤免疫反应。
CIK是将人外周血单核细胞在体外用多种细胞因子共同培养一段时间后获得的一群对肿瘤细胞有高度杀伤能力且具有不同细胞表型的异质细胞。其中CD3+CD56+细胞是CIK细胞群体中的主要效应细胞,被称为自然杀伤细胞型淋巴细胞,兼有T淋巴细胞强大的抗瘤活性和自然杀伤细胞的非主要组织相容性复合体限制性杀瘤优点。因此,CIK细胞对多种不同组织来源的肿瘤细胞均有杀伤作用。体外试验结果表明,患者自身来源的CIK抗肿瘤活性明显强于自体淋巴细胞激活的杀伤细胞,动物体内实验结果也表明CIK对BALB/c裸鼠负荷的BEL-7402肝癌生长的平均抑制率明显高于杀伤细胞。
虽然目前大量研究显示DC、DC瘤苗、CIK细胞有显著的抗肿瘤作用,但是临床应用发现单独应用DC、CIK细胞治疗肿瘤效果并不是很理想,肿瘤细胞对这些免疫效应细胞发生抵抗导致过继免疫疗效不佳。DC和CIK是肿瘤免疫治疗的两部分,DC识别病原,激活获得性免疫系统,而CIK通过发挥自身细胞毒性与分泌细胞因子杀伤肿瘤细胞。因此,设想可将CIK细胞和DC联合起来治疗恶性肿瘤,从而发挥协同抗肿瘤作用。实验研究还证实,DC-CIK共培养后其抗肿瘤活性明显高于单纯CIK。
技术实现要素:
本发明首先提供miRNA-155作为药物靶标在提高DC细胞共培养增强的CIK细胞对肿瘤细胞的杀伤力中的应用;其次提供miRNA-155抑制剂或含有该抑制剂的试剂或试剂盒在提高DC细胞共培养增强的CIK细胞对肿瘤细胞的杀伤力中的应用,并提供太子参环肽B和太子参环肽C作为有效miRNA-155抑制剂。
本发明通过如下技术方案得以实现:
miRNA-155作为药物靶标在提高DC细胞共培养增强的CIK细胞对肿瘤细胞的杀伤力中的应用。
所述的应用指利用miRNA-155表达下调的DC细胞与CIK细胞共培养提高CIK细胞对肿瘤细胞的杀伤力。
进一步地,所述肿瘤细胞为白血病细胞。
miRNA-155抑制剂在提高DC细胞共培养增强的CIK细胞对肿瘤细胞的杀伤力中的应用。
进一步地,所述miRNA-155抑制剂为太子参环肽B。
进一步地,所述miRNA-155抑制剂为太子参环肽C。
一种含有miRNA-155抑制剂的试剂或试剂盒在提高DC细胞共培养增强的CIK细胞对肿瘤细胞的杀伤力中的应用。
进一步地,所述miRNA-155抑制剂为太子参环肽B。
进一步地,所述miRNA-155抑制剂为太子参环肽C。
本发明优点:
本发明发现,miRNA-155下调表达的DC-CIK细胞比miRNA-155正常表达的DC-CIK细胞具有更高的杀伤力,而miRNA-155下调表达的DC细胞与miRNA-155正常表达的DC细胞的杀伤力基本一致,无显著性差异。这表明,miRNA-155下调并不能直接提高DC细胞对白血病细胞的杀伤力,但是miRNA-155下调的DC细胞可以通过共培养显著增强CIK细胞对肿瘤细胞的杀伤力。因此,miRNA-155可以作为药物靶标用于提高DC细胞共培养增强的CIK细胞对肿瘤细胞的杀伤力。本发明提供了两种天然化合物作为miRNA-155有效抑制剂,天然化合物来源比合成的核苷酸类siRNA具有更高的化学稳定性。
附图说明
图1为抑制组、对照组和阴性对照组DC细胞miRNA-155的相对表达量;
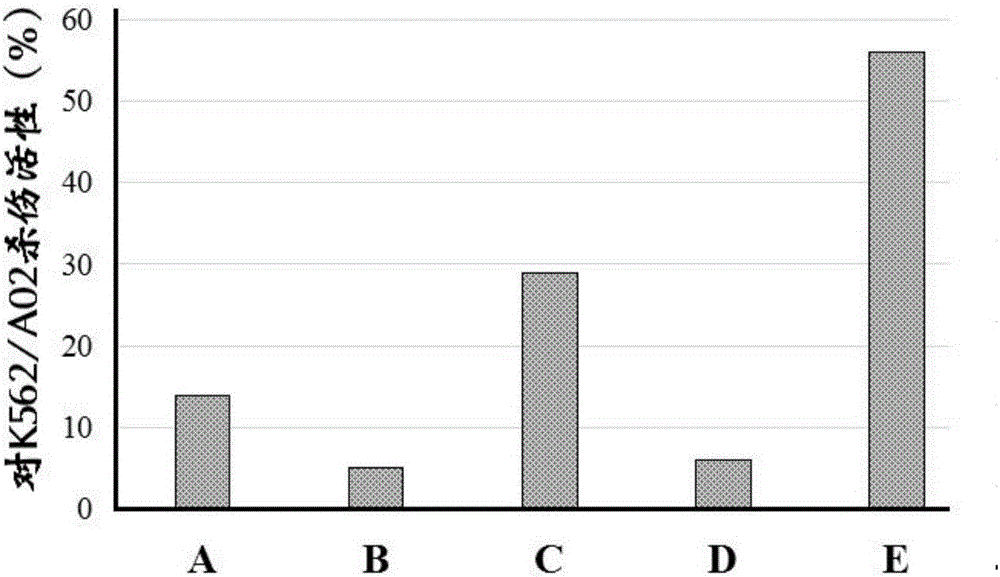
图2为不同组效应细胞对白血病K562/A02细胞系的杀伤活性;
图3为不同组效应细胞对白血病THP-1细胞系的杀伤活性;
图4为不同组效应细胞对白血病HL-60细胞系的杀伤活性。
具体实施方式
为了更好地解释本发明的技术方案,下面结合具体实施例进一步介绍。实施例中未特别强调的实验材料均为常规实验材料,属于本领域技术人员易于获得的范畴。
实施例1:miRNA-155对DC-CIK细胞共培养的影响
一、实验材料
1、miRNA-155 inhibitor由上海吉玛制药技术有限公司提供(如下序列1);inhibitor negative control由上海吉玛制药技术有限公司提供(如下序列2)。
序列1:5’-ACCCCUAUCACGAUUAGCAUUAA-3’;
序列2:5’-CAGUACUUUUGUGUAGUACAA-3’。
2、肿瘤细胞为白血病细胞,包括K562/A02、THP-1及HL-60细胞。
二、实验方法
1、效应细胞DC与CIK的分离培养
(1)单个核细胞的分离:采集健康志愿者外周血20mL,预冷的PBS 1:1稀释,缓慢加入淋巴细胞分离液上层,650g,4℃离心20min,收集白色细胞层,分离单个核细胞,1640培养基重悬细胞后置于37℃,5%CO2孵箱中孵育2h。
(2)DC细胞的培养:单个核细胞培养2h后收集贴壁细胞,在完全培养基(1640+10%FBS)中添加GM-CSF(1000U/mL)、IL-4(1000U/mL)诱导DC生成,于37℃,5%CO2孵育箱中培养,每2天半量换液一次,换液后补充GM-CSF、IL-4,于第6d在培养基中添加TNF-α诱导DC成熟(100ng/mL),连续培养7d,收集细胞备用。
(3)CIK细胞的培养:收集单核细胞中的悬浮细胞,调整细胞密度至1×106/ml,在完全培养基(1640+10%FBS)中加入INF-γ(1000U/mL),并于24h后添加IL-2(300U/mL)、IL-1α(l00U/mL)和抗人CD3单抗(50μg/mL)。每2-3d进行换液,并补充等量的细胞因子,连续培养7天,收集细胞备用。
2、效应细胞DC的转染
转染试剂为美国Invitrogen公司生产的lipofectamine2000,严格按照使用说明操作。
(1)传细胞培养板:以6孔板为例,转染前一天,按1×106/ml密度接种DC细胞于6孔板,每孔加2ml培养基,使转染时贴壁细胞密度达60%。
(2)用DEPC水稀释miRNA-155 inhibitor或inhibitor negative control(NC),配制终浓度为20μM的存储液,分装使用。
(3)配制混合液:
miRNA-155 inhibitor或NC混合液:取10μl上述存储液,用opti-MEM稀释,轻轻混匀,配制250μl稀释液A;lipofectamine2000稀释液:取5μl lipofectamine2000,用opti-MEM稀释,轻轻混匀,配制250μl稀释液B。
(4)稀释液A和稀释液B室温孵育5分钟后,将二者轻轻混匀,室温孵育20分钟,配制总体积为500μl的稀释液C。
(5)将6孔板内原培养基吸去,PBS冲洗1次后吸去,每孔加入1.5ml opti-MEM。将稀释液C加入每孔,使得每孔液体总体积为2ml,miRNA-155 inhibitor或NC浓度为100nM。
(6)将6孔板放入细胞培养箱培养6小时,吸去含有miRNA-155 inhibitor或NC的培养基,PBS冲洗1次后,加入完全培养基2ml,放入细胞培养箱中继续培养48小时。
3、效应细胞DC转染后miRNA-155的表达量(qRT-PCR)
3.1细胞总RNA的提取
(1)吸去6孔板中的培养基,用PBS冲洗细胞2次,吸去PBS,每孔注入RNAiso Plus 1ml,缓慢吹打细胞,使细胞充分裂解;
(2)将裂解液吸出转入1.5ml EP管中,冰上静置5min;
(3)在EP管中加入氯仿200μl,剧烈震荡混匀约15秒,冰上静置3min;然后于4℃条件下12000g/min离心15分钟;
(4)离心后吸取EP管中上层水相液体500μl转入新的1.5ml EP管中,加入异丙醇500μl,颠倒混匀,冰上静置10min;然后于4℃条件下12000g/min离心10分钟;
(5)将EP管中沉淀留下,加入75%乙醇1ml震荡混匀,重悬白色沉淀;然后于4℃条件下7500g/min离心10分钟;
(6)吸去EP管中液体,可见管中沉淀,室温中干燥5分钟后用DEPC水30μl左右溶解沉淀获得总RNA,置于4℃冰箱过夜;
(7)取2μl上述总RNA,加198μl DEPC水,配制200μl稀释的总RNA,测定浓度和纯度;置于-80℃冰箱保存备用。
3.2 miRNA-155逆转录
(1)将总RNA逆转录成cDNA
用Hairpin-itTMmiRNAs qPCR Quantitation Kit(上海吉玛制药技术有限公司)按照说明书在DEPC处理的200μl EP管中配制如下反应体系:5×RT Buffer,4μl;dNTP(10mM),0.75μl;miR-RT primers(1μM),1.2μl;MMLV Reverse Transcriptase(200U/μl),0.2μl;RNA sample,1μg;加RNase Free H2O至20μl。将该体系轻轻混匀后,瞬时离心,设置反应条件如下:16℃,30min;42℃,30min;85℃,10min。反应产物cDNA置于-20℃冰箱保存备用。
(2)实时荧光定量PCR
将cDNA稀释3倍,然后混匀并吸取2μl作模板,用逆转录试剂盒按说明书配制如下反应体系:2×RT PCR Buffer,10μl;miR specific Primer set(5μM),0.4μl;miRNA RT Product,2μl;Taq DNA polymerase(5U/ml),0.2μl;加ddH2O至20μl。将该体系轻轻混匀后,瞬时离心,设置反应条件如下:95℃,3min;95℃,12sec;62℃,40sec;40cycles。
miRNA-155以U6为内参,miRNA-155和U6的引物由上海吉玛制药技术有限公司提供。
4、效应细胞DC与CIK共培养
成熟的DC细胞分组如下:
(1)miRNA-155下调的DC(miRNA-155 inhibitor转染);
(2)miRNA-155正常表达的DC(inhibitor negative control转染)
将上述成熟的DC和CIK按1:8混合,置于含300U/mL IL-2的RPMI1640培养基中,于37℃、5%CO2孵箱中继续培养,隔天半量换液,共培养4天,收集细胞。
5、体外特异性杀伤试验
分别使用K562/A02,THP-1及HL-60细胞作为靶细胞,使用完全培养基调整细胞浓度为105个/mL,按照效靶5:1将效应细胞及靶细胞加入96孔板中,37℃、5%CO2孵育箱中培养48h。通过MTT检测试剂盒检测细胞活率。
杀伤活性(%)=[1-(试验孔均值-效应对照孔均值)/靶细胞对照孔均值]×100%。
根据效应细胞的种类分为如下组别:
(A)CIK组;
(B)miRNA-155正常表达的DC组;
(C)miRNA-155正常表达的DC-CIK组;
(D)miRNA-155下调表达的DC组;
(E)miRNA-155下调表达的DC-CIK组。
三、实验结果
1、DC、CIK细胞增殖情况和表型分析
从外周血分离获得单个核细胞,通过诱导刺激分别得到DC和CIK细胞。经过传代培养,使用MTT检测试剂盒分析两种细胞的增殖活性,从570nm的吸光值结果可以看出,初种细胞后的1-2d,DC、CIK细胞生长缓慢,d3细胞进入快速生长期,6d以后细胞生长速度减缓。提取培养7d后的DC及CIK,通过流式细胞仪检测其表面标志物,其中DC细胞表面CD80、CD83、CD86的阳性率分别为73.24%、57.48%、61.17%,说明DC细胞已经成熟,纯度较高。CIK细胞表面CD3+CD8+、CD3+CD56+双阳性比率分别为58.28%、50.46%。
2、DC细胞转染后miRNA-155表达情况
转染miRNA-155 inhibitor的DC细胞(抑制组)中的miRNA-155表达量显著下调,其与对照组DC(不转染inhibitor或negative control)和阴性对照组DC(转染inhibitor negative control)的相对表达量如图1所示。
抑制组、对照组、阴性对照组的DC细胞的活力及增殖行为基本一致,证明miRNA-155低表达后并不影响DC细胞的活力和增殖行为。
3、MTT比色法检测效应细胞的杀伤效应
A~E组效应细胞对不同白血病细胞系的杀伤活性见图2-4。结果可见,miRNA-155下调表达的DC-CIK细胞比miRNA-155正常表达的DC-CIK细胞具有更高的杀伤力,而miRNA-155下调表达的DC细胞与miRNA-155正常表达的DC细胞的杀伤力基本一致,无显著性差异。这表明,miRNA-155下调并不能直接提高DC细胞对白血病细胞的杀伤力,但是miRNA-155下调的DC细胞可以通过共培养显著增强CIK细胞对肿瘤细胞的杀伤力。
miRNA-155可以作为药物靶标提高DC细胞共培养增强的CIK细胞对肿瘤细胞的杀伤力。
实施例2:miRNA-155抑制剂的筛选(太子参环肽B、C)
一、实验材料
太子参环肽B购买自上海源叶生物科技有限公司;太子参环肽C购买自中国科学院昆明植物研究所。其他材料同实施例1。
二、实验方法
1、效应细胞DC与CIK的分离培养
(1)单个核细胞的分离:采集健康志愿者外周血20mL,预冷的PBS 1:1稀释,缓慢加入淋巴细胞分离液上层,650g,4℃离心20min,收集白色细胞层,分离单个核细胞,1640培养基重悬细胞后置于37℃,5%CO2孵箱中孵育2h。
(2)DC细胞的培养:单个核细胞培养2h后收集贴壁细胞,在完全培养基(1640+10%FBS)中添加GM-CSF(1000U/mL)、IL-4(1000U/mL)诱导DC生成,于37℃,5%CO2孵育箱中培养,每2天半量换液一次,换液后补充GM-CSF、IL-4,于第6d在培养基中添加TNF-α诱导DC成熟(100ng/mL),连续培养7d,收集细胞备用。
(3)CIK细胞的培养:收集单核细胞中的悬浮细胞,调整细胞密度至1×106/ml,在完全培养基(1640+10%FBS)中加入INF-γ(1000U/mL),并于24h后添加IL-2(300U/mL)、IL-1α(l00U/mL)和抗人CD3单抗(50μg/mL)。每2-3d进行换液,并补充等量的细胞因子,连续培养7天,收集细胞备用。
2、太子参环肽B、C诱导DC细胞低表达miRNA-155
(1)传细胞培养板:以6孔板为例,转染前一天,按1×106/ml密度接种DC细胞于6孔板,每孔加2ml培养基,使转染时贴壁细胞密度达60%。
(2)药物诱导:吸去6孔板中的培养基,PBS冲洗1次后,加入含有太子参环肽B(8μg/ml)或C(5μg/ml)的完全培养基2ml,放入细胞培养箱中继续培养48小时。
3、DC细胞中miRNA-155的表达(qRT-PCR)
3.1细胞总RNA的提取
(1)吸去6孔板中的培养基,用PBS冲洗细胞2次,吸去PBS,每孔注入RNAiso Plus 1ml,缓慢吹打细胞,使细胞充分裂解;
(2)将裂解液吸出转入1.5ml EP管中,冰上静置5min;
(3)在EP管中加入氯仿200μl,剧烈震荡混匀约15秒,冰上静置3min;然后于4℃条件下12000g/min离心15分钟;
(4)离心后吸取EP管中上层水相液体500μl转入新的1.5ml EP管中,加入异丙醇500μl,颠倒混匀,冰上静置10min;然后于4℃条件下12000g/min离心10分钟;
(5)将EP管中沉淀留下,加入75%乙醇1ml震荡混匀,重悬白色沉淀;然后于4℃条件下7500g/min离心10分钟;
(6)吸去EP管中液体,可见管中沉淀,室温中干燥5分钟后用DEPC水30μl左右溶解沉淀获得总RNA,置于4℃冰箱过夜;
(7)取2μl上述总RNA,加198μl DEPC水,配制200μl稀释的总RNA,测定浓度和纯度;置于-80℃冰箱保存备用。
3.2 miRNA-155逆转录
(1)将总RNA逆转录成cDNA
用Hairpin-itTMmiRNAs qPCR Quantitation Kit(上海吉玛制药技术有限公司)按照说明书在DEPC处理的200μl EP管中配制如下反应体系:5×RT Buffer,4μl;dNTP(10mM),0.75μl;miR-RT primers(1μM),1.2μl;MMLV Reverse Transcriptase(200U/μl),0.2μl;RNA sample,1μg;加RNase Free H2O至20μl。将该体系轻轻混匀后,瞬时离心,设置反应条件如下:16℃,30min;42℃,30min;85℃,10min。反应产物cDNA置于-20℃冰箱保存备用。
(2)实时荧光定量PCR
将cDNA稀释3倍,然后混匀并吸取2μl作模板,用逆转录试剂盒按说明书配制如下反应体系:2×RT PCR Buffer,10μl;miR specific Primer set(5μM),0.4μl;miRNA RT Product,2μl;Taq DNA polymerase(5U/ml),0.2μl;加ddH2O至20μl。将该体系轻轻混匀后,瞬时离心,设置反应条件如下:95℃,3min;95℃,12sec;62℃,40sec;40cycles。
miRNA-155以U6为内参,miRNA-155和U6的引物由上海吉玛制药技术有限公司提供。
4、效应细胞DC与CIK共培养
成熟的DC细胞分组如下:
(1)对照DC细胞(不加药处理);
(2)太子参环肽B处理的DC细胞;
(3)太子参环肽C处理的DC细胞。
将上述成熟的DC和CIK按1:8混合,置于含300U/mL IL-2的RPMI1640培养基中,于37℃、5%CO2孵箱中继续培养,隔天半量换液,共培养4天,收集细胞。
5、体外特异性杀伤试验
分别使用K562/A02,THP-1及HL-60细胞作为靶细胞,使用完全培养基调整细胞浓度为105个/mL,按照效靶5:1将效应细胞及靶细胞加入96孔板中,37℃、5%CO2孵育箱中培养48h。通过MTT检测试剂盒检测细胞活率。
杀伤活性(%)=[1-(试验孔均值-效应对照孔均值)/靶细胞对照孔均值]×100%。
根据效应细胞的种类分为如下组别:
(A)普通DC-CIK组;
(B)太子参环肽B处理的DC-CIK组;
(C)太子参环肽C处理的DC-CIK组。
三、实验结果
1、DC、CIK细胞增殖情况和表型分析
结果同实施例1。
不同处理的DC细胞的活力及增殖行为基本一致,证明上述剂量下的太子参环肽B或C不影响DC细胞的活力和增殖行为。
2、DC细胞处理后miRNA-155表达情况
太子参环肽B或C处理的DC细胞中的miRNA-155表达量显著下调,分别为对照DC细胞中的miRNA-155表达量的0.38倍、0.32倍。
3、MTT比色法检测效应细胞的杀伤效应
太子参环肽B处理的DC-CIK组、太子参环肽C处理的DC-CIK组的DC-CIK细胞对白血病细胞的杀伤力显著提高,以HL-60细胞系为例,分别为普通DC-CIK组DC-CIK细胞杀伤力的2.17倍和2.35倍。
上述结果表明,太子参环肽B或C可以作为miRNA-155抑制剂用于提高DC细胞共培养增强的CIK细胞对肿瘤细胞的杀伤力。
上述实施例仅用于进一步解释本发明的技术方案,本领域技术人员应当明白,任何简单替换或修改均不脱离本发明,本发明的保护范围并不受限于上述具体实施例。
- 还没有人留言评论。精彩留言会获得点赞!