细胞聚集体的制备方法与流程
本发明涉及在液体培养基中对多能干细胞等有用的细胞进行悬浮培养而制备细胞聚集体的方法。
背景技术:
随着近年对人es细胞、人ips细胞等人多能干细胞的研究,再生医疗的实用化的可能性正在增加。这些细胞具有能够无限增殖的能力和分化为各种细胞的能力,因此期待使用了多能干细胞的再生医疗可根本性地改变对疑难疾病、生活习惯病等的治疗方法。已经能够在试管内从多能干细胞分化诱导为以神经细胞为代表的心肌细胞、血液细胞及网膜细胞等各种细胞。
作为面向使用多能干细胞对各种脏器进行再生的再生医疗的实用化的课题之一,有如何高效地生产脏器再生所需要的大量细胞的课题。例如,肝脏的再生需要约2×1011个细胞。通过在平坦的基板上的贴壁培养来培养上述个数的细胞需要106cm2以上的基板,以普通的10cm培养皿计,这相当于约20,000个的量分。对于基板表面上的贴壁培养而言,由于得到的细胞数量依赖于培养面积,因此难以扩大规模,难以供给再生医疗所需要的足够量的细胞。
在液体培养基中使细胞悬浮并进行培养的悬浮培养容易进行规模扩大,可以期待其适于细胞的大量生产。
非专利文献3中公开了一种制备均匀大小的球状体的方法,该方法包括:使用悬浮培养瓶(spinnerflask)作为悬浮培养的细胞培养容器,并在通过强大的搅拌力对液体培养基进行搅拌的同时进行人多能干细胞的悬浮培养。
非专利文献4中公开了一种使用形成了微小的微孔的基板在各微孔中制备均匀大小的球状体的方法。
非专利文献5中公开了如下方法:使用调整了粘性、比重的培养基作为培养基,保持多能干细胞的悬浮状态,并且在抑制细胞彼此碰撞的同时进行培养。
专利文献1中公开了一种在液体培养基中在对细胞进行旋转培养的同时进行培养,从而制备细胞的聚集体的技术。
专利文献2中公开了一种将多能干细胞悬浮培养至细胞团的平均直径为约200~300μm的方法。
现有技术文献
专利文献
专利文献1:日本特开2003-304866号公报
专利文献2:国际公开wo2013/077423号小册子
非专利文献
非专利文献1:takayaman,nishimuras,nakamuras,shimizut,ohnishir,endoh,yamaguchit,otsum,nishimurak,nakanishim,sawaguchia,nagair,takahashik,yamanakas,nakauchih,etok.transientactivationofc-mycexpressioniscriticalforefficientplateletgenerationfromhumaninducedpluripotentstemcells.jexpmed.2010dec20;207(13):2817-30.doi:10.1084/jem.20100844.epub2010nov22.pubmedpmid:21098095;pubmedcentralpmcid:pmc3005234.
非专利文献2:frgarcia-gonzaloandjcibelmonte,albumin-associatedlipidsregulatehumanembryonicstemcellself-renewal.plosone,2008,3(1),e1384
非专利文献3:olmerr.etal.,tissueengineering:partc,volume18(10):772-784(2012)
非专利文献4:ungrinmdetal.,plosone,2008,3(2),e1565
非专利文献5:otsujigtetal.,stemcellreports,volume2:734-745(2014)
技术实现要素:
发明要解决的课题
虽然如上所述开发了通过悬浮培养来制备细胞聚集体的各种技术,但本发明人等认为仍有以下尚未解决的课题。
多能干细胞等贴壁细胞(adherentcell)通过悬浮培养而形成聚集体。作为细胞凝聚的机理,可以列举:膜蛋白质、细胞膜等细胞间的非特异性吸附、细胞表面的钙黏着蛋白所介导的细胞间的粘接等。人ips细胞等细胞无法以单细胞的形式生存,因此,为了生存需要形成细胞聚集体,但在聚集体过大时,营养无法充分地到达聚集体内部的细胞,存在增殖受阻、对保持未分化性造成影响的问题。为了防止过度凝聚,可以考虑在培养中使液体培养基流动,但存在过度的流动对细胞造成物理性刺激而对细胞造成伤害的危险。因此,要求不对细胞造成伤害地生产适度大小的聚集体的悬浮培养技术,但背景技术一栏中列举的现有的聚集体制备方法仍有改善的余地。
非专利文献3的方法中存在因剪切应力而导致细胞死亡的问题。
非专利文献4的方法中存在难以大规模化、难以更换培养基等的问题。
非专利文献5的方法中存在培养时培养基的移动少而难以对细胞聚集体供给氧、营养成分的问题。
专利文献1中未公开用于将细胞团的大小控制为适度大小的方法。
专利文献2中记载了在培养基中添加水溶性高分子来提高粘性的方法作为用于防止细胞团彼此粘接的方法。因此,与非专利文献5同样地存在难以对细胞聚集体供给氧、营养成分的问题。
因此,本发明的目的在于提供一种基于悬浮培养的细胞聚集体的制备方法,该方法易于将细胞聚集体制备成适于培养的大小、且对细胞造成伤害的可能性小。
解决课题的方法
本发明人等令人惊讶地发现,通过在液体培养基中添加脂质(特别是磷脂)来进行细胞的悬浮培养能够大量生产适当尺寸的细胞聚集体的集群,从而完成了本发明。在本发明中,不使用培养基的粘性、基于搅拌的剪切应力、或微孔板等培养器的形状等培养环境改变的机械学/物理学方法,而是使用利用生物体中存在的物质使培养基组成发生改变的生化学/化学方法。具体而言,本发明包括以下的发明。
(1)一种细胞聚集体的制备方法,该方法包括:在含有溶血磷脂的液体培养基中使细胞悬浮并进行培养的工序。典型的所述工序是通过在含有溶血磷脂的液体培养基中使细胞悬浮并进行培养来控制培养中所述细胞聚集体的尺寸增大的工序。
(2)根据(1)所述的方法,其中,所述液体培养基含有大于0.0064μg/ml且100μg/ml以下的所述溶血磷脂。
(3)根据(1)或(2)所述的方法,其还包括下述工序中的至少一者:
添加所述溶血磷脂来制备所述液体培养基的工序,以及
通过酶反应生成所述溶血磷脂来制备所述液体培养基的工序。
(4)根据(1)~(3)中任一项所述的方法,其中,所述细胞是在贴壁或悬浮进行培养后经过分离的细胞。
(5)根据(1)~(4)中任一项所述的方法,其中,所述溶血磷脂是溶血磷脂酸及鞘氨醇-1-磷酸中的至少一者。
(6)根据(1)~(5)中任一项所述的方法,其中,所述液体培养基含有选自l-抗坏血酸、胰岛素、运铁蛋白、硒及碳酸氢钠中的至少一者。
(7)根据(1)~(6)中任一项所述的方法,其中,所述液体培养基含有生长因子。
(8)根据(7)所述的方法,其中,所述生长因子是fgf2及tgf-β1中的至少一者。
(9)根据(1)~(8)中任一项所述的方法,其中,所述液体培养基含有rock抑制剂。
(10)根据(9)所述的方法,其中,所述rock抑制剂是y-27632。
(11)根据(1)~(10)中任一项所述的方法,其中,所述细胞是多能干细胞。
(12)通过(1)~(11)中任一项所述的方法制备的细胞聚集体。
(13)一种细胞凝聚抑制剂,其含有溶血磷脂。在本发明中,“细胞凝聚抑制剂”也可以表达为“细胞凝聚控制剂”。
(14)根据(13)所述的细胞凝聚抑制剂,其含有大于0.0064μg/ml且100μg/ml以下的所述溶血磷脂。
(15)根据(13)或(14)所述的细胞凝聚抑制剂,其还含有生长因子。
(16)根据(15)所述的细胞凝聚抑制剂,其中,所述生长因子是fgf2及tgf-β1中的至少一者。
(17)根据(13)~(16)中任一项所述的细胞凝聚抑制剂,其还含有rock抑制剂。
(18)根据(17)所述的细胞凝聚抑制剂,其中,所述rock抑制剂是y-27632。
(19)根据(13)~(18)中任一项所述的细胞凝聚抑制剂,其中,所述溶血磷脂是溶血磷脂酸及鞘氨醇-1-磷酸中的至少一者。
(20)一种溶血磷脂的用途,其用于抑制细胞的凝聚。在本发明中,“用于抑制细胞的凝聚的用途”可以表达为“用于在细胞培养中控制细胞的凝聚的用途”。
(21)根据(20)所述的用途,其中,所述溶血磷脂以大于0.0064μg/ml且100μg/ml以下的浓度存在。
(22)根据(20)或(21)所述的用途,其中,所述溶血磷脂与生长因子组合使用。
(23)根据(22)所述的用途,其中,所述生长因子是fgf2及tgf-β1中的至少一者。
(24)根据(20)~(23)中任一项所述的用途,其中,所述溶血磷脂与rock抑制剂组合使用。
(25)根据(24)所述的用途,其中,所述rock抑制剂是y-27632。
(26)根据(20)~(25)中任一项所述的用途,其中,所述溶血磷脂是溶血磷脂酸及鞘氨醇-1-磷酸中的至少一者。
(27)一种细胞聚集体的制备方法,该方法包括:在含有具有与白蛋白结合的能力的脂质的液体培养基中使细胞悬浮并进行培养的工序。
(28)根据(27)所述的方法,其中,所述液体培养基以0.00325~0.065mg/ml含有所述脂质。
(29)根据(27)或(28)所述的方法,其中,所述液体培养基含有l-抗坏血酸和/或胰岛素和/或运铁蛋白和/或硒和/或碳酸氢钠和/或1种以上的生长因子。
(30)根据(29)所述的方法,其中,所述液体培养基中含有的所述生长因子是fgf2和/或tgf-β1。
(31)根据(27)~(30)中任一项所述的方法,其中,所述细胞是多能干细胞。
(32)通过(27)~(31)中任一项所述的方法制备的细胞聚集体。
(33)一种细胞凝聚抑制剂(或细胞凝聚控制剂),其含有具有与白蛋白结合能力的脂质。
(34)一种具有与白蛋白结合的能力的脂质的用途,其用于抑制(或控制)细胞的凝聚的用途。
(35)根据(33)所述的细胞凝聚抑制剂或(34)所述的用途,其中,所述脂质以0.00325~0.065mg/ml的浓度存在。
(36)根据(33)所述的细胞凝聚抑制剂或(34)所述的用途,其中,所述脂质与l-抗坏血酸和/或胰岛素和/或运铁蛋白和/或硒和/或碳酸氢钠和/或1种以上的生长因子组合使用。
(37)根据(33)所述的细胞凝聚抑制剂或(34)所述的用途,其中,所述细胞是多能干细胞。
本说明书包含作为本申请优先权基础的日本专利申请号2015-015306号所公开的内容。
发明的效果
本发明的方法能够大量生产适于悬浮培养的细胞聚集体,且可以大量生产细胞自身。
附图说明
图1示意性地示出了细胞聚集体的制备步骤的概述。
图2示出了在各ksr添加浓度下,通过在非贴壁性的容器内进行旋转振荡培养(培养第2天)而从人ips细胞形成的三维聚集体及其大小。%=体积(v)/体积(v)。
图3示出了各ksr添加浓度下,葡萄糖消耗量的经时变化。n=4。
图4示出了各ksr添加浓度下,培养第5天的细胞数。n=4。
图5示出了非专利文献2中公开的ksr的构成成分。
图6示出了添加各因子(albumaxtmii、bsa、胰岛素、运铁蛋白)时对聚集体形成的影响。%=重量(w)/体积(v)。
图7示出了人ips细胞在贴壁培养时及悬浮培养时(聚集体)的oct4表达率。
图8示出了使用添加了无脂质牛血清白蛋白和各脂质的人ips细胞悬浮液进行悬浮培养时的显微镜观察图像。
图9示出了使用添加了无脂质牛血清白蛋白和各浓度lpa(溶血磷脂酸)的人ips细胞悬浮液进行悬浮培养时的显微镜观察图像。φ表示细胞聚集体的尺寸的平均值(±标准差)。
图10示出了使用添加了无脂质牛血清白蛋白和各浓度s1p(鞘氨醇-1-磷酸)的人ips细胞悬浮液进行悬浮培养时的显微镜观察图像。φ表示细胞聚集体的尺寸的平均值(±标准差)。
图11示出了使用仅添加了无脂质牛血清白蛋白、或者添加了各浓度的lpa或s1p的人ips细胞悬浮液进行悬浮培养时的显微镜观察图像。
图12示出了使用仅添加了无脂质牛血清白蛋白、或者添加了各浓度的lpa或s1p的人ips细胞悬浮液进行悬浮培养时的培养系统的葡萄糖消耗量的经时变化。n=3。
图13示出了使用仅添加了无脂质牛血清白蛋白、或者添加了各浓度lpa或s1p的人ips细胞悬浮液进行悬浮培养时培养第5天的细胞产量。n=3。
图14示出了人ips细胞在贴壁培养时、以及在添加了1.0μg/ml的lpa或s1p的细胞悬浮液中进行悬浮培养时的未分化标记物(oct4及sox2)的阳性率。
图15示出了在进行悬浮培养的各培养规模(4ml规模、300ml规模、1.6l规模)下,接种后1天(第1天)和接种后5天或6天(第5天或第6天)的显微镜观察图像。
图16示出了在进行悬浮培养的各培养规模(4ml规模、300ml规模、1.6l规模)下,细胞密度的经时变化。
图17示出了在进行悬浮培养的各培养规模(4ml规模、300ml规模、1.6l规模)下及贴壁培养时的未分化标记物(oct4及sox2)的阳性率。
具体实施方式
以下,使用优选的实施方式详细地对本发明进行说明。
<1.细胞>
用本发明的方法培养并形成细胞聚集体的细胞只要是具有贴壁性的细胞(贴壁细胞)即可,没有特别限定,可以是来自于动物的细胞等,可以优选为来自于哺乳类动物的细胞等,可以更优选为来自于生物体组织的细胞及由来自于生物体组织的细胞所衍生出的细胞等,可以特别优选为来自于上皮组织的细胞及由上皮组织细胞所衍生出的细胞等、或者来自于结缔组织的细胞及由来自于结缔组织的细胞所衍生出的细胞等、或者来自于肌肉组织的细胞及由来自于肌肉组织的细胞所衍生出的细胞等、或者来自于神经组织的细胞及由来自于神经组织的细胞所衍生出的细胞等,可以进一步优选为来自于动物的干细胞及由来自于动物的干细胞分化成的细胞等,可以更优选为来自于动物的多能干细胞及由来自于动物的多能干细胞分化成的细胞等,可以更进一步优选为来自于哺乳类动物的多能干细胞及由来自于哺乳类动物的多能干细胞分化成的细胞等,可以最优选为来自于人的多能干细胞及由来自于人的多能干细胞分化成的细胞等。
在本发明中,“多能干细胞”是指具有能够分化为构成生物体的所有种类的细胞的多分化能力(多能性)的细胞,是能够在适当条件下的体外(invitro)培养中以保持多能性的状态持续无限增殖的细胞。作为多能干细胞的具体例子,可以列举例如:胚胎干细胞(es细胞)、作为来自于胎儿原始生殖细胞的多能干细胞的eg细胞(shamblottm.j.etal.,proc.natl.acad.sci.usa.(1998)95,p.13726-13731)、作为来自于睾丸的多能干细胞的gs细胞(conrads.,nature(2008)456,p.344-349)、作为来自于体细胞的诱导多能干细胞的ips细胞(诱导的多能干细胞(inducedpluripotentstemcells))等,但并不限定于此。本发明中使用的多能干细胞特别优选为es细胞或ips细胞。es细胞是来自于从在被称为胚泡的早期胚胎的内部存在的内部细胞团中采集的未分化细胞的培养细胞。ips细胞是通过在体细胞中导入重编程因子(reprogrammingfactors)而使体细胞重编程为未分化状态,并赋予了多能性的培养细胞。作为重编程因子,可以使用例如oct3/4、klf4、sox2及c-myc(yuj,etal.science.2007;318:1917-20.),可以使用例如oct3/4、sox2、lin28及nanog(takahashik,etal.cell.2007;131:861-72.)。这些因子导入细胞的方式没有特别限定,可以列举例如:使用了质粒的基因导入、合成rna的导入、以蛋白质的形式直接导入等。另外,可以使用通过使用了microrna、rna、低分子化合物等的方法制备的ips细胞。以es细胞、ips细胞为代表的多能干细胞可以使用市售品或分售的细胞,也可以使用新制备的细胞。作为ips细胞,可以使用例如253g1株、201b6株、201b7株、409b2株、454e2株、hips-riken-1a株、hips-riken-2a株、hips-riken-12a株、nips-b2株、tkdn4-m株、tkda3-1株、tkda3-2株、tkda3-4株、tkda3-5株、tkda3-9株、tkda3-20株、hipsc38-2株、msc-ipsc1株、bj-ipsc1株等。作为es细胞,可以使用例如khes-1株、khes-2株、khes-3株、khes-4株、khes-5株、sees1株、sees2株、sees3株、hues8株、cyt49株、h1株、h9株、hs-181株等。可以使用新制备的临床级别的ips细胞或es细胞。制备ips细胞时的细胞来源没有特别限定,可以使用例如成纤维细胞或淋巴细胞等。
本发明所使用的细胞可以是来自于任意动物的细胞,例如,可以是来自于小鼠、大鼠、仓鼠等啮齿类、人、大猩猩、黑猩猩等灵长类、以及犬、猫、兔、牛、马、棉羊、山羊等家畜或宠物等哺乳动物的细胞,特别优选为来自于人的细胞。
在本发明中,可以使用贴壁或悬浮进行培养后进行了分离的细胞。这里,“进行了分离的细胞”是指将多个细胞以细胞群的方式附着在一起的细胞剥离、分散后的状态的上述细胞。分离是指将附着于培养容器、培养担载体等的状态的细胞或细胞彼此附着的状态的细胞群进行剥离、分散而形成单一细胞的工序。待分离的细胞群可以处于悬浮在液体培养基中的状态。分离的方法没有特别限定,可以优选使用剥离剂(胰蛋白酶或胶原酶等细胞剥离酶)或edta(乙二胺四乙酸)等螯合剂或剥离剂与螯合剂的混合物等。剥离剂没有特别限定,可以列举:胰蛋白酶、accutase(注册商标)、trypletmexpressenzyme(lifetechnologiesjapan公司)、trypletmselectenzyme(lifetechnologiesjapan公司)、dispase(注册商标)、胶原酶等。分离后冷冻保存的上述细胞也可以优选用于本发明。
<2.细胞聚集体>
在本发明中,细胞聚集体是指多个细胞三维凝聚而形成的块状体,也被称为球状体。本发明中制备的典型的细胞聚集体具有基本上为球形的形状。
在本发明中,构成细胞聚集体的细胞只要为1种以上的上述贴壁细胞即可,没有特别限定。例如,由人多能干细胞或人胚胎干细胞等多能干细胞构成的上述细胞聚集体包含表达了多能干细胞标记物的细胞。作为上述多能干细胞标记物,可以例示出:碱性磷酸酶、nanog、oct4、sox2、tra-1-60、c-myc、klf4、lin28、ssea-4、ssea-1等。在构成上述细胞聚集体的细胞为上述多能干细胞时,表达上述多能干细胞标记物的细胞的比例优选为80%以上,更优选为90%以上,更优选为91%以上,更优选为92%以上,更优选为93%以上,更优选为94%以上,更优选为95%以上,更优选为96%以上,更优选为97%以上,更优选为98%以上,更优选为99%以上,更优选为100%以下。
根据本发明的方法制备的细胞聚集体的尺寸没有特别限定,用显微镜观察时,观察图像中最宽部分的尺寸的上限优选为1000μm,更优选为900μm,更优选为800μm,更优选为700μm,进一步优选为600μm,更优选为500μm,更进一步优选为400μm,最优选为300μm。下限优选为50μm,更优选为60μm,进一步优选为70μm,更优选为80μm,更进一步优选为90μm,最优选为100μm。这样的尺寸范围的细胞聚集体易于对内部的细胞供给氧、营养成分,优选作为细胞的增殖环境。
对于根据本发明的方法制备的细胞聚集体的集群而言,在构成该集群的细胞聚集体中,以重量基准计,优选10%以上、更优选为20%以上、进一步优选为30%以上、更优选为40%以上、更进一步优选为50%以上、进一步更优选为60%以上、进一步更优选为70%以上、进一步更优选为80%以上、最优选为90%以上具有上述范围的尺寸。
<3.液体培养基>
本发明所使用的液体培养基可以通过如下方式制备:以任意的动物细胞培养用液体培养基作为基础培养基,适当添加上述脂质及根据需要而添加的其它成分。
作为基础培养基,可以使用bme培养基、bgjb培养基、cmrl1066培养基、glasgowmem培养基、改良memzincoption培养基、imdm培养基(iscove’smodifieddulbecco’smedium)、medium199培养基、eaglemem培养基、αmem培养基、dmem培养基(dulbecco’smodifiedeagle’smedium)、ham'sf10培养基、ham'sf12培养基、rpmi1640培养基、fischer’s培养基、以及它们的混合培养基(例如dmem/f12培养基(dulbecco’smodifiedeagle’smedium/nutrientmixturef-12ham))等培养基,没有特别限定。作为dmem/f12培养基,特别使用优选以60/40~40/60的重量比、更优选以55/45~45/55的重量比、最优选以等量混合有dmem培养基和ham'sf12培养基的培养基。
本发明所使用的液体培养基优选为不含有血清的培养基,即无血清培养基。
本发明所使用的液体培养基更优选含有选自l-抗坏血酸、胰岛素、运铁蛋白、硒及碳酸氢钠中的至少一者,更优选包含上述全部。l-抗坏血酸、胰岛素、运铁蛋白、硒及碳酸氢钠可以以溶液、衍生物、盐或混合试剂等形式添加于培养基。例如,l-抗坏血酸可以以抗坏血酸-2-磷酸酯镁等衍生物的形式添加于培养基。硒可以以亚硒酸盐(亚硒酸钠等)的形式添加于培养基。胰岛素及运铁蛋白可以是从动物(优选为人、小鼠、大鼠、牛、马、山羊等)的组织或血清等中分离得到的天然来源的物质,也可以是基因工程制备的重组蛋白质。胰岛素、运铁蛋白及硒可以以its试剂(胰岛素-运铁蛋白-硒)的形式添加于培养基。its是含有胰岛素、运铁蛋白及亚硒酸钠的用于促进细胞增殖的添加剂。
可以使用含有选自l-抗坏血酸、胰岛素、运铁蛋白、硒及碳酸氢钠中的至少一者的市售的培养基作为本发明的液体培养基来使用。作为添加了胰岛素及运铁蛋白的市售的培养基,可以使用:cho-s-sfmii(lifetechnologiesjapan公司)、hybridoma-sfm(lifetechnologiesjapan公司)、erdfdrypowderedmedia(lifetechnologiesjapan公司)、ultraculturetm(biowhittaker公司)、ultradomatm(biowhittaker公司)、ultrachotm(biowhittaker公司)、ultramdcktm(biowhittaker公司)等。可以优选使用stempro(注册商标)hescsfm(lifetechnologiesjapan公司)、mtesr1(veritas公司)、tesr2(veritas公司)等。另外,也可以优选使用用于人ips细胞、人es细胞的培养的液体培养基。
本发明所使用的液体培养基优选含有至少一种生长因子。作为生长因子,没有限定,优选含有选自fgf2(碱性成纤维细胞生长因子-2)、tgf-β1(转化生长因子-β1)、激活蛋白a(activina)、igf-1、mcp-1、il-6、pai、pedf、igfbp-2、lif及igfbp-7中的至少一者以上。特别优选的生长因子为fgf2和/或tgf-β1。
作为本发明所使用的液体培养基,最优选的培养基是还含有选自l-抗坏血酸、胰岛素、运铁蛋白、硒及碳酸氢钠、以及至少一种生长因子作为作为白蛋白和/或后面叙述的脂质以外的成分的无血清培养基,特别优选为含有l-抗坏血酸、胰岛素、运铁蛋白、硒及碳酸氢钠、以及至少一种生长因子(优选为fgf2及tgf-β1)、且不含有血清的dmem/f12培养基。作为这样的培养基,可以优选使用添加了白蛋白和/或后面叙述的脂质的essential8tm培养基(lifetechnologiesjapan公司)。essential8tm培养基可以将由lifetechnologiesjapan公司销售的dmem/f12培养基dmem/f-12(ham)1∶1与essential8tm补充剂(包含l-抗坏血酸、胰岛素、运铁蛋白、硒、碳酸氢钠、fgf2及tgf-β1)混合来制备。
本发明所使用的液体培养基也可以含有脂肪酸或脂质、氨基酸(例如非必需氨基酸)、维生素、细胞因子、抗氧化剂、2-巯基乙醇、丙酮酸、缓冲剂、无机盐类、抗生素、激酶抑制剂等成分。
作为抗生素,可以使用青霉素、链霉素、两性霉素b等。
作为激酶抑制剂,可以添加rock抑制剂。
rock抑制剂定义为抑制rho-激酶(rock,rho相关蛋白激酶)的激酶活性的物质,可以列举例如:y-27632(4-[(1r)-1-氨基乙基]-n-吡啶-4-基环己烷-1-甲酰胺)或其二盐酸盐(例如参照,ishizakietal.,mol.pharmacol.57,976-983(2000);narumiyaetal.,methodsenzymol.325,273-284(2000))、fasudil/ha1077(1-(5-异喹啉磺酰基)高哌嗪)或其二盐酸盐(例如参照,uenataetal.,nature389:990-994(1997))、h-1152((s)-(+)-2-甲基-1-[(4-甲基-5-异喹啉基)磺酰基]-六氢-1h-1,4-二氮杂卓(diazepine))或其二盐酸盐(例如参照,sasakietal.,pharmacol.ther.93:225-232(2002))、wf-536((+)-(r)-4-(1-氨基乙基)-n-(4-吡啶基)苯甲酰胺一盐酸盐)(例如参照,nakajimaetal.,cancerchemother.pharmacol.52(4):319-324(2003))及它们的衍生物、以及针对rock的反义核酸、rna干扰诱导核酸(例如sirna)、显性失活突变体及它们的表达载体。另外,作为rock抑制剂,还已知其它低分子化合物,因此在本发明中也可以使用这样的化合物或它们的衍生物(例如参照:美国专利申请公开第20050209261号、美国专利申请公开第20050192304号、美国专利申请公开第20040014755号、美国专利申请公开第20040002508号、美国专利申请公开第20040002507号、美国专利申请公开第20030125344号、美国专利申请公开第20030087919号、以及国际公开第2003/062227号、国际公开第2003/059913号、国际公开第2003/062225号、国际公开第2002/076976号、国际公开第2004/039796号)。在本发明中,至少使用1种rock抑制剂。
本发明所使用的rock抑制剂优选为下述式i所示的化合物或作为其盐(例如,二盐酸盐)的y-27632。作为y-27632,可以添加水合物形态的化合物。
化学式1
式i:
液体培养基中的y-27632的浓度没有特别限定,例如为80~120nm(特别是100nm)、400~600nm(特别是500nm)、600~900nm(特别是750nm)、0.8~1.2μm(特别是1μm)、1.6~2.4μm(特别是2μm)、2.4~3.6μm(特别是3μm)、3.2~4.8μm(特别是4μm)、4~6μm(特别是5μm)、4.8~7.2μm(特别是6μm)、μm(特别是7μm)、6.4~9.6μm(特别是8μm)、7.2~10.8μm(特别是9μm)、8~12μm(特别是10μm)、12~18μm(特别是15μm)、16~24μm(特别是20μm)、20~30μm(特别是25μm)、24~36μm(特别是30μm)、32~48μm(特别是40μm)、或者40~60μm(特别是50μm)、更优选为8~12μm(特别是10μm)。
<4.脂质>
在本发明的一个实施方式中,本发明所使用的脂质可以是具有与白蛋白结合的能力的脂质。在本栏<4.脂质>中,在没有特别说明时,“脂质”是指具有与白蛋白结合的能力的脂质。作为具体的脂质,可以列举下述形态的脂质:与血清白蛋白等蛋白质形成了复合体的脂质、从血清白蛋白中分离的脂质、通过微生物、化学合成等生产且具有与白蛋白结合的能力的脂质等。需要说明的是,“与白蛋白的结合能力”是指能够借助化学性键合和/或物理性结合与白蛋白形成复合体的性质。
脂质的来源动物没有特别限定,可以是小鼠、大鼠、仓鼠等啮齿类、人、大猩猩、黑猩猩等灵长类、犬、猫、兔、牛、马、棉羊、山羊、猪等家畜或宠物等哺乳动物,优选为牛或人。优选为来自于与培养的细胞相同种类的生物的脂质。另外,脂质还可以是人工合成的脂质。
脂质可以以含有其的血清的形式添加入液体培养基中。另外,可以以包含脂质的血清白蛋白(含脂质的血清白蛋白)的形式添加入液体培养基中。作为含脂质的血清白蛋白,可以使用脂质与血清白蛋白的蛋白质形成了复合体的物质。在含脂质的血清白蛋白当中,特别优选提高了脂质含有率的形态的含脂质的血清白蛋白。作为该含脂质的血清白蛋白,可以列举市售的albumaxtm,具体可以列举:albumaxtmi或albumaxtmii(均为lifetechnologiesjapan公司)。
脂质只要是来自于血清的脂质、或者能够与血清白蛋白结合的脂质即可,没有特别限定,可以随来源生物而改变,可以是游离脂肪酸、磷脂(甘油磷脂、鞘磷脂、溶血磷脂酰胆碱等)、中性脂肪、胆固醇等。脂质例如可以包含选自溶血磷脂酰胆碱、三酰甘油、磷脂酰胆碱、磷脂酸、胆固醇及鞘磷脂中的至少一种,更优选包含上述全部。以脂质的总重量为基准,进一步优选本发明所使用的脂质至少包含20~80重量%(更优选为40~70重量%)的游离脂肪酸、5~50重量%(更优选为10~30重量%)的溶血磷脂酰胆碱、5~45重量%(更优选为10~30重量%)的三酰甘油、以及2~25重量%(更优选为5~15重量%)的卵磷脂,优选还包含选自1~10重量%(更优选为1~6重量%)的磷脂酸、0.1~3重量%(更优选为0.5~2重量%)的胆固醇及0.1~3重量%(更优选为0.5~2重量%)的鞘磷脂中的至少一者。在本发明的方法中可以优选使用含有这样组成的脂质的含脂质的血清白蛋白。需要说明的是,根据非专利文献2,以脂质的总重量为基准,albumaxtmii包含约54重量%的游离脂肪酸、约17重量%的溶血磷脂酰胆碱、约15重量%的三酰甘油、约8重量%的卵磷脂、约3重量%的磷脂酸、约1重量%的胆固醇及约1重量%的鞘磷脂。
从血清白蛋白中分离出的上述脂质也可以优选用于本发明。从上述血清白蛋白中分离上述脂质的方法没有特别限定,可以举出:对与脂质形成了复合体的血清白蛋白实施胰蛋白酶处理等蛋白质分解处理,然后对脂质进行回收的方法。分离得到的脂质可以以实质上保持了血清白蛋白所包含的脂质组成的状态直接用于本发明,也可以对一部分脂质进行富集来使用。
对于脂质而言,在作为血清代替物而市售的试剂中含有的情况下,可以作为该试剂中包含的一种成分而添加于液体培养基中使用。血清代替物(serumreplacement)是指在es细胞、ips细胞的培养中,作为血清(fbs等)的代替品,用于保持细胞的未分化状态并进行培养的试剂,可以列举例如:knockouttmsr(knockouttmserumreplacement(ksr);lifetechnologiesjapan公司)、stemsure(注册商标)serumreplacement(ssr;和光纯药工业)、n2补充剂(和光纯药工业)等。上述ksr中包含albumaxtm,具体来说包含albumaxtmi或albumaxtmii。
通常,血清中含有的白蛋白浓度约为50mg/ml,可以容易地想到ksr中也含有同样浓度的血清白蛋白。根据非专利文献2,ksr中含有的血清白蛋白为albumaxtm,另外如非专利文献2所述,100mg的albumaxtm中含有的脂质为0.65mg,因此,例如在含有最终浓度1%(体积/体积)的ksr的液体培养基中,含有0.5mg/ml的albumaxtm,即以0.00325mg/ml的浓度含有脂质。例如,在含有最终浓度2mg/ml的albumaxtm的液体培养基中,含有0.013mg/ml的脂质。因此,本发明的悬浮培养所使用的液体培养基中的脂质含量没有特别限定,可以设为0.00325~0.065mg/ml,可以优选设为0.00325~0.0325mg/ml,可以更优选设为0.00325~0.01625mg/ml,可以进一步优选为0.00325~0.013mg/ml。脂质的浓度可以采用通过适当的分析方法(例如,使用了液相色谱、气相色谱等设备的分析方法)求出的浓度。
脂质可以以未与白蛋白结合的状态存在于液体培养基中。可以将分别准备的脂质和白蛋白添加于液体培养基,添加的白蛋白的来源没有特别限定,例如,优选来自于人或牛的白蛋白。即,在本发明的方法的一个实施方式中,可以包括以未与白蛋白结合的状态添加上述脂质来制备液体培养基的工序。另外,也可以使用无脂质的血清白蛋白。还可以使用通过基因重组技术在大肠杆菌、动物细胞中表达、制备的白蛋白。也可以添加作为白蛋白代替物的蛋白质、添加物,例如两亲性物质(表面活性剂等)。
<5.溶血磷脂(lysophospholipid)>
本发明的其它实施方式中,使用的脂质为溶血磷脂。
溶血磷脂是具有一个脂肪族基(例如,一个中链或长链脂肪族基)的磷脂的总称。作为溶血磷脂,可以具有甘油骨架,也可以具有鞘氨醇骨架。作为上述溶血磷脂,可以列举:溶血磷脂酸(lpa)、鞘氨醇-1-磷酸(s1p)、溶血磷脂酰胆碱(lpc)、溶血磷脂酰丝氨酸(lps)、溶血磷脂酰肌醇(lpi)、溶血磷脂酰甘油(lpg)、溶血磷脂酰苏氨酸(lpt)、溶血磷脂酰乙醇胺(lpe)等,可以是多种溶血磷脂的混合物。这些溶血磷脂可以是盐等任意形态。作为上述溶血磷脂,优选为lpc以外的溶血磷脂,更优选lpa、s1p等具有无取代的磷酸基作为极性头部基团的溶血磷脂。在上述溶血磷脂含有酰基时,酰基的碳原子数、不饱和度没有特别限定,可以是与来源生物对应的碳原子数、不饱和度,典型的酰基的碳原子数为16~24,不饱和度为0~6的范围。更优选碳原子数∶不饱和度为16∶0、16∶1、18∶0、18∶1、18∶2、18∶3、20∶0、20∶1、20∶2、20∶3、20∶4、20∶5、22∶0、22∶1、22∶2、22∶3、22∶4、22∶5、或者22∶6的酰基。另外,具有甘油骨架的溶血磷脂可以是1-酰基型溶血磷脂及2-酰基型溶血磷脂的任一者,优选为1-酰基型溶血磷脂。
上述溶血磷脂的来源生物可以从与<4.脂质>中说明的来源生物相同的范围中进行选择。另外,上述溶血磷脂还可以是人工制备的。
上述溶血磷脂可以以含有其的组合物的形式添加于液体培养基中。作为上述组合物,可以例示出溶血磷脂与蛋白质的混合物等。
上述溶血磷脂可以以未与蛋白质结合的形态用于培养。特别是作为用于制备液体培养基的原料,如果使用不是与蛋白质的混合物的形态的上述溶血磷脂、优选使用实质上纯化后的形态的上述溶血磷脂,则可容易地将上述溶血磷脂的添加量调节至优选范围,因此优选。这样的溶血磷脂可以从来源生物中分离,也可以人工制备。
上述溶血磷脂在悬浮培养开始时的液体培养基中的浓度可以适当调整,例如为0.00128μg/ml以上,优选为0.0064μg/ml以上,优选大于0.0064μg/ml,优选为0.032μg/ml以上,优选为0.064μg/ml以上,优选为0.16μg/ml以上,优选为0.2μg/ml以上,优选为0.3μg/ml以上,优选为0.4μg/ml以上,优选为0.5μg/ml以上,在这样的情况下,能够适度抑制细胞的凝聚而形成基本均匀大小的细胞聚集体,例如为1000μg/ml以下,优选为200μg/ml以下,优选为150μg/ml以下,更优选为100μg/ml以下,更优选为90μg/ml以下,更优选为80μg/ml以下,更优选为70μg/ml以下,更优选为60μg/ml以下,更优选为50μg/ml以下,更优选为40μg/ml以下,更优选为30μg/ml以下,更优选为20μg/ml以下,更优选为10μg/ml以下,更优选为9μg/ml以下,更优选为8μg/ml以下,更优选为7μg/ml以下,更优选为6μg/ml以下,更优选为5μg/ml以下,更优选为4μg/ml以下,更优选为3μg/ml以下,更优选为2μg/ml以下,更优选为1μg/ml以下,更优选为0.9μg/ml以下,更优选为0.8μg/ml以下,更优选为0.7μg/ml以下,更优选为0.6μg/ml以下,在这样的情况下,能够形成上述的适当尺寸的球状细胞聚集体。在液体培养基中添加多种成分作为溶血磷脂时,优选将各溶血磷脂的浓度设定为上述范围,更优选将溶血磷脂的总浓度设定为上述范围。需要说明的是,上述的溶血磷脂的量是指在制备液体培养基时添加的溶血磷脂的量(其中,在如后面叙述那样在液体培养基中通过酶反应生成溶血磷脂时,也包含该反应中生成的溶血磷脂的量),不包含培养的细胞所产生的溶血磷脂。上述溶血磷脂的浓度可以采用通过适当的分析方法(例如使用了液相色谱、气相色谱等设备的分析方法)求出的浓度。更优选使将溶血磷脂换算为2s-氨基-1-(二氢磷酸酯)-4e-十八碳烯-1,3r-二醇(分子量379.5)时的重量浓度为上述的范围。
在上述溶血磷脂为溶血磷脂酸的情况下,可以适当调整悬浮培养开始时的液体培养基中的溶血磷脂酸的浓度,例如为0.00128μg/ml以上或0.00279μm以上,优选为0.0064μg/ml以上或0.0140μm以上,优选大于0.0064μg/ml或大于0.0140μm,优选为0.032μg/ml以上或0.0698μm以上,优选为0.064μg/ml以上或0.140μm以上,优选为0.16μg/ml以上或0.349μm以上,优选为0.2μg/ml以上或0.436μm以上,优选为0.3μg/ml以上或0.654μm以上,优选为0.4μg/ml以上或0.872μm以上,优选为0.5μg/ml以上或1.09μm以上,在该情况下,能够适度抑制细胞的凝聚而形成基本均匀大小的细胞聚集体,例如为1000μg/ml以下或2180μm以下,优选为200μg/ml以下或436μm以下,优选为150μg/ml以下或327μm以下,更优选为100μg/ml以下或218μm以下,更优选为90μg/ml以下或196μm以下,更优选为80μg/ml以下或174μm以下,更优选为70μg/ml以下或153μm以下,更优选为60μg/ml以下或131μm以下,更优选为50μg/ml以下或109μm以下,更优选为40μg/ml以下或87.2μm以下,更优选为30μg/ml以下或65.4μm以下,更优选为20μg/ml以下或43.6μm以下,更优选为10μg/ml以下或21.8μm以下,更优选为9μg/ml以下或19.6μm以下,更优选为8μg/ml以下或17.4μm以下,更优选为7μg/ml以下或15.3μm以下,更优选为6μg/ml以下或13.1μm以下,更优选为5μg/ml以下或10.9μm以下,更优选为4μg/ml以下或8.72μm以下,更优选为3μg/ml以下或6.54μm以下,更优选为2μg/ml以下或4.36μm以下,更优选为1μg/ml以下或2.18μm以下,更优选为0.9μg/ml以下或1.96μm以下,更优选为0.8μg/ml以下或1.74μm以下,更优选为0.7μg/ml以下或1.53μm以下,更优选为0.6μg/ml以下或1.31μm以下,在该情况下,能够形成上述的适当尺寸的球状细胞聚集体。需要说明的是,上述的溶血磷脂酸的量是指制备液体培养基时添加的溶血磷脂酸的量(其中,在如后面叙述那样在液体培养基中通过酶反应生成溶血磷脂酸时,也包含该反应中生成的溶血磷脂酸的量),不包含培养的细胞所产生的溶血磷脂酸。上述的溶血磷脂酸的重量浓度优选为换算成钠盐(1-o-9z-十八碳烯酰-sn-甘油基-3-磷酸,钠盐;分子量458.5)的重量浓度。
在上述溶血磷脂为鞘氨醇-1-磷酸的情况下,可以适当调整悬浮培养开始时的液体培养基中的鞘氨醇-1-磷酸的浓度,例如为0.00128μg/ml以上或0.00337μm以上,优选为0.0064μg/ml以上或0.0169μm以上,优选大于0.0064μg/ml或大于0.0169μm,优选为0.032μg/ml以上或0.0843μm以上,优选为0.064μg/ml以上或0.169μm以上,优选为0.16μg/ml以上或0.422μm以上,优选为0.2μg/ml以上或0.527μm以上,优选为0.3μg/ml以上或0.791μm以上,优选为0.4μg/ml以上或1.05μm以上,优选为0.5μg/ml以上或1.32μm以上,在该情况下,能够适度抑制细胞的凝聚而形成基本均匀大小的细胞聚集体,例如为1000μg/ml以下或2640μm以下,优选为200μg/ml以下或527μm以下,优选为150μg/ml以下或395μm以下,更优选为100μg/ml以下或264μm以下,更优选为90μg/ml以下或237μm以下,更优选为80μg/ml以下或211μm以下,更优选为70μg/ml以下或184μm以下,更优选为60μg/ml以下或158μm以下,更优选为50μg/ml以下或132μm以下,更优选为40μg/ml以下或105μm以下,更优选为30μg/ml以下或79.1μm以下,更优选为20μg/ml以下或52.7μm以下,更优选为10μg/ml以下或26.4μm以下,更优选为9μg/ml以下或23.7μm以下,更优选为8μg/ml以下或21.1μm以下,更优选为7μg/ml以下或18.4μm以下,更优选为6μg/ml以下或15.8μm以下,更优选为5μg/ml以下或13.2μm以下,更优选为4μg/ml以下或10.5μm以下,更优选为3μg/ml以下或7.91μm以下,更优选为2μg/ml以下或5.27μm以下,更优选为1μg/ml以下或2.64μm以下,更优选为0.9μg/ml以下或2.37μm以下,更优选为0.8μg/ml以下或2.11μm以下,更优选为0.7μg/ml以下或1.84μm以下,更优选为0.6μg/ml以下或1.58μm以下,在该情况下,能够形成上述的适当尺寸的球状细胞聚集体。需要说明的是,上述的鞘氨醇-1-磷酸的量是指制备液体培养基时添加的鞘氨醇-1-磷酸的量(其中,在如后面叙述那样在液体培养基中通过酶反应生成鞘氨醇-1-磷酸时,也包含该反应中生成的鞘氨醇-1-磷酸的量),不包含培养的细胞所产生的鞘氨醇-1-磷酸。上述的鞘氨醇-1-磷酸的重量浓度是指优选换算成游离体(2s-氨基-1-(二氢磷酸酯)-4e-十八碳烯-1,3r-二醇;分子量379.5)的重量浓度。
可以混合多种上述溶血磷脂使用。混合比率没有特别限定,例如,lpa∶s1p以重量比计为1∶1~80000或1~80000∶1,具体而言,可以以下述比例使用:1∶0.5~1.5(例如1∶1)、1∶2.5~7.5(例如1∶5)、1∶13~38(例如1∶25)、1∶63~190(例如1∶125)、1∶78~230(例如1∶156.25)、1∶310~940(例如1∶625)、1∶1600~4700(例如1∶3125)、1∶7800~23000(例如1∶15625)、1∶39000~120000(例如1∶78125)、2.5~7.5∶1(例如5∶1)、13~38∶1(例如25∶1)、63~190∶1(例如125∶1)、78~230∶1(例如156.25∶1)、78~230∶5(例如156.25∶5)、78~230∶25(例如156.25∶25)、78~230∶125(例如156.25∶125)、310~940∶1(例如625∶1)、310~940∶156.25(例如625∶156.25)、1600~4700∶1(例如3125∶1)、1600~4700∶156.25(例如3125∶156.25)、7800~23000∶1(例如15625∶1)、7800~23000∶156.25(例如15625∶156.25)、39000~120000∶1(例如78125∶1)、39000~120000∶156.25(例如78125∶156.25)。上述重量比优选为将lpa换算为钠盐(1-o-9z-十八碳烯酰-sn-甘油基-3-磷酸,钠盐;分子量458.5)、将s1p换算为游离体(2s-氨基-1-(二氢磷酸酯)-4e-十八碳烯-1,3r-二醇;分子量379.5)的重量比。
作为上述溶血磷脂,除了溶血磷脂酸(lpa)和鞘氨醇-1-磷酸(s1p)以外,也可以以上述浓度或上述混合比率使用溶血磷脂酰胆碱(lpc)、溶血磷脂酰丝氨酸(lps)、溶血磷脂酰肌醇(lpi)、溶血磷脂酰甘油(lpg)、溶血磷脂酰苏氨酸(lpt)、溶血磷脂酰乙醇胺(lpe)。
在本发明的方法中还可以包括通过酶反应由脂质生成上述溶血磷脂的工序。作为上述酶反应,可以例示出水解酶反应、激酶反应等。
作为上述水解酶反应,可以列举以上述磷脂作为底物的基于水解酶的水解反应。本发明所使用的上述水解酶没有特别限定,优选为磷脂酶及溶血磷脂酶。上述磷脂酶及上述溶血磷脂酶没有特别限定,优选为磷脂酶a1、磷脂酶a2、溶血磷脂酶d(autotaxin)。磷脂酶a1是对甘油磷脂的sn-1位的酯键进行水解的酶。磷脂酶a2是对甘油磷脂的sn-2位的酯键进行水解的酶。autotaxin是对磷脂或溶血磷脂中磷酸基上与取代基的磷酸酯键进行水解,生成无取代的磷酸基作为极性头部基团的水解酶,例如,可以水解lpc生成lpa和胆碱。在本发明中,作为溶血磷脂,可以优选使用以甘油磷脂作为底物通过基于磷脂酶a1或磷脂酶a2及autotaxin的反应而得到的水解物(lpa等)。在本发明中,可以优选使用将lpc、lps、lpi、lpg、lpt、lpe等通过上述autotaxin处理而得到的水解产物(lpa等)。
在本发明中,可以优选使用由上述鞘磷脂制备的s1p等作为溶血磷脂。制备方法没有特别限定,例如,可以优选使用通过鞘激酶(sphingokinase)等激酶对鞘氨醇进行磷酸化而得到的磷酸化产物(s1p等)作为溶血磷脂。
在本发明的方法中,还可以还包括添加上述溶血磷脂而制备液体培养基的工序。此时,以未与蛋白质结合的形态添加上述溶血磷脂可易于调节上述溶血磷脂的添加量,因此优选。
在本发明中,可以优选使用细胞凝聚抑制试剂盒,所述细胞凝聚抑制试剂盒含有上述溶血磷脂(优选包含lpa或s1p中的任一者)、或上述脂质的水解产物、或上述脂质和上述水解酶的混合物、或上述鞘磷脂和上述激酶的混合物等、或含有这些物质中任一种的液体培养基等。
<6.细胞凝聚抑制剂>
本发明的细胞凝聚抑制剂含有上述脂质,且可以用于在悬浮培养系统中适度抑制细胞的凝聚而形成基本均匀大小的细胞聚集体。
本发明的细胞凝聚抑制剂的形态没有特别限定,可以是上述脂质自身,也可以是上述脂质与其它成分组合而成的组合物。上述组合物的形态没有特别限定。上述组合物例如可以是用于悬浮培养的液体培养基,也可以是制备液体培养基时所配合的添加用组合物。
本发明的细胞凝聚抑制剂的优选实施方式是以上述浓度或上述比率含有上述溶血磷脂的上述液体培养基或磷酸缓冲液等缓冲液。
本发明的细胞凝聚抑制剂的另一优选实施方式是在液状培养基中含有上述溶血磷脂的液态组合物。上述液态组合物是在制备悬浮培养用的液体培养基时添加的添加物。上述液态组合物优选以待制备的液体培养基中的上述溶血磷脂的最终浓度为上述浓度的方式进行制备,与上述细胞混合前的上述液态组合物中的上述溶血磷脂的浓度没有特别限定,优选为上述溶血磷脂的、作为悬浮培养时的优选浓度而列举的上述浓度的1倍以上,更优选为10倍以上,更优选为100倍以上,更优选为1000倍以上,更优选为10000倍以上。
对于细胞凝聚抑制剂而言,作为添加剂,可以含有酶(特别是水解酶、激酶)、抗生素、激酶抑制剂、缓冲剂、增稠剂、着色剂、稳定剂、表面活性剂、乳化剂、防腐剂、保存剂、抗氧化剂等。酶没有特别限定,可以使用水解酶、激酶等,上述水解酶、激酶如上所述。抗生素没有特别限定,可以使用例如青霉素、链霉素、两性霉素b等。激酶抑制剂没有特别限定,优选为rock抑制剂。rock抑制剂没有特别限定,优选为上述y-27632。本发明的细胞凝聚抑制剂优选含有rock抑制剂,并使其相对于液体培养基的最终浓度为上述浓度,最优选含有rock抑制剂,并使其相对于液体培养基的最终浓度为10μm。作为缓冲剂,可以列举:磷酸缓冲液、tris-盐酸缓冲液、甘氨酸缓冲液等。作为增稠剂,可以列举:明胶、多糖类等。作为着色剂,可以举出酚红等。作为稳定剂,可以列举:白蛋白、葡聚糖、甲基纤维素、明胶等。作为表面活性剂,可以列举:胆固醇、烷基糖苷、烷基多糖苷、烷基单甘油基醚、糖苷、麦芽糖苷、新戊二醇类、聚氧乙烯二醇类、硫代糖苷、硫代麦芽糖苷、肽、皂苷、磷脂、脱水山梨糖醇脂肪酸酯、脂肪酸二乙醇胺等。作为乳化剂,可以列举:甘油脂肪酸酯、脱水山梨糖醇脂肪酸酯、丙二醇脂肪酸酯、蔗糖脂肪酸酯等。作为防腐剂,可以列举:氨基乙基磺酸、苯甲酸、苯甲酸钠、乙醇、依地酸钠、琼脂、dl-樟脑、柠檬酸、柠檬酸钠、水杨酸、水杨酸钠、水杨酸苯酯、二丁基羟基甲苯、山梨酸、山梨钾、氮气、脱氢乙酸、脱氢乙酸钠、2-萘酚、白糖、蜂蜜、对羟基苯甲酸异丁酯(paraoxyisobutylbenzoate)、对羟基苯甲酸异丙酯、对羟基苯甲酸乙酯、对羟基苯甲酸丁酯、对羟基苯甲酸丙酯、对羟基苯甲酸甲酯、l-薄荷醇、桉树油等。作为保存剂(preservingagent),可以列举:苯甲酸、苯甲钠、乙醇、依地酸钠、干燥亚硫酸钠、柠檬酸、甘油、水杨酸、水杨酸钠、二丁基羟基甲苯、d-山梨糖醇、山梨酸、山梨酸钾、脱氢乙酸钠、对羟基苯甲酸异丁酯、对羟基苯甲酸异丙酯、对羟基苯甲酸乙酯、对羟基苯甲酸丁酯、对羟基苯甲酸丙酯、对羟基苯甲酸甲酯、丙二醇、磷酸等。作为抗氧化剂,可以列举:柠檬酸、柠檬酸衍生物、维生素c及其衍生物、番茄红素、维生素a、类胡萝卜素类、维生素b及其衍生物、类黄酮类、多酚类、谷胱甘肽、硒、硫代硫酸钠、维生素e及其衍生物、α-硫辛酸及其衍生物、碧萝芷(pycnogenol)、flavangenol(フラバンジェノール)、超氧化物歧化酶(sod)、谷胱甘肽过氧化物酶、谷胱甘肽-s-转移酶、谷胱甘肽还原酶、过氧化氢酶、抗坏血酸过氧化物酶、以及它们的混合物等。
细胞凝聚抑制剂可以含有生长因子,优选至少含有fgf2或tgf-β1中的任一者。
<7.悬浮培养>
在本发明中,通过在上述液体培养基中使细胞悬浮进行培养来形成细胞聚集体。在本发明中,优选在假如液体培养基中不存在本发明所给定的脂质的情况下细胞就会形成超过上述优选尺寸的细胞聚集体的条件下,进行悬浮培养。
用于悬浮细胞培养的培养容器优选为细胞对容器内面的贴壁性低的容器。作为这样的细胞对容器内面的贴壁性低的容器,可以列举例如:用具有生物体适应性的物质进行了亲水性表面处理的板。例如,可以使用nunclontmsphera(thermofisherscientific公司),但没有特别限定。
培养容器的形状没有特别限定,可以列举例如:盘状、烧瓶状、孔状、袋状、悬浮培养瓶状等形状的培养容器。
悬浮培养可以是静置培养,也可以是在液体培养基流动的条件下进行的培养,优选为在液体培养基流动的条件下进行的培养。作为在液体培养基流动的条件下进行的培养,优选以促进细胞凝聚的方式在液体培养基流动的条件下进行的培养。作为以促进细胞凝聚的方式在液体培养基流动的条件下进行的培养,可以列举例如:以通过基于旋转流、摇动流等流动的应力(离心力、向心力)使细胞集中于一点的方式使液体培养基流动的条件下进行的培养、在通过线性往复运动使液体培养基流动的条件下进行的培养,特别优选利用了旋转流和/或摇动流的培养。
在旋转振荡培养(振荡培养)中,优选使容纳液体培养基和细胞的培养容器基本上沿着水平面画出圆、椭圆、扁平圆、扁平椭圆等封闭轨道进行旋转。旋转速度没有特别限定,上限可以优选为200rpm,更优选为150rpm,进一步优选为120rpm,更优选为115rpm,更优选为110rpm,更优选为105rpm,更优选为100rpm,更优选为95rpm,特别优选为90rpm。下限可以优选为1rpm,更优选为10rpm,进一步优选为50rpm,更优选为60rpm,更优选为70rpm,进一步优选为80rpm,更优选为90rpm。旋转振荡培养时的旋转幅度没有特别限定,下限例如可以为1mm,优选为10mm,更优选为20mm,最优选为25mm。旋转幅度的上限例可以为200mm,优选为100mm,优选为50mm,更优选为30mm,最优选为25mm。旋转振荡培养时的旋转半径也没有特别限定,优选设定得使旋转幅度为上述范围。旋转半径的下限例如可以为5mm,优选为10mm,上限例如可以为100mm,优选为50mm。通过将旋转振荡培养的条件设为该范围,可以容易地制造适当尺寸的细胞聚集体,因此优选。
摇摆培养(rockingculture)是通过摇摆(rocking)搅拌使液体培养基流动而进行的培养。摇摆培养通过使容纳液体培养基和细胞的培养容器基本上在与水平面垂直的平面内摇摆来进行。摇摆速度没有特别限定,例如可以以1分钟2~50次、优选为4~25次(将一次往返作为1次)进行摇摆。摇摆角度没有特别限定,例如可以为0.1°~20°,更优选为2°~10°。通过将摇摆培养的条件设为该范围,可以制造适当尺寸的细胞聚集体,因此优选。
还可以通过组合了上述旋转摇动与摇摆的运动而在搅拌的同时进行培养。
使用了悬浮培养瓶状培养容器的培养是在培养容器中使用搅拌桨对液体培养基进行搅拌的培养。转速、培养基量没有特别限定。如果是市售的悬浮培养瓶状培养容器,可以优选使用厂商推荐的培养液量。转速可以为例如10rpm以上且100rpm以下,但没有特别限定。
在悬浮培养中,可以适当调整细胞在液体培养基中的接种密度(悬浮培养开始时的细胞密度),作为下限,例如为0.01×105个细胞/ml,更优选为0.1×105个细胞/ml,更优选为1×105个细胞/ml。作为接种密度的上限,例如为20×105个细胞/ml,更优选为10×105个细胞/ml。接种密度在该范围时,容易形成适当大小的细胞聚集体。
悬浮培养时的培养液量可以根据使用的培养容器来适当调整,例如,在使用12孔板(俯视时每1孔的孔底面积为3.5cm2)时,可以为0.5ml/孔以上、且1.5ml/孔以下,更优选为1ml/孔。例如,在使用6孔板(俯视时每1孔的孔底面积为9.6cm2)时,可以为1.5ml/孔以上,优选为2ml/孔以上,更优选为3ml/孔以上,可以为6.0ml/孔以下,优选为5ml/孔以下,更优选为4ml/孔以下。例如,在使用125ml三角烧瓶(容量为125ml的三角烧瓶)时,可以为10ml/容器以上,优选为15ml/容器以上,更优选为20ml/容器以上,更优选为25ml/容器以上,更优选为20ml/容器以上,更优选为25ml/容器以上,更优选为30ml/容器以上,可以为50ml/容器以下,更优选为45ml/容器以下,更优选为40ml/容器以下。例如,在使用500ml三角烧瓶(容量为500ml的三角烧瓶)时,可以为100ml/容器以上,优选为105ml/容器以上,更优选为110ml/容器以上,更优选为115ml/容器以上,更优选为120ml/容器以上,可以为150ml/容器以下,更优选为145ml/容器以下,更优选为140ml/容器以下,更优选为135ml/容器以下,更优选为130ml/容器以下,更优选为125ml/容器以下。例如,在使用1000ml三角烧瓶(容量为1000ml的三角烧瓶)时,可以为250ml/容器以上,优选为260ml/容器以上,更优选为270ml/容器以上,更优选为280ml/容器以上,更优选为290ml/容器以上,可以为350ml/容器以下,更优选为340ml/容器以下,更优选为330ml/容器以下,更优选为320ml/容器以下,更优选为310ml/容器以下。例如,在使用2000ml三角烧瓶(容量为2000ml的三角烧瓶)时,可以为500ml/容器以上,更优选为550ml/容器以上,更优选为600ml/容器以上,可以为1000ml/容器以下,更优选为900ml/容器以下,更优选为800ml/容器以下,更优选为700ml/容器以下。例如,在使用3000ml三角烧瓶(容量为3000ml的三角烧瓶)时,可以为1000ml/容器以上,优选为1100ml/容器以上,更优选为1200ml/容器以上,更优选为1300ml/容器以上,更优选为1400ml/容器以上,更优选为1500ml/容器以上,可以为2000ml/容器以下,更优选为1900ml/容器以下,更优选为1800ml/容器以下,更优选为1700ml/容器以下,更优选为1600ml/容器以下。例如,在使用2l培养袋(容量为2l的一次性培养袋)时,可以为100ml/袋以上,更优选为200ml/袋以上,更优选为300ml/袋以上,更优选为400ml/袋以上,更优选为500ml/袋以上,更优选为600ml/袋以上,更优选为700ml/袋以上,更优选为800ml/袋以上,更优选为900ml/袋以上,更优选为1000ml/袋以上,可以为2000ml/袋以下,更优选为1900ml/袋以下,更优选为1800ml/袋以下,更优选为1700ml/袋以下,更优选为1600ml/袋以下,更优选为1500ml/袋以下,更优选为1400ml/袋以下,更优选为1300ml/袋以下,更优选为1200ml/袋以下,更优选为1100ml/袋以下。例如,在使用10l培养袋(容量为10l的一次性培养袋)时,可以为500ml/袋以上,更优选为1l/袋以上,更优选为2l/袋以上,更优选为3l/袋以上,更优选为4l/袋以上,更优选为5l/袋以上,可以为10l/袋以下,更优选为9l/袋以下,更优选为8l/袋以下,更优选为7l/袋以下,更优选为6l/袋以下。例如,在使用20l培养袋(容量为20l的一次性培养袋)时,可以为1l/袋以上,更优选为2l/袋以上,更优选为3l/袋以上,更优选为4l/袋以上,更优选为5l/袋以上,更优选为6l/袋以上,更优选为7l/袋以上,更优选为8l/袋以上,更优选为9l/袋以上,更优选为10l/袋以上,可以为20l/袋以下,更优选为19l/袋以下,更优选为18l/袋以下,更优选为17l/袋以下,更优选为16l/袋以下,更优选为15l/袋以下,更优选为14l/袋以下,更优选为13l/袋以下,更优选为12l/袋以下,更优选为11l/袋以下。例如,在使用50l培养袋(容量为50l的一次性培养袋)时,可以为1l/袋以上,更优选为2l/袋以上,更优选为5l/袋以上,更优选为10l/袋以上,更优选为15l/袋以上,更优选为20l/袋以上,更优选为25l/袋以上,可以为50l/袋以下,更优选为45l/袋以下,更优选为40l/袋以下,更优选为35l/袋以下,更优选为30l/袋以下。培养液量为该范围时,容易形成适当大小的细胞聚集体。
使用的培养容器的容量可以适当选择,没有特别限定,以俯视容纳液体培养基的部分的底面时的面积计,可以使用下限例如为0.32cm2、优选为0.65cm2、更优选为0.65cm2、进一步优选为1.9cm2、更优选为3.0cm2、3.5cm2、9.0cm2或9.6cm2的培养容器,作为上限,例如可以使用1000cm2、优选为500cm2、更优选为300cm2、更优选为150cm2、更优选为75cm2、更优选为55cm2、进一步优选为25cm2、进一步更优选为21cm2、进一步更优选为9.6cm2或3.5cm2的培养容器。
上述脂质存在下的细胞悬浮培养的温度、时间、co2浓度等条件没有特别限定。培养温度优选为20℃以上,更优选为35℃以上,优选为45℃以下,更优选为40℃以下,最优选为37℃。培养时间优选为0.5小时以上,更优选为12小时以上,优选为7天以下,更优选为72小时以下,更优选为48小时以下,最优选为24小时以下。作为培养时的co2浓度,优选为4%以上,更优选为4.5%以上,优选为10%以下,更优选为5.5%以下,最优选为5%。悬浮培养可以伴随进行传代。培养条件为该范围时,容易形成适当大小的细胞聚集体。
悬浮培养所使用的细胞可以预先通过通常方法进行保持培养。保持培养可以是使细胞贴壁于容器、担载体等培养基材进行培养的贴壁培养,也可以是使细胞悬浮于培养基中进行培养的悬浮培养。进行了保持培养的细胞用上述的剥离剂从培养基材上剥离或使细胞彼此剥离,充分使其分散后用于悬浮培养。为了使细胞分散,可以使其通过过滤器而使其分散为单细胞。
可以对通过上述脂质存在下的悬浮培养而形成的细胞聚集体进一步进行培养。作为细胞聚集体的进一步的培养方法,可以列举在不含上述激酶抑制剂的液体培养基中使细胞聚集体悬浮而进行培养的方法。作为进一步培养所使用的液体培养基,可以使用除了不含有上述激酶抑制剂以外与上述相同的液体培养基,作为培养的条件,可以使用与上述实质上相同的条件。在该进一步的培养中,优选以适当的频率进行培养基更换。培养基更换的频率随细胞种类而不同,可以包括优选以5天一次以上、更优选以4天一次以上、进一步优选以3天一次以上、更优选以2天一次以上、最优选以1天一次以上的频率进行培养基更换操作。在培养本发明所使用的多能干细胞的细胞聚集体时,特别优选该频率的培养基更换。培养基更换的方法没有特别限定,可以优选通过如下方式对细胞聚集体进行持续培养:将全部量的含有细胞聚集体的培养液回收于离心管,进行离心分离或以静置状态放置5分钟左右,保留沉淀的细胞聚集体而除去上清液,然后添加新鲜的液体培养基,使细胞聚集体平稳地分散后再次将细胞聚集体分散液体培养基返回到板等培养容器中。进一步培养的培养时间没有特别限定,优选为3天~7天。
本发明中的“添加上述溶血磷脂制备上述液体培养基的工序”是指在上述液体培养基中添加上述溶血磷脂使其达到上述浓度或上述比率。可以在将上述溶血磷脂添加于上述液体培养基后混合上述分离的细胞,也可以将上述分离的细胞混合于上述液体培养基中后添加上述溶血磷脂,优选将上述溶血磷脂添加于上述液体培养基后混合上述分离的细胞。将上述溶血磷脂添加于上述液体培养基时,可以添加稳定剂。上述稳定剂只要是有助于上述溶血磷脂在液体培养基中的稳定化、活性保持、防止对培养容器等的吸附等的物质即可,没有特别限定,可以使用白蛋白等蛋白质、乳化剂、表面活性剂、两亲性物质或肝素等多糖类等。“添加上述溶血磷脂制备上述液体培养基的工序”可以包括对添加了上述溶血磷脂的上述液体培养基(可以含有上述稳定剂)进行冷冻的工序、以及解冻的工序。
实施例
通过以下的实施例对本发明进一步详细地进行说明,但这些仅是示例,对本发明没有任何限定。
图1示意性地示出了下述实施例中细胞聚集体的制备步骤的概述。对人ips细胞进行贴壁培养,回收并分离细胞后,在液体培养基中进行悬浮培养,接着进行聚集体培养。在以下的说明中,开始悬浮培养的第一天作为“第0天(day0)”,将第二天以后分别作为“第1天(day1)”、“第2天(day2)”、“第3天(day3)”、“第4天(day4)”、“第5天(day5)”。悬浮培养进行至第2天,接着进行了3天(即,从开始悬浮培养至第5天)的聚集体培养。
<实施例1.人ips细胞的保持培养>
人ips细胞使用了tkdn4-m株(非专利文献1)。将人ips细胞接种于涂敷了matrigel(corning公司)或vitronectin(lifetechnologiesjapan公司)的细胞培养皿上,培养基使用mtesr1(stemcelltechnologies公司)或essential8tm(lifetechnologiesjapan公司)进行保持培养。作为传代时的细胞剥离剂,在matrigel上进行培养的情况下,使用trypleselect(lifetechnologiesjapan公司),在vitronectin上进行培养的情况下,使用0.02%edta(乙二胺四乙酸)溶液或accutase(lifetechnologiesjapan公司)。另外,仅在细胞接种时向培养基添加y-27632(和光纯药工业株式会社)并使其达到10μm的浓度。每天进行培养基更换。实验中使用了传代数至50次为止的人ips细胞。
<实施例2.人ips细胞的聚集体形成>
用trypleselect或edta溶液对人ips细胞进行3~5分钟处理来进行剥离,分散至单细胞后,使其通过40μm孔径细胞过滤器(becton,dickinsonandcompany)。将该细胞悬浮于包含最终浓度10μm的y-27632(和光纯药工业株式会社)的essential8tm培养基,将其一部分进行锥虫蓝染色并调查了细胞数。制备每1ml包含2×105个细胞后,以多个不同的浓度添加knockouttmserumreplacement(ksr;lifetechnologiesjapan公司)。以1ml/孔的比例将该细胞悬浮液接种于低贴壁12孔板(nunc公司)。接种了细胞的板在旋转振荡器(optima公司)上以90rpm的速度沿水平面进行旋转培养,使其画出旋转幅度(直径)为25mm圆,在5%co2、37℃的环境下进行悬浮培养,直至第2天。开始培养第2天用显微镜获取图像。
接着,将培养基更换为不含有上述ksr(脂质)及y-27632的essential8tm培养基,继续在相同条件下进行了3天(从上述悬浮培养开始至第5天)旋转振荡培养。这期间,每天进行培养基更换。作为更换培养基的方法,将全部量的含有细胞聚集体的培养基回收至离心管,使其静置5分钟左右,使细胞聚集体沉淀。然后,除去上清液,添加新鲜的培养基,使细胞聚集体平稳地再悬浮,再次接种于低贴壁12孔板。
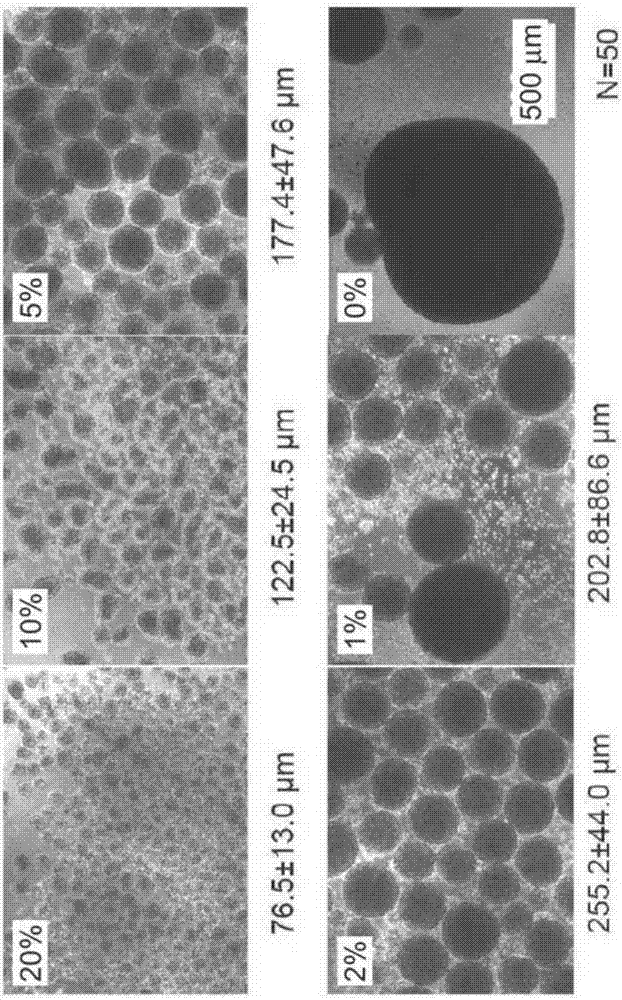
从培养开始起第5天(聚集体培养第3天)拍摄细胞聚集体的显微镜照片,通过图像分析软件(例如imagej)分析聚集体的大小,测定了聚集体的直径。培养后,将聚集体悬浮于trypleselect(lifetechnologiesjapan公司),在5%co2、37℃的环境下处理10分钟,使用微量移液器使聚集体分散为单细胞,通过锥虫蓝染色调查了细胞数。
上述的显微镜观察的结果是确认了:在未添加ksr的条件下形生了大的聚集体,但通过添加ksr,形成了具有约70~260μm直径的多个聚集体(图2)。ksr的添加浓度越高,聚集体的大小越小,可知由于ksr所含有的某种成分,具有抑制细胞凝聚的效果。另外,对于形成的聚集体,调查了各ksr浓度下葡萄糖消耗量与第5天的细胞数,结果(图3及图4、均为n=4)是ksr浓度为1~10%(v/v)(换算为脂质的含量时为0.00325~0.0325mg/ml)时,细胞显著增殖,由此可以确认,通过形成具有100μm~260μm直径的细胞聚集体,能够进行高效的细胞培养。另一方面可知,过度地抑制细胞凝聚时,细胞增殖也受到抑制。
<实施例3.ksr中含有的具有抑制凝聚作用的成分>
作为ksr的构成成分,已报告了如图5所示的成分(非专利文献2)。
在这些构成成分当中,对于被认为具有显示出抑制凝聚效果的可能性的蛋白质性各构成成分(albumaxtm、bsa、胰岛素、运铁蛋白),调查了通过添加是否具有人ips细胞的抑制凝聚作用。
具体进行了如下操作:添加多个不同浓度的富含脂质的白蛋白albumaxtmii(lifetechnologiesjapan公司)、普通的牛血清白蛋白(bsa;sigma公司)、胰岛素(sigma公司)或运铁蛋白(sigma公司)来代替实施例2中的ksr,除此以外,按照与实施例2相同的步骤进行了人ips细胞的旋转培养(各因子存在下的悬浮培养进行2天,接着在更换培养基后进行悬浮培养3天)。在添加albumaxtmii条件及添加bsa条件下开始培养,在第2天通过显微镜获取图像,在添加胰岛素条件及添加运铁蛋白条件下开始培养,在第1天通过显微镜获取图像。实施例3中添加的各因子的浓度以示出每100ml液体培养基的重量(单位g)的%(w/v)来表示。
其结果是确认了:在不含脂质的胰岛素及运铁蛋白的情况下,生成了大聚集体,与以0.2%(w/v)添加bsa时相比,以0.2%(w/v)添加脂质含量多的albumaxtmii时(换算为脂质的含量时为0.013mg/ml)凝聚明显受到抑制。由此可知,可以通过albumaxtmii中含有的脂质、即具有与白蛋白结合的能力的脂质来抑制凝聚(图6)。
<实施例4.形成了聚集体的人ips细胞的未分化性>
在实施例3中,利用accutase(lifetechnologiesjapan公司)将在含有albumaxtmii0.2%(w/v)的条件下形成的来自于人ips细胞的聚集体分散,用pbs(磷酸盐缓冲生理盐水)清洗。然后,用4%pfa(多聚甲醛)在室温下固定20分钟,然后用pbs清洗3次,用冷甲醇在-20℃下进行透化处理过夜。用pbs清洗3次后,用3%fbs(胎牛血清)/pbs封闭,通过荧光标记过的抗oct4抗体(cat.no.653703、biolegend公司)在4℃下染色1小时。用3%fbs(胎牛血清)/pbs清洗1次后,用facsverse(becton,dickinsonandcompany)对通过了细胞过滤器的细胞进行分析。其结果与常规贴壁培养时的人ips细胞相同,在聚集体的人ips细胞中,96%以上的细胞表达了未分化标记物oct4,可以确认形成聚集体的人ips细胞保持了未分化性(图7)。
<实施例5.基于磷脂的细胞凝聚抑制效果>
分析了使用磷脂对细胞聚集体形成造成的影响。
(步骤)
将按照实施例1的步骤培养的人ips细胞用trypleselect或edta溶液或accutase进行3~5分钟处理,进行剥离,分散至单细胞,然后使其通过40μm孔径细胞过滤器(becton,dickinsonandcompany),使其分散为单细胞。将该细胞悬浮于含有最终浓度10μm的y-27632(和光纯药工业株式会社)的essential8tm培养基,对其一部分进行锥虫蓝染色,调查了细胞数。制备成每1ml含有2×105个细胞。向该细胞悬浮液中添加无脂质牛血清白蛋白(bsa-ff;culturesure白蛋白、和光纯药)使其最终浓度为5mg/ml,并且添加y-27632(和光纯药工业株式会社)使其最终浓度10μm,再添加下述脂质,在与实施例2相同的条件下进行1天旋转振荡培养,进行了人ips细胞的悬浮培养。在该1天悬浮培养后,用显微镜对细胞进行观察。
本试验所使用的脂质或添加剂如下所述:
·lpa(溶血磷脂酸)(1-o-9z-十八碳烯酰-sn-甘油基-3-磷酸,钠盐、cat.no.62215、cayman公司、sn-1位具有油基)
·s1p(鞘氨醇-1-磷酸)(2s-氨基-1-(二氢磷酸酯)-4e-十八碳烯-1,3r-二醇,cat.no.62570、cayman公司)
在上述人ips细胞悬浮液中添加lpa为0.2μg/ml、s1p为0.2μg/ml。
作为对照试验,除了未添加上述脂质以外,在使用了与上述同样制备的细胞悬浮液的条件下进行了试验。
(结果)
将上述悬浮培养后的显微镜观察图像示于图8。观察的结果是可以确认:虽然在对照试验中形成了大聚集体(直径为1mm以上),但在含有lpa(溶血磷脂酸)或s1p(鞘氨醇-1-磷酸)0.2μg/ml的细胞悬浮液中,可形成约100μm直径的多个基本上均匀大小的球状细胞聚集体。
<实施例6.lpa及s1p的添加浓度与聚集体的大小>
对于实施例5确认了细胞凝聚抑制能力的lpa及s1p,使用含有不同添加浓度的细胞悬浮液进行了悬浮培养。
(lpa浓度)
人ips细胞悬浮液按照与实施例5相同的步骤制备,lpa的添加浓度以上述钠盐计为0.00128μg/ml、0.0064μg/ml、0.032μg/ml、0.16μg/ml、0.8μg/ml、4μg/ml、20μg/ml、100μg/ml,分别添加了最终浓度为5mg/ml的bsa-ff,再添加了最终浓度为10μm的y-27632(和光纯药工业株式会社)。在与实施例5相同的条件下悬浮培养1天,使用显微镜进行观察。
将观察结果示于图9。细胞聚集体的大小根据lpa浓度而变化。0.16~100μg/ml的lpa浓度时,形成了基本均匀大小的细胞聚集体。0.032μg/ml以下的lpa浓度时,形成了直径1mm以上的大细胞聚集体。
在lpa浓度为0.16~100μg/ml的观察图像中对30个细胞聚集体进行观察,以显微镜相片的比例尺进行比较,求出各细胞聚集体最宽部分的宽度(设为“φ”),计算出平均值±标准差。
lpa浓度为0.16μg/ml时,φ=124.9±26.5μm;lpa浓度为0.8μg/ml时,φ=68.2±9.8μm;lpa浓度为4μg/ml时,φ=57.2±8.7μm;lpa浓度为20μg/ml时,φ=39.9±8.0μm;lpa浓度为100μg/ml时,φ=41.6±9.9μm。
(s1p浓度)
人ips细胞悬浮液按照与实施例5相同的步骤制备,s1p的添加浓度以上述游离体计为0.00128μg/ml、0.0064μg/ml、0.032μg/ml、0.16μg/ml、0.8μg/ml、4μg/ml、20μg/ml、100μg/ml,分别添加了最终浓度为5mg/ml的bsa-ff,再添加了最终浓度为10μm的y-27632(和光纯药工业株式会社)。在与实施例5相同的条件下悬浮培养1天,使用显微镜进行观察。
将观察结果示于图10。细胞聚集体的大小根据s1p浓度而变化。0.032~100μg/ml的s1p浓度时,形成了基本均匀大小的细胞聚集体。0.0064μg/ml以下的s1p浓度时,形成了直径1mm以上的大细胞聚集体。
s1p浓度为0.032~100μg/ml的观察图像中对30个细胞聚集体进行观察,以显微镜相片的比例尺进行比较,求出各细胞聚集体最宽部分的宽度(设为“φ”),计算出平均值±标准差。
s1p浓度为0.16μg/ml时,φ=142.4±16.4μm;s1p浓度为0.8μg/ml时,φ=118.5±21.8μm;s1p浓度为4μg/ml时,φ=109.9±23.1μm;s1p浓度为20μg/ml时,φ=94.0±19.4μm;s1p浓度为100μg/ml时,φ=89.0±19.5μm。
<实施例7.lpa或s1p存在条件下对细胞增殖能力、未分化能力的影响>
在以不同浓度含有lpa或s1p的培养存在条件下进行人ips细胞的悬浮培养,测定葡萄糖消耗量、细胞产量、未分化标记物的阳性率,分析这些添加物对细胞造成的影响。
(方法)
人ips细胞悬浮液按照与实施例5相同的步骤制备,添加了最终浓度为0.2μg/ml或1μg/ml的lpa或s1p、最终浓度为5mg/ml的bsa-ff及最终浓度为10μm的y-27632(和光纯药工业株式会社)。作为对照,按照与实施例5相同的步骤制备,制备了仅添加有最终浓度为5mg/ml的bsa-ff及最终浓度为10μm的y-27632的细胞悬浮液。
在与实施例5相同的培养条件下对上述细胞悬浮液进行2天的悬浮培养。培养2天后,用添加了5mg/ml的bsa-ff的essential8tm培养基进行每天培养基的更换。测定培养第2天、第3天、第4天、第5天培养上清液中的葡萄糖浓度,计算出葡萄糖消耗量。另外,在培养第5天回收细胞聚集体,用accutase分散,悬浮于添加了5mg/ml的bsa-ff的essential8tm培养基。将该细胞悬浮液的一部分进行锥虫蓝染色,调查了细胞数。以300g对上述细胞悬浮液进行5分钟离心分离,然后去除上清液,用pbs(磷酸缓冲生理盐水)清洗细胞。然后,用4%pfa(多聚甲醛)在室温下固定20分钟,然后用pbs清洗3次,用冷甲醇在-20℃下进行透化处理过夜。用pbs清洗3次后,用3%fbs(胎牛血清)/pbs封闭,通过荧光标记过的抗sox2抗体(cat.no.656110、biolegend公司)及荧光标记抗oct4抗体(cat.no.653703、biolegend社)在4℃下染色1小时。用3%fbs(胎牛血清)/pbs清洗1次后,用facsverse对通过了细胞过滤器的细胞进行分析。
葡萄糖消耗量的侧定按照下述步骤进行。即,在培养基更换时采集培养上清液,用ysi公司制造的生物分析仪(ysi2950)测定残留葡萄糖量,计算出葡萄糖消耗量。
在培养第5天测定了细胞产量。细胞产量的测定按照下述步骤进行。即,用trypleselect对形成的细胞聚集体进行5~10分钟处理,通过用蓝色移液器吸头的移液操作使细胞单独分散,进行锥虫蓝染色后,血细胞计数器对细胞数进行计数,测定了细胞产量。
(结果)
图11的相片是培养开始后第2天观察的显微镜相片。在添加了lpa及s1p的试验中形成了适度大小(直径500μm以下)的细胞聚集体,相比之下,在仅添加了bsa-ff的试验中形成了大细胞聚集体(直径1mm以上)。
分别将葡萄糖消耗量的测定结果示于图12,将培养第5天的细胞产量示于图13。可知,与仅添加了bsa-ff的情况相比,在添加了lpa或s1p的情况下,葡萄糖消耗量及细胞数多,细胞显著增殖。
将未分化标记物的阳性率的测定结果示于图14。在含有1μg/ml的lpa或s1p的细胞悬浮液中进行悬浮培养的情况下,与单层贴壁培养时同样地95%以上的细胞表达了未分化标记物oct4及sox2,确认了通过添加脂质而形成的人ips细胞的聚集体保持了未分化性。
<实施例8.传代及扩大培养规模的探讨>
按照与实施例5相同的步骤制备人ips细胞悬浮液,添加最终浓度5mg/ml的albumaxtmii、最终浓度5mg/ml的bsa-ff及最终浓度10μm的y-27632,以培养基量为每1孔4ml、细胞密度为每1ml2×105个的方式接种于6孔板(sumitomobakelite公司),在旋转振荡器(optima公司)上于90rpm的旋转速度、5%co2、37℃的环境下培养2天,形成聚集体。然后,用含有最终浓度0.5mg/ml的albumaxtmii及最终浓度5mg/ml的bsa-ff的essential8tm培养基每天更换培养基,进行4天。接种细胞6天后按照下述的方法进行传代操作。回收细胞聚集体,用pbs清洗1次,然后用accutase在37℃下处理10分钟,将细胞分散后,添加了含有最终浓度5mg/ml的bsa-ff的essential8tm培养基。以300g离心分离3分钟,除去上清液后,与上述同样地制备人ips细胞悬浮液(添加最终浓度5mg/ml的albumaxtmii、最终浓度5mg/ml的bsa-ff及最终浓度10μm的y-27632),以培养基量为每个容器300ml、细胞密度为每1ml2×105个的方式接种于1l三角烧瓶(corning公司、产品编号431147),与上述6孔板同样地进行培养。接种5天后,与上述同样地制备人ips细胞悬浮液(添加最终浓度5mg/ml的albumaxtmii、最终浓度5mg/ml的bsa-ff及最终浓度10μm的y-27632),以培养基量为每个容器1.6l、细胞密度为每1ml2×105个的方式接种于3l三角烧瓶(corning公司、产品编号431252)并传代,将旋转速度设为70rpm,通过与上述实质上相同的方法进行培养操作。在各容量(4ml规模、300ml规模、1.6l规模)的培养中,在接种后1天和5天或6天拍摄了细胞聚集体的显微镜相片,而且在培养最后一天用与实施例2相同的方法调查了细胞数,用与实施例7相同的方法分析了未分化标记物的阳性率。作为对照,使用了通过实施例1的方法进行了贴壁培养的细胞。
上述的显微镜观察的结果是确认了:无论培养规模如何,均能同样地形成基本均匀大小的细胞聚集体,可以以保持未分化性的状态进行增殖(图15、16、17)。
通过引用将本说明书所引用的全部出版物、专利及专利申请的全部内容并入本说明书。
- 还没有人留言评论。精彩留言会获得点赞!