干细胞培养基及干细胞分离方法与流程
本发明属于干细胞培养领域,尤其涉及干细胞培养基及干细胞培养方法。
背景技术:
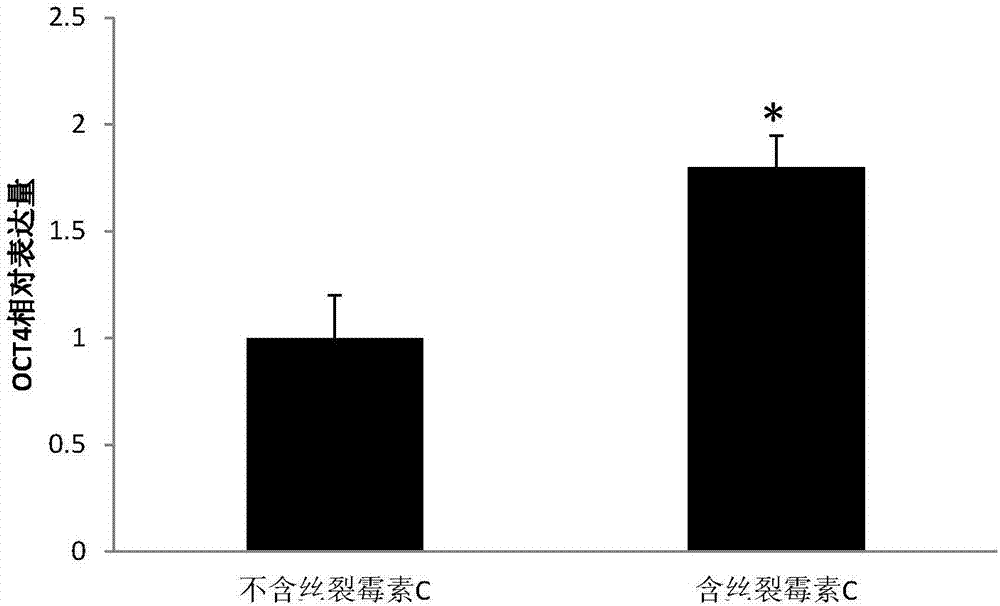
:干细胞(stemcell)是一种具有自我更新能力以及多向分化潜能的细胞。按照分化潜能,干细胞可分为三大类:全能干细胞、多能干细胞、单能干细胞。按照发育阶段,干细胞又可以分为:胚胎干细胞与成体干细胞。由于伦理学的限制,现在用于临床研究和应用的干细胞多为成体干细胞。成体干细胞来源于成年动物的许多组织和器官,包括造血干细胞、神经干细胞、脂肪干细胞、骨髓间充质干细胞、脐带干细胞、脐血干细胞等等。脂肪干细胞即脂肪来源干细胞或脂肪来源间充质干细胞(adipose-derivedstemcells,adscs),由于脂肪干细胞具有促进伤口愈合、损伤组织细胞再生和减少疤痕的能力及抗衰老能力,脂肪干细胞一经发现,就在以修复重建为主旨的整形外科及以年轻化为核心的美容医学领域引起轰动。随着国内消费水平的不断提高,新一代的微整形、抗衰老为主流的美容市场获得了突破性的机遇。其中脂肪干细胞产品以其独特的优势尤为引人注目。脂肪干细胞具有来源丰富,取材方便的特点。一方面,脂肪组织在体内分布广泛,储量丰富;另一方面,吸脂术是整形外科成熟的常规手术,手术风险小,其作为常规“废弃的副产品”获取容易。对患者来说,吸脂雕塑体形的同时享受干细胞的年轻化神奇功效是一次双赢的生命重塑,痛苦与恐惧感少于骨髓提取,亦无血源污染与免疫排斥风险,由此形成临床应用的优势。目前,脂肪干细胞的分离方法多为胶原酶消化法,导致细胞得率低,消化时间不好把握,容易影响细胞的活性。而且培养体系多采用含血清培养法,由于血清含有其它动物源成分,使培养体系存在引入外源性病毒的风险,从而使脂肪干细胞在临床应用中存在很大瓶颈。技术实现要素:有鉴于此,本发明提供了一种干细胞培养基及干细胞分离方法,能避免现有干细胞培养基大多含有血清而引入外源病毒的风险,而且公开的干细胞分离方法无需胶原酶消化法分离,能提高干细胞分离效率。本发明提供了一种干细胞培养基,包括基础培养基、血小板裂解物、l-谷氨酰胺和丝裂霉素c。作为优选,所述血小板裂解物在所述干细胞培养基的体积百分比为5%。作为优选,所述l-谷氨酰胺在所述干细胞培养基的浓度为4mmol/l。作为优选,所述丝裂霉素c在所述干细胞培养基的浓度为50ng/ml。本发明还提供了一种干细胞分离方法,包括以下步骤:获取离体组织,所述离体组织与干细胞培养基混合置于培养瓶中培养至所述离体组织中的细胞从所述组织中爬出来后刮除所述离体组织;继续培养,待培养基中细胞融合度达80%~90%时,消化后传代培养。作为优选,所述离体组织在所述干细胞培养基培养的第9天刮除离体组织。其中,所述分离方法中的干细胞培养基为本发明提供的干细胞培养基。其中,所述离体组织与干细胞培养基混合置于培养瓶中培养至所述离体组织中的细胞从所述组织中爬出来时,这时所述离体组织与干细胞培养基混合培养的时间为第9天。其中,细胞从所述离体组织爬出来,剔除组织,给细胞增殖留出空间,在细胞没有从离体组织爬出来之前,不能去除组织块。作为优选,所述离体组织为脂肪组织。作为优选,所述消化为edta-胰酶消化。作为优选,所述传代培养采用干细胞培养基进行传代培养。作为优选,所述离体组织与所述干细胞培养基混合前采用生理盐水清洗。作为优选,所述生理盐水含有质量百分比为1%的青霉素和质量百分比为1%的链霉素。作为优选,所述离体组织与所述干细胞培养基混合置于培养瓶中培养直至传代培养之间,每隔2-3天更换所述干细胞培养基。其中,所述待培养基中细胞融合度达80%~90%具体为在所述培养瓶中干细胞融合度。本发明所公开的干细胞培养基和所述的干细胞分离方法在干细胞培养与干细胞分离中的应用。本发明的目的针对现有干细胞培养基含有血清会增加引入外源病毒风险的技术缺点,而且传统的干细胞分离方法获得率低的技术缺陷。因此,本发明公开干细胞培养基及干细胞分离方法,所述干细胞培养基包括基础培养基、血小板裂解物、l-谷氨酰胺和丝裂霉素c,丝裂霉素c均可刺激脂肪干细胞上调干细胞维持因子oct4的表达,研究表明,oct4的作用是确保干细胞粘附在一起,而干细胞要茁壮成长必须粘附在一起,oct4通过将干细胞互相粘连,阻止干细胞分化,从而使脂肪干细胞在培养过程中避免分化,维持干细胞的“干性”(自我更新和分化能力)。本发明还提供一种干细胞分离方法,该干细胞分离方法为离体组织贴壁培养,操作方便,且能消除酶消化对细胞的不良影响,而且,采用本发明分离的脂肪干细胞传代多次后依然维持干性。此外,干细胞分离后培养时采用本发明的干细胞培养基,本发明的干细胞培养基为无血清培养体系,没有添加血清,可以避免引入外源病毒,增强细胞临床使用的安全性。附图说明为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。图1示脂肪干细胞形态;图2示脂肪干细胞在不同培养条件的oct4的相对表达量统计图;图3示p3代脂肪干细胞成脂分化;图4示p6代脂肪干细胞成脂分化。具体实施方式本发明提供了干细胞培养基及干细胞培养方法,用于解决现有技术中的技术缺陷。下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。其中,以下实施例的材料均为市售,dmem/f12为gibco品牌,血小板裂解物购自美国compassbiomedical、l-谷氨酰胺、丝裂霉素c均购自sigma。实施例1干细胞培养基的配置以dmem/f12为基础培养基,加入血小板裂解物、l-谷氨酰胺、丝裂霉素c,使血小板裂解物在干细胞培养基的体积百分比为5%;l-谷氨酰胺和丝裂霉素c在干细胞培养基的终浓度分别为50ng/ml、4mmol/l和50ng/ml,4℃避光保存备用。实施例2脂肪干细胞分离,步骤如下:步骤一、脂肪组织由专业的美容机构或专业医院通过吸脂手术获得。将分离的脂肪组织50ml转移到无菌采集瓶中,2-8℃保存,12h内进行脂肪干细胞分离。步骤二、将脂肪组织用含有双抗(质量百分比为1%青霉素和质量百分比为1%链霉素)的生理盐水冲洗3遍,洗去血细胞直至加入生理盐水后脂肪组织悬液澄清无血色。步骤三、800r/min离心5min,去掉下层液体。吸取上层组织块放入t75培养瓶中,稍稍倾斜培养瓶去除吸取步骤二清洗时带进去的生理盐水,并将组织块均匀地铺在培养瓶中,置37℃、5%co2的培养箱中培养。30min后组织块贴于培养面,轻柔地加入6-9ml实施例1制备的干细胞培养基浸润组织块,得到脂肪干细胞。实施例3脂肪干细胞培养,步骤如下,本实施例采用的培养基为实施例1配置的干细胞培养基:将实施例2步骤三得到的脂肪干细胞在第二天进行全量换液,以后每2-3天进行半量换液;当脂肪干细胞在干细胞培养基培养到第9天,脂肪干细胞从组织中爬出来后刮除组织块,让脂肪干细胞继续培养至细胞融合度达80%-90%时,去除培养瓶中培养基,用生理盐水冲洗细胞2次,加入0.25%edta-胰酶进行消化,待细胞变圆时加入等体积实施例1制备的干细胞培养基终止消化;离心收集后,用本发明的干细胞培养基重悬计数,并计算活率。如表1所示,50ml组织最终获得原代脂肪干细胞6.5×107个,活率为99.9%。表150ml脂肪组织的脂肪干细胞得率及活率细胞数(个)活率(%)原代脂肪干细胞6.5±0.1×10799.9±0.01调整细胞密度为0.5×105个/ml进行传代;当p1代细胞融合度达到90%以上时;调整细胞密度为0.5×105个/ml进行传代,后续均按此标准进行传代培养。如图1所示,脂肪干细胞贴壁,成成纤维状,传至p3代、p6代时细胞形态没有出现变化。实施例4流式细胞技术检测脂肪干细胞表型,步骤如下:取实施例3的p3代脂肪干细胞,将细胞转入流式管中,600g离心3min,弃上清,加入1mlpbs冲洗2遍。200μlpbs重悬细胞后,分别加入cd34、cd45、cd29、cd73、cd90、cd105和hla-dr抗体。室温孵育30min后,pbs洗涤3次,弃上清后pbs重悬细胞,流式细胞技术检测细胞表型。表2adscs细胞流式表型cd34cd45cd29cd73cd90cd105hla-drp31.01±0.520.33±0.2199.76±0.1598.95±0.1399.84±1.5699.49±1.170.73±0.015p60.15±0.060.18±0.0399.97±0.4599.95±0.0599.94±0.0499.79±0.470.10±0.01结果如表2所示,采用本发明的干细胞培养基和干细胞分离方法(实施例3的干细胞分离方法和实施例1的干细胞培养基),分离培养获得的脂肪干细胞完全符合脂肪干细胞表面标志的鉴定标准,即高表达cd29,cd73,cd90,cd105,低表达或不表达cd34、cd45和hla-dr,p3代和p6代无显著差异,说明应用本发明公开的干细胞培养基和分离方法所分离培养的脂肪干细胞多次传代后并未发生分化。实施例5取实施例3的p6代脂肪干细胞,按1×106细胞/每孔铺于6孔板,每孔2ml。第二天换液,其中3个孔作为实验组,每孔2ml更换为本发明的干细胞培养基(含dmem/f12、血小板裂解物、l-谷氨酰胺和丝裂霉素c),其细胞标记为含丝裂霉素c组。另外3孔作为对照组,每孔2ml更换为不含丝裂霉素c的培养基(即只含有dmem/f12、血小板裂解物和l-谷氨酰胺),其细胞标记为不含丝裂霉素c组,将两组细胞于37℃,5%co2的培养箱中继续培养24h。24h后收集细胞,trizol裂解法提取rna。并按系列反应体系和反应步骤反转录成cdna:1、配置下列反应体系,得到混合物:2、将上述步骤1的混合物:放入pcr仪在65℃,反应5min后迅速移至冰上,得到混合物;3、将上述步骤2的混合物添加4μl的5×buffer和2μl的0.1m的dtt后,轻轻混匀后置于pcr仪中,在37℃反应2min,得到混合物;4、将步骤3的混合物室温下加入1ulm的mlv后轻混匀,pcr仪中在37℃,反应50min后,在70℃反应15min后,在4℃反应5min,得到cdna。以步骤4获得的cdna为模板,gapdh为内参,qpcr检测含丝裂霉素c组和不含丝裂霉素c组的oct4的相对表达量。其引物序列分别为gapdh的引物如seqidno.3-seqidno.4所示;oct4的引物如seqidno.1-seqidno.2所示。采用常规的2-△△ct方法计算脂肪干细胞在不同培养条件的oct4的相对表达量。结果如图2所示,含有丝裂霉素c组的oct4的表达量显著增高,是对照组的1.7倍,p<0.05。实施例6脂肪干细胞成脂诱导分化,步骤如下:采用adipogenesisdifferentiationkit(gibco)试剂盒对实施例3所获取的p3代和p6代脂肪干细胞进行成脂诱导分化实验。收集p3代和p6代脂肪干细胞,以2×104个/孔接种于12孔板,采用本发明的干细胞培养基培养脂肪干细胞,于37℃,5%co2培养箱中培养。24h后细胞融合度达到80%时,将p3和p6代细胞分成实验组和对照组,实验组更换成诱导培养基继续培养,每3天换新鲜诱导液。对照组更换成本发明的干细胞培养基,对照组每3天更换本发明的干细胞培养基,持续培养14-21天。诱导14-21天后,油红0染色鉴定。结果如图2、图3所示,本发明所获取的p3代和p6代脂肪干细胞具有成脂分化能力,且传代至p6代时仍能维持其干性。以上所述仅是本发明的优选实施方式,应当指出,对于本
技术领域:
的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。sequencelisting<110>深圳市泰华细胞工程有限公司<120>干细胞培养基及干细胞分离方法<130>s17p0746<160>4<170>patentinversion3.5<210>1<211>20<212>dna<213>人工序列<400>1caaagcagaaaccctcgtgc20<210>2<211>22<212>dna<213>人工序列<400>2tctcactcggttctcgatactg22<210>3<211>22<212>dna<213>人工序列<400>3acaactttggtatcgtggaagg22<210>4<211>19<212>dna<213>人工序列<400>4gccatcacgccacagtttc19当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1