甲基化基因组合物及制备诊断预示三阴性型乳腺癌骨转移试剂盒的用途的制作方法
本发明属于生物化学领域,涉及诊断组合物及诊断试剂盒,具体涉及一种甲基化基因诊断组合物及在制备诊断预示不同分子亚型乳腺癌骨转移的诊断试剂盒方面的应用。
背景技术:
乳腺癌是威胁女性生命健康的恶性肿瘤之一,每年约有40-45万人死于乳腺癌(参考文献:不同分子亚型乳腺癌骨转移患者的临床特征和预后分析,西安交通大学学报·医学版,2017年9月第38卷第5期)。乳腺癌非常容易发生远处转移,骨是乳腺癌最常见的远处转移部位,大于50%的患者首发转移部位是骨组织(参考文献:genesassociatedwithbreastcancermetastatictobone,jclinoncol,2006;implicationsofbone-onlymetastasesinbreastcancer:favorablepreferencewithexcellentoutcomesofhormonereceptorpositivebreastcancer,cancerrestreat,2011)。根据雌激素受体(estrogenreceptor,er)、孕激素受体(progesteronereceptor,pr)、人表皮生长因子受体-2(humanepidermalgrowthfactorreceptor-2,her-2)的表达情况,可将乳腺癌分为4个亚型,分别为:luminala型、luminalb型、her-2过表达型和三阴性乳腺癌(参考文献:geneexpressionpatternsofbreastcarcinomasdistinguishtumorsubclasseswithclinicalimplications,pnas,2001)。研究表明,乳腺癌骨转移的预后与其分子分型、临床分期、淋巴结状态等密切相关(参考文献:prevalenceandriskfactorsofbonemetastasisandskeletalrelatedeventsinpatientswithprimarybreastcancerinjapan,intjclinonco,2014)。不同分子亚型乳腺癌特定的分子生物学和临床病理特征,决定了其治疗方式及预后的差异。不同分子亚型乳腺癌骨转移的基因表型也存在差异。
早期诊断乳腺癌骨转移是挽救患者生命的关键。目前,放射性核素骨扫描(ect)、电子计算机断层扫描(ct)、核磁共振(mri)、正电子发射计算机断层扫描(pet-ct)和骨组织活检是发现和确诊乳腺癌骨转移的金标准。但是,这些方法均存在不同的不足,比如检查费用高,介入诊断增加了患者的负担。这增加了乳腺癌患者骨转移常规检测的压力。
dna甲基化是指基因组cpg二核苷酸的胞嘧啶5号碳原子上共价结合一个甲基基团,其主要参与基因的表达调控。许多基因的甲基化被证明与各种临床疾病密切相关,有些甚至可以被确定为疾病致病的独立因素。dna甲基化异常与肿瘤等疾病密切相关。因此,甲基化基因不仅可作为肿瘤分子诊断的标志物,同时也可作为分子治疗的靶标(参考文献:dna甲基化标志物在分子诊断与治疗中的价值,分子诊断与治疗杂志2009年9月第1卷第3期)。
研究表明,乳腺癌原发肿瘤的多种基因表达是发生骨转移所必需的,因而认为特定器官的转移是多因子共同作用的结果,该结论提示,骨的特异性转移是骨对原发肿瘤内不同表型肿瘤细胞的选择和骨源性因子诱导的结果,不同分子亚型乳腺癌骨转移的甲基化基因有望成为成为乳腺癌骨转移的诊断标志物(参考文献:kangy,siegelpm,shuw,etal.amultigenicprogrammediatingbreastcancermetastasistobone.cancercell,2003)。
申请人旨在研究比较发生骨转移与未发生骨转移的乳腺癌患者血清中甲基化基因的差异,发现、验证可以用作诊断、预示不同分子亚型乳腺癌骨转移的甲基化基因标志物,以提供一种通过血液即可快速诊断、预示不同分子亚型乳腺癌骨转移的试剂盒和方法。
技术实现要素:
本发明的目的在于克服现有技术的不足,提供一种甲基化基因诊断组合物,制备成一种检测成本低、非介入性、方便快捷诊断预示不同分子亚型乳腺癌骨转移的诊断试剂盒。
本发明的上述目的是通过下面的技术方案得以实现的:
一、luminala型乳腺癌骨转移
一种甲基化基因诊断组合物,由甲基化pitx1和甲基化amot组成。
上述诊断组合物在制备诊断预示luminala型乳腺癌骨转移的诊断试剂盒方面的应用。
一种用于诊断预示luminala型乳腺癌骨转移的诊断试剂盒,包括甲基化pitx1和甲基化amot的pcr扩增引物。
优选地,所述的诊断试剂盒中,甲基化pitx1的pcr扩增上游引物如sequenceno.1所示,pcr扩增下游引物如sequenceno.2所示。
优选地,所述的诊断试剂盒中,甲基化amot的pcr扩增上游引物如sequenceno.4所示,pcr扩增下游引物如sequenceno.5所示。
优选地,所述的诊断试剂盒中还包括甲基化pitx1和甲基化amot的焦磷酸测序引物。
优选地,所述的诊断试剂盒中,甲基化pitx1的焦磷酸测序引物如sequenceno.3所示。
优选地,所述的诊断试剂盒中,甲基化amot的焦磷酸测序引物如sequenceno.6所示。
优选地,所述的诊断试剂盒中,还包括pcr扩增和焦磷酸测序所需的酶和试剂。
一种诊断预示luminala型乳腺癌骨转移的方法,包括如下步骤:
步骤s1,采集luminala型乳腺癌患者空腹静脉血,自然凝固后离心分离出血清;
步骤s2,提取血清总dna,经pcr扩增、dna亚硫酸盐修饰和焦磷酸测序测定总dna中甲基化pitx1和甲基化amot的甲基化指数,依次用x1、x2表示;
步骤s3,将x1、x2值代入二元逻辑回归方程y=1/[1+exp(1.499x1+2.302x2-0.258)]得到y值,y值小于0.238预示该乳腺癌患者发生骨转移,大于0.238预示未发生骨转移。
二、luminalb型乳腺癌骨转移
一种甲基化基因诊断组合物,由甲基化ptpn1和甲基化slit2组成。
上述诊断组合物在制备诊断预示luminalb型乳腺癌骨转移的诊断试剂盒方面的应用。
一种用于诊断预示luminalb型乳腺癌骨转移的诊断试剂盒,包括甲基化ptpn1和甲基化slit2的pcr扩增引物。
优选地,所述的诊断试剂盒中,甲基化ptpn1的pcr扩增上游引物如sequenceno.7所示,pcr扩增下游引物如sequenceno.8所示。
优选地,所述的诊断试剂盒中,甲基化slit2的pcr扩增上游引物如sequenceno.10所示,pcr扩增下游引物如sequenceno.11所示。
优选地,所述的诊断试剂盒中,还包括甲基化ptpn1和甲基化slit2的焦磷酸测序引物。
优选地,所述的诊断试剂盒中,甲基化ptpn1的焦磷酸测序引物如sequenceno.9所示。
优选地,所述的诊断试剂盒中,甲基化slit2的焦磷酸测序引物如sequenceno.12所示。
优选地,所述的诊断试剂盒中,还包括pcr扩增和焦磷酸测序所需的酶和试剂。
一种诊断预示luminalb型乳腺癌骨转移的方法,包括如下步骤:
步骤s1,采集luminalb型乳腺癌患者空腹静脉血,自然凝固后离心分离出血清;
步骤s2,提取血清总dna,经pcr扩增、dna亚硫酸盐修饰和焦磷酸测序测定总dna中甲基化ptpn1和甲基化slit2的甲基化指数,依次用x1、x2表示;
步骤s3,将x1、x2值代入二元逻辑回归方程y=1/[1+exp(2.016x1+1.898x2-0.455)]得到y值,y值小于0.310预示该乳腺癌患者发生骨转移,大于0.310预示未发生骨转移。
三、her-2过表达型乳腺癌骨转移
一种甲基化基因组合物,由甲基化mylk2、甲基化efemp1和甲基化sostdc1组成。
上述诊断组合物在制备诊断预示her-2过表达型乳腺癌骨转移的诊断试剂盒方面的应用。
一种用于诊断预示her-2过表达型乳腺癌骨转移的诊断试剂盒,包括甲基化mylk2、甲基化efemp1和甲基化sostdc1的pcr扩增引物和焦磷酸测序引物。
优选地,所述的诊断试剂盒中,甲基化mylk2的pcr扩增上游引物如sequenceno.13所示,pcr扩增下游引物如sequenceno.14所示,焦磷酸测序引物如sequenceno.15所示。
优选地,所述的诊断试剂盒中,甲基化efemp1的pcr扩增上游引物如sequenceno.16所示,pcr扩增下游引物如sequenceno.17所示,焦磷酸测序引物如sequenceno.18所示。
优选地,所述诊断试剂盒中,甲基化sostdc1的pcr扩增上游引物如sequenceno.19所示,pcr扩增下游引物如sequenceno.20所示,焦磷酸测序引物如sequenceno.21所示。
优选地,所述的诊断试剂盒中,还包括pcr扩增和焦磷酸测序所需的酶和试剂。
一种诊断预示her-2过表达型乳腺癌骨转移的方法,包括如下步骤:
步骤s1,采集her-2过表达型乳腺癌患者空腹静脉血,自然凝固后离心分离出血清;
步骤s2,提取血清总dna,经pcr扩增、dna亚硫酸盐修饰和焦磷酸测序测定总dna中甲基化mylk2、甲基化efemp1和甲基化sostdc1的甲基化指数,依次为x1、x2、x3;
步骤s3,将x1、x2、x3代入方程y=1/[1+exp(1.342x1+1.401x2+1.345x3-2.035)]得到y值,y值小于0.308预示该乳腺癌患者发生骨转移,大于0.308预示未发生骨转移。
四、三阴性乳腺癌骨转移
一种甲基化基因诊断组合物,由甲基化mylk3和甲基化scara5组成。
上述诊断组合物在制备诊断预示三阴性型乳腺癌骨转移的诊断试剂盒方面的应用。
一种用于诊断预示三阴性型乳腺癌骨转移的诊断试剂盒,包括甲基化mylk3和甲基化scara5的pcr扩增引物。
优选地,所述的诊断试剂盒中,甲基化mylk3的pcr扩增上游引物如sequenceno.22所示,pcr扩增下游引物如sequenceno.23所示。
优选地,所述的诊断试剂盒中,甲基化scara5的pcr扩增上游引物如sequenceno.25所示,pcr扩增下游引物如sequenceno.26所示。
优选地,所述诊断试剂盒中还包括甲基化mylk3和甲基化scara5的焦磷酸测序引物。
优选地,所述诊断试剂盒中甲基化mylk3的焦磷酸测序引物如sequenceno.24所示。
优选地,所述诊断试剂盒中甲基化scara5的焦磷酸测序引物如sequenceno.27所示。
优选地,所述的诊断试剂盒中,还包括pcr扩增和焦磷酸测序所需的酶和试剂。
一种诊断预示三阴性型乳腺癌骨转移的方法,包括如下步骤:
步骤s1,采集三阴性型乳腺癌患者空腹静脉血,自然凝固后离心分离出血清;
步骤s2,提取血清总dna,经pcr扩增、dna亚硫酸盐修饰和焦磷酸测序测定总dna中甲基化mylk3和甲基化scara5的甲基化指数,依次用x1、x2表示;
步骤s3,将x1、x2值代入二元逻辑回归方程y=1/[1+exp(1.775x1+1.236x2-0.398)]得到y值,y值小于0.366预示该乳腺癌患者发生骨转移,大于0.366预示未发生骨转移。
本发明发现,血清甲基化pitx1和甲基化amot可以联合用于诊断预示luminala型乳腺癌是否骨转移,在独立验证集中诊断预示准确率达90%以上;血清甲基化ptpn1和甲基化slit2可以联合用于诊断预示luminalb型乳腺癌是否骨转移,在独立验证集中诊断预示准确率达90%以上;血清甲基化mylk2、甲基化efemp1和甲基化sostdc1可以联合用于诊断预示her-2过表达型乳腺癌是否骨转移,在独立验证集中诊断预示准确率达90%以上;血清甲基化mylk3和甲基化scara5可以联合用于诊断预示三阴性型乳腺癌是否骨转移,在独立验证集中诊断预示准确率达90%以上。使用上述血清甲基化基因诊断预示不同分子亚型乳腺癌骨转移准确度高,检测成本低、非介入性、方便快捷,极大降低患者痛苦和负担。
附图说明
图1为测试集中甲基化pitx1和甲基化amot联合用于诊断区分luminala型乳腺癌未转移和luminala型乳腺癌骨转移的roc曲线;
图2为验证集中甲基化pitx1和甲基化amot联合用于诊断区分luminala型乳腺癌未转移和luminala型乳腺癌骨转移的准确率;
图3为测试集中甲基化ptpn1和甲基化slit2联合用于诊断区分luminalb型乳腺癌未转移和luminalb型乳腺癌骨转移的roc曲线;
图4为验证集中甲基化ptpn1和甲基化slit2联合用于诊断区分luminalb型乳腺癌未转移和luminalb型乳腺癌骨转移的准确率;
图5为测试集中甲基化mylk2、甲基化efemp1和甲基化sostdc1联合用于诊断区分her-2过表达型乳腺癌未转移和her-2过表达型乳腺癌骨转移的roc曲线;
图6为验证集中甲基化mylk2、甲基化efemp1和甲基化sostdc1联合用于诊断区分her-2过表达型乳腺癌未转移和her-2过表达型乳腺癌骨转移的准确率;
图7为测试集中甲基化mylk3和甲基化scara5联合用于诊断区分三阴性型乳腺癌未转移和三阴性型乳腺癌骨转移的roc曲线;
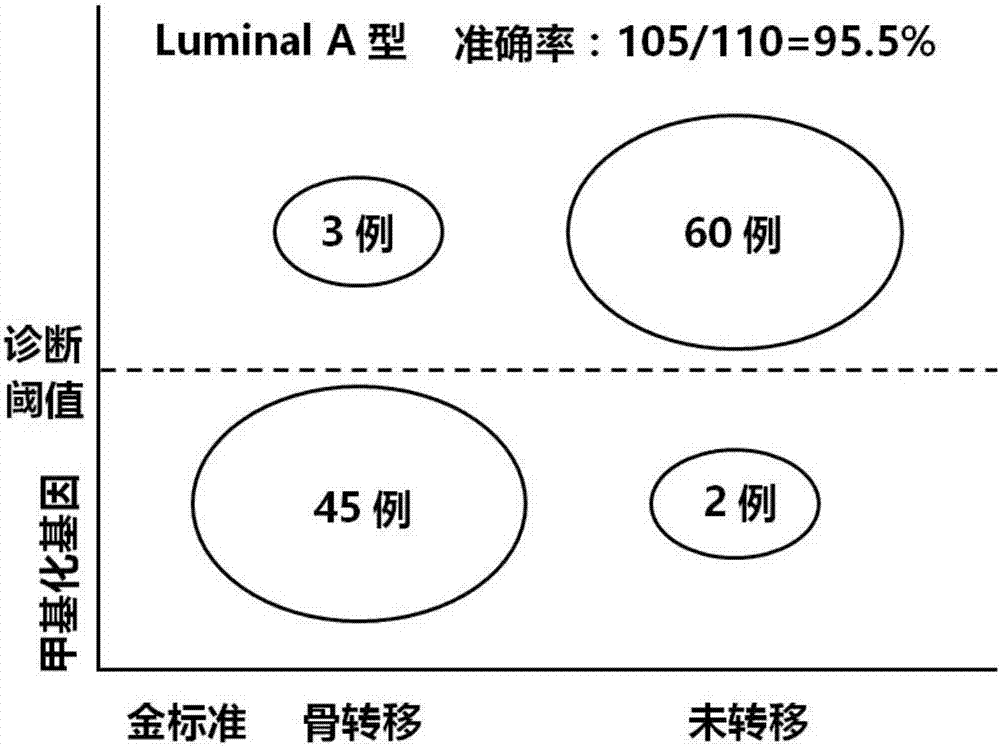
图8为验证集中甲基化mylk3和甲基化scara5联合诊断区分三阴性型乳腺癌未转移和三阴性型乳腺癌骨转移的准确率。
具体实施方式
下面结合附图和实施例具体介绍本发明实质性内容,但并不以此限定本发明的保护范围。
本项目所有乳腺癌样本均取自2014年9月至2017年9月来南通大学附属医院或南通市第一人民医院或南京鼓楼医院检查确诊为乳腺癌且不合并其他恶性肿瘤的患者。所有样本根据免疫组化检测分为luminala型、luminalb型、her-2过表达型和三阴性型,各种分子亚型根据是否转移分为乳腺癌未转移组和乳腺癌骨转移组,且乳腺癌骨转移组各病例均属于骨为首发远处转移部位。乳腺癌未转移组和乳腺癌骨转移组经过放射性核素骨扫描(ect)、电子计算机断层扫描(ct)、核磁共振(mri)、正电子发射计算机断层扫描(pet-ct)和/或组织活检等检查证实。各分子亚型中乳腺癌未转移组和骨转移组患者年龄比较无明显差异,具有可比性。最后将各组样本随机对半均分为测试集和验证集。
所有样本分组信息及样本数经上述金标准诊断后如下表所示:
血清标本的收集:采集患者空腹静脉血5.0ml,自然凝固后离心(4000r/min,2860×g)7min后分离出血清,置于-80℃保存,用于检测血清中目标甲基化基因。
实施例1:luminala型乳腺癌骨转移
一、实验样本和实验方法
1、实验样本
luminala型中乳腺癌未转移组、luminala型乳腺癌骨转移组的测试集和验证集。
2、血清总dna提取
血清dna提取按照dnabloodmidikit说明书进行,每份样本采用0.8ml血清。提取的dna纯度用紫外分光光度计检测,吸光度a260/a280比值在1.7-2.0之间进行后续操作。计算dna含量,-70℃保存备用。
3、dna亚硫酸盐修饰和焦磷酸测序检测
dna亚硫酸盐修饰:
取1μgdna,按照dnamethylation-goldkit说明书对基因组dna进行甲基化修饰后,-70℃保存备用。多聚酶链式反应:采用pcr对样品中pitx1和amot基因启动子甲基化区域进行扩增。反应体系包括亚硫酸盐处理后模板2μl,10×pcrbuffer,0.25u/μlhotstartaq酶,0.5mmol/ldntp,上下游引物各1μl,总体积50μl。以双蒸水作为空白对照。
焦磷酸测序检测:
(1)分别取45μlpcr扩增产物至psq96platelow样品制备板a中,各加入45μl结合缓冲液和8μl包被有链亲和素的磁珠,43℃振荡25min。将结合pcr产物的磁珠转移至变性缓冲液的板b中,使双链dna充分变性。转移结合有单链pcr产物的磁珠至150μl退火缓冲液的板c涡旋振荡洗涤3min。
(2)测序引物杂交:将结合单链pcr产物的磁珠转入50μl复性缓冲液中,加入10μl测序引物,75℃杂交7min。
(3)使用psq96焦磷酸测序仪和测序反应试剂盒(pyrogoldreagents),分别检测pitx1和amot启动子区域内甲基化位点的碱基频率。
其中pcr扩增引物和测序引物如下:
pitx1
上游5’-ggaaggtatttagtataggtgagtttga-3’
下游5’-aaaccttaatattcactacactttatc-3’
测序5’-gtgtttattttggattgtttaatt-3’
amot
上游5’-tgagttaatatgaaagaagatagta-3’
下游5’-tgatctctacatctcaactaatatac-3’
测序5’-gtaggtttatttaggtt-3’
通过使用焦磷酸测序仪中等位基因频率分析功能对各甲基化位点进行分析。按照如下公式计算各基因启动子区域的甲基化指数,该指数可以反映该基因启动子区域的甲基化程度:
4、统计学处理
数据采用spss19.0进行分析。计量资料用均值±偏差表示,采用t检验,计数资料用百分率表示,采用χ2检验,以p<0.05为差异有统计学意义,并建立roc曲线,计算曲线下面积(areaunderthecurve,auc)及95%可信区间。运用logistic回归筛选变量,建立回归方程,产生一组新变量y。对新变量及各单项指标进行roc曲线分析。
二、实验结果
1、luminala型乳腺癌未转移和骨转移组甲基化pitx1和甲基化amot的甲基化程度
在测试集中,分别测定各样本中甲基化pitx1和甲基化amot的甲基化指数。与luminala型乳腺癌未转移组相比,luminala型乳腺癌骨转移组样本中甲基化pitx1和甲基化amot的甲基化指数显著升高,骨转移组甲基化pitx1和甲基化amot的甲基化指数分别为未转移组甲基化指数的(3.5±0.4)倍、(3.3±0.5)倍。
2、甲基化pitx1和甲基化amot的甲基化指数单独用于诊断区分luminala型乳腺癌未转移和luminala型乳腺癌骨转移的roc曲线分析
roc曲线评价法的原理:
诊断试验的基本评价指标有敏感度、特异性等,综合评价指标有youden指数、roc、auc等。对于诊断试验的评价,首先需要通过金标准知道待测样本的真实组别。对于按金标准确定的疾病组(相当于本发明中的乳腺癌骨转移组)和健康组(相当于本发明中的乳腺癌未转移组),采用诊断试验检测的结果可以分为如下情况:
阳性(truepositive,tp);诊断试验检测为阳性(与金标准结果一致);
阴性(truenegative,tn);诊断试验检测为阴性(与金标准结果一致);
假阳性(falsepositive,fp):诊断试验检测为阳性(与金标准结果不一致);
假阴性(falsenegative,fn):诊断试验检测为阴性(与金标准结果不一致)。
可以用下表表示:
诊断试验的敏感度=a/(a+c);诊断试验的特异性=d/(b+d)。通过敏感度和特异性可以得出诊断试验相对于金标准的诊断灵敏程度和特异程度。敏感度高代表将疾病例诊断为阴性的个数少,漏诊率低;特异性高代表将健康例诊断为阳性的个数少,误诊率低。
roc曲线正是基于上述敏感度和特异性绘制出的曲线。以诊断试验中可能的诊断界值作为诊断点,根据上述表格计算出相应的敏感度和特异性。然后,以敏感度为纵坐标,1-特异性为横坐标,将各诊断点时各点的敏感度和特异性点在坐标图中标出,连接坐标点得到平滑曲线,该曲线即为roc曲线。诊断点设置的越多越密,得到的roc曲线就越平滑。
roc曲线是以每一个检测结果作为可能的诊断界值,其曲线下面积auc的大小表明了诊断试验准确度的大小。roc曲线下面积auc作为诊断试验真实性评价的固有准确度指标已被普遍认可,auc为0.5时,即无诊断意义;auc在0.5~0.7时,表示诊断准确率较低;auc在0.7~0.9时,表示诊断准确性中等;auc>0.9时,表示诊断有较高的准确性。
在spss19.0中绘制甲基化pitx1和甲基化amot的甲基化指数单独用于诊断区分luminala型乳腺癌未转移和luminala型乳腺癌骨转移的roc曲线,auc分别为0.715、0.707,具有中等的准确性。
3、甲基化pitx1和甲基化amot的甲基化指数联合诊断模型的构建及用于诊断区分luminala型乳腺癌未转移和luminala型乳腺癌骨转移的roc曲线分析
以测试集样本中甲基化pitx1和甲基化amot的甲基化指数作为自变量(设x1=甲基化pitx1的甲基化指数,x2=甲基化amot的甲基化指数),以组别(即根据金标准该样本属于骨转移组还是未转移组)作为应变量,对甲基化pitx1和甲基化amot在luminala型乳腺癌未转移和luminala型乳腺癌骨转移样本中的甲基化指数进行二元逻辑回归,得到二元逻辑回归方程:y=1/[1+exp(1.499x1+2.302x2-0.258)];
再将各样本中甲基化pitx1和甲基化amot的甲基化指数代入该二元逻辑回归方程,即可得到各个样本的回归值y,以可能的回归值y作为诊断点,计算灵敏度和特异性,据此绘制roc曲线(如图1所示),auc为0.935,具有较高的准确性。根据roc曲线的坐标计算维登指数=特异性+灵敏度-1,维登指数最大值时对应的y值为能进行诊断区分luminala型乳腺癌未转移组和骨转移组的最佳cut-off值0.238(即诊断阈值)。
4、验证集中验证甲基化pitx1和甲基化amot的甲基化指数联合诊断区分luminala型乳腺癌未转移和luminala型乳腺癌骨转移的准确程度
在验证集中,将各样本甲基化pitx1和甲基化amot的甲基化指数代入上述回归模型,得到各样本的回归值y,y低于诊断阈值0.238的预测为luminala型乳腺癌骨转移,高于诊断阈值0.238的预测为luminala型乳腺癌未转移,准确度为95.5%(105/110),如图2所示。
实施例2:luminalb型乳腺癌骨转移
一、实验样本和实验方法
1、实验样本
luminalb型中乳腺癌未转移组、luminalb型乳腺癌骨转移组的测试集和验证集。
2、血清总dna提取
血清dna提取按照dnabloodmidikit说明书进行,每份样本采用0.8ml血清。提取的dna纯度用紫外分光光度计检测,吸光度a260/a280比值在1.7-2.0之间进行后续操作。计算dna含量,-70℃保存备用。
3、dna亚硫酸盐修饰和焦磷酸测序检测
dna亚硫酸盐修饰:
取1μggdna,按照dnamethylation-goldkit说明书对基因组dna进行甲基化修饰后,-70℃保存备用。多聚酶链式反应:采用pcr对样品中ptpn1和slit2基因启动子甲基化区域进行扩增。反应体系包括亚硫酸盐处理后模板2μl,10×pcrbuffer,0.25u/μlhotstartaq酶,0.5mmol/ldntp,上下游引物各1μl,总体积50μl。以双蒸水作为空白对照。
焦磷酸测序检测:
(1)分别取45μlpcr扩增产物至psq96platelow样品制备板a中,各加入45μl结合缓冲液和8μl包被有链亲和素的磁珠,43℃振荡25min。将结合pcr产物的磁珠转移至变性缓冲液的板b中,使双链dna充分变性。转移结合有单链pcr产物的磁珠至150μl退火缓冲液的板c涡旋振荡洗涤3min。
(2)测序引物杂交:将结合单链pcr产物的磁珠转入50μl复性缓冲液中,加入10μl测序引物,75℃杂交7min。
(3)使用psq96焦磷酸测序仪和测序反应试剂盒(pyrogoldreagents),分别检测ptpn1和slit2启动子区域内甲基化位点的碱基频率。
其中pcr扩增引物和测序引物如下:
ptpn1
上游5’-agcgggttagagggtagatgt-3’
下游5’-taggtttctcctctcccacatat-3’
测序5’-tttccattcatcctaa-3’
slit2
上游5’-tgaagttttattaggttgtggaggagta-3’
下游5’-ataccaaatatcctatccttatcttc-3’
测序5’-gtttaaggtttatgata-3’
通过使用焦磷酸测序仪中等位基因频率分析功能对各甲基化位点进行分析。按照如下公式计算各基因启动子区域的甲基化指数,该指数可以反映该基因启动子区域的甲基化程度:
4、统计学处理
数据采用spss19.0进行分析。计量资料用均值±偏差表示,采用t检验,计数资料用百分率表示,采用χ2检验,以p<0.05为差异有统计学意义,并建立roc曲线,计算曲线下面积(areaunderthecurve,auc)及95%可信区间。运用logistic回归筛选变量,建立回归方程,产生一组新变量y。对新变量及各单项指标进行roc曲线分析。
二、实验结果
1、luminalb型乳腺癌未转移和骨转移组甲基化ptpn1和甲基化slit2的甲基化程度
在测试集中,分别测定各样本中甲基化ptpn1和甲基化slit2的甲基化指数。与luminalb型乳腺癌未转移组相比,luminalb型乳腺癌骨转移组样本中甲基化ptpn1和甲基化slit2的甲基化指数显著升高,骨转移组甲基化ptpn1和甲基化slit2的甲基化指数分别为未转移组甲基化指数的(2.9±0.5)倍、(3.4±0.5)倍。
2、甲基化ptpn1和甲基化slit2的甲基化指数单独用于诊断区分luminalb型乳腺癌未转移和luminalb型乳腺癌骨转移的roc曲线分析
roc曲线评价法的原理:
诊断试验的基本评价指标有敏感度、特异性等,综合评价指标有youden指数、roc、auc等。对于诊断试验的评价,首先需要通过金标准知道待测样本的真实组别。对于按金标准确定的疾病组(相当于本发明中的乳腺癌骨转移组)和健康组(相当于本发明中的乳腺癌未转移组),采用诊断试验检测的结果可以分为如下情况:
阳性(truepositive,tp);诊断试验检测为阳性(与金标准结果一致);
阴性(truenegative,tn);诊断试验检测为阴性(与金标准结果一致);
假阳性(falsepositive,fp):诊断试验检测为阳性(与金标准结果不一致);
假阴性(falsenegative,fn):诊断试验检测为阴性(与金标准结果不一致)。
可以用下表表示:
诊断试验的敏感度=a/(a+c);诊断试验的特异性=d/(b+d)。通过敏感度和特异性可以得出诊断试验相对于金标准的诊断灵敏程度和特异程度。敏感度高代表将疾病例诊断为阴性的个数少,漏诊率低;特异性高代表将健康例诊断为阳性的个数少,误诊率低。
roc曲线正是基于上述敏感度和特异性绘制出的曲线。以诊断试验中可能的诊断界值作为诊断点,根据上述表格计算出相应的敏感度和特异性。然后,以敏感度为纵坐标,1-特异性为横坐标,将各诊断点时各点的敏感度和特异性点在坐标图中标出,连接坐标点得到平滑曲线,该曲线即为roc曲线。诊断点设置的越多越密,得到的roc曲线就越平滑。
roc曲线是以每一个检测结果作为可能的诊断界值,其曲线下面积auc的大小表明了诊断试验准确度的大小。roc曲线下面积auc作为诊断试验真实性评价的固有准确度指标已被普遍认可,auc为0.5时,即无诊断意义;auc在0.5~0.7时,表示诊断准确率较低;auc在0.7~0.9时,表示诊断准确性中等;auc>0.9时,表示诊断有较高的准确性。
在spss19.0中绘制甲基化ptpn1和甲基化slit2的甲基化指数单独用于诊断区分luminalb型乳腺癌未转移和luminalb型乳腺癌骨转移的roc曲线,auc分别为0.723、0.741,具有中等的准确性。
3、甲基化ptpn1和甲基化slit2的甲基化指数联合诊断模型的构建及用于诊断区分luminalb型乳腺癌未转移和luminalb型乳腺癌骨转移的roc曲线分析
以测试集样本中甲基化ptpn1和甲基化slit2的甲基化指数作为自变量(设x1=甲基化ptpn1的甲基化指数,x2=甲基化slit2的甲基化指数),以组别(即根据金标准该样本属于骨转移组还是未转移组)作为应变量,对甲基化ptpn1和甲基化slit2在luminalb型乳腺癌未转移和luminalb型乳腺癌骨转移样本中的甲基化指数进行二元逻辑回归,得到二元逻辑回归方程:y=1/[1+exp(2.016x1+1.898x2-0.455)];
再将各样本中甲基化ptpn1和甲基化slit2的甲基化指数代入该二元逻辑回归方程,即可得到各个样本的回归值y,以可能的回归值y作为诊断点,计算灵敏度和特异性,据此绘制roc曲线(如图3所示),auc为0.942,具有较高的准确性。根据roc曲线的坐标计算维登指数=特异性+灵敏度-1,维登指数最大值时对应的y值为能进行诊断区分luminalb型乳腺癌未转移组和骨转移组的最佳cut-off值0.310(即诊断阈值)。
4、验证集中验证甲基化ptpn1和甲基化slit2的甲基化指数联合诊断区分luminalb型乳腺癌未转移和luminalb型乳腺癌骨转移的准确程度
在验证集中,将各样本甲基化ptpn1和甲基化slit2的甲基化指数代入上述回归模型,得到各样本的回归值y,y低于诊断阈值0.310的预测为luminalb型乳腺癌骨转移,高于诊断阈值0.310的预测为luminalb型乳腺癌未转移,准确度为93.7%(59/63),如图4所示。
实施例3:her-2过表达型乳腺癌骨转移
一、实验样本和实验方法
1、实验样本
her-2过表达型中乳腺癌未转移组、her-2过表达型乳腺癌骨转移组的测试集和验证集。
2、血清总dna提取
血清dna提取按照dnabloodmidikit说明书进行,每份样本采用0.8ml血清。提取的dna纯度用紫外分光光度计检测,吸光度a260/a280比值在1.7-2.0之间进行后续操作。计算dna含量,-70℃保存备用。
3、dna亚硫酸盐修饰和焦磷酸测序检测
dna亚硫酸盐修饰:
取1μggdna,按照dnamethylation-goldkit说明书对基因组dna进行甲基化修饰后,-70℃保存备用。多聚酶链式反应:采用pcr对样品中mylk2、efemp1和sostdc1基因启动子甲基化区域进行扩增。反应体系包括亚硫酸盐处理后模板2μl,10×pcrbuffer,0.25u/μlhotstartaq酶,0.5mmol/ldntp,上下游引物各1μl,总体积50μl。
焦磷酸测序检测:
(1)分别取45μlpcr扩增产物至psq96platelow样品制备板a中,各加入45μl结合缓冲液和8μl包被有链亲和素的磁珠,43℃振荡25min。将结合pcr产物的磁珠转移至变性缓冲液的板b中,使双链dna充分变性。转移结合有单链pcr产物的磁珠至150μl退火缓冲液的板c涡旋振荡洗涤3min。
(2)测序引物杂交:将结合单链pcr产物的磁珠转入50μl复性缓冲液中,加入10μl测序引物,75℃杂交7min。
(3)使用psq96焦磷酸测序仪和测序反应试剂盒(pyrogoldreagents),分别检测mylk2、efemp1和sostdc1启动子区域内甲基化位点的碱基频率。
其中pcr扩增引物和测序引物如下:
mylk2
上游5’-gagggaaaggatatggttgatt-3’
下游5’-aactccactccattctccc-3’
测序5’-agtaagttatttatttgttatttg-3’
efemp1
上游5’-ggtttaggtggggagtatgatag-3’
下游5’-accaacaacccaactttaacataacc-3’
测序5’-taatgaggggttgag-3’
sostdc1
上游5’-gtaaaggagaaagtttggtatatgg-3’
下游5’-caaaactatacaaaagtatctctctcaat-3’
测序5’-ataatttaattgttagagttgaata-3’
通过使用焦磷酸测序仪中等位基因频率分析功能对各甲基化位点进行分析。按照如下公式计算各基因启动子区域的甲基化指数,该指数可以反映该基因启动子区域的甲基化程度:
4、统计学处理
数据采用spss19.0进行分析。计量资料用均值±偏差表示,采用t检验,计数资料用百分率表示,采用χ2检验,以p<0.05为差异有统计学意义,并建立roc曲线,计算曲线下面积(areaunderthecurve,auc)及95%可信区间。运用logistic回归筛选变量,建立回归方程,产生一组新变量y。对新变量及各单项指标进行roc曲线分析。
二、实验结果
1、her-2过表达型乳腺癌未转移和骨转移组甲基化mylk2、甲基化efemp1和甲基化sostdc1的甲基化程度
在测试集中,分别测定各样本中甲基化mylk2、甲基化efemp1和甲基化sostdc1的甲基化指数。与her-2过表达型乳腺癌未转移组相比,her-2过表达型乳腺癌骨转移组样本中甲基化mylk2、甲基化efemp1和甲基化sostdc1的甲基化指数显著升高,分别为未转移组甲基化指数的(3.7±0.6)倍、(2.6±0.4)、(3.1±0.5)倍。
2、甲基化mylk2、甲基化efemp1和甲基化sostdc1的甲基化指数单独用于诊断区分her-2过表达型乳腺癌未转移和her-2过表达型乳腺癌骨转移的roc曲线分析
roc曲线评价法的原理:
诊断试验的基本评价指标有敏感度、特异性等,综合评价指标有youden指数、roc、auc等。对于诊断试验的评价,首先需要通过金标准知道待测样本的真实组别。对于按金标准确定的疾病组(相当于本发明中的乳腺癌骨转移组)和健康组(相当于本发明中的乳腺癌未转移组),采用诊断试验检测的结果可以分为如下情况:
阳性(truepositive,tp);诊断试验检测为阳性(与金标准结果一致);
阴性(truenegative,tn);诊断试验检测为阴性(与金标准结果一致);
假阳性(falsepositive,fp):诊断试验检测为阳性(与金标准结果不一致);
假阴性(falsenegative,fn):诊断试验检测为阴性(与金标准结果不一致)。
可以用下表表示:
诊断试验的敏感度=a/(a+c);诊断试验的特异性=d/(b+d)。通过敏感度和特异性可以得出诊断试验相对于金标准的诊断灵敏程度和特异程度。敏感度高代表将疾病例诊断为阴性的个数少,漏诊率低;特异性高代表将健康例诊断为阳性的个数少,误诊率低。
roc曲线正是基于上述敏感度和特异性绘制出的曲线。以诊断试验中可能的诊断界值作为诊断点,根据上述表格计算出相应的敏感度和特异性。然后,以敏感度为纵坐标,1-特异性为横坐标,将各诊断点时各点的敏感度和特异性点在坐标图中标出,连接坐标点得到平滑曲线,该曲线即为roc曲线。诊断点设置的越多越密,得到的roc曲线就越平滑。
roc曲线是以每一个检测结果作为可能的诊断界值,其曲线下面积auc的大小表明了诊断试验准确度的大小。roc曲线下面积auc作为诊断试验真实性评价的固有准确度指标已被普遍认可,auc为0.5时,即无诊断意义;auc在0.5~0.7时,表示诊断准确率较低;auc在0.7~0.9时,表示诊断准确性中等;auc>0.9时,表示诊断有较高的准确性。
在spss19.0中绘制甲基化mylk2、甲基化efemp1和甲基化sostdc1的甲基化指数单独用于诊断区分her-2过表达型乳腺癌未转移和her-2过表达型乳腺癌骨转移的roc曲线,auc分别为0.794、0.688、0.738,具有较低或中等的准确性。
3、甲基化mylk2、甲基化efemp1和甲基化sostdc1的甲基化指数联合诊断模型的构建及用于诊断区分her-2过表达型乳腺癌未转移和her-2过表达型乳腺癌骨转移的roc曲线分析
以测试集样本中甲基化mylk2、甲基化efemp1和甲基化sostdc1的甲基化指数作为自变量(设x1=甲基化mylk2的甲基化指数,x2=甲基化efemp1的甲基化指数,x3=甲基化sostdc1的甲基化指数),以组别(即根据金标准该样本属于骨转移组还是未转移组)作为应变量,对甲基化mylk2、甲基化efemp1和甲基化sostdc1在her-2过表达型乳腺癌未转移和her-2过表达型乳腺癌骨转移样本中的甲基化指数进行二元逻辑回归,得到二元逻辑回归方程:y=1/[1+exp(1.342x1+1.401x2+1.345x3-2.035)];
再将各样本中甲基化mylk2、甲基化efemp1和甲基化sostdc1的甲基化指数代入该二元逻辑回归方程,即可得到各个样本的回归值y,以可能的回归值y作为诊断点,计算灵敏度和特异性,据此绘制roc曲线(如图5所示),auc为0.950,具有较高的准确性。根据roc曲线的坐标计算维登指数=特异性+灵敏度-1,维登指数最大值时对应的y值为能进行诊断区分her-2过表达型乳腺癌未转移组和骨转移组的最佳cut-off值0.308(诊断阈值)。
4、验证集中验证甲基化mylk2、甲基化efemp1和甲基化sostdc1的甲基化指数联合诊断区分her-2过表达型乳腺癌未转移和her-2过表达型乳腺癌骨转移的准确程度
在验证集中,将各样本甲基化mylk2、甲基化efemp1和甲基化sostdc1的甲基化指数代入上述回归模型,得到各样本的回归值y,y低于诊断阈值0.308的预测为her-2过表达型乳腺癌骨转移,高于诊断阈值0.308的预测为her-2过表达型乳腺癌未转移,准确度为96.4%(54/56),如图6所示。
实施例4:三阴性型乳腺癌骨转移
一、实验样本和实验方法
1、实验样本
三阴性型中乳腺癌未转移组、三阴性型乳腺癌骨转移组的测试集和验证集。
2、血清总dna提取
血清dna提取按照dnabloodmidikit说明书进行,每份样本采用0.8ml血清。提取的dna纯度用紫外分光光度计检测,吸光度a260/a280比值在1.7-2.0之间进行后续操作。计算dna含量,-70℃保存备用。
3、dna亚硫酸盐修饰和焦磷酸测序检测
dna亚硫酸盐修饰:
取1μggdna,按照dnamethylation-goldkit说明书对基因组dna进行甲基化修饰后,-70℃保存备用。多聚酶链式反应:采用pcr对样品中mylk3和scara5基因启动子甲基化区域进行扩增。反应体系包括亚硫酸盐处理后模板2μl,10×pcrbuffer,0.25u/μlhotstartaq酶,0.5mmol/ldntp,上下游引物各1μl,总体积50μl。以双蒸水作为空白对照。
焦磷酸测序检测:
(1)分别取45μlpcr扩增产物至psq96platelow样品制备板a中,各加入45μl结合缓冲液和8μl包被有链亲和素的磁珠,43℃振荡25min。将结合pcr产物的磁珠转移至变性缓冲液的板b中,使双链dna充分变性。转移结合有单链pcr产物的磁珠至150μl退火缓冲液的板c涡旋振荡洗涤3min。
(2)测序引物杂交:将结合单链pcr产物的磁珠转入50μl复性缓冲液中,加入10μl测序引物,75℃杂交7min。
(3)使用psq96焦磷酸测序仪和测序反应试剂盒(pyrogoldreagents),分别检测mylk3和scara5启动子区域内甲基化位点的碱基频率。
其中pcr扩增引物和测序引物如下:
mylk3
上游5’-taggggaggttaagaaagtgta-3’
下游5’-aactccttatcaattcctaacatacaat-3’
测序5’-ggagtaatgatgtaatgtgtat-3’
scara5
上游5’-aggaattaggtaaggtatgttagta-3’
下游5’-aaaactccaacctattccaaccatacctac-3’
测序5’-gttttaagttttggtgtttgatat-3’
通过使用焦磷酸测序仪中等位基因频率分析功能对各甲基化位点进行分析。按照如下公式计算各基因启动子区域的甲基化指数,该指数可以反映该基因启动子区域的甲基化程度:
4、统计学处理
数据采用spss19.0进行分析。计量资料用均值±偏差表示,采用t检验,计数资料用百分率表示,采用χ2检验,以p<0.05为差异有统计学意义,并建立roc曲线,计算曲线下面积(areaunderthecurve,auc)及95%可信区间。运用logistic回归筛选变量,建立回归方程,产生一组新变量y。对新变量及各单项指标进行roc曲线分析。
二、实验结果
1、三阴性型乳腺癌未转移和骨转移组甲基化mylk3和甲基化scara5的甲基化程度
在测试集中,分别测定各样本中甲基化mylk3和甲基化scara5的甲基化指数。与三阴性型乳腺癌未转移组相比,三阴性型乳腺癌骨转移组样本中甲基化mylk3和甲基化scara5的甲基化指数显著升高,骨转移组甲基化mylk3和甲基化scara5的甲基化指数分别为未转移组甲基化指数的(2.1±0.3)倍、(3.6±0.7)倍。
2、甲基化mylk3和甲基化scara5的甲基化指数单独用于诊断区分三阴性型乳腺癌未转移和三阴性型乳腺癌骨转移的roc曲线分析
roc曲线评价法的原理:
诊断试验的基本评价指标有敏感度、特异性等,综合评价指标有youden指数、roc、auc等。对于诊断试验的评价,首先需要通过金标准知道待测样本的真实组别。对于按金标准确定的疾病组(相当于本发明中的乳腺癌骨转移组)和健康组(相当于本发明中的乳腺癌未转移组),采用诊断试验检测的结果可以分为如下情况:
阳性(truepositive,tp);诊断试验检测为阳性(与金标准结果一致);
阴性(truenegative,tn);诊断试验检测为阴性(与金标准结果一致);
假阳性(falsepositive,fp):诊断试验检测为阳性(与金标准结果不一致);
假阴性(falsenegative,fn):诊断试验检测为阴性(与金标准结果不一致)。
可以用下表表示:
诊断试验的敏感度=a/(a+c);诊断试验的特异性=d/(b+d)。通过敏感度和特异性可以得出诊断试验相对于金标准的诊断灵敏程度和特异程度。敏感度高代表将疾病例诊断为阴性的个数少,漏诊率低;特异性高代表将健康例诊断为阳性的个数少,误诊率低。
roc曲线正是基于上述敏感度和特异性绘制出的曲线。以诊断试验中可能的诊断界值作为诊断点,根据上述表格计算出相应的敏感度和特异性。然后,以敏感度为纵坐标,1-特异性为横坐标,将各诊断点时各点的敏感度和特异性点在坐标图中标出,连接坐标点得到平滑曲线,该曲线即为roc曲线。诊断点设置的越多越密,得到的roc曲线就越平滑。
roc曲线是以每一个检测结果作为可能的诊断界值,其曲线下面积auc的大小表明了诊断试验准确度的大小。roc曲线下面积auc作为诊断试验真实性评价的固有准确度指标已被普遍认可,auc为0.5时,即无诊断意义;auc在0.5~0.7时,表示诊断准确率较低;auc在0.7~0.9时,表示诊断准确性中等;auc>0.9时,表示诊断有较高的准确性。
在spss19.0中绘制甲基化mylk3和甲基化scara5的甲基化指数单独用于诊断区分三阴性型乳腺癌未转移和三阴性型乳腺癌骨转移的roc曲线,auc分别为0.644、0.809,具有较低或中等的准确性。
3、甲基化mylk3和甲基化scara5的甲基化指数联合诊断模型的构建及用于诊断区分三阴性型乳腺癌未转移和三阴性型乳腺癌骨转移的roc曲线分析
以测试集样本中甲基化mylk3和甲基化scara5的甲基化指数作为自变量(设x1=甲基化mylk3的甲基化指数,x2=甲基化scara5的甲基化指数),以组别(即根据金标准该样本属于骨转移组还是未转移组)作为应变量,对甲基化mylk3和甲基化scara5在三阴性型乳腺癌未转移和三阴性型乳腺癌骨转移样本中的甲基化指数进行二元逻辑回归,得到二元逻辑回归方程:y=1/[1+exp(1.775x1+1.236x2-0.398)];
再将各样本中甲基化mylk3和甲基化scara5的甲基化指数代入该二元逻辑回归方程,即可得到各个样本的回归值y,以可能的回归值y作为诊断点,计算灵敏度和特异性,据此绘制roc曲线(如图7所示),auc为0.954,具有较高的准确性。根据roc曲线的坐标计算维登指数=特异性+灵敏度-1,维登指数最大值时对应的y值为能进行诊断区分三阴性型乳腺癌未转移组和骨转移组的最佳cut-off值0.366(即诊断阈值)。
4、验证集中验证甲基化mylk3和甲基化scara5的甲基化指数联合诊断区分三阴性型乳腺癌未转移和三阴性型乳腺癌骨转移的准确程度
在验证集中,将各样本甲基化mylk3和甲基化scara5的甲基化指数代入上述回归模型,得到各样本的回归值y,y低于诊断阈值0.366的预测为三阴性型乳腺癌骨转移,高于诊断阈值0.366的预测为三阴性型乳腺癌未转移,准确度为94.6%(53/56),如图8所示。
实施例5:诊断预示不同亚型乳腺癌骨转移的诊断试剂盒
1、luminala型乳腺癌骨转移诊断预示试剂盒
包括甲基化pitx1和甲基化amot的pcr扩增引物:甲基化pitx1的pcr扩增上游引物如sequenceno.1所示,pcr扩增下游引物如sequenceno.2所示;甲基化amot的pcr扩增上游引物如sequenceno.4所示,pcr扩增下游引物如sequenceno.5所示;还包括甲基化pitx1和甲基化amot的焦磷酸测序引物,甲基化pitx1的焦磷酸测序引物如sequenceno.3所示,甲基化amot的焦磷酸测序引物如sequenceno.6所示。
还包括pcr扩增和焦磷酸测序所需的酶和试剂。
2、luminalb型乳腺癌骨转移诊断预示试剂盒
包括甲基化ptpn1和甲基化slit2的pcr扩增引物;甲基化ptpn1的pcr扩增上游引物如sequenceno.7所示,pcr扩增下游引物如sequenceno.8所示;甲基化slit2的pcr扩增上游引物如sequenceno.10所示,pcr扩增下游引物如sequenceno.11所示;还包括甲基化ptpn1和甲基化slit2的焦磷酸测序引物,甲基化ptpn1的焦磷酸测序引物如sequenceno.9所示,甲基化slit2的焦磷酸测序引物如sequenceno.12所示。
还包括pcr扩增和焦磷酸测序所需的酶和试剂。
3、her-2过表达型乳腺癌骨转移诊断预示试剂盒
包括甲基化mylk2、甲基化efemp1和甲基化sostdc1的pcr扩增引物和焦磷酸测序引物;甲基化mylk2的pcr扩增上游引物如sequenceno.13所示,pcr扩增下游引物如sequenceno.14所示,焦磷酸测序引物如sequenceno.15所示;甲基化efemp1的pcr扩增上游引物如sequenceno.16所示,pcr扩增下游引物如sequenceno.17所示,焦磷酸测序引物如sequenceno.18所示甲基化sostdc1的pcr扩增上游引物如sequenceno.19所示,pcr扩增下游引物如sequenceno.20所示,焦磷酸测序引物如sequenceno.21所示。
还包括pcr扩增和焦磷酸测序所需的酶和试剂。
4、三阴性型乳腺癌骨转移诊断预示试剂盒
包括甲基化mylk3和甲基化scara5的pcr扩增引物;甲基化mylk3的pcr扩增上游引物如sequenceno.22所示,pcr扩增下游引物如sequenceno.23所示;甲基化scara5的pcr扩增上游引物如sequenceno.25所示,pcr扩增下游引物如sequenceno.26所示;还包括甲基化mylk3和甲基化scara5的焦磷酸测序引物,甲基化mylk3的焦磷酸测序引物如sequenceno.24,甲基化scara5的焦磷酸测序引物如sequenceno.27。
还包括pcr扩增和焦磷酸测序所需的酶和试剂。
综上可知,本发明发现,血清甲基化pitx1和甲基化amot可以联合用于诊断预示luminala型乳腺癌是否骨转移,在独立验证集中诊断预示准确率达90%以上;血清甲基化ptpn1和甲基化slit2可以联合用于诊断预示luminalb型乳腺癌是否骨转移,在独立验证集中诊断预示准确率达90%以上;血清甲基化mylk2、甲基化efemp1和甲基化sostdc1可以联合用于诊断预示her-2过表达型乳腺癌是否骨转移,在独立验证集中诊断预示准确率达90%以上;血清甲基化mylk3和甲基化scara5可以联合用于诊断预示三阴性型乳腺癌是否骨转移,在独立验证集中诊断预示准确率达90%以上。使用上述血清甲基化基因诊断预示不同分子亚型乳腺癌骨转移不仅准确度高,而且检测成本低、非介入性、方便快捷,极大降低患者痛苦和负担。
上述实施例的作用在于具体介绍本发明的实质性内容,但本领域技术人员应当知道,不应将本发明的保护范围局限于该具体实施例。
序列表
<110>薛守海
<120>甲基化基因组合物及制备诊断预示三阴性型乳腺癌骨转移试剂盒的用途
<160>29
<170>siposequencelisting1.0
<210>1
<211>28
<212>dna/rna
<213>人工序列(artificialsequence)
<400>1
ggaaggtatttagtataggtgagtttga28
<210>2
<211>27
<212>dna/rna
<213>人工序列(artificialsequence)
<400>2
aaaccttaatattcactacactttatc27
<210>3
<211>24
<212>dna/rna
<213>人工序列(artificialsequence)
<400>3
gtgtttattttggattgtttaatt24
<210>4
<211>25
<212>dna/rna
<213>人工序列(artificialsequence)
<400>4
tgagttaatatgaaagaagatagta25
<210>5
<211>26
<212>dna/rna
<213>人工序列(artificialsequence)
<400>5
tgatctctacatctcaactaatatac26
<210>6
<211>17
<212>dna/rna
<213>人工序列(artificialsequence)
<400>6
gtaggtttatttaggtt17
<210>7
<211>21
<212>dna/rna
<213>人工序列(artificialsequence)
<400>7
agcgggttagagggtagatgt21
<210>8
<211>23
<212>dna/rna
<213>人工序列(artificialsequence)
<400>8
taggtttctcctctcccacatat23
<210>9
<211>16
<212>dna/rna
<213>人工序列(artificialsequence)
<400>9
tttccattcatcctaa16
<210>10
<211>28
<212>dna/rna
<213>人工序列(artificialsequence)
<400>10
tgaagttttattaggttgtggaggagta28
<210>11
<211>26
<212>dna/rna
<213>人工序列(artificialsequence)
<400>11
ataccaaatatcctatccttatcttc26
<210>12
<211>17
<212>dna/rna
<213>人工序列(artificialsequence)
<400>12
gtttaaggtttatgata17
<210>13
<211>22
<212>dna/rna
<213>人工序列(artificialsequence)
<400>13
gagggaaaggatatggttgatt22
<210>14
<211>19
<212>dna/rna
<213>人工序列(artificialsequence)
<400>14
aactccactccattctccc19
<210>15
<211>24
<212>dna/rna
<213>人工序列(artificialsequence)
<400>15
agtaagttatttatttgttatttg24
<210>16
<211>23
<212>dna/rna
<213>人工序列(artificialsequence)
<400>16
ggtttaggtggggagtatgatag23
<210>17
<211>26
<212>dna/rna
<213>人工序列(artificialsequence)
<400>17
accaacaacccaactttaacataacc26
<210>18
<211>15
<212>dna/rna
<213>人工序列(artificialsequence)
<400>18
taatgaggggttgag15
<210>19
<211>25
<212>dna/rna
<213>人工序列(artificialsequence)
<400>19
gtaaaggagaaagtttggtatatgg25
<210>20
<211>29
<212>dna/rna
<213>人工序列(artificialsequence)
<400>20
caaaactatacaaaagtatctctctcaat29
<210>21
<211>25
<212>dna/rna
<213>人工序列(artificialsequence)
<400>21
ataatttaattgttagagttgaata25
<210>22
<211>3
<212>dna/rna
<213>人工序列(artificialsequence)
<400>22
<210>23
<211>22
<212>dna/rna
<213>人工序列(artificialsequence)
<400>23
taggggaggttaagaaagtgta22
<210>24
<211>28
<212>dna/rna
<213>人工序列(artificialsequence)
<400>24
aactccttatcaattcctaacatacaat28
<210>25
<211>22
<212>dna/rna
<213>人工序列(artificialsequence)
<400>25
ggagtaatgatgtaatgtgtat22
<210>26
<211>3
<212>dna/rna
<213>人工序列(artificialsequence)
<400>26
<210>27
<211>25
<212>dna/rna
<213>人工序列(artificialsequence)
<400>27
aggaattaggtaaggtatgttagta25
<210>28
<211>30
<212>dna/rna
<213>人工序列(artificialsequence)
<400>28
aaaactccaacctattccaaccatacctac30
<210>29
<211>24
<212>dna/rna
<213>人工序列(artificialsequence)
<400>29
gttttaagttttggtgtttgatat24
- 还没有人留言评论。精彩留言会获得点赞!