一种AhR受体蛋白抑制剂在制备抗病毒药物中的用途的制作方法
本发明属生物医药技术领域,涉及抗病毒药物,具体涉及一种宿主AhR受体蛋白抑制剂黄芩苷类化合物或与其它抗病毒药物组合物,在用于制备临床治疗多种病毒感染疾病药物中的用途。
背景技术:
据研究报道,病毒快速变异耐药及病毒感染发病机制不明确等因素致使目前靶向病毒的特异性预防和治疗手段陷入了困境。以流感病毒为例,病毒株快速变异和大流行预测手段的缺失,导致预防性流感疫苗效果大幅降低,也引发了日渐广泛的耐药现象,这使得流感预防与治疗都面临极大挑战。另一重大传染病病毒HBV,则在中国乃至全球有数亿存量感染者,该疾患对预防性疫苗无应答,主流的核苷类似物治疗由于病毒变异而耐药现象日趋普遍,这严重影响乙型肝炎治疗效果。而更多感染性病毒,如RSV,HSV,EV71,Norovirus等,由于对病毒分子感染复制机制认知不清晰,目前还没有靶向病毒的特异性预防和治疗药物的产生。这些问题也是在病毒性传染病新发和再发的社会环境下,发展靶向病毒药物所需要面对的严峻问题。
靶向宿主的药物研发是目前抗病毒研究的新方向。宿主系统作为病毒感染的交互主体,其在病毒感染复制发病的整个环节都扮演着非常重要的角色,其优势在于宿主应答模式的保守性,不随病毒的变异而改变。如流感病毒感染致病致死性主要源于病毒诱发的宿主过度应激,应激环节的阻断对削弱病毒复制和提供宿主保护的设想已经获得了初步证实:通过鞘氨醇类似物阻断炎症应激可明显削弱病毒病理进程,本课题组前期也证实了抑制TNF-alpha炎症通路能减轻流感病毒复制和损伤。另,干预宿主CCR5受体能显著阻断高突变HIV病毒复制感染,这预示HIV预防和治疗的新方向。目前,EV71病毒感染也无特效药物,但研究显示干预转录激活因子可抑制病毒的复制。这些证据都提示基于宿主的靶向药物研 发对抗病毒研究而言,可能是一个非常有希望的方向,而寻找合适的靶位及高效的药物分子则是研究热门。
中药宝库中大量的药效分子则是开发具有中国特色的新抗病毒药物最有利的物质保障。目前已经有大量研究证实许多中药成分具有多种药理学活性,如黄酮类,皂苷类,生物碱,多糖类等均显示了抗炎、抗病毒的作用。但是抗病毒中药研发的困难在于研究大多集中在各自的药效分析,无法提供一致性机制解释,导致相应构效关系研究缺乏,这些问题严重制约了中国传统中药研发进程。从中药药效学分析,靶向宿主的调节机制是传统中药最有可能的作用机制。
于本发明相关的现有技术有:
1.Antiviral Drugs for Seasonal Influenza 2014-2015.JAMA.2015;313:413-4.
2.Okomo-Adhiambo M,Fry AM,Su S,et al.Oseltamivir-Resistant Influenza A(H1N1)pdm09Viruses,United States,2013-14.Emerg Infect Dis.2015;21:136-41.
3.Hurt AC,Chotpitayasunondh T,Cox NJ,et al.Antiviral resistance during the 2009influenza A H1N1pandemic:public health,laboratory,and clinical perspectives.Lancet Infect Dis.2012;12:240-8.
4.Lee YB,Lee JH,Choi WM,et al.Efficacy of adefovir-based combination therapy for patients with Lamivudine-and entecavir-resistant chronic hepatitis B virus infection.Antimicrob Agents Chemother.2013;57:6325-32.
5.Wedemeyer H,Yurdaydin C,Dalekos,et al.Peginterferon plus adefovir versus either drug alone for hepatitis delta.N Engl J Med.2011;364:322-31.
6.Raguin G,Eholié S.Ebola:national health stakeholders are the cornerstones of the response.Lancet.2015;384:2207-8.
7.Ahmed SM,Hall AJ,Robinson AE,et al.Global prevalence of norovirus in cases of gastroenteritis:a systematic review and meta-analysis. Lancet Infect Dis.2014;14:725-30.
8.Walsh KB,Teijaro JR,Wilker PR,et al.Suppression of cytokine storm with a sphingosine analog provides protection against pathogenic influenza virus.Proc Natl Acad Sci USA 2011,108:12018-12023.
9.Iwasaki A,Medzhitov R:A new shield for a cytokine storm.Cell 2011,146:861-862.
10.Shi X,Zhou W,Huang H,Zhu H,Zhou P,Zhu H,Ju D:Inhibition of the inflammatory cytokine TNF-alpha with etanercept provides protection against lethal H1N1 influenza infection in mice.Crit Care 2013,17:R301
11.Woollard SM,Kanmogne GD.Maraviroc:a review of its use in HIV infection and beyond.Drug Des Devel Ther.2015 Oct 1;9:5447-68.
12.Zhang W,Qiao H,Lv Y,et al.Apigenin inhibits enterovirus-71infection by disrupting viral RNA association with trans-acting factors.PLoS One.2014;9:e110429.
13.de Sousa LR,Wu H,Nebo L,et al.Flavonoids as noncompetitive inhibitors of Dengue virus NS2B-NS3 protease:Inhibition kinetics and docking studies.Bioorg Med Chem.2015;23:466-70.
14.Li E,Sun N,Zhao JX,et al.In vitro evaluation of antiviral activity of tea seed saponins against porcine reproductive and respiratory syndrome virus.Antivir Ther.2015.doi:10.3851/IMP2937.
15.Wang C,Lu L,Na H,et al.Conjugation of a nonspecific antiviral sapogenin with a specific HIV fusion inhibitor:a promising strategy for discovering new antiviral therapeutics.J Med Chem.2014;57:7342-54.
16.Song S,Qiu M,Chu Y,et al.Downregulation of cellular c-Jun N-terminal protein kinase and NF-κB activation by berberine may result in inhibition of herpes simplex virus replication.Antimicrob Agents Chemother.2014;58:5068-78.
17.Su B,Cai C,Deng M,et al.Design,synthesis,antiviral activity,and SARs of 13a-substituted phenanthroindolizidine alkaloidderivatives. Bioorg Med Chem Lett.2014;24:2881-4.
18.Cheung RC,Wong JH,Pan WL,et al.Antifungal and antiviral products of marine organisms.Appl Microbiol Biotechnol.2014;98:m3475-94.
19.Jin M,Zhao K,Huang Q,et al.Structural features and biological activities of the polysaccharides from Astragalus membranaceus.Int J Biol Macromol.2014;64:257-66.
20.Moghaddam E,Teoh BT,Sam SS,et al.Baicalin,a metabolite of baicalein with antiviral activity against dengue virus.Sci Rep.2014;4:5452.
21.Nayak MK,Agrawal AS,Bose S,et al.Antiviral activity of baicalin against influenza virus H1N1-pdm09 is due to modulation of NS1-mediated cellular innate immune responses.J Antimicrob Chemother.2014;69:1298-310.
22.Dou J,Chen L,Xu G,et al.Effects of baicalein on Sendai virus in vivo are linked to serum baicalin and its inhibition of hemagglutinin-neuraminidase.Arch Virol.2011;156:793-801.
23.Romero MR,Efferth T,Serrano MA,et al.Effect of artemisinin/artesunate as inhibitors of hepatitis B virus production in an"in vitro"replicative system.Antiviral Res.2005;68:75-83.
24.Wu JA,Attele AS,Zhang L,et al.Anti-HIV activity of medicinal herbs:usage and potential development.Am J Chin Med.2001;29:69-81.
25.Zhu HY,Han L,Shi XL,et al.Baicalin inhibits autophagy induced by influenza A virus H3N2.Antiviral Res.2015;113:62-70.
26.Harada A,Sugihara K,Watanabe Y,et al.Aryl Hydrocarbon Receptor Ligand Activity of Extracts from 62 Herbal Medicines and Effect on Cytochrome P450 Activity.Yakugaku Zasshi.2015;135:1185-96.
27.Xue Y,Shui X,Su W,et al.Baical in inhibits inflammation and attenuates myocardial ischaemic injury by aryl hydrocarbon receptor.J Pharm Pharmacol.2015.doi:10.1111/jphp.12484.
28.Huang S,Chen P,Shui X,et al.Baicalin attenuates transforming growth factor-β1-induced human pulmonary artery smooth muscle cell proliferation and phenotypic switch by inhibiting hypoxia inducible factor-1αand aryl hydrocarbon receptor expression.J Pharm Pharmacol.2014;66:1469-77.
29.Winans B,Nagari A,Chae M,et al.Linking the aryl hydrocarbon receptor with altered DNA methylation patterns and developmentally induced aberrant antiviral CD8+T cell responses.J Immunol.2015;194:4446-57.
30.Boule LA,Winans B,Lawrence BP.Effects of developmental activation of the AhR on CD4+T-cell responses to influenza virus infection in adult mice.Environ Health Perspect.2014;122:1201-8.
31.Jin GB,Winans B,Martin KC,et al.New insights into the role of the aryl hydrocarbon receptor in the function of CD11c+ cells during respiratory viral infection.Eur J Immunol.2014;44:1685-98.
32.Wheeler JL,Martin KC,Lawrence BP.Novel cellular targets of AhR underlie alterations in neutrophilic inflammation and inducible nitric oxide synthase expression during influenza virus infection.J Immunol.2013;190:659-68.
技术实现要素:
:
本发明的目的是提供天然活性物质中的抗病毒药物,具体涉及一种AhR受体蛋白抑制剂在制备抗病毒药物中的用途,尤其是,天然活性物质黄芩类化合物在制备抗多种病毒的活性药物中的用途
本发明提供了天然活性物质黄芩类化合物在制备抗多种病毒的活性药物中的用途。
本发明中,黄芩苷类化合物包含但不限于黄芩苷、黄芩素、高黄芩素,野黄芩苷,野黄芩素、千层素等。
千层纸素A-7-O-β-D-葡萄糖苷
本发明中,所述病毒包含但不限于乙肝病毒,流感病毒,疱疹病毒,合胞病毒等。
本发明进行了下述试验:(1)黄芩苷抑制流感病毒试验;(2)黄芩苷抑制HBV试验;(3)黄芩苷下调AhR受体蛋白转录水平;(4)黄芩苷类化合物抗不同病毒效果。
本发明对以黄芩苷类化合物为代表的中药单体和提取物作进行了抗多种病毒的活性的试验,结果明确证实了黄芩苷能对抗流感H1N1/H3N2及乙肝病毒HBV等病毒,研究表明,所述的黄芩苷作用模式可能非病毒特异性作用模式,更可能通过干预宿主某个应答环节对病毒的复制产生影响,使黄芩苷具备拮抗不同种属病毒感染的能力。
本发明中,实验显示黄芩苷能抑制流感病毒诱导的自噬行为,达到干扰流感病毒H3N2复制的作用,而其作用靶位可能在通路蛋白mTOR上游的信号环节;抗乙肝病毒试验发现黄芩苷不仅可以抑制HBV-RNA的转录水平,而且其作用不受病毒耐药突变的影响,且与核苷类似物发生协同,这提示黄芩苷的作用机制区别于核苷类似物;进一步研究显示黄芩苷能有效抑制与病毒转录密切相关的核转录因子HNF水平,进而干扰HBV-DNA的复制进程;结果表明,黄芩苷可能通过干预宿主应答的上游途径(如自噬通路mTOR上游信号,核转录因子上游信号),达到抗多种病毒的效果。
本发明基于芳香烃受体蛋白(Aryl hydrocarbon receptor,AhR)是一种存在哺乳动物细胞胞浆中配体激活转录因子,它激活核转录信号通路,参与组织细胞的信号转导、细胞分化、细胞凋亡等细胞生理病理行为,经研究验证了黄芩苷能下调流感病毒感染过程中AhR的转录水平,证实黄芩苷具有抗多种病毒的能力,主要通过干预AhR受体信号通路,调控宿主对病毒应答。
本发明中,研究结果还显示了不同黄芩苷类化合物中均具备不同抗病毒作用,黄芩苷能抑制病毒诱导的AhR受体蛋白转录水平,直接或间接抑制多种病毒的复制,基于该特异性作用,黄芩苷类化合物可与其它抗病毒药物联合或制成药物组合物,,增强抗病毒药物的效果;进一步用于制备临床治疗多种病毒感染疾病的药物。
所述的药物组合物其组合方式,可以不改变现有药物剂型下,黄芩类化合物与其它抗病毒药物分别以单独成药的方式组合干预,也可以将黄芩类化合物与其它抗病毒药物制成同一剂型,其给药途径或制剂包括且不限定于以下方式:口服、注射、粘膜给药,注射液、气雾剂等。
本发明的优点在于:
证实黄芩苷可明显干扰宿主AhR转录水平,且黄芩类化合物具有多种抗病毒活性,如,具有干扰宿主AhR受体蛋白信号通路,阻断病毒复制,进而拮抗多种病毒的活性。作为AhR受体蛋白抑制剂,所述黄芩苷类化合物可用于制备抗多种病毒药物的用途。
下面结合附图和具体实施例对本发明作进一步说明。
附图说明
图1显示了黄芩苷明显减弱流感病毒在肺泡上皮细胞A549、巨噬细胞ana-1的复制及减轻MDCK的细胞病变。
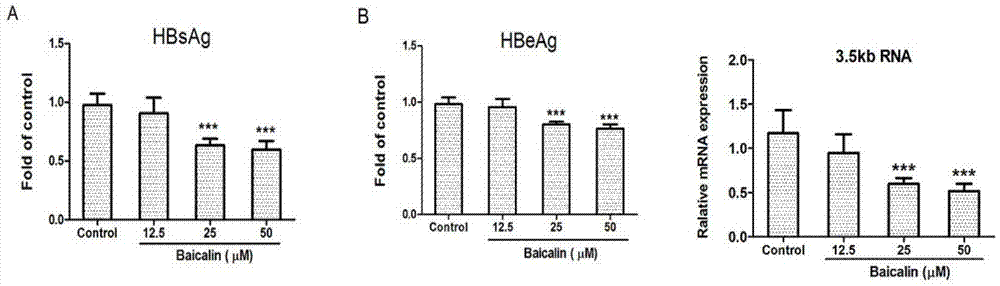
图2显示了黄芩苷能抑制hepG2.2.15分泌HBsAg、HBeAg和胞内的HBV-RNA水平。
图3显示了黄芩苷在野生型HBV(HepG2.2.15细胞)和耐药突变株HBV转染细胞株模型中都能有效与ETV产生组合效应。
图4显示了黄芩苷能下调流感病毒感染细胞中AhR转录水平。
具体实施方式
实施例1黄芩苷抗流感病毒H3N2病毒试验
将H3N2病毒在肺泡上皮细胞A549、巨噬细胞ana-1培养复制,加黄芩苷干预,并设不含药物对照,常规观察后,结果显示,黄芩苷明显减弱流感病毒在肺泡上皮细胞A549、巨噬细胞ana-1的复制及减轻MDCK的细胞病变(如图1所示)。
实施例2黄芩苷抑制HBV试验
常规培养hepG2.2.15细胞,加黄芩苷干预,并设不含药物对照,常规观察后,结果显示,黄芩苷能抑制hepG2.2.15分泌HBsAg、HBeAg和胞内的HBV-RNA水平(如图2所示)。
实施例3黄芩苷下调AhR受体蛋白转录水平试验
在野生型HBV(HepG2.2.15细胞)和耐药突变株HBV转染细胞株模型中加黄芩苷干预,并设不含药物对照,常规观察后,结果显示,黄芩苷在野生型HBV(HepG2.2.15细胞)和耐药突变株HBV转染细胞株模型中都能有效与ETV产生组合效应(如图3所示)。
实施例4黄芩苷类化合物抗不同病毒效果。
分别采用黄芩苷、千层纸素A,千层纸素A-7-O-β-D-葡萄糖苷对不同病毒进行干预,结果显示,黄芩苷类化合物具有抗不同病毒的效果。
表1 黄芩苷类似物结构变化对抗病毒药效的影响
- 还没有人留言评论。精彩留言会获得点赞!
- 作为AXL抑制剂的杂环化合物的制作方法与工艺
- HPTP‑β抑制剂的制作方法与工艺
- 作为LSD1抑制剂的环丙胺的制作方法与工艺
- KRAS G12C的抑制剂的制作方法与工艺
- 调节雌激素受体突变体的方法和组合物与流程
- 作为PI3K抑制剂的吡啶并[1,2‑A]嘧啶酮类似物的制作方法与工艺
- 作为PI3K抑制剂的吡啶并[1,2‑A]嘧啶酮类似物的制作方法与工艺
- 包含Ⅲ类受体酪氨酸激酶抑制剂和烷基化组蛋白‑脱乙酰酶抑制剂融合分子EDO‑S101的药物组合及其在治疗癌症中的用途的制作方法与工艺
- 包含Ⅲ类受体酪氨酸激酶抑制剂和烷基化组蛋白‑脱乙酰酶抑制剂融合分子EDO‑S101的药物组合及其在治疗癌症中的用途的制作方法与工艺
- 新型雌激素相关受体α抑制剂及其医学用途的制作方法与工艺
- 作为原肌球蛋白受体激酶(Trk)抑制剂的取代的吡唑并[1,5‑a]吡啶的制作方法与工艺
- 一种核孤儿受体TR3抑制剂多肽及其应用的制作方法与工艺
- 程序性死亡受体1基因抑制剂及其制备方法与应用与流程
- 作为H3受体抑制剂的包含哌啶和哌嗪环的氨基甲酸酯/脲衍生物的制作方法与工艺
- 一种雄性激素受体抑制剂的结晶形式及其制备方法与流程
- 一种雄性激素受体抑制剂的结晶形式及其制备方法与流程
- 丙型肝炎病毒辅助受体CD36的特异性抑制剂在制备防治丙型肝炎病毒感染药物中的应用的制造方法与工艺
- IRE‑1α抑制剂的制造方法与工艺
- 白细胞介素‑23受体的口服肽抑制剂以及其治疗炎症性肠病的用途的制造方法与工艺
- 一类孪药型HMG‑CoA还原酶抑制剂及其合成方法与制造工艺
- Flt3蛋白在制备肝癌对索拉菲尼疗效评估试剂盒中的应用
- 用于治疗癌症的雄激素受体抑制剂与akt抑制剂的组合的制作方法
- 一种药物中间体2-芳酰基吲哚衍生物的合成方法
- 一种作用于EGFR敏感突变激酶EGFR<sup>L858R</sup>,EGFR<sup>(d746-750)</sup>的6-取代氨基嘌呤类化合物及 ...的制作方法
- 一种6-溴喹啉的制备方法
- 一种基于巢式复合cold-pcr的t790m突变检测方法
- 具抗肿瘤活性的表皮生长因子受体酪氨酸激酶抑制剂irsf和irsh及其制备方法和应用
- 具抗肿瘤活性的表皮生长因子受体酪氨酸激酶抑制剂irsf和irsh及其制备方法和应用
- 一种多维替尼的制备方法
- 具有抗肿瘤活性的表皮生长因子受体酪氨酸激酶抑制剂nxgf和nxgh及其制备方法和应用