组蛋白去乙酰化酶及其抑制剂在制备肿瘤全细胞抗原负载的DC肿瘤疫苗中的应用的制作方法
本发明属于肿瘤免疫领域,涉及肿瘤疫苗,具体涉及组蛋白去乙酰化酶及其抑制剂在制备肿瘤全细胞抗原负载的DC肿瘤疫苗中的应用。
背景技术:
免疫治疗是手术、放疗、化疗之后的第四种肿瘤治疗方式,在肿瘤的综合治疗模式中,免疫治疗在提高肿瘤治愈率、改善患者生活质量、延长生存期方面起重要作用。在肿瘤免疫中,T淋巴细胞识别的肿瘤抗原不是被肿瘤细胞提呈,而是被抗原提呈细胞提呈。树突状细胞(DC)是人体内目前已知功能最强大、唯一能激活静息状态T细胞的抗原提呈细胞,具有强大的激活辅助和细胞毒T细胞的能力。树突状细胞肿瘤疫苗是肿瘤治疗的第四模式之一,有望成为一种很有实用前景的抗肿瘤方法。肿瘤全细胞抗原负载的树突状细胞肿瘤疫苗是由树突状细胞经肿瘤细胞裂解物或完整肿瘤细胞(两种最常用的全细胞抗原)致敏形成,致敏树突状细胞能表达MHC-Ⅰ、Ⅱ类分子及共刺激分子,使疫苗的抗肿瘤作用明显提高。
肿瘤细胞相关抗原的表达水平对DC疫苗的治疗效果有重要影响。申请人2017年1月12日提交了名称为“一种细胞裂解液、试剂盒及在制备肿瘤全细胞抗原负载DC肿瘤疫苗中的应用”的申请,抗原结构影响DC疫苗的预防和治疗效果。申请人前期研究发现,SAHA处理后的肿瘤全细胞抗原可以显著提高DC肿瘤疫苗对肿瘤的预防和治疗效果,并进一步研究了SAHA作用靶标组蛋白去乙酰化酶与肿瘤全细胞抗原负载DC肿瘤疫苗疗效的关系。
研究表明,肿瘤的发生与核小体核心组蛋白N-端的赖氨酸残基的乙酰化和去乙酰化的失衡有着密切的关系。组蛋白去乙酰化酶(HDACs)抑制剂通过调节组蛋白N-端的赖氨酸残基的乙酰化和去乙酰化,激活抑癌基因,抑制癌症基因,从而抑制肿瘤细胞生长,诱导肿瘤细胞凋亡(Apoptosis on hepatoma cells but not on primary hepatocytes by histone deacetylase inhibitors valproate and ITF2357.JHepatol,2005,42:210-217)。康印东等2009年发表了一篇组蛋白去乙酰化酶抑制剂通过树突细胞发挥免疫调节作用的研究综述(康印东等,组蛋白去乙酰化酶抑制剂通过树突细胞发挥免疫调节作用研究,中华移植杂志2009年第3卷第2期)。该综述综合阐述了组蛋白去乙酰化酶抑制剂(HDACI)与DC和免疫调节之间的关系。HDACI在高浓度下显示出强有力的抗肿瘤活性,在低浓度下显示出多种免疫调节作用。HDACI直接作用于DC时,降低DC在成熟的过程中向趋化因子CCL19迁移的能力,从而限制DC到达输入淋巴器官中发挥抗原呈递功能;作为最主要的抗原呈递细胞,DC对抗原特异性T淋巴细胞的活化至关重要,而HDACI影响了DC分化成熟和迁移,干扰其抗原呈递过程。总体来说,HDACI直接作用于DC起到抑制免疫应答的效果。
技术实现要素:
本发明首先发现SAHA处理后的肿瘤全细胞抗原可以显著提高DC肿瘤疫苗对肿瘤的预防和治疗效果,然后发现SAHA是通过其靶标组蛋白去乙酰化酶来增强肿瘤全细胞抗原对DC致敏效果的,最后以组蛋白去乙酰化酶作为靶标筛选得到相关苯并噻唑类衍生物。
本发明通过如下技术方案得以实现:
组蛋白去乙酰化酶作为效应靶标在制备肿瘤全细胞抗原负载DC肿瘤疫苗中的应用。
优选地,所述肿瘤全细胞抗原为肿瘤细胞裂解物抗原;所述DC肿瘤疫苗为DC与肿瘤细胞裂解物共培养致敏形成。
上述组蛋白去乙酰化酶的抑制剂在制备肿瘤全细胞抗原负载DC肿瘤疫苗中的应用。
一种化学试剂在制备肿瘤全细胞抗原负载DC肿瘤疫苗中的应用,包括上述组蛋白去乙酰化酶的抑制剂。
优选地,所述组蛋白去乙酰化酶的抑制剂为SAHA。
优选地,所述组蛋白去乙酰化酶的抑制剂为如下结构的苯并噻唑类衍生物:
其中,取代基R为甲基、甲氧基、硝基、卤素或氨基中的一种。
优选地,所述苯并噻唑类衍生物中的取代基R为硝基。
优选地,所述苯并噻唑类衍生物中的取代基R为甲氧基。
优选地,所述苯并噻唑类衍生物中的取代基R为甲基。
上述DC肿瘤疫苗在预防、治疗肿瘤方面的应用。
本发明优点:
本发明提供的组蛋白去乙酰化酶抑制剂可以通过其靶标组蛋白去乙酰化酶来增强肿瘤全细胞抗原对DC致敏效果,从而显著提高DC肿瘤疫苗对肿瘤的预防和治疗效果。该靶标和抑制剂可以用于制备更高预防和治疗价值的DC肿瘤疫苗。本发明具有重要的研究意义和产业开发前景。
附图说明
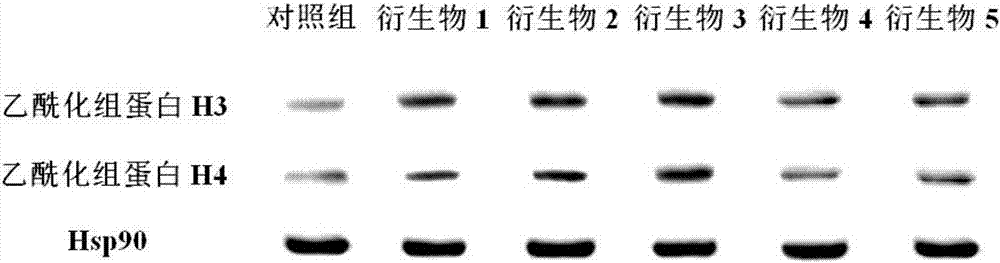
图1为SAHA对3LL中乙酰化组蛋白H3和H4表达的影响(Hsp90为上样对照);
图2为HDACI对3LL中乙酰化组蛋白H3和H4表达的影响(Hsp90为上样对照)。
具体实施方式
为了更好地解释本发明的技术方案,下面结合具体实施例进一步介绍。实施例中未特别强调的实验材料均为常规实验材料,属于本领域技术人员易于获得的范畴。
实施例1:SAHA对组蛋白去乙酰化酶活性及DC疫苗疗效的影响
一、实验材料
C57BL/6小鼠为8周龄雌性SPF级,购自南京大学动物中心;C57BL/6小鼠来源的肺癌细胞系3LL为本公司保存;DMEM培养基、胎牛血清购于Gibco公司。
其它所用试剂均为国产或进口分析纯。
二、实验方法
1、小鼠骨髓DC的分离制备和鉴定
脱颈处死C57BL/6小鼠,取双后腿股骨、胫骨,除去上面附着的肌肉组织,除去骨两端,暴露骨髓腔,用PBS冲洗骨髓腔数次,充分吹打制成单细胞悬液。用200目铜网过滤后,以PBS洗2次,重新悬浮细胞,配制成浓度1×l05/ml细胞悬液,放置于含15%%胎牛血清的DMEM培养液(含100U/ml青霉素、100μg/ml链霉素、1mM谷氨酰氨)中培养。在培养体系中加4ng/ml rhGM-CSF和10ng/ml rhIL-4,6天后培养体系中加入50ng/ml TNF-α继续培养3天使之成熟。每3天半量换液,培养至第9天时收集疏松黏附的细胞。
DC表型鉴定:通过流式细胞仪测定上述方法获得的DC表达MHCⅡ类分子、CD86水平。首先将以上制备的DC分别与FICT-抗MHCⅡ类分子、CD86单抗在PBS中反应45分钟,反应结束后以PBS洗3次,上机分析。
2、肺癌细胞系3LL与SAHA孵育、裂解及组蛋白去乙酰化酶活性测试
实验组:C57BL/6小鼠肺癌细胞系3LL于含10%FBS的DMEM培养液中培养,选取处于对数生长期细胞,调整至1×107/mL,在培养液中加入SAHA使其浓度为0.1μM,培养6小时后,更换为不含SAHA的培养基继续培养6小时,调整至5×106/mL,加入裂解液(50mM pH 7.4Tris-HCl,150mM NaCl,1%Triton X-100,0.5mM EDTA,临用前加入PMSF使终浓度为1mM)200μl,缓慢吹打约5min,收集裂解液于EP管中,4℃冰浴下于脱色摇床上振摇20min,4℃,12000×g离心15min,收集上清液,0.2μm的微孔滤膜过滤,-80℃保存。
对照组除不添加SAHA外,其余同实验组。
组蛋白去乙酰化酶活性测试:组蛋白去乙酰化酶(HDACs)包括多种亚型,如已知的HDAC1、HDAC2和HDAC3。已知乙酰化组蛋白H3和H4是HDAC1、HDAC2和HDAC3的底物,通过Western blot法测定乙酰化组蛋白H3和H4的水平即可获知组蛋白去乙酰化酶活性的变化。具体方法为:取细胞裂解液75μl,使用5μl测定样品蛋白浓度,剩余70μl加等体积蛋白上样缓冲液(2×上样培养液65μl和3M的DTT储备液5μl)置于沸水浴中煮沸5分钟,分装后在4℃冰箱中保存。之后12%SDS聚丙烯酰胺凝胶电泳分离蛋白,据蛋白的条带切胶,将蛋白转至聚偏二氟乙烯膜上,并以5%的封闭液封闭1小时。将聚偏二氟乙烯膜置于1:1000或1:2000稀释的一抗中,4℃孵育过夜。取出膜,以TBST洗膜3次后加入1:2000稀释的二抗室温孵育2小时。之后将膜洗3遍,显影。
3、DC与肺癌细胞系3LL裂解物共培养制备DC肿瘤疫苗
实验组:按6:1的细胞比例将来自C57BL/6小鼠的DC与上述实验组肺癌细胞裂解物共培养18小时,收集半贴壁的致敏DC细胞。
对照组:按6:1的细胞比例将来自C57BL/6小鼠的DC与上述对照组肺癌细胞裂解物共培养18小时,收集半贴壁的致敏DC细胞。
4、DC疫苗体内诱导的免疫预防作用
用DC疫苗对健康小鼠进行免疫:将实验组、对照组DC疫苗悬浮于PBS中,小鼠双侧中腹部皮内注射,每侧100微升,2×106/鼠;3天后对小鼠进行第二次免疫,剂量及方法同第一次免疫。两次免疫小鼠7天后,以肿瘤细胞3LL攻击小鼠,5×104/鼠/200微升,溶于PBS中,双侧中侧腹皮下接种,100微升/侧。定期观察肿瘤生长情况,测定肿瘤体积。空白组注射等剂量PBS,肿瘤细胞正常接种。
5、DC疫苗对荷瘤小鼠的免疫治疗作用
将对数生长期的3LL(悬浮于PBS中)以5×104/鼠/200微升双侧中侧腹皮下接种攻击小鼠,随机分组。7天后,皮下注射经放射线灭活的实验组、对照组DC疫苗,在第10天进行第二次免疫,免疫剂量和方法同上。记录肿瘤生长状况,定期测量肿瘤体积,并记录各组小鼠180天存活率(%)。空白组注射等剂量PBS,肿瘤细胞正常接种。每组20只。
三、实验结果
1、小鼠骨髓DC的分离鉴定结果
小鼠骨髓来源的DC倒置显微镜下观察,具有典型DC的形态,细胞体积大,外形不规则,胞浆丰富,胞膜向外伸出毛刺状或树枝状突起,有明显的贴壁集簇生长现象。DC表型鉴定证明上述方法获得的DC高表达MHCⅡ类分子和CD86。
2、肺癌细胞系3LL与SAHA共孵育后组蛋白去乙酰化酶活性变化
由图1可见,与对照组相比,实验组乙酰化组蛋白H3和H4的表达水平明显升高,证明肺癌细胞系3LL与SAHA孵育后组蛋白去乙酰化酶活性受到抑制。
3、DC疫苗体内诱导的免疫预防作用
肿瘤体积测定结果如下表:
4、DC疫苗对荷瘤小鼠的免疫治疗作用
各组小鼠180天存活率(%)如下表:
上述实验结果证明:组蛋白去乙酰化酶及其抑制剂SAHA与肿瘤全细胞抗原负载DC肿瘤疫苗的预防、治疗效果有关,SAHA通过抑制肿瘤细胞组蛋白去乙酰化酶的活性改变了肿瘤全细胞抗原的性质,这种改变可以显著提高肿瘤全细胞抗原负载DC疫苗的疗效。
实施例2:组蛋白去乙酰化酶抑制剂的筛选
筛选模型:C57BL/6小鼠肺癌细胞系3LL于含10%FBS的DMEM培养液中培养,选取处于对数生长期细胞,调整至1×107/mL,分组,在培养液中分别加入下表中的苯并噻唑类衍生物,培养6小时后,更换为不含苯并噻唑类衍生物的培养基继续培养6小时,调整至5×106/mL,加入裂解液(50mM pH 7.4Tris-HCl,150mM NaCl,1%Triton X-100,0.5mM EDTA,临用前加入PMSF使终浓度为1mM)200μl,缓慢吹打约5min,收集裂解液于EP管中,4℃冰浴下于脱色摇床上振摇20min,4℃,12000×g离心15min,收集上清液,0.2μm的微孔滤膜过滤,-80℃保存。对照组不添加苯并噻唑类衍生物,其他操作相同。
组蛋白去乙酰化酶活性测试:通过Western blot法测定乙酰化组蛋白H3和H4的水平即可获知组蛋白去乙酰化酶活性的变化。具体方法为:取细胞裂解液75μl,使用5μl测定样品蛋白浓度,剩余70μl加等体积蛋白上样缓冲液(2×上样培养液65μl和3M的DTT储备液5μl)置于沸水浴中煮沸5分钟,分装后在4℃冰箱中保存。之后12%SDS聚丙烯酰胺凝胶电泳分离蛋白,据蛋白的条带切胶,将蛋白转至聚偏二氟乙烯膜上,并以5%的封闭液封闭1小时。将聚偏二氟乙烯膜置于1:1000或1:2000稀释的一抗中,4℃孵育过夜。取出膜,以TBST洗膜3次后加入1:2000稀释的二抗室温孵育2小时。之后将膜洗3遍,显影。
苯并噻唑类衍生物及其浓度如下:
实验结果:如图2所示,苯并噻唑类衍生物1-5均能显著抑制组蛋白去乙酰化酶的活性。
实施例3:组蛋白去乙酰化酶抑制剂对DC疫苗疗效的影响
一、实验材料
同实施例1。
二、实验方法
1、小鼠骨髓DC的分离制备和鉴定
同实施例1。
2、肺癌细胞系3LL与HDACs抑制剂孵育、裂解
实验组:C57BL/6小鼠肺癌细胞系3LL于含10%FBS的DMEM培养液中培养,选取处于对数生长期细胞,调整至1×107/mL,在培养液中加入实施例2中结构和浓度的苯并噻唑类衍生物1-3(分别为实验组1-3),培养6小时后,更换为不含HDACs抑制剂的培养基继续培养6小时,调整至5×106/mL,加入裂解液(50mM pH 7.4Tris-HCl,150mM NaCl,1%Triton X-100,0.5mM EDTA,临用前加入PMSF使终浓度为1mM)200μl,缓慢吹打约5min,收集裂解液于EP管中,4℃冰浴下于脱色摇床上振摇20min,4℃,12000×g离心15min,收集上清液,0.2μm的微孔滤膜过滤,-80℃保存。
对照组除不添加苯并噻唑类衍生物外,其余同实验组。
3、DC与肺癌细胞系3LL裂解物共培养制备DC肿瘤疫苗
实验组1-3:按6:1的细胞比例将来自C57BL/6小鼠的DC与上述实验组1-3肺癌细胞裂解物共培养18小时,收集半贴壁的致敏DC细胞。
对照组:按6:1的细胞比例将来自C57BL/6小鼠的DC与上述对照组肺癌细胞裂解物共培养18小时,收集半贴壁的致敏DC细胞。
4、DC疫苗体内诱导的免疫预防作用
用DC疫苗对健康小鼠进行免疫:将实验组1-3、对照组DC疫苗悬浮于PBS中,小鼠双侧中腹部皮内注射,每侧100微升,2×106/鼠;3天后对小鼠进行第二次免疫,剂量及方法同第一次免疫。两次免疫小鼠7天后,以肿瘤细胞3LL攻击小鼠,5×104/鼠/200微升,溶于PBS中,双侧中侧腹皮下接种,100微升/侧。定期观察肿瘤生长情况,测定肿瘤体积。空白组注射等剂量PBS,肿瘤细胞正常接种。
5、DC疫苗对荷瘤小鼠的免疫治疗作用
将对数生长期的3LL(悬浮于PBS中)以5×104/鼠/200微升双侧中侧腹皮下接种攻击小鼠,随机分组。7天后,皮下注射经放射线灭活的实验组1-3、对照组DC疫苗,在第10天进行第二次免疫,免疫剂量和方法同上。记录肿瘤生长状况,定期测量肿瘤体积,并记录各组小鼠180天存活率(%)。空白组注射等剂量PBS,肿瘤细胞正常接种。每组20只。
三、实验结果
1、小鼠骨髓DC的分离鉴定结果
小鼠骨髓来源的DC倒置显微镜下观察,具有典型DC的形态,细胞体积大,外形不规则,胞浆丰富,胞膜向外伸出毛刺状或树枝状突起,有明显的贴壁集簇生长现象。DC表型鉴定证明上述方法获得的DC高表达MHCⅡ类分子和CD86。
2、DC疫苗体内诱导的免疫预防作用
肿瘤体积测定结果如下表:
3、DC疫苗对荷瘤小鼠的免疫治疗作用
各组小鼠180天存活率(%)如下表:
上述实验结果证明:苯并噻唑类衍生物1-3通过抑制肿瘤细胞组蛋白去乙酰化酶的活性改变了肿瘤全细胞抗原的性质,这种改变可以显著提高肿瘤全细胞抗原负载DC疫苗的疗效。
本发明提供的组蛋白去乙酰化酶抑制剂可以通过其靶标组蛋白去乙酰化酶来增强肿瘤全细胞抗原对DC致敏效果,从而显著提高DC肿瘤疫苗对肿瘤的预防和治疗效果。该靶标和抑制剂可以用于制备具有更高预防和治疗价值的DC肿瘤疫苗。
上述实施例仅用于进一步解释本发明的技术方案,本领域技术人员应当明白,任何简单替换或修改均不脱离本发明,本发明的保护范围并不受限于上述具体实施例。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种含有组氨酸去乙酰化酶抑制剂衍生物的抗肿瘤药物的制造方法与工艺
- 氨甲酰基吡啶酮HIV整合酶抑制剂的方法和中间体与流程
- 氨甲酰基吡啶酮HIV整合酶抑制剂的方法和中间体与流程
- 一类组蛋白去乙酰化酶抑制剂及其制备方法和用途与流程
- 组蛋白去乙酰化酶抑制剂于改变蜂王浆中MRJP3蛋白质的新颖用途的制造方法与工艺
- 用于治疗疾病的硫酸乙酰肝素生物合成抑制剂的制造方法与工艺
- 酚氧类氮氧化物作为去乙酰化酶抑制剂的抗肿瘤应用的制造方法与工艺
- 作为NADPH氧化酶抑制剂的酰氨基噻二唑衍生物的制造方法与工艺
- 利用组蛋白脱乙酰酶抑制剂治疗白血病的制造方法与工艺
- 组蛋白去乙酰化酶HDAC6的抑制剂在制备防治急性肾损伤药物中的用途的制造方法与工艺
- 含有色氨酸基本骨架的邻苯二胺类选择性组蛋白去乙酰化酶抑制剂及其制备方法和应用
- 一种生产贝利司他中间体的工艺方法
- 组蛋白去乙酰化酶抑制剂治疗β亚科疱疹病毒的新用图
- 一种含有苯甘氨酸的肉桂酰胺类组蛋白去乙酰化酶抑制剂及其制备方法和应用
- 2-(1-(4-氯苯甲酰基)-5-甲氧基-2-甲基-1氢-吲哚-3-基)-n-羟基乙酰胺作为组蛋白去 ...的制作方法
- Hif羟化酶抑制剂的药物制剂的制作方法
- 一种组蛋白去乙酰酶抑制剂2-(1-(4-氯苯甲酰基)-5-甲氧基-2-甲基-1氢-吲哚-3-基-n ...的制作方法
- 一种组蛋白去乙酰酶抑制剂(e)-3-(2-(1-(4-氯苯甲酰基)-5-甲氧基-2-甲基-1氢-吲哚 ...的制作方法
- 广谱的去乙酰化酶抑制剂及其应用
- 广谱的去乙酰化酶抑制剂乙酰化赖氨酸及其应用
- 一种制备自噬小体型瘤苗的培养基添加剂及其制备方法与制造工艺
- N-萘烷基取代的含氮杂环衍生物、制备方法及其抗肿瘤用途与制造工艺
- 作为BET蛋白抑制剂的1H‑吡咯并[2,3‑c]吡啶‑7(6H)‑酮和吡唑并[3,4‑c]吡啶‑7(6H)‑酮的制造方法与工艺
- 一种人肿瘤抑制蛋白变体及其应用的制造方法与工艺
- 一种人肿瘤抑制蛋白变体及其应用的制造方法与工艺
- G蛋白信号调节因子6及其抑制剂在治疗脂肪肝和Ⅱ型糖尿病中的功能和应用的制造方法与工艺
- 蛋白酶体抑制剂在制备降低动物脂含量或脂储积能力产品中的应用的制造方法与工艺
- GINS2基因或蛋白的抑制剂在制备抗肿瘤药物中的应用的制造方法与工艺
- ZNF383蛋白在制备抑制p53蛋白活性的产品中的应用的制造方法与工艺
- 蛋白酶体抑制剂MLN9708的合成方法与制造工艺