辅酶Q10与二十八烷醇复配的纳米结构脂质载体及制备方法与流程
本发明涉及一种辅酶q10与二十八烷醇复配纳米结构脂质载体及制备方法,该纳米结构脂质载体具有增强免疫力、缓解体力疲劳、保护心脏等作用,它属于药品、保健品
技术领域:
。
背景技术:
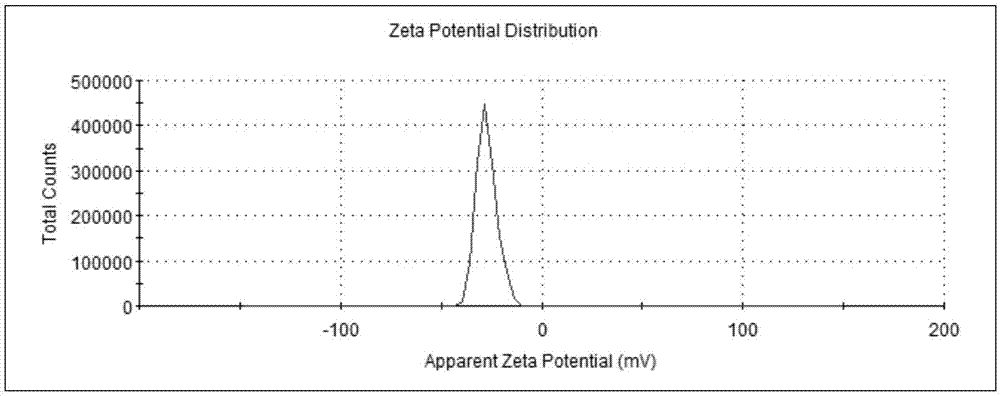
:辅酶q10(coenzymeq10)是一种由人体自行合成的化合物,因其母核六位上的侧链-聚异戊二烯基的聚合度为10而得名,结构与维生素k类似。辅酶q10分为还原型辅酶q10(coq10h2,ubiquinol,泛醇)与氧化型辅酶q10(coq10,ubiquinone,泛醌)两种形态,coq10h2是coq10的二电子还原体。在体内,coq10h2与coq10作为一类递氢/递电子体共同参与线粒体内膜呼吸链等跨膜电子运输体系和细胞氧化磷酸化过程,在三磷酸腺苷(atp)的合成中起着重要作用。辅酶q10是人体中不可缺少的重要生理物质,其化学结构特点决定了它在人体中具有许多重要生理功能,它是生命活动中重要的能量传递物质,是线粒体呼吸链限速反应的关键性物质,在细胞能量生成、增强生物活力方面发挥重要作用。辅酶q10具有较强的抗氧化应激作用,维护线粒体膜完整,与他汀类药物合用可辅助降血脂、减少其副作用,它对高血脂等心血管疾病、肿瘤、糖尿病、帕金森等具有较好治疗和保健作用。二十八烷醇(1-octacosanol),又称为蒙旦醇或普利醇,分子式为c28h58o,是天然存在的高级脂肪醇,目前主要通过甘蔗蜡、米糠、蜂蜡提取精制,是世界公认的抗疲劳物质,在美国、日本等国家作为天然健康食品添加剂、广谱天然良药,已被广泛用于运动饮料、天然保健品、药品和化妆品等领域。二十八烷醇具有提高机体耐久力、降低机体的应激反应、降低体内血脂和胆固醇以及其他生理功能。二十八烷醇还具有增强心脏功能、降低胆固醇,抗机体动脉粥样硬化、抑制胃溃疡、抗血小板聚集、保护肝脏等作用。辅酶q10与二十八烷醇均是脂溶性物质,难溶于水,均属于药剂学ⅱ类物质,口服给药吸收受限于溶解和溶出,其绝对生物利用度均较低,辅酶q10对光、水性质不稳定,针对这种情况,近年来已经开发出多种提高口服给药生物利用度的方法,如包合技术、自乳化技术、脂质体、纳米结构脂质载体等。其中纳米给药是改善生物利用度较好技术,目前已经开发出如纳米脂质体(nanoliposomes,nl)、固体纳米结构脂质载体(solidlipidnano-particles,sln)和纳米乳剂(nano-particaleemulsion,npe)等。纳米结构脂质载体(nanostructuredlipidcarriers,nlc)是在固体纳米结构脂质载体(sln)基础上发展的新型给药系统,在配方中加入固体脂质是形成固体脂质纳米粒或的纳米结构脂质载体必要条件,通常方法是在固体脂质为载体的基础上加入液体脂质,扰乱固态脂质固化后的完美晶型,以增加药物载药率和吸收。nlc载药通常条件是药物成分能够溶解在融化的脂质中,方法是将固体脂质融化后溶解药物成分或使用有机溶媒将脂质与药物成分溶解,通常需要较大量的固体脂质溶解后制备,药物成分载药率受限于其在融化脂质的溶解度,一般情况下其载药率均不高。辅酶q10与二十八烷醇均是脂溶性物质,难溶于水,两者在一般固体脂质中溶解度也比较小,通常按照常规的纳米结构脂质载体制备方法需要较大量的固体脂质溶解后制备,这样很难制备出高载药率的制剂。对目前已公开发表的专利和文献进行检索,未检索到两者复配纳米结构脂质载体或其他纳米制剂的相关专利及文献研究报道,只检索到辅酶q10与二十八烷醇单独制备类似制剂的文献或专利,其中与本专利关联的有:①中国专利cn105708799一种纳米结构脂质载体药物组合物及其制备方法中提到难溶性药物制备成纳米结构脂质载体的方法,其中难溶性药物包括辅酶q10。中国专利cn101658468a辅酶q10纳米结构脂质载体及其制备方法公开了辅酶q10纳米结构脂质载体及其应用。②《精细化工》2016,33(1):65-70;《中国医院药学杂志》2012,32(12):932-936;《日用化学工业》2016,46(9):524-529等上述文献中提到辅酶q10的纳米结构脂质载体的制备及应用。文献europeanjournalofpharmaceuticsandbiopharmaceutics67(2007)141–148中作者rainerh.muller发表题为cetylpalmitate-basednlcfortopicaldeliveryofcoenzymeq10-development,physicochemicalcharacterizationandinvitroreleasestudies文章,文章描述了采用棕榈酸酯制备24%含量的辅酶q10的nlc方法。文献pharmaceuticalresearch,vol.18,no.3,2001,heikebunjes发表incorporationofthemodeldrugubidecarenoneintosolidlipidnanoparticles一文叙述了辅酶q10固体液体纳米粒制备。③中国专利cn100998438a二十八烷醇乳化液及其制备方法叙述了二十八烷醇乳化液制备方法,涉及到二十八烷醇采用乳化法制备最高含量1.5%乳化液的方法,专利内容未公布其水溶液粒径,工艺中未涉及纳米结构脂质载体制备如冷却等关键环节。中国专利cn1316966c一种二十八烷醇提取物微胶囊粉末及其制备方法公开了其微囊的制备方法,未涉及二十八烷醇纳米结构脂质载体制备内容。上述专利都是关于辅酶q10或二十八烷醇单独制备纳米结构脂质载体以及其他相关技术内容的,其中公开文献显示辅酶q10纳米结构脂质载体载药率通常较低,载药率一般在24%以下,二十八烷醇未涉及到纳米结构脂质载体技术内容。辅酶q10纳米结构脂质载体制备一般都采用了有机溶媒溶解并作为油相的方法。以上专利文献均未涉及本发明技术内容。技术实现要素:本发明就是为了解决上述技术问题,而提供的一种辅酶q10与二十八烷醇复配的纳米结构脂质载体及制备方法,本发明采用辅酶q10与二十八烷醇复配形成纳米结构脂质载体,具有降血脂、保护心脏等作用,具有较高释放度和生物利用度、持续释放的特点。制备纳米结构脂质载体一般要求包裹药物成分能够在选定的固体脂质中溶解才能制备,一般情况下其载药率均不高。辅酶q10与二十八烷醇虽然均是脂溶性物质,但在通常使用的固体脂质中溶解度均不高,因此按照常规方法制备需要较大量的固体脂质,所以很难制备高载药率的纳米载体。辅酶q10熔点为49℃,二十八烷醇单体熔点为83℃,因此在水浴85℃情况下,两者完全混融为均一脂质固体分散体,其两者熔融的固体分散体中熔点峰整体下移,在40-70℃,符合制备nlc的固体脂质条件,因此本发明利用这两种成分理化性质特点,创新以主药成分本身作为固体脂质成分,或加入少量选定的固体脂质后加热混融,形成了主药高含量均匀的固体分散体脂质,然后在不使用有机溶媒情况下采用乳化法就可实现制备高载药率的辅酶q10与二十八烷醇纳米结构脂质载体。为使这种高载药率的辅酶q10与二十八烷醇纳米结构脂质载体更好应用于固体给药制剂,对已经形成nlc纳米结构脂质载体水溶液中纳米粒进行保护,本发明筛选了保护剂种类,通过加入保护剂方法得到可以复溶的辅酶q10与二十八烷醇纳米结构脂质载体固体粉末,筛选出适合工业化生产的干燥方法。为了解决上述技术问题,本发明是通过下述技术方案实现:辅酶q10与二十八烷醇复配的纳米结构脂质载体,它主要是由下述原料按所述重量份数制备而成:辅酶q101-5份,二十八烷醇1-2份,辛,癸酸甘油酯0.5-1份,维生素e0.001-0.003份,乳化剂2-5份。辅酶q10与二十八烷醇复配的纳米结构脂质载体,它是由下述原料按所述重量份数制备而成:辅酶q101-5份,二十八烷醇1-2份,固体脂质0.5-1.5份,辛,癸酸甘油酯0.5-1份,维生素e0.001-0.003份,乳化剂2-5份。辅酶q10与二十八烷醇复配的纳米结构脂质载体,它是由下述原料按所述重量份数制备而成:辅酶q101-5份,二十八烷醇1-2份,固体脂质0.5-1.5份,辛,癸酸甘油酯0.5-1份,维生素e0.001-0.003份,乳化剂2-5份,保护剂7-15份。上述的固体脂质为单硬脂酸甘油酯或山嵛酸甘油酯。上述的乳化剂是卵磷脂、十聚甘油月桂酸酯、十聚甘油硬脂酸酯、聚乙二醇-12-羟基硬脂酸酯、吐温-80中的至少一种。上述的辅酶q10是氧化型辅酶q10或还原型辅酶q10。上述的二十八烷醇是二十八烷醇单体成分或含二十八烷醇不少于50%的一组c22~c36高级脂肪烷醇混合物。上述的保护剂是辛烯基琥珀酸淀粉钠或辛烯基琥珀酸单阿拉伯胶酯。辅酶q10与二十八烷醇复配的纳米结构脂质载体的制备方法,它包括下述工艺步骤:称取符合所述重量份数的辅酶q10、二十八烷醇、辛,癸酸甘油酯、维生素e在70~90℃下加热熔融,搅拌混匀,形成油相;称取符合所述重量份数的乳化剂加入70~90℃水中,搅拌混匀,形成水相;将上述油相加入水相中,使用剪切机,以16000rpm剪切1-2分钟后,形成初乳;然后使用高压均质机,在30~80mp的压力下,通n2保护,经过5~10次循环,形成乳液,冷却至室温,制得纳米结构脂质载体水溶液。上述的辅酶q10与二十八烷醇复配的纳米结构脂质载体的制备方法,它包括下述工艺步骤:称取符合所述重量份数的辅酶q10、二十八烷醇、0.5-1.5份固体脂质、辛,癸酸甘油酯、维生素e在70~90℃下加热熔融,搅拌混匀,形成油相;称取符合所述重量份数的乳化剂加入70~90℃水中,搅拌混匀,形成水相;将上述油相加入水相中,使用剪切机,以16000rpm剪切1-2分钟后,形成初乳;然后使用高压均质机,在30~80mp的压力下,通n2保护,经过5~10次循环,形成乳液,冷却至室温,制得纳米结构脂质载体水溶液,加入7-15份保护剂,搅拌均匀,干燥,制得纳米结构脂质载体固体粉末。上述干燥可以采用喷雾干燥或冷冻干燥,高压均质可以使用超声波震荡替代。由于采用上述技术方案,使得本发明具有如下特点和效果:本发明与以往技术不同的是采用辅酶q10和二十八烷醇复配合用为一个制剂方案,目的将起到很好的协同作用,由于辅酶q10和二十八烷醇都有良好的增强心脏功能和降血脂的作用,辅酶q10是细胞内位于线粒体中的抗氧化剂,具有较强清除体内过氧化自由基作用,心肌细胞提供能量,治疗和改善心血管疾病,二十八烷醇具有抗脂质过氧化、保护心肌细胞线粒体完整性和调节心肌能量代谢作用,二十八烷醇主要是通过调节胆固醇生物合成中的关键酶——羟甲基戊二酰辅酶a(hmg-coa)的活性来抑制胆固醇的合成,从而降低人体总胆固醇,由于该酶也是体内辅酶q10的合成酶,因此有可能对辅酶q10的生物合成构成影响,两者合用消除了这种影响,同时由于两者基于不同的机理抗氧化应激以及生理活性的作用,经试验验证两者合用具有更强的生理活性作用,尤其在降血脂的应用上,达到了更好的效果。本发明制备的辅酶q10与二十八烷醇复配的纳米结构脂质载体粒径采用激光粒径仪测定,其粒径在100~300nm,其辅酶q10载药率最高可达20%~50%,二十八烷醇载药率可达28%,包封率为90%~99%,其高载药率超过以往同类技术。其加入保护剂后可干燥成固体粉末,其复溶溶液粒径仍可在在200~400nm,使其可以方便应用于固体制剂。本发明纳米载体由于其辅酶q10与二十八烷醇具有脂溶性低熔点的理化性质,因此利用本发明采用的技术手段,可以形成两者混融的脂质分散体,可以不使用或只使用少量固体脂质就能产生更低熔点混融脂质分散体,为进一步制备高载药率纳米结构脂质载体创造了条件,并且不使用有机溶媒作为油相,因此最后本发明制备的纳米结构脂质载体超过了以往的技术效果。热分析图谱dsc显示辅酶q10与二十八烷醇熔点峰消失或偏移,证明其形成了均匀的混融脂质分散体,辅酶q10与二十八烷醇在纳米结构脂质载体中处于无定型状态,该晶体状态有助于其吸收。透射电镜图像显示本发明载体粒子为基本为圆形,粒径在100-300nm,固体粉末粒子复溶水溶液粒径在200-400nm。本发明制备的辅酶q10与二十八烷醇复配的纳米结构脂质载体及其粉末与原型药相比,其释放度有较大幅度提高,且呈现持续释放趋势。本发明制备的辅酶q10与二十八烷醇复配的纳米结构脂质载体通过体外抗氧化药效试验证明,其体外抗氧化性如对dpph自由基清除能力显著超过辅酶q10与二十八烷醇原型药混合物以及它们的单独纳米粒制剂,证明同时负载了辅酶q10与二十八烷醇的纳米结构脂质载体抗氧化效果显著优于以往的单个原料制备的纳米载体和两者原料混合物。本发明负载辅酶q10与二十八烷醇复配的纳米结构脂质载体固体粉末,具有较好的固体粉末流动性、可压性、复溶性、快速崩解物理特性,使其较容易制备如片剂、胶囊等固体制剂。本发明辅酶q10与二十八烷醇复配的纳米结构脂质载体的辅酶q10含量测定方法主要采用高效液相色谱法,方法是取辅酶q10与二十八烷醇复配的纳米结构脂质载体样品适量,用乙醇加热超声,放冷定容至规定浓度后,过滤,取续滤液作为供试品溶液,进样,色谱条件:辅酶q10:c18柱,流动相为乙腈:四氢呋喃:水=55:40:5(体积比),检测波长275nm,外标法定量,即得。本发明辅酶q10与二十八烷醇复配的纳米结构脂质载体的二十八烷醇含量测定方法主要采用气相色谱方法,方法是称取辅酶q10与二十八烷醇复配的纳米结构脂质载体样品适量,于10ml具塞试管中,准确加入10ml混合提取液(三氯甲烷:正己烷体积比9:1),超声提取15min,静置分层后,取上清液进样1μl,色谱条件:色谱柱为pe-5ms(30m×0.25mm×0.25μm),程序升温(180℃保持3min,9℃/min升至290℃,保持35min,22℃/min升至300℃,保持5min),进样口温度为320℃,fid检测器温度为330℃,分流比为60:1,氮气流速为50ml/min,氢气流速为35ml/min,空气流速为400ml/min。本发明辅酶q10与二十八烷醇复配的纳米结构脂质载体的包封率测定方法,采用超滤离心法测其包封率和载药量,取适量样品稀释10倍后涡旋1min混合均匀,置于超滤离心管中,12000r/min离心10min,取滤液置于10ml量瓶中,加甲醇超声溶解15min后定容至刻度,用0.45μm微孔滤膜过滤,测定滤液中游离药物量(wf);另取适量样品于10ml容量瓶中,加甲醇超声溶解15min后定容至刻度,用0.45μm微孔滤膜过滤,测定总药量(wt)。包封率(%)=(wt-wf)/wt×100%;载药量(%)=(wt-wf)/wl×100%;其中,wl:纳米结构脂质载体的质量。附图说明图1是实施例1制备的nlc水溶液的粒径分布图。图2是实施例1制备的nlc水溶液的zeta电位分布图。图3是实施例14制备的nlc固体粉末的粒径分布图。图4是实施例14制备的nlc、空白nlc、辅酶q10、二十八烷醇的dsc图。图5是实施例1、6、14制备的nlc中辅酶q10累积释放曲线。图6是实施例1、6、14制备的nlc中二十八烷醇累积释放曲线。具体实施方式下面结合实施例对本发明进行进一步描述。以下实施例仅为本发明的几个具体实施例,但本发明的设计构思并不局限于此,凡利用此构思对本发明进行非实质性的改动,均应属于侵犯本发明保护范围的行为。下述实施例中的方法,如无特别说明,均为常规方法,所述的百分含量均为质量百分含量。实施例1氧化型辅酶q102份,二十八烷醇1份,辛,癸酸甘油酯(odo)1份,维生素e0.001份,十聚甘油月桂酸酯1份,十聚甘油硬脂酸酯1份。称取4g氧化型辅酶q10、2g二十八烷醇、2g辛,癸酸甘油酯(odo)、0.002g维生素e在90℃下加热熔融,搅拌混匀,形成油相;称取2g十聚甘油月桂酸酯、2g十聚甘油硬脂酸酯加入90℃200ml水中,搅拌混匀,形成水相;将上述油相缓慢加入水相中,使用剪切机,以16000rpm剪切1分钟后,形成初乳;然后使用高压均质机,在60mp的压力下,通n2保护,经过5次循环,形成乳液,冷却至室温,制得纳米结构脂质载体水溶液。经测定,平均粒径112.9nm,电位为(-27.5±4.99)mv,辅酶q10的载药率和包封率分别为32.5%和97.4%,二十八烷醇的载药量和包封率分别为15.9%和95.3%。实施例2氧化型辅酶q101份,二十八烷醇2份,辛,癸酸甘油酯(odo)1份,维生素e0.002份,吐温-801.5份,大豆卵磷脂1.5份。称取2g氧化型辅酶q10、4g二十八烷醇、2g辛,癸酸甘油酯(odo)、0.004g维生素e在85℃下加热熔融,搅拌混匀,形成油相;称取3g吐温-80、3g大豆磷脂加入85℃250ml水中,搅拌混匀,形成水相;将上述油相缓慢加入水相中,使用剪切机,以16000rpm剪切1.5分钟后,形成初乳;然后使用高压均质机,在70mp的压力下,通n2保护,经过7次循环,形成乳液,迅速冷却至室温,制得纳米结构脂质载体水溶液。经测定,平均粒径210.6nm,辅酶q10的载药率和包封率分别为13.6%和95.5%,二十八烷醇的载药量和包封率分别为26.6%和93.2%。实施例3氧化型辅酶q101份,含二十八烷醇70%的c22~c36高级脂肪烷醇混合物1份,辛,癸酸甘油酯(odo)0.5份,维生素e0.003份,大豆卵磷脂0.2份,聚乙二醇-12-羟基硬脂酸酯(hs15)1.8份。称取2g氧化型辅酶q10、2g含二十八烷醇70%的c22~c36高级脂肪烷醇混合物、1g辛,癸酸甘油酯(odo)、0.006g维生素e在70℃下加热熔融,搅拌混匀,形成油相;称取0.4g大豆卵磷脂,3.6g聚乙二醇-12-羟基硬脂酸酯(hs15)加入70℃150ml水中,搅拌混匀,形成水相;将上述油相缓慢加入水相中,使用剪切机,以16000rpm剪切2分钟后,形成初乳;然后使用高压均质机,在30mp的压力下,通n2保护,经过10次循环,形成乳液,迅速冷却至室温,制得纳米结构脂质载体水溶液。经测定,平均粒径195.2nm,辅酶q10的载药率和包封率分别为22.9%和96.1%,二十八烷醇的载药量和包封率分别为15.6%和93.6%。实施例4还原型辅酶q105份,二十八烷醇2份,辛,癸酸甘油酯(odo)0.5份,维生素e0.002份,蛋黄卵磷脂0.2份,聚乙二醇-12-羟基硬脂酸酯(hs15)4.8份。称取5g还原型辅酶q10、2g二十八烷醇、0.5g辛,癸酸甘油酯(odo)、0.002g维生素e在80℃下加热熔融,搅拌混匀,形成油相;称取0.2g蛋黄卵磷脂,4.8g聚乙二醇-12-羟基硬脂酸酯(hs15)加入80℃210ml水中,搅拌混匀,形成水相;将上述油相缓慢加入水相中,使用剪切机,以16000rpm剪切2分钟后,形成初乳;然后使用高压均质机,在80mp的压力下,通n2保护,经过5次循环,形成乳液,迅速冷却至室温,制得纳米结构脂质载体水溶液。经测定,平均粒径180.7nm,辅酶q10的载药率和包封率分别为38.6%和96.5%,二十八烷醇的载药量和包封率分别为15.0%和93.8%。实施例5氧化型辅酶q105份,二十八烷醇1份,单硬脂酸甘油酯1份,辛,癸酸甘油酯(odo)0.5份,维生素e0.003份,聚乙二醇-12-羟基硬脂酸酯(hs15)3份。称取5g氧化型辅酶q10、1g二十八烷醇、1g单硬脂酸甘油酯、0.5g辛,癸酸甘油酯(odo)、0.003g维生素e在85℃下加热熔融,搅拌混匀,形成油相;称取3g聚乙二醇-12-羟基硬脂酸酯(hs15)加入85℃180ml水中,搅拌混匀,形成水相;将上述油相缓慢加入水相中,使用剪切机,以16000rpm剪切1分钟后,形成初乳;然后使用高压均质机,在30mp的压力下,通n2保护,经过5次循环,形成乳液,迅速冷却至室温,制得纳米结构脂质载体水溶液。经测定,平均粒径222.6nm,辅酶q10的载药率和包封率分别为45.2%和94.9%,二十八烷醇的载药量和包封率分别为8.9%和93.0%。实施例6氧化型辅酶q105份,二十八烷醇1份,单硬脂酸甘油酯1.5份,辛,癸酸甘油酯(odo)0.75份,维生素e0.002份,十聚甘油月桂酸酯2.67份,十聚甘油硬脂酸酯1.33份。称取5g氧化型辅酶q10、1g二十八烷醇、1.5g单硬脂酸甘油酯、0.75g辛,癸酸甘油酯(odo)、0.002g维生素e在75℃下加热熔融,搅拌混匀,形成油相;称取2.67g十聚甘油月桂酸酯、1.33g十聚甘油硬脂酸酯加入75℃220ml水中,搅拌混匀,形成水相;将上述油相缓慢加入水相中,使用剪切机,以16000rpm剪切1分钟后,形成初乳;然后使用高压均质机,在40mp的压力下,通n2保护,经过6次循环,形成乳液,迅速冷却至室温,制得纳米结构脂质载体水溶液。经测定,平均粒径120.5nm,辅酶q10的载药率和包封率分别为40.1%和98.2%,二十八烷醇的载药量和包封率分别为7.9%和96.8%。实施例7氧化型辅酶q104份,二十八烷醇2份,山嵛酸甘油酯1份,辛,癸酸甘油酯(odo)0.5份,维生素e0.001份,十聚甘油月桂酸酯1.67份,十聚甘油硬脂酸酯3.33份。称取4g氧化型辅酶q10、2g二十八烷醇、1g山嵛酸甘油酯、0.5g辛,癸酸甘油酯(odo)、0.001g维生素e在60℃下加热熔融,搅拌混匀,形成油相;称取1.67g十聚甘油月桂酸酯、3.33g十聚甘油硬脂酸酯加入70℃140ml水中,搅拌混匀,形成水相;将上述油相缓慢加入水相中,使用剪切机,以16000rpm剪切2分钟后,形成初乳;然后使用高压均质机,在50mp的压力下,通n2保护,经过6次循环,形成乳液,迅速冷却至室温,制得纳米结构脂质载体水溶液。经测定,平均粒径178.4nm,辅酶q10的载药率和包封率分别为30.8%和96.4%,二十八烷醇的载药量和包封率分别为15.0%和93.5%。实施例8氧化型辅酶q105份,二十八烷醇1份,山嵛酸甘油酯1.5份,辛,癸酸甘油酯(odo)0.6份,维生素e0.002份,吐温-801份,大豆磷脂2份。称取5g氧化型辅酶q10、1g二十八烷醇、1.5g山嵛酸甘油酯、0.6g辛,癸酸甘油酯(odo)、0.002g维生素e在80℃下加热熔融,搅拌混匀,形成油相;称取1g吐温-80、2g大豆磷脂加入80℃170ml水中,搅拌混匀,形成水相;将上述油相缓慢加入水相中,使用剪切机,以16000rpm剪切1分钟后,形成初乳;然后使用高压均质机,在60mp的压力下,通n2保护,经过8次循环,形成乳液,迅速冷却至室温,制得纳米结构脂质载体水溶液。经测定,平均粒径178.8nm,辅酶q10的载药率和包封率分别为43.3%和96.2%,二十八烷醇的载药量和包封率分别为8.4%和93.3%。实施例9还原型辅酶q101份,二十八烷醇2份,山嵛酸甘油酯0.5份,辛,癸酸甘油酯(odo)0.75份,维生素e0.003份,聚乙二醇-12-羟基硬脂酸酯4份。称取2g还原型辅酶q10、4g二十八烷醇、1g山嵛酸甘油酯、1.5g辛,癸酸甘油酯(odo)、0.006g维生素e在65℃下加热熔融,搅拌混匀,形成油相;称取8g聚乙二醇-12-羟基硬脂酸酯加入75℃160ml水中,搅拌混匀,形成水相;将上述油相缓慢加入水相中,使用剪切机,以16000rpm剪切2分钟后,形成初乳;然后使用高压均质机,在40mp的压力下,通n2保护,经过5次循环,形成乳液,迅速冷却至室温,制得纳米结构脂质载体水溶液。经测定,平均粒径168.1nm,辅酶q10的载药率和包封率分别为11.9%和97.8%,二十八烷醇的载药量和包封率分别为23.3%和96.2%。实施例10氧化型辅酶q103份,二十八烷醇1份,单硬脂酸甘油酯1份,辛,癸酸甘油酯(odo)1份,维生素e0.003份,吐温-801.33份,大豆磷脂0.67份。称取6g氧化型辅酶q10、2g二十八烷醇、2g单硬脂酸甘油酯、2g辛,癸酸甘油酯(odo)、0.006g维生素e在85℃下加热熔融,搅拌混匀,形成油相;称取2.66g吐温-80、1.34g大豆磷脂加入85℃150ml水中,搅拌混匀,形成水相;将上述油相缓慢加入水相中,使用剪切机,以16000rpm剪切1.5分钟后,形成初乳;然后使用高压均质机,在30mp的压力下,通n2保护,经过5次循环,形成乳液,迅速冷却至室温,制得纳米结构脂质载体水溶液。经测定,平均粒径238.2nm,辅酶q10的载药率和包封率分别为36.0%和96.1%,二十八烷醇的载药量和包封率分别为11.6%和93.2%。实施例11还原型辅酶q105份,二十八烷醇2份,山嵛酸甘油酯1.5份,辛,癸酸甘油酯(odo)0.75份,维生素e0.002份,十聚甘油月桂酸酯3.75份,十聚甘油硬脂酸酯1.25份,辛烯基琥珀酸单阿拉伯胶酯7份。称取5g还原型辅酶q10、2g二十八烷醇、1.5g山嵛酸甘油酯、0.75g辛,癸酸甘油酯(odo)、0.002g维生素e在65℃下加热熔融,搅拌混匀,形成油相;称取3.75g十聚甘油月桂酸酯、1.25g十聚甘油硬脂酸酯加入75℃300ml水中,搅拌混匀,形成水相;将上述油相缓慢加入水相中,使用剪切机,以16000rpm剪切1.5分钟后,形成初乳;然后使用高压均质机,在40mp的压力下,通n2保护,经过5次循环,形成乳液,迅速冷却至室温,加入7g辛烯基琥珀酸单阿拉伯胶酯,搅拌均匀,经喷雾干燥,制得纳米结构脂质载体固体粉末。经测定,平均粒径280.4nm,辅酶q10的载药率和包封率分别为22.3%和94.8%,二十八烷醇的载药量和包封率分别为8.8%和93.4%。实施例12氧化型辅酶q105份,二十八烷醇1份,单硬脂酸甘油酯0.5份,辛,癸酸甘油酯(odo)0.5份,维生素e0.001份,十聚甘油月桂酸酯1份,十聚甘油硬脂酸酯3份,辛烯基琥珀酸淀粉钠11份。称取5g氧化型辅酶q10、1g二十八烷醇、0.5g单硬脂酸甘油酯、0.5g辛,癸酸甘油酯(odo)、0.001g维生素e在75℃下加热熔融,搅拌混匀,形成油相;称取1g十聚甘油月桂酸酯、3g十聚甘油硬脂酸酯加入75℃260ml水中,搅拌混匀,形成水相;将上述油相缓慢加入水相中,使用剪切机,以16000rpm剪切1分钟后,形成初乳;然后使用高压均质机,在50mp的压力下,通n2保护,经过5次循环,形成乳液,迅速冷却至室温,加入11g辛烯基琥珀酸淀粉钠,搅拌均匀,经喷雾干燥,制得纳米结构脂质载体固体粉末。经测定,平均粒径380.4nm,辅酶q10的载药率和包封率分别为21.9%和96.5%,二十八烷醇的载药量和包封率分别为4.3%和94.6%。实施例13还原型辅酶q105份,二十八烷醇1.5份,山嵛酸甘油酯0.75份,辛,癸酸甘油酯(odo)1份,维生素e0.002份,大豆磷脂5份,辛烯基琥珀酸淀粉钠7份。称取5g还原型辅酶q10、1.5g二十八烷醇、0.75g山嵛酸甘油酯、1g辛,癸酸甘油酯(odo)、0.002g维生素e在80℃下加热熔融,搅拌混匀,形成油相;称取5g大豆磷脂加入80℃270ml水中,搅拌混匀,形成水相;将上述油相缓慢加入水相中,使用剪切机,以16000rpm剪切2分钟后,形成初乳;然后使用高压均质机,在70mp的压力下,通n2保护,经过10次循环,形成乳液,迅速冷却至室温,加入7g辛烯基琥珀酸淀粉钠,搅拌均匀,经冷冻干燥,制得纳米结构脂质载体固体粉末。经测定,平均粒径314.2nm,辅酶q10的载药率和包封率分别为24.3%和98.3%,二十八烷醇的载药量和包封率分别为7.0%和95.1%。实施例14氧化型辅酶q101份,二十八烷醇2份,单硬脂酸甘油酯0.6份,辛,癸酸甘油酯(odo)0.5份,维生素e0.002份,吐温-801份,大豆卵磷脂1份,辛烯基琥珀酸单阿拉伯胶酯13份。称取1g氧化型辅酶q10、2g二十八烷醇、0.6g单硬脂酸甘油酯、0.5g辛,癸酸甘油酯(odo)、0.002g维生素e在85℃下加热熔融,搅拌混匀,形成油相;称取1g吐温-80、1g大豆卵磷脂加入85℃200ml水中,搅拌混匀,形成水相;将上述油相缓慢加入水相中,使用剪切机,以16000rpm剪切1分钟后,形成初乳;然后使用高压均质机,在50mp的压力下,通n2保护,经过5次循环,形成乳液,迅速冷却至室温,加入13g辛烯基琥珀酸单阿拉伯胶酯,搅拌均匀,经喷雾干燥,制得纳米结构脂质载体固体粉末。经测定,平均粒径284.0nm,辅酶q10的载药率和包封率分别为4.9%和93.5%,二十八烷醇的载药量和包封率分别为9.6%和91.6%。实施例15氧化型辅酶q102份,二十八烷醇2份,单硬脂酸甘油酯1.5份,辛,癸酸甘油酯(odo)0.75份,维生素e0.003份,十聚甘油月桂酸酯2份,十聚甘油硬脂酸酯1份,辛烯基琥珀酸单阿拉伯胶酯15份。称取2g氧化型辅酶q10、2g二十八烷醇、1.5g单硬脂酸甘油酯、0.75g辛,癸酸甘油酯(odo)、0.003g维生素e在90℃下加热熔融,搅拌混匀,形成油相;称取2g十聚甘油月桂酸酯、1g十聚甘油硬脂酸酯加入90℃280ml水中,搅拌混匀,形成水相;将上述油相缓慢加入水相中,使用剪切机,以16000rpm剪切2分钟后,形成初乳;然后使用高压均质机,在60mp的压力下,通n2保护,经过8次循环,形成乳液,迅速冷却至室温,加入15g辛烯基琥珀酸单阿拉伯胶酯,搅拌均匀,经喷雾干燥,制得纳米结构脂质载体固体粉末。经测定,平均粒径294.5nm,辅酶q10的载药率和包封率分别为8.2%和98.9%,二十八烷醇的载药量和包封率分别为8.0%和97.1%。实施例16氧化型辅酶q104份,含二十八烷醇50%的c22~c36高级脂肪烷醇混合物1份,山嵛酸甘油酯0.5份,辛,癸酸甘油酯(odo)0.8份,维生素e0.001份,聚乙二醇-12-羟基硬脂酸酯(hs15)4份,辛烯基琥珀酸淀粉钠7份。称取4g氧化型辅酶q10、1g含二十八烷醇50%的c22~c36高级脂肪烷醇混合物、0.5g山嵛酸甘油酯、0.8g辛,癸酸甘油酯(odo)、0.001g维生素e在90℃下加热熔融,搅拌混匀,形成油相;称取4g聚乙二醇-12-羟基硬脂酸酯(hs15)加入90℃290ml水中,搅拌混匀,形成水相;将上述油相缓慢加入水相中,使用剪切机,以16000rpm剪切1.5分钟后,形成初乳;然后使用高压均质机,在50mp的压力下,通n2保护,经过5次循环,形成乳液,迅速冷却至室温,加入7g辛烯基琥珀酸淀粉钠,经冷冻干燥,搅拌均匀,制得纳米结构脂质载体固体粉末。经测定,平均粒径284.9nm,辅酶q10的载药率和包封率分别为23.1%和97.1%,二十八烷醇的载药量和包封率分别为2.8%和94.1%。实施例17氧化型辅酶q101份,二十八烷醇2份,单硬脂酸甘油酯1.5份,辛,癸酸甘油酯(odo)0.75份,维生素e0.002份,十聚甘油月桂酸酯2份,十聚甘油硬脂酸酯1份,辛烯基琥珀酸单阿拉伯胶酯15份。称取1g氧化型辅酶q10、2g二十八烷醇、1.5g单硬脂酸甘油酯、0.75g辛,癸酸甘油酯(odo)、0.002g维生素e在90℃下加热熔融,搅拌混匀,形成油相;称取2g十聚甘油月桂酸酯、1g十聚甘油硬脂酸酯加入85℃260ml水中,搅拌混匀,形成水相;将上述油相缓慢加入水相中,使用剪切机,以16000rpm剪切2分钟后,形成初乳;然后使用高压均质机,在60mp的压力下,通n2保护,经过7次循环,形成乳液,迅速冷却至室温,加入15g辛烯基琥珀酸单阿拉伯胶酯,搅拌均匀,经喷雾干燥,制得纳米结构脂质载体固体粉末。经测定,平均粒径306.5nm,辅酶q10的载药率和包封率分别为4.2%和96.9%,二十八烷醇的载药量和包封率分别为8.3%和96.1%实施例18以下通过实验对本发明做进行进一步说明:1.粒径及zeta电位测定:取实施例1-10的辅酶q10与二十八烷醇纳米结构脂质载体水溶液适量进行稀释,测试温度均为25℃,测试次数为3次,采用动态激光光散射粒径测定仪测定粒径及zeta电位。取实施例11-17的辅酶q10与二十八烷醇纳米结构脂质载体固体粉末适量进行溶解后测定粒径。图1为实施例1纳米载体动态激光光散射粒径图谱,图2为实施例1纳米载体zeta电位,图3为实施例14纳米载体粉末动态激光光散射粒径图谱。2.dsc测定:根据实施例14的制备方法做空白纳米结构脂质载体(原料中不含辅酶q10和二十八烷醇),分别称取空白纳米结构脂质载体、实施例14的辅酶q10与二十八烷醇纳米结构脂质载体固体粉末、辅酶q10与二十八烷醇各3-5mg于密封铝坩埚中,温度范围25-200℃,升温速率为20℃/min,压片、进行热分析(dsc)测定,结果见图4。结果表明,负载辅酶q10与二十八烷醇双载药纳米结构脂质载体粉末的熔点低于辅酶q10与二十八烷醇的熔点,辅酶q10与二十八烷醇熔点峰基本消失,证明其形成了均匀的混融脂质分散体,辅酶q10与二十八烷醇在纳米结构脂质载体中处于无定型状态,该状态有助于其吸收。3.形态学考察:取实施例1的辅酶q10与二十八烷醇纳米结构脂质载体适量,均匀铺展在铜网上,滴加2%的磷钨酸水溶液负染15min,自然干燥后,取出铜网,在透射电镜下观察样品的表面形态与结构,纳米结构脂质载体为圆形或类圆形实体小球,大小比较均匀,分散较好,基本无黏连。4.离心稳定性:取实施例1的辅酶q10与二十八烷醇纳米结构脂质载体水溶液50ml,在4℃下采用10000rpm离心10min,观察是否形成沉淀并测上清液粒径。离心后未形成沉淀,经测定,粒径为116.2nm,pdi0.177,说明辅酶q10与二十八烷醇纳米结构脂质载体水溶液的离心稳定性较好。实施例19释放度测定:采用透析袋法测定本发明实施例1、6、14制备的辅酶q10与二十八烷醇纳米结构脂质载体、辅酶q10与二十八烷醇物理混合物的体外释放度实验。选用醋酸纤维素半透膜(截留分子量10000)为渗透膜,于使用前在超纯水中煮沸半小时。药物释放介质为5%labrasol-20%乙醇-pbs溶液。取一定量的辅酶q10与二十八烷醇纳米结构脂质载体粉末、辅酶q10与二十八烷醇物理混合物加入透析袋中,用绳子扎紧两端,将透析袋置于装有250ml含5%labarsol-20%乙醇-pbs释放介质的锥形瓶中,(37±0.5)℃摇床振摇,速度为200r/min,于1h,2h,3h,5h,7h,9h,12h,24h取样10ml,再迅速补充10ml相同温度的空白释放介质,样品用hplc法和gc法分别测定q10和二十八烷醇的释放量,得到累积释放曲线如图5与图6。实施例20清除dpph自由基法测抗氧化性试验:分别取实施例1~17制备的辅酶q10和二十八烷醇纳米结构脂质载体,以及空白样品(不含coq10和二十八烷醇的nlc)150μl加入2.85ml超纯水中,即稀释20倍。用无水乙醇溶解配制dpph溶液(5×10-5mol/l)待用。取试管编号,按表1进行加样,混合均匀,水浴37℃下反应60min后,在517nm波长处测定待测样品反应液吸光度值,以及空白样品的吸光度值。(调零参比为1ml空白样品与2ml超纯水混合)表1清除dpph自由基实验各成分所需量组别待测样品/ml空白样品/mldpph/ml超纯水/mla待测样.dpph2.004.00a待测样.水2.0004.0a空白样.dpph02.04.00利用下述公式计算抑制率:抑制率e(%)=(1-(a待测样.dpph-a待测样.水)/a空白样.dpph)×100%对负载辅酶q10与二十八烷醇的纳米结构脂质载体(按照实施例1~16制备)和辅酶q10与二十八烷醇原料药混合物、辅酶q10nlc、二十八烷醇nlc进行比较清除dpph自由基能力,结果如表2:表2清除dpph自由基法实验结果实施例21分别取实施例11~16的载体固体粉末125g,加入100g微晶纤维素,105g聚维酮k30,106g麦芽糊精,50g交联聚维酮,9g柠檬酸,5g硬脂酸镁,以压力30-50n压制片剂1000片,规格0.5g/片。测试其粉末休止角,崩解时限、复溶性,结果见表3。表3实施例11、14、16制备的nlc片剂的评价指标当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1