重组表达载体、宿主及其构建方法以及动物模型的构建方法与流程
本发明涉及生物技术领域,特别涉及重组表达载体、宿主及其构建方法以及动物模型的构建方法。
背景技术:
肾脏移植是终末期肾脏疾病最好的治疗方法。随着免疫抑制药物广泛使用,T细胞介导排斥反应显著降低,但是急、慢性抗体介导排斥反应在肾脏移植物丢失中起着越来越重要作用。预存抗供者HLA(人类白细胞抗原)抗体与移植肾失功及抗体介导排斥反应密切相关,针对HLA高致敏患者的肾脏移植成功率较低,因此有效脱敏疗法是成功进行肾移植的关键。动物实验是移植免疫研究的主要手段之一,因此成功合成“足量”可溶性人源化HLA-A2蛋白并构建“滴度可控型”抗HLA-A2抗体动物模型是我们探索有效脱敏疗法的关键。
HLA-A2是在人类中发现的最频繁的特异性HLA-A分子之一,其拥有最多的异构等位基因,已检测到31个亚族。HLA-A2在不同的人群中的分布频率不同。鉴于我国汉族人表达人白细胞抗原位点HLA-A*02:01的几率最高[16-18],故为更进一步了解HLA分子及其特异性抗体在人体器官移植排斥反应中的具体作用,我们通过原核表达体系合成可溶性人源化HLA-A2蛋白并构建预存HLA-A2抗体动物模型,为临床上探索有效清除预存抗供者HLA特异性抗体和治疗抗体介导的体液性排斥方法提供物质基础。
主动免疫常被用于构建预存抗特异性抗体肾移植动物模型,常见的方法有:1,将含目的基因的转基因小鼠脾脏细胞输入同种非转基因受鼠的腹腔,使受鼠对目的蛋白致敏;2,将含目的基因的供鼠的皮肤移植至受鼠,使其产生针对供鼠的特异性抗体;3,将目的蛋白直接接种于受鼠皮下,使其产生针对供鼠的特异性抗体。
现有技术通过真核表达体系体外合成可溶性MICA蛋白(主要组织相容性I类相关链A位点),将纯化后MICA蛋白与等体积弗氏完全佐剂混匀或将能表 达MICA蛋白的昆虫Sf-9细胞悬液,经尾静脉注射后,使受鼠产生针对MICA蛋白的特异性抗体。
现有技术的缺点:1、真核表达体系蛋白表达量低、费用高、耗时长且纯化难,不足以构建大量预存特异性抗体动物模型以探索抗体清除方案;2、将MICA蛋白与等体积弗氏完全佐剂混匀后,经尾静脉注射后,受鼠体内特异性抗MICA抗体可疑阳性,并未能成功建立预存抗MICA抗体动物模型;3、将能表达MICA蛋白的昆虫Sf-9细胞悬液,经尾静脉注射后,虽然受鼠体内特异性MICA抗体阳性,但是该方法中Sf-9细胞除表达MICA蛋白外,还可以产生大量自身蛋白,因此在致敏受鼠过程中,不可避免产生交叉反应,从而影响实验的精确性;4、目前构建预存抗特异性抗体肾移植动物模型的方法,尚不能控制所预存特异性抗体的滴度;也未观察致敏过程中与抗体产生有关的淋巴细胞变化。
技术实现要素:
有鉴于此,本发明提供一种重组表达载体、宿主及其构建方法以及动物模型的构建方法。特有的原核表达体系合成“足量”可溶性人源化HLA-A2蛋白;采用纯化后的HLA-A2蛋白作为免疫原,从而确保实验的“精确性”;不同浓度的HLA-A2蛋白可引起受鼠产生不同滴度的预存抗HLA-A2抗体,使预存抗体的产生强度变为“可控型”。
为了实现上述发明目的,本发明提供以下技术方案:
本发明提供了一种重组表达载体,由编码可溶性人源化HLA-A2蛋白的核苷酸和原核表达载体构成。
在本发明的一些具体实施方案中,重组表达载体中所述编码可溶性人源化HLA-A2蛋白的核苷酸具有:
(Ⅰ)如SEQ ID No.1所示的核苷酸序列;或
(Ⅱ)、如SEQ ID No.1所示的核苷酸序列的互补序列;或
(Ⅲ)、与(Ⅰ)或(Ⅱ)的核苷酸序列编码相同蛋白质,但因遗传密码的简并性而与(Ⅰ)或(Ⅱ)的核苷酸序列不同的序列;或
(Ⅳ)、与(Ⅰ)或(Ⅱ)或(Ⅲ)所述序列至少有70%同源性的序列。
在本发明的一些具体实施方案中,重组表达载体中所述原核表达载体为pCzn 1。
本发明还提供了所述重组表达载体的构建方法,将所述编码可溶性人源化HLA-A2蛋白的核苷酸连接到所述原核表达载体中,构建重组表达载体。
在本发明的一些具体实施方案中,所述重组表达载体的构建方法具体为将所述编码可溶性人源化HLA-A2蛋白的核苷酸和所述原核表达载体分别经Nde I和Xho I双酶切后连接,构建重组表达载体pCzn-HLA-A2。
本发明还提供了一种宿主,包括所述的重组表达载体。
在本发明的一些具体实施方案中,宿主为原核生物,优选大肠杆菌。
本发明还提供了所述宿主的构建方法,取所述的重组表达载体转化原核生物。
本发明还提供了所述的重组表达载体或所述的宿主用于表达可溶性人源化HLA-A2蛋白的应用。
本发明还提供了一种预存抗体动物模型的构建方法,取所述的重组表达载体或所述的宿主表达的可溶性人源化HLA-A2蛋白免疫小鼠,构建预存抗体动物模型。
在本发明的一些具体实施方案中,预存抗体动物模型的构建方法中,免疫的剂量为100μg/鼠。
本发明提供的重组表达载体由编码可溶性人源化HLA-A2蛋白的核苷酸和原核表达载体构成。本发明运用纯化的人源化可溶性HLA-A2蛋白于腹部皮下免疫小鼠,成功建立预存抗HLA-A2抗体的动物模型,以为进一步探索清除特异性预存抗体提供科学基础。
本发明具有如下优点:
1、运用特有的原核表达体系,合成“足量”人源化可溶性HLA-A2蛋白,构建大量预存HLA-A2抗体BALb/c小鼠模型,为进一步的研究提供物质基础;
2、采用纯化后HLA-A2蛋白作为免疫原,从而确保实验的“精确性”;
3、不同浓度的HLA-A2蛋白可引起受鼠产生不同滴度的预存抗HLA-A2抗体,使预存抗体的产生变为“滴度可控型”,从而为研究不同滴度预存抗HLA-A2抗体对肾移植影响提供物质基础;
4、通过观察预存抗体动物模型的骨髓和脾脏中淋巴细胞的变化,了解免疫原对机体免疫系统的影响,从而为有效清除预存抗HLA-A2抗体的特异性药物选择和时间点选择奠定理论基础。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。
图1示HLA-A2胞外段基因PCR扩增后电泳图;
图2示克隆质粒的构建路线;
图3示克隆质粒的PCR鉴定结果;
图4示pMD 19-HLA-A2克隆质粒基因序列测定结果;
图5示以克隆质粒为模板PCR扩增目的基因后电泳图;
图6示重组表达质粒pCzn-HLA-A2的构建路线;
图7示重组表达载体的酶切鉴定(lane 1:DNA Marker,lane 2:对照组,lane 3:酶切后产物);
图8示重组表达载体测序后部分比对结果;
图9示HLA-A2在大肠杆菌中表达的SDS-PAGE鉴定(M:蛋白marker,Lane 1:未诱导,Lane 2:诱导后总蛋白,Lane 3:诱导后上清中蛋白,Lane 4:诱导后沉淀中蛋白);
图10示纯化后蛋白的SDS-PAGE鉴定(M:蛋白marker,Lane 1:纯化前蛋白,Lane 2:纯化中流出液,Lane 3:纯化后洗脱液);
图11示不同剂量HLA-A2蛋白免疫后BALb/c小鼠外周血中HLA-A2抗体变化;
图12示100μg HLA-A2蛋白免疫后BALb/c小鼠外周血中HLA-A2抗体变化;
图13示免疫后小鼠脾脏中淋巴细胞总数、CD19+B细胞和CD138+浆细胞变化(左侧),及各群淋巴细胞达到峰值时的流式图(右侧);
图14示免疫后小鼠脾脏中各种B细胞亚群的变化(上方)及流式图(下方);
图15示免疫后小鼠骨髓中淋巴细胞总数、CD19+B细胞和CD138+浆细胞变化(左侧),及各群淋巴细胞达到峰值时的流式图(右侧);
图16示免疫后小鼠骨髓中各种B细胞亚群的变化(上方)及流式图(下方);
图17示重组质粒PMD19-HLA-A2胞外区成熟肽基因序列作为模板设计的特异性引物,其中图17(A)示上游引物HLA-A2-F,图17(B)示下游引物HLA-A2-R;黄色标记的为重组臂,红色为酶切位点,划线部分为所设计的引物序列;
图18示重组表达载体pCzn-HLA-A2序列的测定结果;其中,单划线区域为HLA-A2胞外段基因区域,红色标识为酶切位点;
图19示纯化重组蛋白浓度测定。
具体实施方式
本发明公开了一种重组表达载体、宿主及其构建方法以及动物模型的构建方法,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
本发明提供的一种重组表达载体、宿主及其构建方法以及动物模型的构建方法中所用原料、试剂、原始载体、菌株均可由市场购得。其中,PMD19-T载体,购于Takara公司;DH5α感受态细胞和TOP10感受态细胞购于欣宏科生物化学有限公司;pCzn1表达载体和Arctic Express菌株购于南京钟鼎有限公司)。
“预存抗HLA-A2抗体动物模型”指在进行肾脏移植前,受者体内存在针对供者的特异性HLA-A2抗体,该模型可用于探索有效清除预存抗体的方案和研究预存抗体对移植肾脏的影响。
下面结合实施例,进一步阐述本发明:
实施例1人源化可溶性HLA-A2蛋白制备
(一)人THP-1细胞培养
将人THP-1细胞置于含10%胎牛血清的1640培养基中,放在37℃、5%CO2培养箱中孵育,每三日更换培养液一次,将细胞培养至对数期。
(二)引物的设计与合成
根据GenBank上公布的HLA-A2序列,运用Olig6.0软件分别设计一对引物,用于扩增HLA-A2胞外段(AF1,AR1)成熟肽基因序列,引物由上海生工生物工程技术有限公司合成。
AF1:5’CGA ACC CTC GTC CTG CTA 3’
AR1:5’GCT CTT CCT CCT CCA CAT CA 3’
(三)THP-1细胞总RNA的提取
1.人THP-1细胞分离收集后,放入1.5ml的EP管中,用1×PBS洗涤一次,加入1ml Trizol充分溶解,用加样器吹打均匀,使核蛋白完全从核酸上解离;
2.加200μl氯仿,猛烈颠倒20次,充分混匀,冰上放置5min.;
3.4℃,12000rpm离心15min。分三层,上层为无色的水样层,RNA存在于水样层中。
4.转移上清至1.5ml EP管中,加入等体积异丙醇500μl混匀,沉淀15min后,4℃,12000rpm离心15min。离心后可见一片胶栋沉淀附着于管底,即RNA;
5.弃上清,加入800μl 75%乙醇混匀,4℃,12000rpm离心5min;
6.弃上清,加入无水乙醇800μl混匀,4℃,12000rpm离心5min;
7.弃上清,加DEPC水溶解,定量并将RNA浓度调整为0.5μg/μl。
(四)构建PMD 19-HLA-A2重组质粒
1.逆转录合成人cDNA模板反应体系:
(1)管1:
70℃,5min,4℃,forever
(2)管2:
(3)将管2加入管1,共40μl体系,37℃,60min,95℃,5min,4℃,forever
2.扩增HLA-A2胞外段基因片段
95℃变性5min,95℃变性30S,56℃退火30S,72℃延伸1min,共30个循环,72℃,7min,4℃forever
3.琼脂糖凝胶鉴定PCR产物
(1)蒸馏水冲洗电泳槽和梳子,架好梳子;
(2)配置1.5%琼脂糖凝胶;
(3)用1×TAE 50ml于三角烧杯中,称取0.75mg琼脂糖粉放入其中,并置于微波炉中加热融化,待冷却到60℃左右时加入溴化乙锭溶液2μl,倒入模板中,待凝固;
(4)向电泳槽中加入1×TAE,其量以没超过胶面2mm为宜,小心移去梳子;
(5)在DNA样品中以1:5加入Loading Buffer,混匀后,加入样品孔内;
(6)接通电源,红色为正极,黑色为负极,100V电压,45min;
(7)在紫外仪上观察电泳带及其位置,并与核酸分子量标准比较扩增产物的大小。
4.割胶回收纯化目的基因
(1)在紫外灯下切下含有目的DNA的琼脂糖凝胶,吸尽凝胶表面液体并切碎。计算凝胶重量,等同于凝胶体积(如100mg=100ml)。
(2)加入3倍凝胶体积的Buffer DE-A,混匀后75℃加热,间断混合,5-8min,直至凝胶块完全熔化。(Buffer DE-A为红色溶液,在熔化凝胶的过程中,有助于观察凝胶是否完全熔化)。
(3)加1/2Buffer DE-A体积的Buffer DE-B,混合均匀,当分离的DNA片段小于400bp时,加入1倍凝胶体积的异丙醇。(加Buffer DE-B后混合物颜色变为黄色,充分混匀以保证形成均一的黄色溶液)。
(4)吸取步骤3中的混合液,转移到DNA制备管中,12000rpm离心1min,弃滤液。
(5)将制备管置回2ml离心管,加500μl Buffer W1,12000rpm离心30s,弃滤液。
(6)将制备管置回2ml离心管,加700μl Buffer W2,12000rpm离心30s,弃滤液。以同样方法再用700μl Buffer W2洗涤一次,12000rpm离心1min。
(7)将制备管置回1.5ml离心管,12000rpm离心1min。
(8)将制备管置于洁净的1.5ml离心管中,在制备膜中央加已预热至65℃的25-30μl Eluent溶液或去离子水,室温静置1min,12000rpm离心1min洗脱DNA。
(9)产物于-20℃保存备用
5.目的基因连入PMD 19-T载体:
载体0.5μl,纯化的PCR产物4.5μl,连接酶Buffer 5.0μl,在16℃低温连接槽中,连接过夜。
6.连接产物的转化
(1)将50μl DH5α感受态细胞和10μl连接产物混匀后加入1.5ml EP管,置冰上30min;
(2)42℃热激90s,冰浴2min
(3)将上述产物加入37℃预热的500μl LB液体培养基中,充分混匀,37℃摇床45min;
(4)将步骤3中获取产物3000rpm离心,5min;
(5)吸弃上层400μl LB液体培养基,留约150μl,重悬并铺于含氨苄青霉素的LB固体培养基上;
(6)37℃固体培养基正向放置1小时,以吸收过度液体,然后倒置培养过夜。
7.挑斑
随机挑取生长于LB平板上的白色菌落,分别接种于含氨苄青霉素的3ml LB液体培养基中,37℃摇床(250-300rpm)培养过夜。
8.质粒抽提
(1)取1.5ml菌液,12000rpm离心1min,弃上清
(2)将步骤1中沉淀物加入Buffer S1250μl,涡旋振荡混匀,悬浮需均匀,不应留有小菌块;
(3)将步骤2中沉淀物加入Buffer S2250μl,温和地充分颠倒混匀4-6次,混合均匀使菌体充分裂解,直至形成透亮液体,此步骤不超过5min;
(4)将步骤3中沉淀物加入Buffer S3350μl,温和地充分颠倒混匀4-6次,避免剧烈晃动导致DNA污染;12000rpm离心10min;
(5)将步骤4中上清移至制备管中,并将其置于2ml离心管上,12000rpm离心1min,弃滤液;
(6)将制备管置回离心管中,加500μl Buffer W1,12000rpm离心1min,弃滤液;
(7)将制备管置回离心管中,加700μl Buffer W2,12000rpm离心1min,弃滤液;
(8)同样方法,重复步骤7一次;
(9)将制备管置回2ml离心管中,12000rpm离心1min,弃滤液;
(10)将制备管移入新的1.5ml离心管中,在制备膜中央加入65℃预热的Eluent溶液50μl.,室温静置1min,12000rpm离心1min。
(11)产物于-20℃保存备用。
9.目的基因的克隆鉴定
用上述所提含HLA-A2α链克隆质粒作PCR鉴定,PCR反应体系如下:
95℃变性5min,95℃变性30S,56℃退火30S,72℃延伸1min,共30个循环,72℃,7min,4℃forever
10.HLA-A2的基因序列分析
将所提取质粒送往金思特公司行DNA测序。
结果:
(一)构建HLA-A2克隆载体
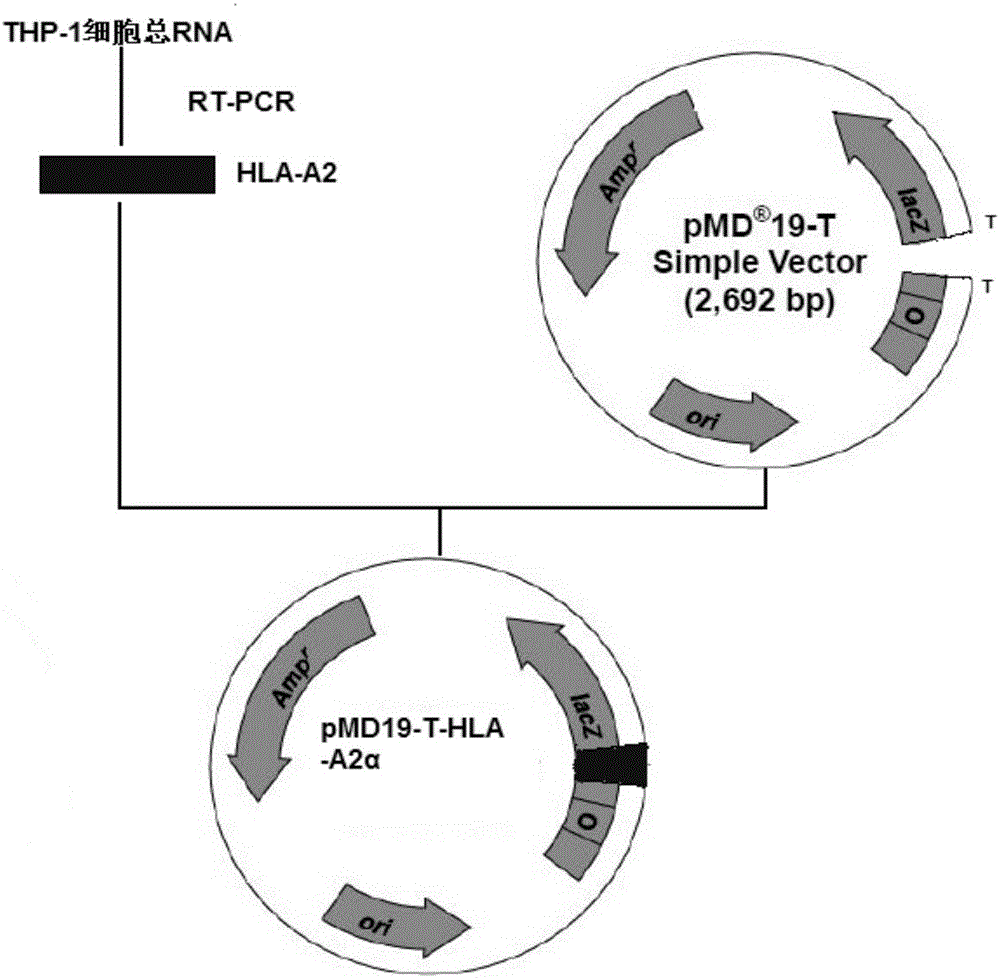
1.HLA-A2胞外段的逆转录聚合酶链式反应(Reverse Transcription-Polymerase Chain Reaction,RT-PCR)扩增 从THP-1细胞中提取总RNA,然后利用RT-PCR技术扩增反转录产物,取5μlPCR产物,用1%琼脂糖凝胶电泳,初步检测证明,HLA-A2胞外段基因在830bp左右出现一条特异性条带(图1)。
2.克隆质粒的构建
将HLA-A2胞外段基因的RT-PCR产物经纯化回收后,插入到pMD 19-Tvector的外源基因插入位点,构建克隆质粒,构建路线见下图(图2)。
3.克隆质粒的鉴定
把克隆质粒pMD 19-HLA-A2转化DH5α感受菌后挑选白色菌落,摇菌,抽提重组质粒进行PCR扩增,电泳出现长约830bp的特异条带(图3)。
4.HLA-A2基因序列测定
选择含有pMD 19-HLA-A2的阳性重组菌进行基因序列测定,基因测定结果见图4。
实施例2构建HLA-A2表达载体并表达目的蛋白
(一)引物的设计与合成
1.以重组质粒PMD19-HLA-A2胞外区成熟肽基因序列作为模板设计特异性引物来扩增目的基因序列,引物由南京钟鼎有限公司合成。黄色标记的为重组臂,红色为酶切位点,划线部分为所设计的引物序列(上游引物序列如SEQ ID No.3所示,下游引物序列如SEQ ID No.4所示),见图17。其中图17(A)示上游引物HLA-A2-F,图17(B)示下游引物HLA-A2-R。
(二)构建pCzn1-HLA-A2重组质粒
1.HLA-A2胞外段基因的PCR扩增与回收
以PMD19-HLA-A2重组克隆质粒为模板扩增HLA-A2胞外段基因,反应体系如下:
95℃变性5min,95℃变性30S,56℃退火30S,72℃延伸1min,共30个循环,72℃,7min,4℃forever
电泳切下所需目的条带,参照先前实验方法,纯化回收HLA-A2特异性DNA条带。
2.目的片段的酶切回收
取纯化回收的HLA-A2胞外段基因于200μl反应管中,分别用Nde I和Xho I进行双酶切,酶切体系为:
37℃酶切3h,酶切产物行电泳,参照先前实验,纯化回收HLA-A2目的基因
3.重组表达载体的构建
(1)表达载体的纯化与扩增
将含有表达载体Pczn1的菌液在含有氨苄青霉素的LB固体培养基上涂板,37℃培养12-16小时,挑选单个菌落接种到含氨苄青霉素的LB液体培养基摇床培养15小时。
(2)表达载体的质粒提取
参照先前实验方法提取质粒
(3)表达载体的酶切回收
取纯化回收环状质粒DNA于200μl反应管中,分别用Nde I和Xho I进行双酶切,酶切体系为:
加样完成后,37℃酶切三小时,目的条带行电泳,参照先前实验方法,行割胶回收纯化特异的DNA条带。
4.利用重组试剂盒(SimpLigTM快速克隆试剂盒)将目的片段与表达质粒pCzn1连接
反应体系如下:
5.重组表达质粒的转化和筛选
取10μl pCzn1-HLA-A2连接产物加入100μl TOP10感受态细胞中,轻轻混匀后冰浴30min,42℃水浴热激90秒,再立即冰浴10min,加入950μl LB液体培养基,37℃振荡(180rpm)1小时;8000rpm离心5min;无菌弃 上清,再用150μl LB液体培养基重新悬浮,将重悬液均匀涂抹在含氨苄青霉素的LB固体培养板上,放置37℃培养箱中培养1小时,待平板表面菌液干后,再倒置于培养箱培养12-16小时。
随机挑斑,并接种于含氨苄青霉素的LB液体培养基中,37℃摇床上震荡过夜。
6.重组表达质粒的鉴定
(1)重组表达质粒的提取
取pCzn1-HLA-A2重组表达质粒的菌液3ml提取质粒,质粒提取步骤参照先前实验方法。
(2)重组表达质粒的酶切鉴定
提取质粒用Nde I和XhoI进行双酶切,体系如下:
加样完成后,37℃酶切3h,取10μl酶切产物,电泳观察酶切结果。
(3)重组表达质粒的测序
将上述初步鉴定为阳性的重组质粒命名为pCzn1-HLA-A2,并取少量重组质粒送往金斯特公司进行序列测定。
(三)表达、纯化及鉴定目的蛋白
1.重组表达质粒的转化
取鉴定为阳性的重组质粒pCzn1-HLA-A2转化到Arctic Express细胞中,步骤如下:
(1)将质粒1μl(约5ug)加入100μl感受态细菌中,置冰上20min;
(2)42℃热激90sec,迅速置冰中5min;加入600μl 37℃预热的LB培养液;
(3)37℃,220rpm振摇1h,离心后全部涂布于含50μg/ml Amp的LB平板,37℃倒置培养过夜。
2.IPTG诱导pCzn1-HLA-A2融合蛋白的表达及SDS-PAGE电泳分析
(1)挑取转化平板上的单克隆接种于含50μg/ml Amp的3ml LB培养液的试管中,37℃220rpm振摇过夜;
(2)次日按1:100接种于50μg/ml Amp的30ml LB培养液中,37℃220rpm振摇至菌体OD600为0.6-0.8(约2h);
(3)取出1ml培养物,10000g室温离心2min,弃上清,用100μl 1×上样缓冲液重悬菌体沉淀;
(4)向剩余的培养物中加入IPTG至终浓度为0.5mM,11℃220rpm振摇16h,诱导HLA-A2-His融合蛋白表达;
(5)取出1ml培养物,12000g室温离心2min,弃上清,用100μl 1×上样缓冲液重悬菌体沉淀;
(6)进行10%SDS-PAGE分析。
3.可溶性HLA-A2融合蛋白的制备
(1)将诱导表达后的培养菌液低温离心6000rpm,10min,菌体沉淀重悬于20ml lysis buffer(20mM Tris-HCl containing 1mM PMSF and bacteria protease inhibitor cocktail,pH 8.0),超声破碎(功率400W,工作4sec,间歇8sec,共20min);
(2)将超声破碎的细胞裂解液4℃10000rpm离心20min,收集沉淀;
(3)使用包涵体洗涤液(20mM Tris,1mM EDTA,2M尿素,1M NaCl,1%Triton X-100,pH8.0)洗涤包涵体3次;
(4)用溶解缓冲液(20mM Tris,5mM DTT,8M尿素pH8.0),按一定比例溶解包涵体,4℃放置过夜;室温,15000rpm离心15min;
(5)将包涵体溶解液滴加到20mM Tris,pH 8.0缓冲液逐步成倍梯度稀释,缓慢搅拌;至尿素浓度达到0.5M时,将蛋白溶液装入透析袋于4℃在20mM PBS,pH7.4中透析过夜。
4.重组HLA-A2融合蛋白的纯化
(1)按Invitrogen公司纯化试剂盒配制纯化缓冲液:
①Native缓冲液:NaH2PO47g和NaCl 29.2g用NaOH调整PH值为8.0定容至1L;
②Wash缓冲液:100ml Native缓冲液加670ul 3M咪唑调整PH值为8.0;
③配制15ml洗脱缓冲液:13.75ml Native缓冲液加1.25ml 3M咪唑调整PH值为8.0;
(2)装柱:检查塑料柱及垫片是否完整,混匀镍质并取2ml放入柱中静置5-10min,轻轻吸弃上层上清液;
(3)洗柱:向柱中加入6ml灭菌双蒸水混匀镍质静置5-10min,轻轻吸弃上层上清液;同法再加入6ml Native缓冲液洗柱两次;
(4)上样:向柱中加入蛋白透析液混匀,在4℃冰箱中放置摇床轻摇结合60min后静置5-10min,轻轻吸取上层上清液即流穿液;重复上样2-4次;也可以将镍质放入50ml离心管中,在50ml离心管中上样,洗柱,洗脱,最后将镍质移入产品柱中过垫片收集纯化蛋白。
(5)洗柱:加入8ml清洗缓冲液混匀,静置5-10min,轻轻吸取清洗液;重复洗柱3次;
(6)洗脱:加入8ml洗脱缓冲液混匀,垂直静置5-10min,剪去塑料柱末端,收集洗脱液,洗脱液内含纯化的重组HLA-A2蛋白,并留取100μl洗脱液做电泳;
(7)将收集洗脱液放入4℃冰箱保存备用。
5.重组HLA-A2融合蛋白鉴定
(1)离心取上清进行SDS-PAGE电泳;
(2)制备10ml 12%分离胶;
(3)分离胶加入2/3后,预留1~2cm空间左右,立刻加入ddH2O封闭凝胶,静置30min至分离胶凝固;
(4)将封胶ddH2O倒掉,配置5%浓缩胶;
(5)浓缩胶加满溢出,插入梳子,等胶凝固;
(6)胶凝固后,置入电泳槽,加入电泳液,拔出梳子;
(7)取出标本及蛋白Marker,开始加样;
(8)加入等体积(10μl)标本后电泳,初始电压80V,当标本跑至分离胶时调整电压至120V,电泳约1h;
(9)考马斯亮蓝染色液染色:将胶放入考马斯亮蓝染色液中染色,摇床室温轻摇染色2h,可见胶被染成如染色液一样蓝时停止染色。将染色液适当加热可以加快染色速度;
(10)脱色:吸弃染色液,用脱色液冲洗凝胶,缓慢摇动1h,吸弃脱色液,再加入新脱色液进行脱色,反复数次直至获得清晰的蓝色的条带和干净的背景;将脱色液适当加热可以加快脱色速度;
(11)对凝胶进行拍照分析.
6.重组HLA-A2蛋白浓度测定
(1)按蛋白浓度测定试剂盒说明,取一支1ml 2mg蛋白标准液,按说明将标准品稀释成A、B、C、D、E、F、G、H、I管(表1);
(2)根据样品数量,按50体积BCA试剂A加1体积BCA试剂B(50:1)配制适量BCA工作液,充分混匀;
(3)将A、B、C、D、E、F、G、H、I管蛋白标准液和蛋白纯化洗脱液各取25μl加入96孔板标记孔,各取3个复孔;
(4)在各孔中加入200μl工作液,混匀;
(5)将96孔板放入37℃培养箱恒温孵育30min;
(6)拿出96孔板平衡至室温;
(7)酶标仪测定562nm波长下的吸光度OD值。绘制标准曲线,根据标准曲线计算出样品的蛋白浓度。
表1用于标准方案的稀释方法(检测范围=20-2000μg/ml)
结果:
1.HLA-A2成熟蛋白基因的扩增
以PMD19-HLA-A2重组克隆质粒为模板扩增HLA-A2胞外段基因(图5)
2.重组表达载体的构建
将HLA-A2胞外段基因和原核表达载体pCzn 1经Nde I和Xho I双酶切回收后连接,构建重组表达质粒pCzn-HLA-A2。重组表达质粒的构建路线见图6。
3.重组表达载体的酶切鉴定和测序
(1)重组表达载体pCzn-HLA-A2的酶切鉴定(图7):
(2)重组表达载体pCzn-HLA-A2序列测定(图18):
测序结果中单划线区域为HLA-A2胞外段基因区域(核苷酸序列如SEQ ID No.1所示),红色标识为酶切位点;
(3)测序结果与设计的预期序列进行比对,100%匹配,截取部分比对序列如图8所示:
4.翻译后蛋白序列如SEQ ID No.2所示,加上N端的His标签,蛋白理论分子量为33.19KD,HLA-A2蛋白理论分子量为31.75KD。
5.表达蛋白的SDS-PAGE检测结果见图9。
6.融合蛋白的纯化,见图10。
蛋白表达量对比试验:
实验组:本发明提供的原核表达体系。
浓度测定结果见图19。
测得蛋白纯化洗脱液OD值为0.68,根据标准曲线算出纯化后HLA-A2蛋白浓度为0.49mg/ml。
对照组:昆虫杆状病毒载体系统(真核表达体系)表达HLA-A2融合蛋白,纯化的融合蛋白浓度为0.014mg/ml。
相较于真核表达体系,原核表达体系表达的蛋白具有产量高(P<0.05)、成本低、周期短等特点。
实施例3构建预存抗HLA-A2抗体的BALb/c小鼠模型
1、通过原核表达体系获得蛋白浓度为0.49mg/ml的可溶性抗HLA-A2蛋白,分别将25μg、50μg、100μg、200μg HLA-A2蛋白与等体积弗氏完全佐剂混匀后行小鼠腹壁皮下注射。分别于1周、2周、4周、6周、8周采集眼球内眦静脉,约200-300μl,置入促凝管,离心收集血清,运用ELISA(酶联免疫吸附剂测定)法检测抗HLA-A2抗体。四种不同HLA-A2蛋白剂量皆能使BALb/c小鼠外周血产生抗HLA-A2抗体,1周时抗体开始增高,4周时抗体浓度达到顶峰,随后抗体逐渐下降,尤以25μg和50μg组下降最明显,而100μg和200μg组抗体浓度较为稳定。因此不同HLA-A2蛋白量可使受鼠产生不同滴度抗体特异性抗体。具体结果见图11。
2、虽然200μg组抗HLA-A2抗体浓度稍高于100μg组,但差异并不明显,提示100μg免疫原时抗体产生达到饱和,故采用100μg/鼠作为本研究的免疫原剂量。将100μg重组HLA-A2蛋白与相对应的等体积弗氏完全佐剂混匀后进行腹壁皮下注射,分别于0W、1W、2W、4W、6W、8W、10W、12W采集眼球内眦静脉血及小鼠脾脏和骨髓,运用ELISA法检测抗HLA-A2抗体及流式细胞仪检测小鼠骨髓和脾脏中淋巴细胞变化。免疫后,1周内BALb/c小鼠外周血中抗HLA-A2特异性抗体迅速增高,于4周时达到顶峰,随后抗体滴度缓慢下降,但第12周时仍维持较高的抗体滴度,具体结果见图12。
3、免疫后小鼠脾脏中淋巴细胞及B淋巴细胞亚群变化
免疫后BALb/c小鼠脾脏中CD19+B细胞比例逐渐升高,4周时该细胞比例明显高于免疫前(p<0.05),12周时该细胞比例仍高于免疫前;脾脏中CD138+浆细胞比例显著升高,4周时达到顶峰,明显高于免疫前(p<0.05),但随着时间推移逐渐下降,12周时略高于免疫前,差异不具有统计学意义(p>0.05);而淋巴细胞比例在4周和12周时均高于免疫前(p<0.05),具体结果见图13。由于脾脏淋巴细胞绝对数目渐渐升高,所以CD19+B细胞和CD138+浆细胞的数目也显著增高。
免疫后BALb/c小鼠脾脏中记忆性B细胞细胞逐渐增加,4周时达到顶峰,但随后渐渐降低,12周时仍有少许存在;T2细胞变化与其相似,而T1细胞和成熟初始B细胞变化并不规律(图14)。
4、免疫后小鼠骨髓中淋巴细胞及B淋巴细胞亚群变化
免疫后BALb/c小鼠骨髓中CD19+B细胞比例明显升高,2周时该细胞比例达到最高峰(p<0.05),随后渐渐降低;骨髓中CD138+浆细胞比例显著升高,2周时达到顶峰,明显高于免疫前(p<0.05),12周时仍明显高于免疫前;而骨髓中淋巴细胞比例免疫后1周时达到高峰(p<0.05),随后逐渐降低(图15)。免疫后骨髓内淋巴细胞、CD19+B细胞和CD138+浆细胞数目也呈类似变化。免疫后BALb/c小鼠骨髓中前/祖B细胞逐渐增加,2周时达到顶峰,但随后渐渐降低,12周时仍明显高于免疫前;T1、T2、成熟初始B细胞变化趋势与其类似(图16)。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种人重组组织因子及其基因、表达载体、宿主菌和表达方法与流程
- 特异性抑制Eya2基因表达的siRNA及其重组载体和应用的制作方法与工艺
- 一种人乙型肝炎病毒重组载体及其应用的制作方法与工艺
- 梨转录因子PyMYB114及其重组表达载体和应用的制作方法与工艺
- 特异性抑制CLDN8基因表达的siRNA及其重组载体和应用的制作方法与工艺
- 一种基于多重信息载体的公路机电设备合格证的制造方法与工艺
- 基于位点特异性重组的四膜虫表达载体及其构建和应用的制造方法与工艺
- 特异性抑制PADI2基因表达的siRNA及其重组载体和应用的制造方法与工艺
- 双组分显影剂用载体、双组分显影剂和该载体的制备方法与流程
- 一种制备重组内参GAPDH抗体的表达载体的构建方法与制造工艺
- 带Flag标签的LAMP1真核表达载体及其在溶酶体分离中的应用
- 带ha标签的lamp1真核表达载体及其在溶酶体分离中的应用
- 重组人cc16基因、其真核表达载体的构建及重组蛋白的纯化的制作方法
- pVAX-PTX3真核表达载体、构建方法及所表达的PTX3蛋白对猪链球菌2型的抗菌应用
- 作为体外检测试剂的真核通用表达载体系统及其构建方法
- 人胱抑素c真核表达载体的构建及其表达、纯化的制作方法
- 一种标记细胞骨架蛋白的多肽及其真核表达载体的制作方法
- hALR基因微环真核表达载体在降低肝脏胶原蛋白合成方面的应用的制作方法
- 重组肿瘤抑素-肿瘤坏死因子分泌型真核表达载体及其制备方法和用途的制作方法
- 人ski基因真核表达载体、制备方法及其应用的制作方法