一种用于基因传递的非病毒基因载体及其制备方法和用途与流程
本发明涉及一种用于基因传递的非病毒基因载体及其制备方法和用途。
背景技术:
基因治疗越来越受到人们的关注,它可以通过向靶细胞或组织传递基因药物从而为众多诸如艾滋病和癌症等疾病提供一种高效的、有潜力的治疗方法。众所周知,由于裸露的DNA进入体内后容易被血液或体液当中的核酸酶快速降解、清除,所以裸露的DNA不适合直接用于体内治疗。因此,我们亟需一种既能很好的保护基因药物不被降解同时又能高效的将基因药物传递到靶细胞或组织的基因载体。虽然一些病毒载体具有高效的转染效率,但是病毒载体固有的免疫原性与生物不安全性限制了其进一步的临床应用。最近,一些非病毒基因载体引起了众多科学家的注意。阳离子聚合物、树状聚合物、脂质体和多肽等这些非病毒基因载体不仅具有低的免疫原性、生物安全性高等性质而且制备过程可操控性高,材料表面易修饰。因此非病毒载体被认为是一种具有潜力的基因治疗载体工具。
聚乙烯亚胺(Polyethyleneimine,PEI)是一种最常见的阳离子聚合物非病毒基因载体。它可以将带负电的基因包裹住并形成纳米复合物,此复合物能够通过细胞内吞方式进入肿瘤细胞经过溶酶体逃逸展现出较好的转染效率。然而,PEI的分子量大小影响着它转染效率与毒性之间的平衡。例如,分子量为25000的PEI转染效率很高的同时也具有较大的细胞毒性;相反,分子量为600的PEI虽然细胞毒性低但是转染效率也很低。因此PEI的应用受到很大程度的限制。
通常将PEI嫁接在诸如透明质酸、肝素、壳聚糖或者海藻酸钠一类的阴离子天然聚合物上可以有效的克服PEI的一些缺点。纵然PEI-阴离子聚合物复合物的细胞毒性大大降低,但是转染效率总是不尽如人意。因此,如何能够降低PEI毒性的同时又能增加其转染效率是现如今的重中之重。
技术实现要素:
为了解决上述问题,本发明提供了一种新的非病毒基因载体,及其制备方法和用途。
本发明非病毒基因载体,它由聚乙烯亚胺和聚乙烯亚胺-细胞穿膜肽R8的混合物与肝素钠制备而成,其中,聚乙烯亚胺-细胞穿膜肽R8由聚乙烯亚胺与细胞穿膜肽R8连接而成,二者的摩尔比为1:1。
其中,所述肝素钠与混合物的重量比为1:3-1:5,优选为1:4。其中,肝素钠与PEI的比为1:3-1:5时,均可以制备得到非病毒基因载体,其中,1:4的效果最优。
其中,所述混合物中,聚乙烯亚胺-细胞穿膜肽R8占混合物总重量的20~40%,优选为30~40%,进一步优选30%。
其中,所述聚乙烯亚胺为聚乙烯亚胺1.8K。
其中,所述聚乙烯亚胺-细胞穿膜肽R8是由3-马来酰亚胺基丙酸羟基琥珀酰亚胺酯将聚乙烯亚胺与细胞穿膜肽R8连接而成。
本发明还提供了前述非病毒基因载体的制备方法,步骤如下:
(1)取聚乙烯亚胺,溶于氯仿中,加入3-马来酰亚胺基丙酸羟基琥珀酰亚胺酯,反应后除去溶剂,再加入细胞穿膜肽R8,搅拌反应,透析;
(2)取肝素钠溶于MES缓冲液中,活化肝素钠中的羧基,将活化了的肝素钠溶液滴加到聚乙烯亚胺和聚乙烯亚胺-细胞穿膜肽R8的混合溶液中,搅拌反应,透析,即可。
本发明还提供了前述非病毒基因载体在制备携带基因的载体中的用途。其中,所述载体是用于基因治疗的载体。
本发明还提供了前述一种基因传递系统,它包含前述的非病毒基因载体以及待传递的基因。
其中,所述载体与基因的质量比不低于5:1;进一步优选地,所述载体与基因的质量比为(5~20):1
为了解决PEI在转染中的一些棘手问题,我们制备了一种极低毒性转染效率高的肝素-PEI-R8(HPR)纳米粒。本发明HPR纳米粒可以较好的包裹质粒DNA同时又展现出优异的溶酶体逃逸效应,HPR在结直肠癌HCT116细胞中的转染效率高,同时装载hTRAIL质粒形成HPR/phTRAIL纳米粒后表现出良好的促凋亡效果,说明其是有效的基因传递系统,可以作为基因治疗的载体使用,临床应用前景非常优良。
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
图1.A:PEI和PEI-R8的核磁氢谱图。B:HPR和HPR/phTRAIL的粒径分布图。C:HPR和HPR/phTRAIL的电位分布图。D:HPR的投射电镜图。E:HPR/phTRAIL的投射电镜图。
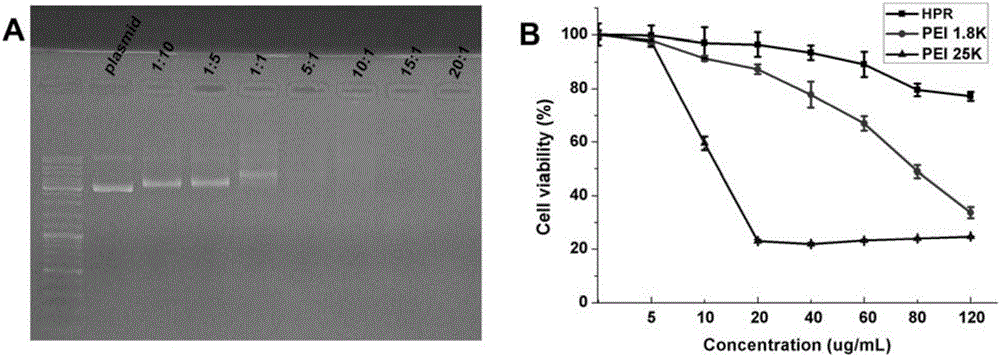
图2.A:HPR包裹质粒DNA后的凝胶电泳图。B:HPR在HCT116细胞中的毒性。
图3.HPR/pDNA纳米粒在HCT116细胞中分别孵育0.5、1、2、4小时后的激光共聚焦图。质粒DNA用YOYO-1标记为绿色;溶酶体用
LysoTracker-Red标记为红色;细胞核用DAPI标记为蓝色。
图4.A,B,C:分别为PEI1.8K/pGFP,PEI25K/pGFP和HPR/pGFP转染HCT116细胞后的荧光图。D:转染效率的定量分析统计结果。
图5.A:不同组(NS,PEI25K/pMCS,PEI25K/phTRAIL,HPR,HPR/pMCS和HPR/phTRAIL)诱导HCT116细胞凋亡的流式分析结果图。B:细胞凋亡阳性(Annexin V阳性)结果统计图。C:用Western-blot检测各组细胞中凋亡相关蛋白表达水平。
图6.实施例3制备的HPR的转染图。
具体实施方式
材料:PEI1.8K购自sigma,3-马来酰亚胺基丙酸羟基琥珀酰亚胺酯购自成都聚慧化工,cys-R8购自上海强耀生物,肝素钠购自sigma,其余材料均为市售产品。
实施例1本发明用于基因传递的非病毒基因载体(HPR)的制备
1、制备方法
(1)PEI-R8的制备
用10mL氯仿将PEI 1.8K(1g,0.55mmol,1.0eq)溶在25mL的圆底烧瓶中,然后加入3-马来酰亚胺基丙酸羟基琥珀酰亚胺酯(177mg,0.666mmol,1.2eq)。室温条件下搅拌反应3小时后将溶剂除去。然后用10mL THF/H2O(1:1,v/v)将上述残渣溶解,再加入cys-R8(760mg,0.55mmol,1.0eq)室温搅拌反应6小时。反应完全后用截留分子量为1000的透析袋在水中透析上述反应液三天。最后将得到的产物的水溶液冻干,保存在-20度以备使用。
(2)HPR的制备
将50mg肝素钠溶于100mL MES缓冲液(pH 5.5,0.05M)中,再加入30mg EDCI、30每个NHS室温搅拌反应3小时活化肝素钠中的羧基。在剧烈搅拌的情况下将上述活化了的肝素钠溶液慢慢滴加到20mL PEI水溶液中(140mg PEI 1.8K/60mg PEI-R8),滴加完毕后继续搅拌12小时。最后反应液用截留分子量为10000的透析袋在纯水中透析3天。最后HPR纳米粒溶液用0.22um的滤膜过滤掉残渣。用纯水将HPR纳米粒的浓度调到1mg/mL。
2、性质检测
2.1检测方法HPR/pDNA纳米粒通过正负电荷作用力而制备。首先,40ug HPR纳米粒溶液与2ug phTRAIL质粒溶液轻轻混合均匀,室温静置25分钟即形成稳定的HPR/pDNA纳米粒。HPR和HPR/phTRAIL纳米粒的粒径和电位用马尔文动态光闪射仪(Zetasizer NanoZS ZEN 3600,UK)测定。纳米粒的形态用透射电镜(TEM,JEOL JEM;100CX,Japan)的方法观察。
核酸凝胶电泳实验方法如下:首先,制备不同质量比的HPR/phTRAIL纳米粒(1:10、1:5、1:1、5:1、10:1、15:1和20:1,固定质粒DNA的质量)。然后将HPR/phTRAIL纳米粒在1%琼脂糖凝胶上经120伏电压条件进行电泳20分钟。凝胶用GelView染料预染。最后DNA条带用Gel Doc System(Bio-Rad)观看。
2.2检测结果
图1A为PEI与PEI-R8的核磁氢谱图。与PEI比较,PEI-R8的图谱中在1.5ppm,2.8ppm和4.2ppm出现了新的信号峰,也就是R8穿膜肽的特征信号峰。由此证明PEI-R8的成功合成。从图1B、1C中可看出HPR纳米粒的粒径为125±3nm,电位为+28±2mV。将HPR通过正负电荷作用与质粒DNA形成HPR/pDNA纳米粒后粒径有所降低为113±2nm,电位为+20±3mV。从透射电镜图(图1D,1E)中可看出HPR和HPR/pDNA纳米粒都展现出球形的形态。
我们用核酸凝胶电泳实验来评价HPR包裹质粒DNA的能力。从图2A可知,当HPR/pDNA的质量比低于1:1时,HPR不能完全包裹住质粒DNA。然而,当HPR/pDNA的质量比不低于5:1时HPR可以完整的包裹住质粒DNA从而形成带正电的HPR/pDNA纳米粒。
实施例2本发明用于基因传递的非病毒基因载体(HPR)的制备
1、制备方法
(1)PEI-R8的制备
用10mL氯仿将PEI 1.8K(1g,0.55mmol,1.0eq)溶在25mL的圆底烧瓶中,然后加入3-马来酰亚胺基丙酸羟基琥珀酰亚胺酯(177mg,0.666mmol,1.2eq)。室温条件下搅拌反应3小时后将溶剂除去。然后用10mL THF/H2O(1:1,v/v)将上述残渣溶解,再加入cys-R8(760mg,0.55mmol,1.0eq)室温搅拌反应6小时。反应完全后用截留分子量为1000的透析袋在水中透析上述反应液三天。最后将得到的产物的水溶液冻干,保存在负20度以备使用。
(2)HPR的制备
将50mg肝素钠溶于100mL MES缓冲液(pH 5.5,0.05M)中,再加入30mg EDCI、30每个NHS室温搅拌反应3小时活化肝素钠中的羧基。在剧烈搅拌的情况下将上述活化了的肝素钠溶液慢慢滴加到20mL PEI水溶液中(150mg PEI 1.8K/100mg PEI-R8),滴加完毕后继续搅拌12小时。最后反应液用截留分子量为10000的透析袋在纯水中透析3天。最后HPR纳米粒溶液用0.22um的滤膜过滤掉残渣。用纯水将HPR纳米粒的浓度调到1mg/mL。
实施例3本发明用于基因传递的非病毒基因载体(HPR)的制备
1、制备方法
(1)PEI-R8的制备
用10mL氯仿将PEI 1.8K(1g,0.55mmol,1.0eq)溶在25mL的圆底烧瓶中,然后加入3-马来酰亚胺基丙酸羟基琥珀酰亚胺酯(177mg,0.666mmol,1.2eq)。室温条件下搅拌反应3小时后将溶剂除去。然后用10mL THF/H2O(1:1,v/v)将上述残渣溶解,再加入cys-R8(760mg,0.55mmol,1.0eq)室温搅拌反应6小时。反应完全后用截留分子量为1000的透析袋在水中透析上述反应液三天。最后将得到的产物的水溶液冻干,保存在负20度以备使用。
(2)HPR的制备
将50mg肝素钠溶于100mL MES缓冲液(pH 5.5,0.05M)中,再加入30mg EDCI、30每个NHS室温搅拌反应3小时活化肝素钠中的羧基。在剧烈搅拌的情况下将上述活化了的肝素钠溶液慢慢滴加到20mL PEI水溶液中(90mg PEI 1.8K/60mg PEI-R8),滴加完毕后继续搅拌12小时。最后反应液用截留分子量为10000的透析袋在纯水中透析3天。最后HPR纳米粒溶液用0.22um的滤膜过滤掉残渣。用纯水将HPR纳米粒的浓度调到1mg/mL。
以下用实验例的方式来说明本发明的有益效果:
实验例1本发明用于基因传递的非病毒基因载体(HPR)的应用
1、试验方法
取本发明实施例1制备的HPR纳米粒,进行如下检测:
1.1体外细胞毒性评价。
用MTT实验检测PEI 25K、PEI 1.8K和HPR纳米粒的细胞毒性。将处于对数期的HCT116细胞铺于96孔板中(细胞密度5000个/孔),培养过夜使细胞完全贴壁。分别用不同浓度(5,10,20,40,60,80和120ug/mL)的PEI 25K、PEI 1.8K和HPR处理细胞48小时。然后用每孔加入20uLMTT(5mg/mL),继续培养4小时。最后弃去培养基,每孔加入150uLDMSO溶解甲瓒沉淀,在570nm出测定吸光度。每个实验至少做3个复孔。
1.2溶酶体逃逸效应。
phTRAIL质粒用绿色YOYO-1染料标记。将HCT116细胞于每孔20万个的密度铺于6孔板中。将HPR/YOYO-1-phTRAIL纳米粒加入孔板的每个孔中。在预定的时间点(0.5,1,2,4小时)用PBS洗去HPR/YOYO-1-phTRAIL纳米粒后分别用Lyso-Tracker Red和DAPI将溶酶体和细胞核染成红色和蓝色。最后用PBS将染料洗去用共聚焦显微镜(Leica,TCS SP5,Germany)观察不同时间点HPR/phTRAIL在细胞中定位情况。
1.3细胞转染实验
我们用具有报告基因绿色荧光蛋白(GFP)基因的GFP质粒来评价HPR纳米粒的转染效率。首先,将HCT116细胞以每孔20万个细胞的密度铺于6孔板中,培养贴壁。然后将孔里的完全培养基替换成1mL不含血清和抗生素的双无培养基,之后在相对应的孔里加入装载2ug GFP质粒的HPR/pGFP(质量比,20:1)、PEI25K/pGFP(质量比,2:1)和PEI/1.8K/pGFP(质量比,20:1)纳米粒。37℃培养6小时后,用2mL完全培养替换掉孔里的双无培养基继续培养24小时。最后用荧光显微镜(Olympus,Japan)观察相对应孔里的GFP表达情况,用流式细胞仪(Calibur,BD,USA)定量检测表达GFP的细胞的比例。
1.4体外促凋亡实验。
将HCT116细胞以每孔20万个细胞的密度铺于6孔板中,培养贴壁。然后将孔里的完全培养基替换成1mL不含血清和抗生素的双无培养基,之后在相对应的孔里加入装载1ug phTRAIL质粒的HPR/phTRAIL(质量比,20:1)、PEI25K/phTRAIL(质量比,2:1)、HPR/pMCS(质量比,20:1)、PEI25K/pMCS(质量比,2:1)纳米粒和空白材料HPR纳米粒。37℃培养6小时后,用2mL完全培养替换掉孔里的双无培养基继续培养24小时。最后将细胞收集,用Annexin V-FITC/PI凋亡检测试剂盒标记凋亡细胞,用流式细胞仪定量检测细胞凋亡比例。同时将各组的细胞收集,用Western-blot方法来检测各组中凋亡相关蛋白(cleaved-caspase3,cleaved-caspase9)的表达水平。
2、实验结果
2.1HPR的细胞毒性实验
从图2B中我们可以看出,PEI 1.8K和PEI25K都展现出浓度依赖性的细胞毒性,即细胞毒性随着材料浓度升高而明显增大。当将PEI1.8K与肝素结合在一起形成纳米粒时,与PEI1.8K和PEI25K相比HPR的毒性明显降低。
试验结果说明,与PEI 1.8K和PEI25K相比,本发明载体HPR的毒性均显著降低。
2.2HPR的溶酶体逃逸效应。
当HPR携带DNA进入细胞后,为了防止DNA在富含多种降解酶的溶酶体中降解,HPR必须有效的携带DNA逃离溶酶体。因此我们评价了HPR的溶酶体逃逸效应。如图3所示,在一开始的0.5小时HPR/phTRAIL纳米粒停留在细胞膜边缘,2小时后HPR/phTRAIL纳米粒与溶酶体重合即进入溶酶体。4小时后,由于PEI-R8的质子海绵体效应溶酶体被胀裂,可以明显看出HPR携带phTRAIL逃离溶酶体并且进入细胞核释放质粒DNA进一步发挥作用。
试验结果说明,本发明载体HPR可以有效逃离溶酶体的酶解,是一个安全高效的基因传递载体。
2.3HPR的体外转染效率
我们在结直肠癌HCT116细胞当中检测HPR/pGFP纳米粒的转染效率,将基因转染的金标准材料PEI25K作为阳性对照。
从图4可以看出,HPR/pGFP纳米粒在24小时的转染效率为64±2%,明显高于PEI25K/pGFP纳米粒的转染效率(37±2%)。PEI1.8K/pGFP纳米粒的转染效率几乎为零。HPR/pGFP纳米粒表面的正电荷有助于其与带负电的细胞膜相互作用而增加摄取,同时HPR/pGFP纳米粒表面裸露的R8穿膜肽也有助于纳米粒进入细胞。
试验结果说明,即便与转染效率非常高的材料PEI25K相比,本发明载体HPR的转染效率还更高,效率提高了27%,是前者的1.73倍,提高幅度非常显著。
2.4HPR/phTRAIL纳米粒的促凋亡作用。
为了进一步验证HPR传递基因的能力,我们将能够表达人TNF相关凋亡诱导配体的质粒装载在HPR中形成HPR/phTRAIL纳米粒,检测HPR/phTRAIL纳米粒在结直肠癌HCT116细胞当中的促凋亡能力。
如图5A,B所示,与阳性对照PEI/phTRAIL的促凋亡效率(19±3%)相比,HPR/phTRAIL纳米粒在结直肠癌HCT116细胞中的促凋亡效率为43±3%。装载不表达人TNF相关凋亡诱导配体的质粒的HPR/pMCS纳米粒的促凋亡效率仅为8%左右。从Western-blot结果(图5C)可知:与对照组和HPR/pMCS组相比,在HPR/phTRAIL组中与细胞凋亡相关的两个重要蛋白cleaved-caspase3和cleaved-caspase9都有明显的上调。
试验结果说明,即便与转染效率非常高的材料PEI25K相比,本发明载体HPR转染后的促凋亡效率大幅度提高,是前者的2.26倍,说明本发明载体HPR转染的效率非常高。
另外,采用实施例3制备的HPR进行转染实验,其转染效率与实施例1制备的HPR相当,转染图如图6所示。
综上,本发明将细胞穿膜肽R8嫁接在阳离子聚乙烯亚胺上再一起连接在肝素上形成一种肝素-PEI-R8(HPR)纳米粒,这种纳米粒不仅能提高PEI的转染效率同时也能降低其细胞毒性。HPR纳米粒可以较好的包裹质粒DNA同时又展现出优异的溶酶体逃逸效应,HPR在结直肠癌HCT116细胞中的转染效率高,同时装载hTRAIL质粒形成HPR/phTRAIL纳米粒后表现出良好的促凋亡效果,说明其是有效的基因传递系统,可以作为基因治疗的载体使用,临床应用前景非常优良。
- 还没有人留言评论。精彩留言会获得点赞!
- 基于CRISPR/Cas9技术的单子叶植物基因敲除载体及其应用的制作方法与工艺
- 一种T1R2基因过表达慢病毒载体、慢病毒及其构建方法与流程
- 一种Gα基因过表达慢病毒载体、慢病毒及其构建方法与流程
- 弱毒力CMV载体表达抗性基因增强植物抗重金属性能的应用的制作方法与工艺
- 猪ApoE基因敲除载体及其构建方法与应用与流程
- 基于CRISPR/Cas9技术的单子叶植物基因敲除载体及其应用的制作方法与工艺
- 敲除衣藻内源基因和表达外源基因的载体构建方法及应用与流程
- 一种能够快速构建植物基因定点敲除载体的新反应体系的制造方法与工艺
- 介导整合的HIV‑1前病毒基因敲除的锌指核酸内切酶及其制法和应用的制造方法与工艺
- 病毒载体、细胞及构建体的制造方法与工艺