一种红树植物木果楝真菌来源的吲哚二萜类化合物及其制备方法与应用与流程
本发明属于海洋真菌次级代谢产物领域,具体涉及一种红树植物木果楝真菌来源的吲哚二萜类化合物及其制备方法与应用。
背景技术:
红树植物生长于热带亚热带潮间带,其生存环境具有高压、高盐、低氧等特点,使得其内生真菌具有独特的代谢途径,进而具有产生结构新颖、生物活性多样的化合物的能力,其代谢产物具有抗菌、抗肿瘤、免疫调节、酶抑制等多种药用价值,是潜在的微生物药物开发资源,因此,红树植物内生真菌将成为新药研发的重要资源之一。
采用人工培养发酵的方法,从红树植物内生真菌中获得有重要抗菌活性的次级代谢产物,具有环境友好、可持续发展等特点,能有效解决药物开发过程中的药源等关键性问题,因此具有独特优势。
技术实现要素:
本发明提供一种海洋真菌eupenicilliumsp.hj002,该真菌分离自木果楝,其中木果楝是发明人于2015年9月采集自海南东寨港红树林自然保护区。本发明所述海洋真菌eupenicilliumsp.hj002的菌种保藏信息:保藏单位名称:中国微生物菌种保藏管理委员会普通微生物中心;保藏单位地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所;保藏日期:2016年12月21日;保藏编号:cgmccno.13373;分类命名:正青霉eupenicilliumsp.。
本发明提供一种红树植物木果楝真菌来源的吲哚二萜类化合物或其药学上可接受的盐,其特征在于所述吲哚二萜类化合物具有如下化合物1-3所示的结构:
本发明提供一种制备上述吲哚二萜类化合物1-3的方法,其特征在于包括如下步骤:
(1)配制种子培养基,将海洋真菌eupenicilliumsp.hj002菌株接入种子培养基,26~28℃,培养3~4天得种子培养液;
(2)将步骤(1)得到的种子培养液接入发酵培养基中,26~28℃静置培养21~28天得发酵物;
(3)将步骤(2)得到的发酵物中的发酵液和菌体分离,发酵液用等体积的乙酸乙酯萃取2~4次,合并乙酸乙酯相后减压浓缩得到浸膏;
(4)步骤(3)得到的浸膏经过减压硅胶柱层析,采用石油醚-乙酸乙酯作为洗脱剂进行梯度洗脱,洗脱梯度分别为100:0、90:10、80:20、70:30、60:40,50:50、40:60、30:70、20:80、10:90、0:100,每个梯度收集两个柱体积,根据极性大小分成6个组分,其中梯度100:0~90:10洗脱得到的为组分1,梯度80:20~70:30洗脱得到的为组分2,梯度60:40~50:50洗脱得到的为组分3,梯度40:60~30:70洗脱得到的为组分4,梯度20:80~10:90洗脱得到的为组分5,梯度0:100洗脱得到的为组分6,其中组分4先经正相硅胶柱层析,洗脱剂为石油醚:乙酸乙酯=5:1-2:1的混合溶剂,洗脱2-5个柱体积,减压浓缩后再经sephadexlh-20凝胶柱层析,洗脱剂为chcl3:meoh=1:1的混合溶剂,洗脱3-6个柱体积,减压浓缩后再经高效液相色谱hplc制备,色谱柱为watersc18,9.4×250mm,7μm,流速为2ml/min,流动相为meoh:h2o=80:30-75:25,依次得到化合物3和化合物2;组分5先经sephadexlh-20凝胶柱层析,洗脱剂为meoh,洗脱3-6个柱体积,减压浓缩后再经高效液相色谱hplc制备,色谱柱为watersc18,9.4×250mm,7μm,流速为2ml/min,流动相为meoh:h2o=72:28,得到化合物1。
其中所述洗脱剂或流动相的比例均为体积比;所述种子培养基中含有葡萄糖1.5%–3.0%、酵母膏0.1%–0.5%、蛋白胨0.1%–0.5%、粗海盐0.11%–0.6%、适量的水;所述发酵培养基中含有葡萄糖1.6%–3.5%、酵母膏0.1%–0.5%、蛋白胨0.1%–0.5%、粗海盐0.11%–0.6%、适量的水;上述百分比均为重量百分比;所述种子培养基和发酵培养基均需120℃灭25–30分钟。
本发明的另一实施方案提供化合物1的晶体,其特征在于其x-射线单晶衍射数据为:斜方晶系,空间群p212121,晶胞参数为
本发明的另一实施方案提供化合物2的晶体,其特征在于其x-射线单晶衍射数据为:斜方晶系,空间群p212121,晶胞参数为
本发明提供化合物1或2晶体的制备方法,其特征在于将化合物1或2溶于溶剂中,自然结晶得到,所述溶剂为甲醇、乙醇、二氯甲烷、石油醚或乙酸乙酯中的一种或几种。
本发明提供一种抗肿瘤药物,其特征在于以上述吲哚二萜类化合物1-3、其晶体或其药学上可接受的盐作为有效成分。
本发明提供的上述抗肿瘤药物,还包含其他抗肿瘤药物;也可以包含药学上可接受的载体或赋形剂。
本发明的另一实施方案提供所述的吲哚二萜类化合物1-3、其晶体或其药学上可接受的盐在制备抗肿瘤药物中的用途。所述肿瘤优选a549、hela、hepg2。
本发明中术语“药学上可接受的盐”是指非毒性的无机或有机酸和/或碱的加成盐,可参见“saltselectionforbasicdrugs”,int.j.pharm.(1986),33,201–217。
附图说明
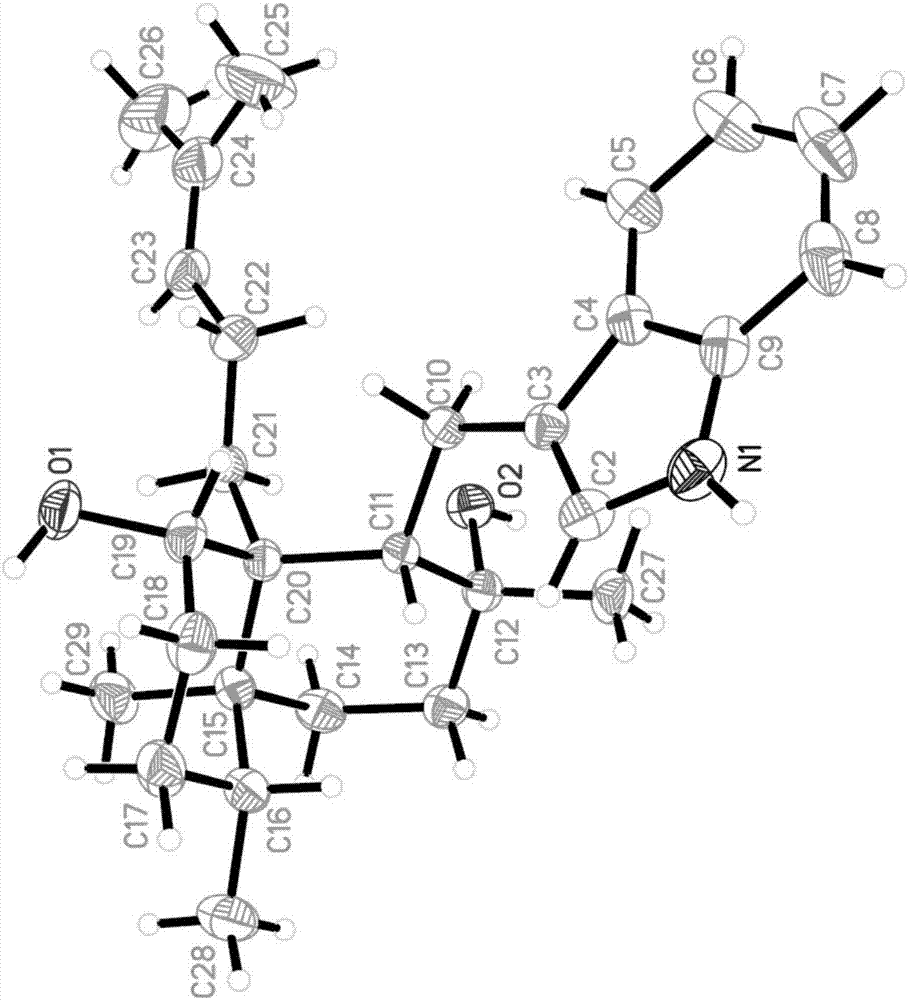
图1化合物1的xrd图。
图2化合物2的xrd图。
具体实施方式
为了便于对本发明的进一步理解,下面提供的实施例对其做了更详细的说明。但是这些实施例仅供更好的理解发明而并非用来限定本发明的范围或实施原则,本发明的实施方式不限于以下内容。
实施例1
(1)海洋真菌eupenicilliumsp.hj002的菌种培养
配制种子培养基:葡萄糖80g,蛋白胨8g,酵母膏8g,粗海盐10g,水4.0l,平均分装于8个1000ml锥形瓶,120℃灭25–30分钟。
将真菌eupenicilliumsp.hj002菌株接入配制好的种子培养基中,于26~28℃下,培养3天得种子培养液;
(2)海洋真菌eupenicilliumsp.hj002的发酵
配制发酵培养基:葡萄糖1.1kg,蛋白胨100g,酵母膏100g,海盐125g,水50l,平均分装于75个1000ml锥形瓶中,120℃灭25–30分钟。
取适量的步骤(1)中得到的种子培养液接入装有发酵培养基的锥形瓶中,于26~28℃静置培养21天。
(3)化合物1-3的提取分离
取15l步骤(2)得到的发酵物过滤,分离发酵液和菌体,发酵液用等体积的乙酸乙酯萃取2-3次;合并乙酸乙酯相后减压浓缩得浸膏,浸膏经过减压硅胶柱层析,采用石油醚-乙酸乙酯作为洗脱剂进行梯度洗脱,洗脱梯度分别为100:0、90:10、80:20、70:30、60:40,50:50、40:60、30:70、20:80、10:90、0:100,每个梯度收集两个柱体积,根据极性大小分成6个组分,其中梯度100:0~90:10洗脱得到的为组分1,梯度80:20~70:30洗脱得到的为组分2,梯度60:40~50:50洗脱得到的为组分3,梯度40:60~30:70洗脱得到的为组分4,梯度20:80~10:90洗脱得到的为组分5,梯度0:100洗脱得到的为组分6,其中组分4先经正相硅胶柱层析,洗脱剂为石油醚:乙酸乙酯=5:1-2:1的混合溶剂,洗脱2-5个柱体积,减压浓缩后再经sephadexlh-20凝胶柱层析,洗脱剂为chcl3:meoh=1:1的混合溶剂,洗脱3-6个柱体积,减压浓缩后再经高效液相色谱hplc制备,色谱柱为watersc18,9.4×250mm,7μm,流速为2ml/min,流动相为meoh:h2o=80:30-75:25,依次得到化合物3(1.5mg)和化合物2(6.4mg);组分5先经sephadexlh-20凝胶柱层析,洗脱剂为meoh,洗脱3-6个柱体积,减压浓缩后再经高效液相色谱hplc制备,色谱柱为watersc18,9.4×250mm,7μm,流速为2ml/min,流动相为meoh:h2o=72:28,得到化合物1(7.2mg)。
化合物1-3的结构确证数据如下:
表1化合物1-3的1h(400mhz)and13c(100mhz)nmr数据(meod)
化合物1:ir(kbr)νmax3427,1636,1455,1377,1243,1121,731cm–1;1hand13cnmr见表1;hresimsm/z424.3204[m+h]+(calcdforc28h42no2,424.3210)。
化合物2:λmax(logε)226(4.02),276(3.50),294(3.34)nm;ir(kbr)νmax3420,1710,1602,1432,1366,1230,1110,738cm–1;1hand13cnmr见表1;hresimsm/z422.3048[m+h]+(calcdforc28h40no2,422.3054)。
化合物3:ir(kbr)νmax3518,1712,1602,1272,1250,1230,1112,1082,1064,798cm–1;1hand13cnmr见表1;hresimsm/z422.3050[m+h]+(calcdforc28h40no2,422.3054)。
实施例2
(1)真菌eupenicilliumsp.hj002的菌种培养
配制种子培养基(5.0l):葡萄糖1.5%(重量百分比,下同)、酵母膏0.5%、蛋白胨0.1%、粗海盐0.11%,其余为水;平均分装于8个1000ml锥形瓶,120℃灭25–30分钟。
将真菌eupenicilliumsp.hj002菌株接入配制好的种子培养基中,于26~28℃下,培养4天得种子培养液;
(2)真菌eupenicilliumsp.hj002的发酵
配制发酵培养基(100l):葡萄糖1.6%(重量百分比,下同)、酵母膏0.5%、蛋白胨0.1%、粗海盐0.11%,其余为水;平均分装于150个1000ml锥形瓶,120℃灭25–30分钟。
取适量的步骤(1)中得到的种子培养液接入装有发酵培养基的锥形瓶中,于26~28℃静置培养28天。
(3)化合物1-3的提取分离
按照实施例1中类似的分离方法,可得到化合物1-3,结构确证数据与实施例1一致。
实施例3
(1)真菌eupenicilliumsp.hj002的菌种培养
配制种子培养基(1.0l):葡萄糖3.0%(重量百分比,下同)、酵母膏0.1%、蛋白胨0.5%、粗海盐0.6%,其余为水;平均分装于3个500ml锥形瓶,120℃灭25–30分钟。
将真菌eupenicilliumsp.hj002菌株接入配制好的种子培养基中,于26~28℃下,培养4天得种子培养液;
(2)真菌eupenicilliumsp.hj002的发酵
配制发酵培养基(20l):葡萄糖3.5%(重量百分比,下同)、酵母膏0.1%、蛋白胨0.5%、粗海盐0.6%,其余为水;平均分装于30个1000ml锥形瓶,120℃灭25–30分钟。
取适量的步骤(1)中得到的种子培养液接入装有发酵培养基的锥形瓶中,于26~28℃静置培养24天。
(3)化合物1-3的提取分离
按照实施例1中类似的分离方法,可得到化合物1-3,结构确证数据与实施例1一致。
实施例4
取2.0mg化合物1溶于2ml甲醇中,静置自然结晶,4天后得到无色晶体(图1),其晶体结构以双子超衍射仪(xcalibur,atlas,geminiultradiffractometer)采用cukα射线
化合物1晶体:斜方晶系,空间群p212121,晶胞参数为
此外,将化合物1溶于乙醇、二氯甲烷、石油醚或乙酸乙酯中的一种或几种混合,静置3-7天均能得到上述晶体。
实施例5
取1.0mg化合物1溶于1ml甲醇中,静置自然结晶,5天后得到无色晶体(图2),其晶体结构以双子超衍射仪(xcalibur,atlas,geminiultradiffractometer)采用cukα射线
化合物2晶体:斜方晶系,空间群p212121,晶胞参数为
此外,将化合物2溶于乙醇、二氯甲烷、石油醚或乙酸乙酯中的一种或几种混合,静置3-7天均能得到上述晶体。
实施例6抗肿瘤活性测试
采用mtt方法对肿瘤细胞a549、hela、hepg2进行细胞毒活性测试,5-fu和adriamycin(阿霉素)作为阳性对照药。
测试结果表明本发明化合物1-3及化合物1和2的晶体对肿瘤细胞a549、hela、hepg2均显示出一定的抑制活性,ic50为1-25μg/ml,其中化合物1-2的具体活性见下表。
- 还没有人留言评论。精彩留言会获得点赞!