一种制备三酮类化合物的方法与流程
本发明涉及农药制备领域,具体地,涉及一种制备三酮类化合物的方法。
背景技术:
对羟基苯基丙酮酸双氧化酶(4-HPPD)是20世纪80年代发现的新的除草剂的作用靶标,它广泛存在于各种有氧生物体中。该酶是一种含有二价铁的依靠α-酮酸的双加氧化酶,它能够将对羟基苯丙酮酸催化转化成尿黑酸。4-HPPD除草剂的作用机理是抑制植物体内对羟基苯基丙酮酸转化为尿黑酸这一过程,在植物体内尿黑酸能够进一步被生物催化成质体醌和生育酚,而质体醌和生育酚是植物光合作用中电子链传递所必需的物质,如果抑制植物体内4-HPPD将会引起尿黑酸的合成受阻,进而影响到植物体内光合作用电子链传递,致使植物体出现白化症状而死亡。
设计与合成含有新型结构的4-HPPD抑制剂是近年来农药化学研究的一个热点领域之一。到目前为止,已经发现了5种以上不同结构类型的4-HPPD抑制剂,主要有三酮类、吡唑类、异恶唑类、二酮氰类和二苯酮类。以4-HPPD为靶标开发的除草剂具有高效,低毒,对环境友好以及对后茬作物安全等一系列优点。因此,4-HPPD除草剂是一类非常具有研究价值和发展前景的除草剂,也吸引了越来越多的农药公司投入到4-HPPD除草剂的研发中来。市售的三酮类的4-HPPD抑制剂的品种很多,它们的分子中都含有一个苯环结构,例如有硝磺草酮、磺草酮等,其中以硝磺草酮的除杂草效果最好,且安全性高。
根据对4-HPPD除草剂系统的研究,CN104557739A设计合成了一类新型的含有喹唑啉二酮结构的三酮类4-HPPD化合物。并具体公开了其三酮类化合物通过在重排反应条件下,将式(II)所示结构的化合物与催化剂在碱和溶剂存在下进行接触而得到。然而,该现有技术的方法中的式(II)所示结构的化合物的商购成本高;自主合成时,又存在工艺路线复杂且收率很低的缺点。
综上,本领域内需要找到一种能够低成本高收率地获得三酮类化合物的方法。
技术实现要素:
本发明的目的是克服现有技术的缺陷,提供一种新的能够低成本且高收率和高纯度地获得三酮类化合物的方法。
为了实现上述目的,第一方面,本发明提供一种制备三酮类化合物的方法,该三酮类化合物具有式(1)所示的结构,其中,R1、R2和R3各自独立地选自H、C1-6的烷基,该方法包括:
(1)在碱性条件下,在第一催化剂存在下,将式(2)所示的化合物与1,3-环己二酮和CO进行反应,得到式(3)所示的产物;
(2)在重排反应条件下,将式(3)所示的产物与第二催化剂和碱性物质进行接触,得到式(1)所示的三酮类化合物。
第二方面,本发明提供一种制备三酮类化合物的方法,该三酮类化合物具有式(1)所示的结构,其中,R1、R2和R3各自独立地选自H、C1-6的烷基,该方法包括:
(1)将式(2)所示的化合物进行氰基化,得到式(4)所示的化合物;
(2)将式(4)所示的化合物进行羧酸化,得到式(5)所示的化合物;
(3)将式(5)所示的化合物进行酰氯化,得到式(6)所示的化合物;
(4)将式(6)所示的化合物进行酯化,得到式(3)所示的化合物;以及
(5)在重排反应条件下,将式(3)所示的化合物与第二催化剂和碱性物质进行接触,得到式(1)所示的三酮类化合物。
本发明的前述方法能够低成本且高收率地获得三酮类化合物。并且,由本发明的方法获得的三酮类化合物的纯度高。
本发明的其它特征和优点将在随后的具体实施方式部分予以详细说明。
附图说明
附图是用来提供对本发明的进一步理解,并且构成说明书的一部分,与下面的具体实施方式一起用于解释本发明,但并不构成对本发明的限制。在附图中:
图1是根据一种优选的具体实施方式制备式(5)所示的化合物的合成路线图。
图2是根据一种优选的具体实施方式制备式(1)所示的三酮类化合物的合成路线图。
图3是根据另一种优选的具体实施方式制备式(1)所示的三酮类化合物的合成路线图。
具体实施方式
以下对本发明的具体实施方式进行详细说明。应当理解的是,此处所描述的具体实施方式仅用于说明和解释本发明,并不用于限制本发明。
在本文中所披露的范围的端点和任何值都不限于该精确的范围或值,这些范围或值应当理解为包含接近这些范围或值的值。对于数值范围来说,各个范围的端点值之间、各个范围的端点值和单独的点值之间,以及单独的点值之间可以彼此组合而得到一个或多个新的数值范围,这些数值范围应被视为在本文中具体公开。
在本发明中,在没有特别说明的情况下,所述第一接触反应、第二接触反应、第一催化剂、第二催化剂等中的“第一”、“第二”均不是表示先后次序,仅是为了区分。本领域技术人员不应理解为对本发明保护范围的限制。
第一方面,本发明提供了提供一种制备三酮类化合物的方法,该三酮类化合物具有式(1)所示的结构,其中,R1、R2和R3各自独立地选自H、C1-6的烷基,该方法包括:
(1)在碱性条件下,在第一催化剂存在下,将式(2)所示的化合物与1,3-环己二酮和CO进行反应,得到式(3)所示的产物;
(2)在重排反应条件下,将式(3)所示的产物与第二催化剂和碱性物质进行接触,得到式(1)所示的三酮类化合物。
优选地,在本发明中,R1、R2和R3各自独立地选自H、C1-3的烷基;更优选地,R1、R2和R3各自独立地选自H、甲基、乙基、正丙基和异丙基,并且R1、R2和R3不同时为H。
所述第一催化剂为能够催化插羰反应的催化剂。
所述第二催化剂为能够催化式(3)所示的产物进行重排反应的催化剂。
优选地,在步骤(1)中,所述第一催化剂中含有组分A和组分B,所述组分A为钯和/或氯化钯;所述组分B为选自双(2-二苯基磷苯基)醚和/或4,5-双二苯基膦-9,9-二甲基氧杂蒽的配体。
优选地,在所述第一催化剂中,所述组分A以钯元素计的用量与所述组分B的含量摩尔比为1:(1-2);更优选地,所述组分A以钯元素计的用量与所述组分B的含量摩尔比为1:(1.05-1.4)。
本发明的发明人发现,在所述第一催化剂中,所述组分A为钯和/或氯化钯;以及所述组分B为选自双(2-二苯基磷苯基)醚和/或4,5-双二苯基膦-9,9-二甲基氧杂蒽的配体;所述组分A以钯元素计的用量与所述组分B的含量摩尔比为1:(1.05-1.4)时,应用该第一催化剂而得到三酮类化合物的纯度和收率均很高。
优选地,在步骤(1)中,式(2)所示的化合物与1,3-环己二酮进行反应的条件包括:反应温度为30-100℃,反应时间为0.2-48h,反应压力为0.1-2.5MPa。
本发明的发明人发现,控制式(2)所示的化合物与1,3-环己二酮进行反应的压力为0.6-2.5MPa时,能够使得本发明的产物的纯度更高。
优选地,在步骤(1)中,所述式(2)所示的化合物与以其中含有的贵金属元素计的所述第一催化剂的用量摩尔比为1:(0.05-0.15)。
优选地,在步骤(1)中,所述碱性条件由选自三乙胺和/或碳酸氢钠的物质形成。
优选地,在步骤(1)中,所述反应在相转移催化剂存在下进行;更优选地,所述相转移催化剂为四丁基溴化铵。
优选地,在步骤(2)中,所述第二催化剂选自氰化钠、氰化钾、丙酮氰醇、三甲基氰硅烷、1,2,4-三氮唑和苯并1,2,4-三氮唑中的至少一种。
优选地,在步骤(2)中,所述碱性物质选自碳酸钾、碳酸钠、碳酸铯、三乙胺和吡啶中的至少一种。
优选地,在步骤(2)中,将式(3)所示的产物与第二催化剂和碱性物质进行接触的条件包括:接触温度为5-50℃;接触时间为5-30h。
第二方面,本发明提供了一种制备三酮类化合物的方法,该三酮类化合物具有式(1)所示的结构,其中,R1、R2和R3各自独立地选自H、C1-6的烷基,该方法包括:
(1)将式(2)所示的化合物进行氰基化,得到式(4)所示的化合物;
(2)将式(4)所示的化合物进行羧酸化,得到式(5)所示的化合物;
(3)将式(5)所示的化合物进行酰氯化,得到式(6)所示的化合物;
(4)将式(6)所示的化合物进行酯化,得到式(3)所示的化合物;以及
(5)在重排反应条件下,将式(3)所示的化合物与第二催化剂和碱性物质进行接触,得到式(1)所示的三酮类化合物。
优选地,在步骤(1)中,进行氰基化的条件包括:在氰基化催化剂存在下进行,回流反应3-48h。
在步骤(1)中,将式(2)所示的化合物进行氰基化的具体操作可以包括:将式(2)所示的化合物与氰基供体进行接触。所述氰基供体例如可以为氰化亚铜。
优选地,在步骤(2)中,进行羧酸化的条件包括:在羧酸化催化剂存在下进行,回流反应2-30h。
在步骤(2)中,将式(4)所示的化合物进行羧酸化的具体操作可以包括:将式(4)所示的化合物与羧基供体进行接触。所述羧基供体例如可以为:乙酸、甲酸等。
优选地,在步骤(3)中,进行酰氯化的条件包括:在酰氯化试剂存在下进行,反应温度为0-80℃,反应时间为0.5-24h。
在步骤(3)中,将式(5)所示的化合物进行酰氯化的具体操作可以包括:在例如二氯甲烷作为溶剂存在下,将式(5)所示的化合物与酰氯化物0-25℃条件下进行接触反应,然后向体系中加入DMF并升温以回流反应。所述酰氯化物例如可以为氯化亚砜。
优选地,在步骤(4)中,进行酯化的条件包括:反应温度为零下10℃至零上25℃,反应时间为0.2-12h。
在步骤(4)中,将式(6)所示的化合物进行酯化的具体操作可以包括:在溶剂(例如DCM)存在下,在碱性条件下,将式(6)所示的化合物与1,3-环己二酮进行接触反应。
优选地,在步骤(5)中,所述第二催化剂选自氰化钠、氰化钾、丙酮氰醇、三甲基氰硅烷、1,2,4-三氮唑和苯并1,2,4-三氮唑中的至少一种。
优选地,在步骤(5)中,所述碱性物质选自碳酸钾、碳酸钠、碳酸铯、三乙胺和吡啶中的至少一种。
优选地,在步骤(5)中,将式(3)所示的化合物与第二催化剂和碱性物质进行接触的条件包括:接触温度为5-50℃;接触时间为5-30h。
在本发明的第一方面和第二方面中,所述式(2)所示的化合物可以通过商购得到,也可以采用现有技术的合成方法合成得到。
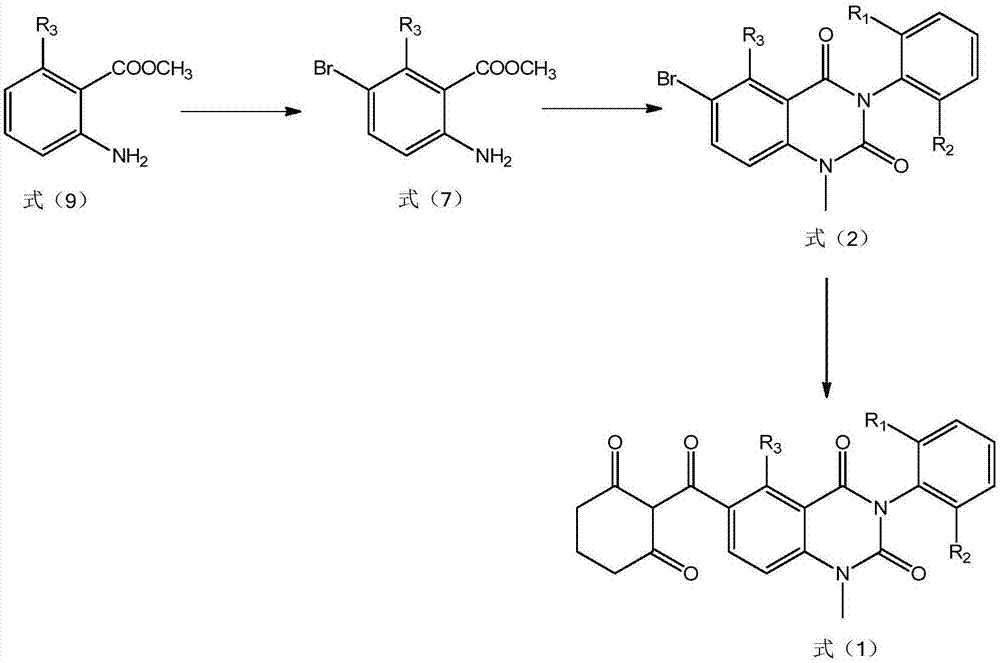
所述式(2)所示的化合物可以由式(7)所示的化合物(R3的定义如前所述)制备得到,具体地:在例如由吡啶等碱性物质形成的碱性环境中,将式(7)所示的化合物与由C1-6的烷基中的至少一种取代基取代的或未取代的苯基异氰酸酯进行第一接触反应,并将接触反应后得到的产物与硫酸二甲酯在由例如碳酸钾等碱性物质形成的碱性环境中进行第二接触反应。所述第一接触反应的条件可以包括:温度为50-150℃,时间为4-48h。所述第二接触反应的条件可以包括:温度为20-80℃,时间为2-48h。
所述式(4)所示的化合物也可以由式(8)所示的化合物(R3的定义如前所述)制备得到,具体地:在例如由吡啶等碱性物质形成的碱性环境中,将式(8)所示的化合物与由C1-6的烷基中的至少一种取代基取代的或未取代的苯基异氰酸酯进行第三接触反应,并将接触反应后得到的产物与硫酸二甲酯在由例如碳酸钾等碱性物质形成的碱性环境中进行第四接触反应。所述第三接触反应的条件可以包括:温度为50-150℃,时间为4-48h。所述第四接触反应的条件可以包括:温度为20-80℃,时间为2-48h。
并且,在本发明中,所述式(8)所示的化合物可以由式(7)所示的化合物进行氰基化而得到,具体地:在溶剂存在下,将式(7)所示的化合物与氰基供体例如氰化亚铜进行第五接触反应,所述第五接触反应的条件可以包括:温度为回流反应温度,时间为4-48h。
所述式(7)所示的化合物可以由式(9)所示的化合物制备得到,具体地:在有机溶剂例如四氯化碳存在下,将式(9)所示的化合物与溴素进行第六接触反应,所述第六接触反应的条件可以包括:温度为0-50℃,时间为3-400min。
根据一种优选的具体实施方式,本发明的所述式(5)所示的化合物可以由图1所示的合成路线制备得到,具体地,包括以下步骤:
(1)在由氢氧化钾等碱性物质形成的碱性环境下,将式(5-1)所示的化合物与高锰酸钾进行第七接触反应,随后将所得产物置于酸性环境中以得到式(5-2)所示的化合物,所述第七接触反应的条件包括:温度为50-150℃,时间为1-10h;
(2)在有机溶剂例如二氯甲烷的存在下,将式(5-2)所示的化合物与氯化亚砜进行第八接触反应,得到式(5-3)所示的化合物,所述第八接触反应的条件包括:温度为回流反应温度,时间为1-18h;
(3)在有机溶剂例如甲醇存在下,将式(5-3)所示的化合物与钯碳催化剂进行第九接触反应,得到式(5-4)所示的化合物,所述第九接触反应的条件包括:温度为0-80℃,时间为4-48h;
(4)在碱性物质例如吡啶存在下,将式(5-4)所示的化合物与由C1-6的烷基中的至少一种取代基取代的或未取代的苯基异氰酸酯进行第十接触反应,并将接触反应后得到的产物与碘甲烷在由例如碳酸钾等碱性物质形成的碱性环境中进行第十一接触反应,得到式(5-5)所示的化合物;所述第十接触反应的条件可以包括:温度为50-150℃,时间为4-48h;所述第十一接触反应的条件可以包括:温度为10-80℃,时间为2-48h;以及
(5)在溶剂例如水的存在下,以及在酸性物质例如浓硫酸存在下,将式(5-5)所示的化合物与羧基供体例如乙酸进行第十二接触反应;得到式(5)所示的化合物;所述第十二接触反应的条件可以包括:温度为60-200℃,时间为2-48h。
根据另一种优选的具体实施方式,本发明的三酮类化合物由图2所示的合成路线制备得到,具体地,包括以下步骤:
(1)在有机溶剂例如四氯化碳存在下,将式(9)所示的化合物与溴素进行第六接触反应,得到式(7)所示的化合物,所述第六接触反应的条件可以包括:温度为0-50℃,时间为3-400min;
(2)在例如由吡啶等碱性物质形成的碱性环境中,将式(7)所示的化合物与由C1-6的烷基中的至少一种取代基取代的或未取代的苯基异氰酸酯进行第一接触反应,并将接触反应后得到的产物与硫酸二甲酯在由例如碳酸钾等碱性物质形成的碱性环境中进行第二接触反应,得到式(2)所示的化合物;所述第一接触反应的条件可以包括:温度为50-150℃,时间为4-48h。所述第二接触反应的条件可以包括:温度为20-80℃,时间为2-48h;
(3)在碱性条件下,在第一催化剂存在下,将式(2)所示的化合物与1,3-环己二酮和CO进行反应,得到式(3)所示的产物;以及
(4)在重排反应条件下,将式(3)所示的产物与第二催化剂和碱性物质进行接触,得到式(1)所示的三酮类化合物。
根据第三种优选的具体实施方式,本发明的三酮类化合物由图3所示的合成路线制备得到,具体地,包括以下步骤:
(1)在有机溶剂例如四氯化碳存在下,将式(9)所示的化合物与溴素进行第六接触反应,得到式(7)所示的化合物,所述第六接触反应的条件可以包括:温度为0-50℃,时间为3-400min;
(2)在例如由吡啶等碱性物质形成的碱性环境中,将式(7)所示的化合物与由C1-6的烷基中的至少一种取代基取代的或未取代的苯基异氰酸酯进行第一接触反应,并将接触反应后得到的产物与硫酸二甲酯在由例如碳酸钾等碱性物质形成的碱性环境中进行第二接触反应,得到式(2)所示的化合物;所述第一接触反应的条件可以包括:温度为50-150℃,时间为4-48h。所述第二接触反应的条件可以包括:温度为20-80℃,时间为2-48h;
(3)将式(2)所示的化合物进行氰基化,得到式(4)所示的化合物;
(4)将式(4)所示的化合物进行羧酸化,得到式(5)所示的化合物;
(5)将式(5)所示的化合物进行酰氯化,得到式(6)所示的化合物;
(6)将式(6)所示的化合物进行酯化,得到式(3)所示的化合物;以及
(5)在重排反应条件下,将式(3)所示的化合物与第二催化剂和碱性物质进行接触,得到式(1)所示的三酮类化合物。
本发明的第一方面和第二方面涉及的反应中均可以采用本领域内常规使用的各种后处理方法对所得到的产物进行后处理。所述后处理的方法包括但不限于:萃取、重结晶、洗涤、干燥、过滤等。本发明在此不再赘述,并且实施例中涉及的后处理方法仅是用于示例性地列举,并不表示那是必须采用的操作,本领域技术人员可以采用常规的其它手段进行替代。
以下将通过实施例和制备例对本发明进行详细描述。
以下实施例和制备例中,在没有特别说明的情况下,使用的各种原料均来自商购。
制备例1:采用图1所示的路线合成式(5)所示的化合物,其中,R3为H,R1和R2为甲基
1、将水(500mL)加入到1000mL的四口烧瓶内,开启搅拌,用冰盐水将体系降温至5℃,再将氢氧化钾(553mmol)缓慢地加入到100mL的四口烧瓶内,加入完毕后,撤去冰盐水,再缓慢滴入2,4-二甲基硝基苯(3311mmol),滴加完毕后,将反应体系加热到90℃。待反应体系升到90℃后,在0.5h内分批将高锰酸钾(1659mmol)加入到四口烧瓶内,加入完毕后将反应体系在90℃保温3h,用HPLC跟踪反应。待反应完毕后趁热过滤并用500mL的热水(70℃)洗涤滤饼。将滤液降温至5℃,并向其内缓慢滴入浓盐酸(36重量%,100mL)。过滤,用500mL的水淋洗滤饼,将滤饼烘干,即得到白色固体,纯度为97.8%,收率为80%。
2、将二氯甲烷(500mL)、步骤1得到的产物(237mmol)加入到1L的四口烧瓶内,加料完毕后再用冰盐水将反应体系温度降至5℃,然后开始缓慢滴加氯化亚砜(1422mmol),待氯化亚砜滴加完毕继续搅拌10min,然后再缓慢滴加DMF(23.7mmol),滴加完毕后搅拌30min,然后缓慢地将反应体系加热至回流并保温6h,用HPLC跟踪反应。待反应完毕后将反应体系降到25℃再减压脱溶。用250mL二氯甲烷将脱溶后的反应液溶解并快速地滴加到0℃的甲醇(500mL)溶液中。滴加完毕后继续搅拌10min,用HPLC监控反应。待反应完毕后,脱溶,向脱溶后的反应液中加入200mL水和600mL乙酸乙酯,搅拌,分层。然后向有机相加入200mL水,并向其中加入碳酸氢钠使得pH调至中性,静置分层,用无水硫酸钠干燥有机相,脱溶,即得到白色固体,纯度为98.5%,其收率为85%。
3、将甲醇(400mL)、步骤2得到的产物(167.2mmol)加入到1000mL的单口瓶内。开启搅拌,向单口瓶内加入钯炭(10重量%)。排气完毕后通入氢气将反应体系缓慢升温到45℃保温过夜,用HPLC跟踪反应。待反应完毕后,趁热过滤反应液,滤饼用热的甲醇(50℃)洗涤并过滤。将滤液脱溶,待甲醇脱除至1/3时,向其内加入600mL的乙酸乙酯和200mL的饱和食盐水,搅拌,静置分层,用无水硫酸钠干燥有机相,脱溶,即得到白色固体,纯度为97.8%,收率为95.4%。
4、将吡啶(250mL),步骤3得到的产物(144mmol)加入到500mL的四口烧瓶内,开启搅拌,再加入2,6-二甲基苯基异氰酸酯(179mmol),加入完毕后将反应体系升温到100℃保温过夜,用HPLC跟踪反应。待反应完毕后,将反应液趁热倒入到1L的水中,并搅拌30min,过滤,滤饼用异丙醚100mL洗涤两次,将所得固体烘干,将所得固体(103.6mmol)以及DMF(350mLl)、碳酸钾(124mmol)加入到500mL的单口瓶内,加入完毕后开启搅拌,将反应体系加热到45℃并保温30min,然后开始滴加硫酸二甲酯(412mmol)。滴加完毕后继续搅拌保温24h,用HPLC跟踪反应。待反应完毕后将反应体系倒入500mL的冰水中并搅拌30min,过滤,用200mL的异丙醚洗涤滤饼,将滤饼烘干,即得到白色固体,纯度为97.5%,收率为60%。
5、将水(89mL)、冰醋酸(120mL)、步骤4得到的产物(59mmol)加入到500mL的四口烧瓶内,开启搅拌,并缓慢滴加浓硫酸(120mL),滴加完毕后将反应体系升温至回流并保温6h,用HPLC跟踪反应。待反应完毕后将反应液趁热倒入到500mL的冰水混合物中,搅拌30min,过滤,将滤饼用200mL的异丙醚洗涤两次,将所得固体烘干,即得到白色固体,纯度为97.5%,收率为90%。
制备例2:制备式(2)所示的化合物,且R1和R2为甲基,R3为H
1、将四氯化碳(100mL)和2-氨基苯甲酸甲酯(149mmol)加入到250mL的四口烧瓶内,开启搅拌,开始滴加溴素(156.45mmol),滴加完毕后取样用HPLC跟踪反应。待反应完毕后过滤反应液,滤饼用200mL异丙醚淋洗,烘干,即可得到黄色固体,纯度为96.5%,收率为90%。
2、将吡啶(250mL),步骤1得到的产物(144mmol)加入到500mL的四口烧瓶内,开启搅拌,再加入2,6-二甲基苯基异氰酸酯(179mmol),加入完毕后将反应体系升温到100℃保温过夜,用HPLC跟踪反应。待反应完毕后,将反应液趁热倒入到1L的水中,并搅拌30min,过滤,滤饼用异丙醚100mL洗涤两次,将所得固体烘干。然后将所得固体(116mmol)、DMF(400mL)、碳酸钾(139mmol)加入到1L的单口瓶内,加入完毕后开启搅拌,将反应体系加热到45℃并保温30min,保温30min后,开始缓慢地滴加硫酸二甲酯(464mmol)。滴加完毕后继续搅拌保温24h,用HPLC跟踪反应。待反应完毕后将反应体系倒入1L的冰水中并搅拌30min,过滤,用200mL的异丙醚洗涤滤饼,将滤饼放烘干,得到产品,纯度为96.8%,收率为72%。
制备例3:制备式(4)所示的化合物,且R1和R2为甲基,R3为H
将DMF(300mL)、2-氨基-5-溴苯甲酸甲酯(130.4mmol)加入到1000mL的单口瓶内,开启搅拌,再加入氰化亚铜(2260.8mmol)。加入完毕后将反应体系升温至回流并保温过夜,用HPLC跟踪反应。待反应完毕后先将反应液降到25℃,然后再向反应液内加入500mL的水搅拌30min,然后再向其内加入300mL的乙酸乙酯,搅拌完毕后过滤,将滤液静置分层,其水相用600mL的乙酸乙酯分别萃取三次,用无水硫酸钠干燥有机相,脱溶,即得到白色固体,纯度为95.6%,其收率为90%。
2、将吡啶(167mL),步骤1得到的产物(113.6mmol)加入到500mL的四口烧瓶内,开启搅拌,再加入2,6-二甲基苯基异氰酸酯(126.32mmol),加入完毕后将反应体系升温到100℃保温过夜,用HPLC跟踪反应。待反应完毕后,将反应液趁热倒入到1L的水中,并搅拌30min,过滤,滤饼用异丙醚100mL洗涤两次,将所得固体烘干。然后将所得固体(83mmol)、DMF(260mL)、碳酸钾(99.6mmol)加入到500mL的单口瓶内,加入完毕后开启搅拌,将反应体系加热到45℃并保温30min,然后开始缓慢地滴加硫酸二甲酯(332mmol),滴加完毕后继续搅拌保温24个小时,用HPLC跟踪反应。待反应完毕后将反应体系倒入500mL的冰水中并搅拌30min,过滤,用100mL的异丙醚洗涤滤饼,将滤饼烘干,即得产品,纯度为97%,收率为72%。
制备例4:制备式(2)所示的化合物,且R1和R3为甲基,R2为H
本制备例采用与制备例2相似的方法制备,所不同的是,本制备例中采用等摩尔量的2-氨基-6-甲基苯甲酸甲酯替换制备例2中的2-氨基苯甲酸甲酯,以及用等摩尔量的2-甲基苯基异氰酸酯替换制备例2中的2,6-二甲基苯基异氰酸酯。其余均与制备例2中相同,得到产品,纯度为96.5%,收率为73%。
实施例1:根据图2所示的反应式制备式(1)所示的三酮类化合物,R3为H,R1和R2为甲基
在二氧六环(400mL)中加入6-溴-3-(2,6-二甲基苯基)-1-甲基喹唑啉-2,4(1H,3H)-二酮(0.1mol)、1,3-环己二酮(0.12mol)、氯化钯(10mmol)、双(2-二苯基磷苯基)醚(11mmol)、三乙胺(0.35mol)、四丁基氯化铵(0.12mol),然后向反应体系中通入一氧化碳,控制压力为2MPa,加热至60℃反应5h。反应完毕,过滤,滤液加水后用乙酸乙酯萃取,有机相用25重量%的盐酸洗涤至中性后干燥有机相,浓缩得到化合物粗品。粗品不经纯化直接用于下一步反应。
将上述粗品40g加至乙腈(400mL)中,搅拌下加入三乙胺(0.15mol),丙酮氰醇(0.01mol)。反应体系在30℃搅拌反应15小时。反应完毕搅拌,用25重量%的盐酸酸化至pH=1。所得固体抽滤、水洗、用甲醇重结晶,即得浅黄色固体3-(2,6-二甲基苯基)-6-(2-羟基-6-氧代环己-1-烯羧基)-1-甲基喹唑啉-2,4(1H,3H)-二酮,纯度为99.8%,收率为96.0%。
实施例2:根据图2所示的反应式制备式(1)所示的三酮类化合物,R3为H,R1和R2为甲基
在二氧六环(400mL)中加入6-溴-3-(2,6-二甲基苯基)-1-甲基喹唑啉-2,4(1H,3H)-二酮(0.1mol)、1,3-环己二酮(0.12mol)、氯化钯(10mmol)、4,5-双二苯基膦-9,9-二甲基氧杂蒽(12mmol)、三乙胺(0.35mol)、四丁基氯化铵(0.12mol),然后向反应体系中通入一氧化碳,控制压力为1.6MPa,加热至80℃反应4h。反应完毕,过滤,滤液加水后用乙酸乙酯萃取,有机相用25重量%的盐酸洗涤至中性后干燥有机相,浓缩得到化合物粗品。粗品不经纯化直接用于下一步反应。
将上述粗品加至乙腈(400mL)中,搅拌下加入三乙胺(0.15mol),丙酮氰醇(0.01mol)。反应体系在30℃搅拌反应15小时。反应完毕搅拌,用25重量%的盐酸酸化至pH=1。所得固体抽滤、水洗、用甲醇重结晶,即得浅黄色固体3-(2,6-二甲基苯基)-6-(2-羟基-6-氧代环己-1-烯羧基)-1-甲基喹唑啉-2,4(1H,3H)-二酮,纯度为99.5%,收率为96.0%。
实施例3:根据图2所示的反应式制备式(1)所示的三酮类化合物,R3和R1为甲基,R2为H
在二氧六环(400mL)中加入5-甲基-6-溴-3-(2-甲基苯基)-1-甲基喹唑啉-2,4(1H,3H)-二酮(0.1mol)、1,3-环己二酮(0.12mol)、氯化钯(10mmol)、双(2-二苯基磷苯基)醚(14mmol)、三乙胺(0.35mol)、四丁基氯化铵(0.12mol),然后向反应体系中通入一氧化碳,控制压力为1.2MPa,加热至60℃反应5h。反应完毕,过滤,滤液加水后用乙酸乙酯萃取,有机相用25重量%的盐酸洗涤至中性后干燥有机相,浓缩得到粗品。粗品不经纯化直接用于下一步反应。
将上述粗品加至乙腈(400mL)中,搅拌下加入三乙胺(0.15mol),丙酮氰醇(0.01mol)。反应体系在30℃搅拌反应15小时。反应完毕搅拌,用25重量%的盐酸酸化至pH=1。所得固体抽滤、水洗、用甲醇重结晶,即得浅黄色固体3-(2,6-二甲基苯基)-6-(2-羟基-6-氧代环己-1-烯羧基)-1-甲基喹唑啉-2,4(1H,3H)-二酮,纯度为98.7%,收率为72%。
实施例4:根据图2所示的反应式制备式(1)所示的三酮类化合物,R3为H,R1和R2为甲基
本实施例采用与实施例1相同的方法进行,所不同的是,本实施例中,向反应体系中通入一氧化碳,控制压力为0.3MPa,其余均与实施例1中相同。
结果所得3-(2,6-二甲基苯基)-6-(2-羟基-6-氧代环己-1-烯羧基)-1-甲基喹唑啉-2,4(1H,3H)-二酮,纯度为67.6%,收率为96.0%。
实施例5:根据图2所示的反应式制备式(1)所示的三酮类化合物,R3为H,R1和R2为甲基
本实施例采用与实施例1相同的方法进行,所不同的是,本实施例中,双(2-二苯基磷苯基)醚的用量为25mmol,其余均与实施例1中相同。
结果所得3-(2,6-二甲基苯基)-6-(2-羟基-6-氧代环己-1-烯羧基)-1-甲基喹唑啉-2,4(1H,3H)-二酮,纯度为90.69%,收率为89.6%。
实施例6:根据图2所示的反应式制备式(1)所示的三酮类化合物,R3为H,R1和R2为甲基
本实施例采用与实施例1相同的方法进行,所不同的是,本实施例中,采用等摩尔量的PdCl2(PPh3)2替换实施例1中的氯化钯,其余均与实施例1中相同。
结果所得3-(2,6-二甲基苯基)-6-(2-羟基-6-氧代环己-1-烯羧基)-1-甲基喹唑啉-2,4(1H,3H)-二酮,纯度为90.69%,收率为68.9%。
实施例7:根据图3所示的反应式制备式(1)所示的三酮类化合物,R3为H,R1和R2为甲基
1、将DMF(300mL)、溴化物(83.6mmol)分别依次加入到1000mL的单口瓶内,开启搅拌,再加入称量好的氰化亚铜(167.1mmol)。加入完毕后将反应体系升温至回流并保温过夜,用HPLC跟踪反应。待反应完毕后先将反应液降到25℃,然后再向反应液内加入500mL的水,搅拌30分钟,然后再向其内加入300mL的乙酸乙酯,搅拌完毕后过滤,将滤液静置分层,其水相用600mL的乙酸乙酯分别萃取三次,用无水硫酸钠干燥有机相,脱溶,即得到白色固体,纯度为96.4%,收率为90%。
2、将冰醋酸(150mL)、水(620mL)、三氟甲磺酸(37mL)和步骤1得到的氰基物(146.6mmol)加入到1000mL的四口烧瓶内,开启搅拌,用冰盐水将反应体系降温至10℃左右,然后缓慢地滴加浓硫酸(500mL),浓硫酸滴加完毕后将反应体系缓慢地升温至回流并保温过夜,用HPLC跟踪反应。待反应完毕后冷却反应体系,将反应液倒入到1L的冰水中搅拌30min,过滤。用200mL的异丙醚洗涤滤饼,烘干,即得到灰色固体,纯度为97.8%,收率为70%。
3、将步骤2得到的产物(77mmol),以及二氯甲烷(300mL)加入到500mL的四口烧瓶内,将反应体系降温至5℃左右开始滴加氯化亚砜(231mmol),滴加完毕后继续搅拌10min。然后再滴加DMF(4mmol),滴加完毕继续搅拌30min,将反应体系升温至回流并保温6个小时,用HPLC跟踪反应。待反应完毕后将反应体系降温到25℃,脱溶,即得到棕色固体,纯度98.9%,收率为100%。
4、将1,3-环己二酮(85mmol),DCM(200mL)加入到500mL的单口瓶内,用冷盐水给反应体系降温至0℃并滴入三乙胺(155mmol),滴加完毕后继续低温搅拌1h,然后将含有50mL的二氯甲烷的前述步骤3制备得到的酰氯化物(77mmol)滴加到低温反应体系内,滴加时间控制在10min之内,滴加完毕后继续低温搅拌30min,用HPLC跟踪反应。待反应完毕后将反应体系分别用2mol/L的盐酸(30mL×2)洗涤、5重量%的碳酸钠溶液(60mL×2)洗涤,最后用饱和食盐水(30mL)洗涤。将所得有机层用无水硫酸钠干燥,脱溶,即得到白色固体,纯度为97.85%,收率为76%。
5、将步骤4得到的产物(48mmol),以及乙腈200mL依次加入到1000mL的四口烧瓶内,开启搅拌,然后将三乙胺(72mmol)、丙酮氰醇(0.48mmol)依次加入到反应体系内,加料完毕后在氮气的保护下将反应体系升温到30℃并保温12h,用HPLC跟踪反应。待反应完毕后在40℃下减压脱溶,脱干乙腈后向其内加入250mL的40℃的水,开启搅拌,再向其内加入三乙胺(100mmol),滴加完毕后将反应体系在40℃保温30min,然后过滤反应液,将所得滤液降温至5℃,边搅拌边向其内加入2mol/L的盐酸调节pH值为1。将所得固体过滤、水洗、用甲醇重结晶,即得到浅黄色固体,纯度为98.9%,收率为70%。
由前述结果可以看出,本发明的前述方法能够低成本且高收率地获得三酮类化合物。并且,由本发明的方法获得的三酮类化合物的纯度高。
以上详细描述了本发明的优选实施方式,但是,本发明并不限于上述实施方式中的具体细节,在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,这些简单变型均属于本发明的保护范围。
另外需要说明的是,在上述具体实施方式中所描述的各个具体技术特征,在不矛盾的情况下,可以通过任何合适的方式进行组合,为了避免不必要的重复,本发明对各种可能的组合方式不再另行说明。
此外,本发明的各种不同的实施方式之间也可以进行任意组合,只要其不违背本发明的思想,其同样应当视为本发明所公开的内容。
- 还没有人留言评论。精彩留言会获得点赞!