固体脂质磁共振纳米粒子及其制备方法和应用与流程
本发明涉及负载磁共振对比剂钆喷酸葡胺的固体脂质纳米粒载体的制备和优化及其体外药物释放行为、细胞药效学研究、体外MRI检测。
背景技术:
相较于传统的影像学检查方法如CT、PET、X射线等,MRI具有较高空间分辨率、良好的软组织对比度、无电离辐射,且在一定程度上可以显示生理学和解剖学细节的优越性。但临床实践中发现良、恶性肿瘤组织之间,肿瘤组织与正常组织之间,弛豫时间T1、T2会互相重叠,信号强度相差不大,因此有必要应用MR对比剂,提高组织间的图像对比,继而提高MRI诊断的敏感性与特异性。应用于临床的MRI造影剂需要满足条件有:(1)良好水溶性;(2)选择性滞留在被检测部位;(3)弛豫效能高;(4)毒性低。其在消化道应用有两种方法,第一种是通过对比剂口服(MR小肠成像)和灌肠(MR大肠成像)方法,此方法小病灶检出率低、且易于肠内容物混淆而不易辨别;第二种是通过静脉注射对比剂,通过病变与正常肠壁的强化差异显示病变,此种方法虽检出效果高于前者,但是无靶向特异性。
目前应用较为广泛的造影剂是钆喷酸葡胺(Gd-DTPA),它本身不能被肠道吸收且不产生信号,需要通过影响体内局部组织的水质子弛豫时间与周围组织形成对比产生造影作用。而大肠与小肠较强的吸收功能可使很多药物通过肠道吸收进入体内,因此设计一个易被肠道吸收的载体包载Gd-DTPA,促进肠壁对Gd-DTPA的吸收并缩短T1弛豫时间、增强MRI信号具有重要的意义。
固体脂质纳米粒(solid lipid nanoparticles,SLN)是由甘油三酯、复合甘油酯等天然或合成的脂质材料制备,粒径在50-1000nm之间。SLN具有较高的口服利用度、可降低药物的肾毒性,此外具有良好稳定性、毒性低、包载药物稳定、低毒、可大规模生产等优点,因此固体脂质纳米粒被认为 是口服药物的理想载体。常见Gd-DTPA载入SLN的方法有溶剂扩散法、乳化法、高压乳匀法等,前期的工作中采用溶剂扩散法包载Gd-DTPA,包封率达到55%,但是在释放实验中发生短时间突释效应,原因在于钆喷酸葡胺是一种亲水性药物,与由脂质材料构成的SLN亲和力弱。
技术实现要素:
本发明提供了一种固体脂质磁共振纳米粒子及其制备方法和应用,该固体脂质磁共振纳米粒子克服了现有的磁共振对比剂中Gd-DTPA释放速度过快的现象。
一种固体脂质磁共振纳米粒子的制备方法,包括以下步骤:
(1)将吐温-80溶于水中得到水相,将司盘-80溶于有机溶剂中得到有机相,然后将水相加入到有机相中,超声处理得到微乳液;
(2)将钆喷酸葡胺溶解于水中得到水溶液,将十八胺溶解于乙醇中得到乙醇溶液,然后将水溶液和乙醇溶液复合后除去溶剂得到中间产物;
(3)将步骤(2)得到的中间产物分散到含有脂质材料的溶液中,然后加热条件下注入到步骤(1)得到的微乳液中,经过搅拌、离心和冷冻干燥得到所述的固体脂质磁共振纳米粒子。
在现有的纳米粒制备过程中,由于脂质材料具有两亲性,当包载水溶性的顺磁性对比剂钆喷酸葡胺时对药物的包封率不高并且会产生药物的突释现象。本发明采用微乳液溶剂扩散法制备固体脂质磁共振纳米粒子,首先通过十八胺与Gd-DTPA复合,加入亚微乳,再进行冷冻干燥,提高了固体脂质磁共振纳米粒子中水溶性药物的包载效率,并且有效地避免了突释现象。
作为优选,步骤(1)中,所述的吐温-80与水的用量比为1.8~2.5g:100mL;
所述的司盘-80与有机溶剂的用量比为1.5~2.0g:100mL。
步骤(1)中,所述的有机溶剂为室温下与水互不混溶的溶剂,例如烃类溶剂或酯类溶剂,作为优选,步骤(1)中,所述的有机溶剂为正戊烷、正己烷和环己烷中的至少一种。
作为优选,步骤(2)中,所述的水溶液中钆喷酸葡胺的质量百分比浓度为7.8%;
所述的乙醇溶液,溶液中十八胺的质量百分比浓度为0.6%;
复合的温度为60℃,复合的时间为30min。
作为优选,步骤(3)中,所述的脂质材料选用单硬脂酸甘油酯、卵磷脂、硬脂酸、三硬脂酸甘油酯中的一种或多种组合;
负载钆喷酸葡胺的载药量为4%~35%(质量百分比浓度),优选为25%~27.5%。作为进一步的优选,步骤(3)中,所述的脂质材料由重量比为85~95:5~15的单硬脂酸甘油酯和卵磷脂组成。
步骤(3)中,用于溶解脂质材料的溶剂的亲和力小于水的亲和力,作为优选,所选用的溶剂为正戊烷、正己烷和环己烷中的至少一种。
步骤(3)中,冷冻干燥时加入海藻糖作为冻干保护剂,以海藻糖为冻干保护剂可以延长固体脂质纳米粒对Gd-DTPA的释放时间。
本发明还提供了一种固体脂质磁共振纳米粒子,由所述的制备方法制备得到。得到的固体脂质磁共振纳米粒子的粒径为100-300nm。
本发明还提供了一种所述的固体脂质磁共振纳米粒子在MRI检测领域中的应用。本发明还提高了负载磁共振对比剂Gd-DTPA的固体脂质纳米粒在体外药效学应用。通过上述步骤方案制备的固体脂质纳米粒设置不同浓度组测得材料与药物对乳腺癌细胞MCF-7的IC50值均较处方改进前降低,材料的IC50值为183.2814ug/ml,计算药物的IC50值为45.82ug/ml。此外,当固体脂质纳米粒的浓度在0.5mg/ml时,在磁共振成像呈现检测信号。
本发明中,钆喷酸葡胺、十八胺、卵磷脂和单硬脂酸甘油酯的最优质量比为32.8:10:5.2:47.2,此时,得到的纳米粒子中钆喷酸葡胺负载量达到或接近质量百分比39%。
同现有技术相比,本发明的固体脂质磁共振纳米粒子不仅可以解决药物的突释问题,而且体外药效学试验结果表明,细胞存活率高,毒性小;同时体外核磁共振试验结果表明,检测效果进一步提高。
附图说明
图1A为实施例1中制备的负载Gd-DTPA脂质纳米粒的透射电镜图片,放大倍数为100000倍,左:SLN-1改进前处方,右:SLN-2改进后处方;图1B为SLN-2的粒径分析图。
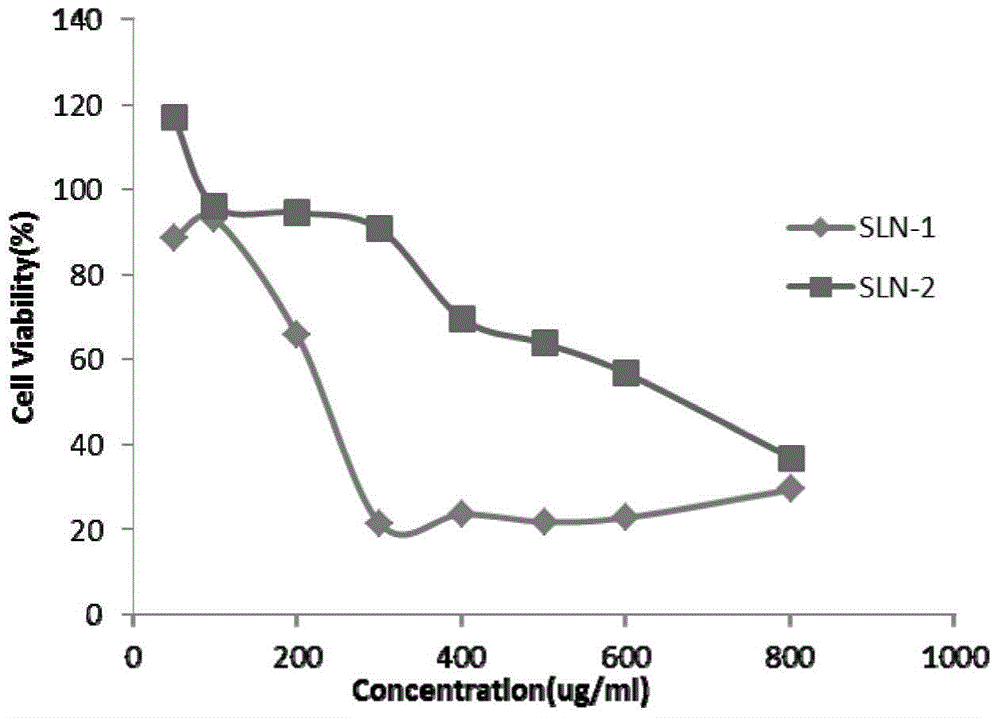
图2为实施例4中以MCF-7作为模型细胞,负载Gd-DTPA的脂质纳米粒的细胞毒性分析图,SLN-1、2分别为改进前、后处方。
图3为实施例3中SLN包载Gd-DTPA随时间释放曲线,SLN-1、2分别指改进前、后处方。
图4A为实施例4中以MCF-7作为模型细胞,负载Gd-DTPA的脂质纳米粒SLN-2的细胞摄取-时间依赖性荧光图片;图4B为SLN-2细胞摄取-浓度依赖性荧光图片。
图5为实施例4中细胞摄取-浓度依赖性流式图片,5A为SLN-1改进前处方,5B为SLN-2改进后处方。
图6为实施例5中MRI检测负载Gd-DTPA的脂质纳米粒SLN-2磁共振响应灵敏性,1-6号为SLN浓度分别为0mg/mL、2mg/mL、4mg/mL、6mg/mL、8mg/mL、12mg/mL,7号为Gd-DTPA 2mg/mL。
具体实施方式
实施例1:负载Gd-DTPA的固体脂质纳米粒的制备
(1)首先称取54mg吐温-80溶于3ml水,组成水相,600mg司盘-80溶于30ml正己烷,组成有机相,在400rpm的室温搅拌条件下,将水相加入有机相,探头超声制得亚微乳;
(2)然后称取62.6mg钆喷酸葡胺溶解于水中得到水溶液,将18mg十八胺溶解在3ml乙醇中得到乙醇溶液,然后将两者于60℃下复合30min,并于60℃真空旋蒸除去溶剂得到中间产物;
(3)步骤(2)制备的中间产物加入3ml乙醇、90mg单甘脂和10mg卵磷脂混合物,60℃加热条件下注入步骤(1)制备的亚微乳液中,室温搅拌5min;之后于20000rpm离心20min,正己烷离心沉淀2次,终加入250mg海藻糖作为冻干保护剂进行冷冻干燥,从而得到固体脂质纳米粒。
实施例2:负载Gd-DTPA的固体脂质纳米粒的理化性质考察
取上述制备的固体脂质纳米粒,以超纯水作为复溶剂,以0.01mg/ml浓度,使用3000HS粒度及表面电位分析仪测定其粒径。
采用间接法测定固体脂质纳米粒中Gd-DTPA的包封率。荧光分光光度法(Ex=495nm,Em=514nm,Slit=5nm)测定荧光值,计算溶液中游离 Gd-DTPA的量,按(1)式计算荧光嫁接物包封率:
Gd-DTPA包封率=(Wo-W游离)/Wo*100% (1)
Gd-DTPA载药量按照(2)式计算:
Gd-DTPA载药量=(加入药物*包封率)/(加入药物*包封率+载体材料用量)*100%
图1为处方负载Gd-DTPA的固体脂质纳米粒的透射电镜图片。
Gd-DTPA是一种水溶性极好的钆离子螯合物,采用一般的溶剂扩散法制备固体脂质纳米粒,由于药物与脂质材料的亲脂性弱而极易向水中渗漏,很难将其有效地包裹于脂质纳米粒中;而采用本发明提供的方法,通过控制十八胺与Gd-DTPA的投料比,以提高脂质材料与药物的亲和力,增加SLN的水溶性,延长药物的释放时间,降低细胞毒性,同时可以增强体外MRI检测的灵敏性。
实施例3:负载Gd-DTPA的固体脂质纳米粒的体外药物释放行为研究
分别移取一定体积的SLN溶液,置于透析袋(MWCO 3.5KDa)后放入装有25ml释放介质(pH 7.2PBS)的释放管中。在37℃、65rpm恒温震荡下进行体外释放,在特定时间点(0.5h,1h,2h,4h,6h,8h,12h,24h,36h,48h及72h)取样,同时更换全部释放介质。用荧光分光光度法测定样品中的药物浓度(Ex=275nm,Em=313nm,狭缝=5nm,工作电压=700V),计算药物的累计释放累积释放量及累计释放百分率。结果如图3所示。
实施例4:负载Gd-DTPA的固体脂质纳米粒的体外药效学考察
采用噻唑兰法(MTT)定量考察固体脂质纳米粒对MCF-7细胞的细胞毒性。首先,按照0.8-1×104个数/mL细胞液的细胞密度转96孔细胞板,置于37℃5%细胞培养箱里培养过夜。其次,配制一系列不同浓度的聚合物溶液,每孔加入聚合物溶液的体积是200μL,平行5个复孔,稀释介质是无酚红DMEM高糖培养基,所需考察聚合物的浓度依次为0,50,100,200,400,500,600,800,单位是μg/mL。接着,从培养箱中取出96孔细胞板,吸去培养液,每孔用100μL PBS缓冲溶液冲洗一次,再吸去磷酸盐缓冲溶液,将一系列不同浓度的聚合物溶液依次加入到细胞板中,置于37℃5%细胞培养箱里培养48小时。然后,从培养箱中取出96 孔细胞板,每孔加入20μLCCK-8,再继续放入培养箱中孵育1-3h后取出细胞板,使用多功能酶标仪测定样品在490nm处的吸光度值。每个样品平行测试5次,取平均值作图(空白作为对照组)。细胞存活率(百分比)是以待测样的吸光度值相比正常细胞的吸光度值来表示。
FITC标记SLN,Hoechst 33342染色细胞核。首先,按照5×104个/mL细胞液的细胞密度转24孔细胞板,置于37℃5%细胞培养箱里培养过夜。其次,分别按照不同时间点0.5h、1h、4h、8h、12h、24h加至每孔;以及不同浓度50ug/ml、100ug/ml、150ug/ml、200ug/ml、300ug/ml加至每孔并在摄取4h收集细胞,流式细胞计数仪比较SLN-1与SLN-2的摄取差异,结果如图4、5所示,载体从0.5h开始便有摄取,并且随着时间点的延长摄取随之增加;浓度依赖性摄取实验中对于不同浓度SLN-2的细胞摄取量多于SLN-1。
实施例5:负载Gd-DTPA的固体脂质纳米粒的体外MRI检测
设置系列不同浓度载有Gd-DTPA的SLN,置于温度20℃,场强3.0T。TR500,ER15的磁场强度下,同时以水和Gd-DTPA作为阴性和阳性对照,得到的结果如图6所示。
- 还没有人留言评论。精彩留言会获得点赞!