改性寡核苷酸及其制备方法与流程
本发明涉及具有改性磷酸基团的核苷酸和寡核苷酸,以及它们的制造方法。
背景技术:
核酸衍生物,例如附加有各种额外功能的寡核苷酸在生命科学中被广泛用作研究工具,具体而言,它们被认为是有前景的疗法[1]和用于分子诊断的灵敏探针[2]。一些寡核苷酸疗法已经受到FDA批准用于临床。实例包括抗病毒试剂福米韦生(Fomivirsen,ISIS 2922)[3]、抗血管生成适体哌加他尼钠(Pegaptanib sodium)[4]和抗胆固醇缺口聚物(gapmer)米泊美生(Mipomersen)(Kynamro,ISIS 301012)[5]。一些其它寡核苷酸候选物,如siRNA、DNA酶和反吗啉类似物(PMO)目前正处于临床试验的各个阶段。
若要被认为是潜在疗法,则寡核苷酸应当满足以下要求。
1.与它们的生物标靶(通常为细胞RNA)的互补配合物具有足够的稳定性和序列特异性。
2.在生物介质如血清中提高的抗性。
3.有利的物理化学性质,如水溶解性和化学稳定性。
4.经济有效的合成和可接受的价格。
5.优选在不使用外传染剂的情况下具有充分的细胞摄取和体内递送。
根据作用机制,寡核苷酸类似物实际上可以干预遗传信息传递的任何阶段:从DNA到RNA(转录)或从RNA到蛋白质(转译)。通过用三链体形式的寡核苷酸(TFOs)[6]特别是肽核酸(PNAs)[7]结合基因组DNA来进行转录的抑制。转译的抑制(反义机制)通过mRNA阻断来实现[8]。迄今已知的大多数寡核苷酸类似物通过反义机制起作用。那些是小的干预RNA(siRNA)[9],核酸酶(核酶或脱氧核酶)[10],以及大部分化学改性寡核苷酸类似物[11]。特定的寡核苷酸衍生物如适体也能够通过直接与蛋白质或小分子辅因子结合来阻断蛋白质功能[12]。
大部分反义寡核苷酸类似物结合mRNA并通过立体阻挡来抑制转译[13]。它们包括在糖部分具有修饰的大部分类似物,例如2’-氟[14],2’-O-甲基[15],2’-O-β-甲氧基乙基(2’-MOE)[16]或锁核酸(LNA)[17]衍生物。用不带电基团取代阴离子性核苷间磷酸酯基团如甲基膦酸酯[18]、磷酸三酯[19]或氨基磷酸酯[20]的寡核苷酸类似物也通过立体阻挡来起作用。远端和酸模拟物如PNA[21]或磷酰二胺吗啉代寡核苷酸(PMO)[22]的作用中也涉及相同的反义机制。
其它兴趣也关注这些类似物,其能够通过催化RNA发生水解来不可逆地使RNA失活,例如通过用2’-脱氧硫代磷酸酯[23],аrа-2’-氟衍生物(2’-FANA)[24]或缺口聚物[24]来吸附细胞酶RNase H。SiRNA通过激活具有核糖核酸活性的RISC复合物来诱导mRNA的催化裂解[25],其中核酸酶(核酶或脱氧核酶)不需要针对它们催化RNA裂解作用的蛋白质[27]。
许多寡核苷酸类似物已经修饰了核苷间磷酸酯基团。它们中有硫代磷酸酯[28]、二硫代磷酸酯[29]和borano磷酸酯[30]。这些衍生物的一个正面特点是它们相对低的成本,因为使用天然2’-脱氧核糖核苷酸和高效固态DNA磷酸酰二胺化学[31]。磷酸酯改性的类似物包含不对称磷原子并且通常以n聚体寡核苷酸的2n-1种非对映异构体的混合物的形式获得。不同的非对映异构体通常具有不同的RNA亲和性和酶耐性,这对于潜在的反义作用是至关重要的。
目前,特别优先的任务是开发具有充分细胞摄取和体内递送的寡核苷酸类似物,优选不存在外部递送试剂如阳离子脂质体、聚合物或纳米颗粒。这里,具有降低或完全消除负电荷的寡核苷酸类似物可能特别受关注[32]。其中有用电中性氨基磷酸酯基取代阴离子磷酸酯的寡核苷磷酸酯。氨基磷酸酯的化学合成相对简单。但是,这些类似物显示出降低的RNA亲和性[33]并且对酸性水解敏感[34]。N3’→P5’氨基磷酸酯已经提高了RNA结合,但是难以合成[35]。那些在侧链具有正电基团的代表更加容易靠近并且具有优异的酶活性,但是它们的RNA亲和性较低[36]。与此同时,大部分已知的氨基磷酸酯衍生物包含有用的反义试剂如吗啉(PMOs)[37]在酸性pH下显示出某种程度的不稳定性。需要提高酸稳定性来防止寡核苷酸类似物在内体内部降解。
在过去二十年中,已经出现了新型膦酸酯寡核苷酸类似物,其用可离子化的膦酸酯基取代天然磷酸酯。它们中有膦酰基乙酸酯和硫代膦酰基乙酸酯[38]、膦酰基甲酸酯[39]和1,2,3-三唑-4-基膦酸酯[40]。这些化合物显示出提高的生物抗性和适当的RNA结合,并且,它们支持RNase H裂解并且即使没有转染试剂也具有提高的细胞摄取。但是,它们的化学合成困难且昂贵。
还报道了至少曾经含有P=N-Acc结构的改性核苷酸和寡核苷酸,其中Acc为电子受体[41]。合适的Acc的例子有–CN、-SO2R和缺电子的六元N+杂环,在所述杂环中至少一个氮是烷基化的并且在邻位或对位。
目前,磷酸二酰胺吗啉代寡核苷酸(PMO)受到很多关注,其是已知的反义试剂[42]。它们可以从GeneTools LLC公司购得。人们积极地探索PMO作为Sarepta疗法的潜在治疗药物(2012 AVI Biopharma)。在2013年,该公司宣布成功完成了PMO药物Eteplirsen(AVI-4658)治疗杜氏肌营养不良(DMD)的阶段III临床试验,该临床试验修正了抗肌萎缩蛋白前体mRNA的异常剪接[43]。在2014年初Sarepta Therapeutics声称他们的吗啉代候选药物AVI-7288已经成功通过了针对含RNA的病毒引起的致命的马尔堡出血热的阶段I临床试验[44]。
然而,吗啉与其它氨基磷酸酯一样是酸敏感性的[45]。此外,它们的合成建立在P(V)化学反应的基础上[46]。该化学反应可能导致副反应,例如鸟嘌呤中发生O6的改性[47]。该副反应可以通过O6位上的保护基团来防止[48],但是这需要特殊的G单体,这增加了PMO合成的成本。该化学反应的另一个缺点是其与通常的亚磷酰胺方法不匹配并且不能使用可从通常供应商如Glen Research,Inc公司获得的改性和标记试剂。
PMO的另一个严重缺陷是难以对它们进行化学改性来获得用于结构-活性研究的各种衍生物。仅报道了若干针对PMO的侧链修饰,声称增强了它们的细胞摄取和疗效[49]。
吗啉通常显示相对差的细胞摄取因此为了看到良好的疗效需要高度重复的给药。PMO-肽结合对的细胞摄取远高于裸PMO,因此在体内试验中需要低得多的剂量[50]。需要获得更好的寡核苷酸类似物,在没有递送助剂的情况下显示更高水平的细胞和组织递送以及提高的治疗效果。
因此,新型寡核苷酸类似物的开发仍是一项重要任务。
技术实现要素:
本发明是基于本发明人对寡核苷酸疗法的具有提高的细胞摄取的可能候选药物的发现。具体而言,本发明基于以下针对这种新型寡核苷酸疗法的合适方法/特征的方面:
1.用中性或带正电的基团取代天然阴离子性磷酸酯。
2.满足以上列出的潜在寡核苷酸治疗药物的要求。
3.优选地保留常规的核苷酸骨架。
4.显示充分的化学稳定性。
5.具有允许加入多种侧链基团的结构柔性。
6.具有低毒性。
本文公开了新型寡核苷酸类似物,其对应于以上要求并且可能潜在地显示提高的细胞摄取。广泛地讲,这些寡核苷酸类似物归类为磷酰亚胺及其类似物,例如,磷酰基胍、磷酰基脒、磷酰基异脲、磷酰基异硫脲、磷酰亚胺酸酯、磷酰基硫代亚胺酸酯及其类似物。
因此,本发明的一个方面涉及一种核苷酸或寡核苷酸,包含磷酰基胍(FI)、磷酰基脒(FII)、磷酰基异脲(FIII)、磷酰基异硫脲(FIV)、磷酰亚胺酸酯(FV)或磷酰基硫代亚胺酸酯(FVI),例如磷酰基胍(FI)、磷酰基脒(FII)、磷酰基异脲(FIII)、磷酰基异硫脲(FIV)。应当理解,本发明还涉及这些部分的改性磷酸酯形式;即,磷原子周围的一个或多个氧原子被例如硫原子、硒原子、亚胺基或硼烷取代的磷酸酯。
例如,本发明特别涉及一种核苷酸或寡核苷酸及其类似物,包含以下模体中的一种或多种:
其中表示取代基结合点。
这些改性的磷酸酯基团因其物理化学性质而受到很大关注。不受限于任何具体理论,本发明人相信,这些部分在生理pH下可以是电中性的、带负电或带正电,这使得它们在合成用于治疗、诊断和研究应用的核苷酸和寡核苷酸方面受到很大关注。
此外,本发明人发现,通过使用本文所描述的方法可以方便地将这些改性的磷酸酯基团结合到寡核苷酸结构中,并且这些改性的磷酸酯基团可以与许多已知且生物学上受关注的改性和/或标记的寡核苷酸模体和序列相兼容。
例如,所述模体可以是:
其中:
R1选自
-NR1AR1B、-OR3、-SR3、-H、-S(O)H、-S(O)R3、-S(O)2H、-S(O)2R3、-S(O)2NH2、-S(O)2NHR3、-S(O)2NR32、-C1-10烷基、-C2-10烯基、-C2-10炔基、-C6-10芳基或-C5-10杂环基;
R2选自-H、-NR2AR2B、-OR3、-SR3、卤素、-CN、-S(O)H、-S(O)R3、-S(O)2H、-S(O)2R3、-S(O)2NH2、-S(O)2NHR3、-S(O)2NR32、-C1-10烷基、C2-10烯基、C2-10炔基、-C6-10芳基或-C5-10杂芳基;
其中每个R1A、R1B、R2A和R2B独立地选自-H、-C1-10烷基,-C2-10烯基,-C2-10炔基、-C6-10芳基或-C5-10杂芳基;
任选地,其中R1A和R2A一起形成2-4个原子长度的亚烷基或杂亚烷基链;
任选地,其中R1A和R1B与它们所结合的原子一起形成5-8元杂环;
任选地,其中R2A和R2B与它们所结合的原子一起形成5-8元杂环;R3选自-C1-10烷基、-C2-10烯基、-C2-10炔基、-C6-10芳基或-C5-10杂芳基;
其中每个烷基、烯基、炔基、芳基、杂芳基、亚烷基或杂亚烷基任选地被取代。
因此,在第一方面,本发明可以提供一种式(I)的化合物:
其中Z选自-O-、-S-、-Se-、-N-RN或-BH3-,其中RN为H、C1-4烷基或保护基团;
X选自核苷、核苷类似物、寡核苷酸或寡核苷酸类似物的5’端,且Y选自核苷、核苷类似物、寡核苷酸或寡核苷酸类似物的3’端、-H、-OH、-SH、NHRN、-O-PG或S-PG,其中PG为保护基团;连接基、单磷酸酯、二磷酸酯或标记或淬灭剂;
或者
Y选自核苷、核苷类似物、寡核苷酸或寡核苷酸类似物的3’端,且X选自核苷、核苷类似物、寡核苷酸或寡核苷酸类似物的5’端、-H、-OH、-SH、NHRN、-O-PG或S-PG,其中PG为保护基团;连接基、单磷酸酯或二磷酸酯或标记或淬灭剂;
R1选自
-NR1AR1B、-OR3、-SR3、-H、-S(O)H、-S(O)R3、-S(O)2H、-S(O)2R3、-S(O)2NH2、-S(O)2NHR3、-S(O)2NR32、-C1-10烷基、-C2-10烯基、-C2-10炔基、-C6-10芳基或-C5-10杂芳基;
R2选自-H、-NR2AR2B、-OR3、-SR3、卤素、-CN、-S(O)H、-S(O)R3、-S(O)2H、-S(O)2R3、-S(O)2NH2、-S(O)2NHR3、-S(O)2NR32、-C1-10烷基、C2-10烯基、C2-10炔基、-C6-10芳基或-C5-10杂芳基;
其中R1A、R1B、R2A和R2B独立地选自-H、-C1-10烷基、-C2-10烯基、-C2-10炔基、-C6-10芳基或-C5-10杂芳基;
任选地,其中R1A和R2A一起形成2-4个原子长度的亚烷基或杂亚烷基链;
任选地,其中R1A和R1B与它们所结合的原子一起形成5-8元杂环;
任选地,其中R2A和R2B与它们所结合的原子一起形成5-8元杂环;R3选自-C1-10烷基、-C2-10烯基、-C2-10炔基、-C6-10芳基或-C5-10杂芳基;
其中,每个烷基、芳基、杂芳基,亚烷基或杂亚烷基任选地被取代。
在一些实施方式中,R1选自-NR1AR1B、-OR3和-SR3。在一些实施方式中,R1为-NR1AR1B。
因此,该化合物可以是式(Ia)的化合物,其中,X、Y、Z、R1A、R1B和R2如本文中所定义的那样。
该化合物可以是“改性的”核苷酸、“改性的”寡核苷酸或“改性的”核苷三磷酸酯。应当理解,在本文中术语“改性的”是指引入了式(I)所述的改性磷酸酯部分,即包含式(FVII)所述的模体的磷酸酯。
核苷三磷酸酯是包含键合有三个磷酸酯基团的核苷的分子。应当理解,在本文中,术语磷酸酯包括本文所定义的改性磷酸酯。适当地,该核苷三磷酸酯具有三个磷酸酯串联连接在一起的三磷酸酯基团;即,该分子可以是dNTP或类似物。在其它实施方式中,核苷可以在5’位和3’位都具有磷酸酯,例如,在5’位具有单磷酸酯且在3’位具有二磷酸酯(两个磷酸酯连接在一起)。应当理解,这些磷酸酯基中的任一个或全部可以是本文所述的改性的磷酸酯。
当该化合物为寡核苷酸时,应当理解,每个进一步的核苷其本身可以独立地使核苷类似物,另外,每个进一步的磷酸酯基(如果存在的话)其自身可以是改性的。
在一些实施方式中,R2选自-H、-NR2AR2B、-OR3、-SR3、-S(O)H、-S(O)R3、-S(O)2H、-S(O)2R3、-S(O)2NH2、-S(O)2NHR3、-S(O)2NR32、-C1-10烷基、-C2-10烯基、-C2-10炔基、-C6-10芳基或-C5-10杂芳基,其中每个烷基、芳基、杂芳基、亚烷基或杂亚烷基任选地被取代。
在一些实施方式中,R2为-H、-NR2AR2B、-OR3、-SR3、-C1-10烷基、C2-10烯基、C2-10炔基、-C6-10芳基或-C5-10杂芳基,其中每个烷基、芳基、杂芳基、亚烷基或杂亚烷基任选地被取代。
在一些实施方式中,R2为-H、-NR2AR2B或-OR3。例如,该化合物可以含有膦酰基甲脒(P-N=CHNR1AR1B)基团、磷酰基胍(P-N=C(NR1AR1B)(NR2AR2B))或磷酰基异脲(P-N=C(NR1AR1B)OR3)基团。
在一些实施方式中,R3为C1-4烷基,优选为甲基。
在一些实施方式中,R1A独立地选自-H和-C1-4烷基,该-C1-4烷基任选地被选自–F、-Cl、-Br、-I、-OH、-C1-4烷氧基、-NH2、-NH(C1-4烷基)和-N(C1-4烷基)2中的一个或多个取代基取代,R1A优选选自-H和-C1-4烷基,更优选选自-H和甲基。
在一些实施方式中,R1B独立地选自-H和-C1-4烷基,该-C1-4烷基任选地被选自-F、-Cl、-Br、-I、-OH、-C1-4烷氧基、-NH2、-NH(C1-4烷基)和-N(C1-4烷基)2中的一个或多个取代基取代;R1B优选选自-H和-C1-4烷基,更优选选自–H和甲基。
在一些实施方式中,R2A独立地选自-H和-C1-4烷基,该-C1-4烷基任选地被选自-F、-Cl、-Br、-I、-OH、-C1-4烷氧基、-NH2、-NH(C1-4烷基)和-N(C1-4烷基)2中的一个或多个取代基取代;R2A优选选自-H和-C1-4烷基,更优选选自–H和甲基。
在一些实施方式中,R2B独立地选自-H和-C1-4烷基,该-C1-4烷基任选地被选自-F、-Cl、-OH、-C1-4烷氧基、-NH2、-NH(C1-4烷基)和-N(C1-4烷基)2中的一个或多个取代基取代,R2B优选选自-H和-C1-4烷基,更优选选自–H和甲基。
在一些实施方式中,每个R1A、R1B、R2A和R2B独立地选自-H和-C1-4烷基,该-C1-4烷基任选地被选自-F、-Cl、-Br、-I、-OH、-C1-4烷氧基、-NH2、-NH(C1-4烷基)和-N(C1-4烷基)2中的一个或多个取代基取代;优选每个R1A、R1B、R2A和R2B独立地选自-H和-C1-4烷基,该-C1-4烷基任选地被选自-F,-Cl,-OH和-NH2中的一个或多个取代基取代,更优选每个R1A、R1B、R2A和R2B独立地选自-H和-C1-4烷基,更优选选自–H和甲基。
在一些实施方式中,R2为-NR2AR2B,优选为-NMe2。
在一些实施方式中,R1为–NH2或-NMe2。
在一些实施方式中,R1A和R2A一起形成2-4个原子长度的亚烷基或杂亚烷基链并且R1B和R2B各自独立地选自-H和-C1-4烷基。在一些实施方式中,R1A和R2A一起形成-CH2-CH2-。在一些实施方式中,R1A和R2A一起形成-CH2-CH2-且R1B和R2B为–H或甲基。
在一些实施方式中,R1A和R1B与它们所结合的原子一起形成5-8元杂环,优选形成吡咯烷、哌啶、哌嗪或吗啉。适当地,它们与它们所结合的原子一起形成5元杂环,优选形成吡咯烷。
在一些实施方式中,R2A和R2B与它们所结合的原子一起形成5-8元杂环,优选形成吡咯烷、哌啶、哌嗪或吗啉。适当地,它们与它们所结合的原子一起形成5元杂环,优选形成吡咯烷。
如本文所述,Z可以选自-O-、-S-、-Se-、-N-RN或-BH3-,其中RN为-H、-C1-4烷基或保护基团。优选地,Z选自-O-或-S-,最优选-O-。应当理解,-P+-O-是-P=O的共振结构。
一些优选的化合物为以下式表示的化合物:
在另一个方面,本发明提供一种寡核苷酸,其具有至少一个式FVII所示的改性磷酸酯部分:
其中R1和R2如本文所定义。
在另一个方面,本发明提供一种寡核苷酸,其中连接相邻核苷/核苷类似物的磷酸酯包含磷酰基胍、磷酰基脒、磷酰基异脲、磷酰基异硫脲、磷酰亚胺酸酯或磷酰基硫代亚胺酸酯。
在另一个方面,本发明提供一种合成包含式FVII所示的模体的化合物的方法:
在一个方面,该方法包括亚磷酸与亚胺基衍生物HN=CR1R2或N-硅烷化的亚胺基衍生物RSi3SiN=CR1R2在氧化剂、任选的硅烷化剂和/或碱的存在下发生反应(工序A),其中每个RSi为烷基或芳基。例如,该亚磷酸衍生物可以是亚磷酸酯或H-亚磷酸酯。
工序A的亚胺基衍生物的实例包括但不限于1,1,3,3-四甲基胍(TMG)、胍盐酸盐、1,1-二甲基胍硫酸盐、1,3-二苯基胍、甲脒盐酸盐、乙脒盐酸盐、1H-吡唑-1-甲脒盐酸盐、N-B℃-1H-吡唑-1-甲脒、乙基甲脒盐酸盐、乙基乙脒盐酸盐、O-甲基异脲硫酸氢盐、S-甲基异硫脲硫酸氢盐、S-苯甲基异硫脲盐酸盐等。
应当理解,亚胺基衍生物可以是游离碱或本文所述的盐的形式。如果该亚胺基衍生物为盐,则可以加入碱来释放出该亚胺基衍生物的游离碱,以及/或者可以使用硅烷化剂来制备亚胺基化合物的N-硅烷基化衍生物。所述氧化剂可以是碘I2、溴Br2、氯Cl2、氯化碘Icl、N-溴琥珀酰亚胺、N-氯琥珀酰亚胺、N-碘琥珀酰亚胺、四氯化碳CCl4、溴三氯甲烷CCl3Br、四溴甲烷CBr4、四碘甲烷CI4、三碘甲烷CHI3、六氯乙烷C2Cl6、六氯丙酮(CCl3)2CO等。优选的氧化剂为碘I2。
在另一个方面,该方法包括亚磷酸衍生物与有机叠氮化物任选地在硅烷基化剂和/或碱的存在下进行反应(工序B)。
例如,有机叠氮化物可以选自双(二取代氨基)-1-叠氮碳鎓盐、1-(二取代氨基)-1-叠氮胍盐、1-(二取代氨基)-1-叠氮-乙烯、N-取代的-1-叠氮胍等。在工序A和工序B的反应中,反应可以在硅烷化剂的存在下进行,该硅烷化剂例如为N,O-双(三甲基甲硅烷基)乙酰胺(BSA)、N,O-双(三甲基甲硅烷基)三氟乙酰胺(BSTFA)、氯三甲基硅烷、溴三甲基硅烷、碘三甲基硅烷、三乙基甲硅烷基氯化物、三苯基甲硅烷基氯化物、六甲基二硅氮烷、三甲基甲硅烷基三氟甲磺酸酯(TMSOTf)、二甲基异丙基甲硅烷基氯化物、二乙基异丙基甲硅烷基氯化物、叔丁基二甲基甲硅烷基氯化物、叔丁基二苯基甲硅烷基氯化物、三异丙基甲硅烷基氯化物、二甲基二氯硅烷、二苯基二氯硅烷等。例如,该反应可以在选自N,O-双(三甲基甲硅烷基)乙酰胺(BSA)、N,O-双(三甲基甲硅烷基)三氟乙酰胺(BSTFA)和氯三甲基硅烷中的甲硅烷基化剂的存在下进行。
在工序A和工序B的反应中,反应可以在碱的存在下进行,该碱例如为三乙基胺、N,N-二异丙基乙基胺(DIEA)、N-甲基吗啉、N-乙基吗啉、三丁基胺、1,4-二氮杂双环[2.2.2]辛烷(DABCO)、N-甲基咪唑(NMI)、吡啶、2,6-二甲基吡啶、2,4,6-三甲基吡啶、4-二甲基氨基吡啶(DMAP)、1,8-双(二甲基氨基)萘(“质子海绵”)、1,8-二氮杂双环[5.4.0]十一碳-7-烯(DBU)、1,5-二氮杂双环[4.3.0]壬-5-烯(DBN)、1,5,7-三氮杂双环[4.4.0]癸-5-烯(TBD)、7-甲基-1,5,7-三氮杂双环[4.4.0]癸-5-烯(MTBD)、1,1,3,3-四甲基胍(TMG)、2-叔丁基-1,1,3,3-四甲基胍、2,8,9-三甲基-2,5,8,9-四氮杂-1-磷杂双环[3.3.3]十一烷、磷腈碱等。
用于工序A的溶剂的例子包括但不限于吡啶、2-甲基吡啶、3-甲基吡啶、4-甲基吡啶、喹啉、四氢呋喃(THF)、1,4-二噁烷、1,2-二甲氧基乙烷(DME)、二乙二醇二甲基醚(diglym),二乙基醚、乙腈等。
用于工序B的溶剂的例子包括但不限于乙腈、N,N-二甲基甲酰胺(DMF)、N,N-二甲基乙酰胺(DMA)、N-甲基吡咯烷酮(NMP)、四甲基脲、1,3-二甲基-2-咪唑啉酮、环丁砜、六甲基磷酸三酰胺(HMPT)、1,4-二噁烷、四氢呋喃(THF)、丙酮、乙酸乙酯等。
下面介绍这工序的其它细节。
如本文所述,本发明的该性磷酸酯部分的具体优点如本发明人所论述的那样,这些部分便于引入。例如,在基于H-膦酸酯或亚磷酰胺化学反应的序列寡核苷酸合成中,式VI的改性磷酸酯部分能够便利地引入到寡核苷酸中。下面介绍其他细节。
本发明的一个或多个方面可以与本发明的任一个或多个其他方面组合。相似地,这些方面中的任一个或多个特征以及任选的特征可以应用到任一个其它方面。因此,这里讨论的任选和优选的特征可以应用到一些或全部方面中。具体而言,涉及化合物、模体和中间体、制备化合物的方法以及使用化合物的方法等的任选和优选的特征适用于全部的其它方面。例如,化合物的优选取代基也适用于叠氮化物/亚胺基衍生物,反之亦然。此外,与方法或用途有关的任选和优选的特征也可以应用于产品,反之亦然。
说明书附图
参照以下附图进一步描述本发明,但不限于以下附图:
图1.用N,N,N’,N’-四甲基-N”-膦酰基胍基团改性的寡核苷酸5’-d(GCGCCAAACpA)(细黑线)、5’-d(GCGCCAAApCpA)(灰色线)和5’-d(GCGCCAApApCpA)(粗黑线)的RP-HPLC;这里和以下р标记改性基团的位置。
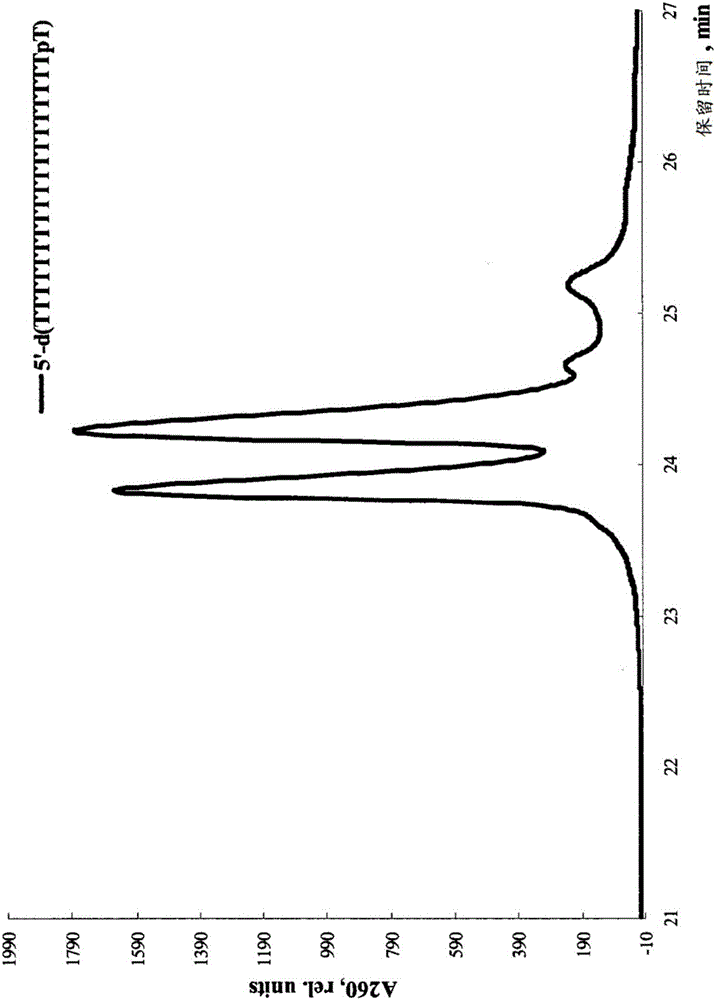
图2.用N-磷酰基胍基团改性的寡核苷酸5’-d(TTTTTTTTTTTTTTTTTTTрT)的RP-HPLC。
图3.具有LNA核苷酸的寡脱氧核糖核苷酸5’-d(TTTT)tdT(细黑线)、用N,N,N’,N’-四甲基-N”-磷酰基胍基团改性的5’-d(TTTT)tpdT(灰色线)和5’-tpd(TTTTT)(虚线)的RP-HPLC;t标记LNA核苷酸的位置。
图4.用N,N'-双(四亚甲基)-N”-磷酰基胍基团改性的寡-2'-O-甲基核糖核苷酸5’-UUUUUp*U(粗黑线)、用N,N’-二甲基-N”-磷酰基亚胺基-2-咪唑烷基改性的5’-UUUUUpU(灰色线)和未改性的寡-2'-O-甲基核糖核苷酸5’-UUUUUU(细黑线)的RP-HPLC。
图5.用N-氰基亚氨基磷酸酯基团改性的寡核苷酸5’-d(TрTTTTT)的RP-UPLC。
图6.用N,N'-双(四亚甲基)-N”-胍基磷酸酯基团改性的寡核苷酸5’-d(TTTTTT)р(粗黑线)、5’-DMTr-Flu pd(TTTTTT)(细黑线)和核苷酸5’-DMTr-Flu pdT(灰色线)的RP-HPLC。
图7.用N,N’-二甲基-N”-磷酰基亚胺基-2-咪唑烷基团改性的寡核苷酸5’-d(TTTTTрT)、5’-d(TTTTpTрT)、5’-d(TTTpTpTрT)、5’-d(TTpTpTpTрT)和5’-d(TpTpTpTpTрT)的RP-HPLC;р标记改性基团的位置。
图8.在全部间核苷位置用N,N’-二甲基-N”-磷酰基亚胺基-2-咪唑烷基团完全改性的寡核苷酸5’-d(GpCpGpCpCpApApApCpA)的RP-HPLC。
缩写和符号
p–表示所描述的改性磷酸酯基团的位置
t–表示LNA-T核苷酸的位置
a–表示LNA-A核苷酸的位置
c–表示LNA-5-Me-C核苷酸的位置
g–表示LNA-G核苷酸的位置
F–2-羟基甲基-3-羟基四氢呋喃(脱嘌呤/脱嘧啶位点)磷酸酯
BHQ–BlackHole QuencherTM
DD–1,12-十二烷二醇磷酸酯
Flu–5(6)-羧基荧光素标记
NS–表示核苷酸的硫代磷酸酯残基“N”
BSA–N,O-双(三甲基甲硅烷基)乙酰胺
BSTFA–N,O-双(三甲基甲硅烷基)三氟乙酰胺
DIEA–N,N-二异丙基乙基胺
NMI–N-甲基咪唑
DMAP–4-二甲基氨基吡啶
DBU–1,8-二氮杂双环[5.4.0]十一碳-7-烯
TMG–1,1,3,3-四甲基胍
具体实施方式
磷酰基胍在自然界表现为例如磷酸肌酸和磷酸精氨酸的化合物。合成的低分子量磷酰基胍至少从20世纪60年代起就是已知的[52]。小分子磷酰基胍被发现有限的农药[53]、阻燃剂[54]和治疗药物[55]用途。磷酰基胍二酯通过胍氮原子与金属离子形成络合物[56]。O,O’-二异丙基磷酰基胍的X-射线分析已经证实在晶体结构中仅存在具有磷酰基亚胺基基团>P(=O)–N=C<的互变异构体。
然而,到目前为止还没有报道核苷或寡核苷酸衍生物,它们的性质还是未知的。本发明采用与之前报道的与仲胺相关的方法[57]类似的方法通过在N,N,N’,N’-四甲基胍(TMG)的存在下在吡啶中进行二硫嘧啶β-氰基乙基亚磷酸酯的碘氧化首次制备了寡核苷磷酰基胍。
本发明人研究了CPG-结合的3’,5’-二硫嘧啶β-氰基乙基亚磷酸酯的氧化,其是一种在根据β-氰基乙基亚磷酰胺方法的固相DNA分析中常见的中间体[58]。如前所述,用0.1M的碘的干燥吡啶溶液在1M TMG和20%N,O-双(三甲基甲硅烷基)乙酰胺的存在下将上述亚磷酸酯氧化生成3’,5’-二硫嘧啶-N,N,N’,N’-四甲基磷酰基胍作为主产物。在室温下浓氨水处理1小时后以两种非对映异构体的混合物的形式分离出寡核苷酸5’-d(TTTTTpT),其中p表示改性磷酸酯基的位置(实施例1.1)。分离出的唯一副产物是dT6,其可能是痕量水导致同时发生的反应性碘磷中间体水解的结果。本发明人以得出结论,磷酰基胍基团在固相寡核苷酸分析和pH11下氨脱保护过程中是稳定的。
通过MALDI-TOF MS证实了寡胸腺嘧啶脱氧核苷单磷酰基胍的完整性。其在20%丙烯酰胺凝胶中的凝胶电泳过程中的移动性比dT6低,这表明suggesting charge neutral character of the四甲基磷酰基胍基团在pH7.4下为电中性,这与低分子量磷酰基胍的文献数据对应[59]。
通过合成具有一个四甲基磷酰基胍基团的20-聚体寡胸苷酸,本发明人注意到随着载体的增加产率逐渐变差,5’-d(T18TрT)>5’-d(T10TрT9)>5’-d(TTрT18)。所得到的寡胸苷酸用于通过与dT20比较来确定单四甲基磷酰基胍基团对具有寡核苷酸5’-d(C2A20C2)的互补双链热稳定性的影响。
本发明人还成功获得了具有未取代的磷酰基胍基团的寡核苷酸。在0.5M胍盐酸盐、0.5M 1,8-二氮杂双环[5.4.0]十一碳-7-烯(DBU)和20%BSA的存在下用0.1M碘的吡啶溶液对CPG-结合的3’,5’-二硫嘧啶β-氰基乙基亚磷酸酯进行氧化,然后合成寡核苷酸,制备了具有磷酰基胍基团的六胸苷酸作为主产物以及dT6水解产物(实施例5)。
类似地,在甲脒盐酸盐、DBU和BSA的存在下在吡啶中进行二硫嘧啶亚磷酸酯的碘氧化,然后合成寡核苷酸,结果形成了六胸苷酸磷酰基甲脒,其是另一类磷酰基亚胺基化合物的代表:磷酰基脒(实施例39).
在0.5M O-甲基异脲硫酸氢盐、1M DBU和20%BSA的存在下用0.1M碘的吡啶溶液进行CPG-结合的3’,5’-二硫嘧啶β-氰基乙基亚磷酸酯的氧化,然后合成寡核苷酸并用浓氨水在室温下脱保护1h,根据MALDI-TOFMS可知,结果得到含有dT6、寡核苷O-甲基磷酰基异脲和磷酰基胍的混合物(实施例7)。后者可能是通过氨取代磷酰基异脲的甲氧基而形成的。另外在55℃下进行氨处理16h,结果导致磷酰基胍的量增加以及O-甲基磷酰基异脲的量降低。同样地,用乙二胺的乙醇溶液(1:1v/v)在55℃下处理该混合物16h,导致O-甲基磷酰基异脲消失并得到N-β-氨基乙基磷酰基胍作为主产物(实施例8)。这提供了将寡核苷酸中带负电的磷酸酯取代为带正电的基团的途径,因为N-β-氨基乙基磷酰基胍基团在生理pH下应该是代正电的。阳离子性寡核苷磷酰基胍可以在没有外部转染剂存在的情况下潜在地显示提高的细胞摄取体内递送。
如本文所述,本发明人获得了具有一个未取代的磷酰基胍基团的20聚体寡胸苷酸(Fig.2)。产率随着寡核苷酸的长度而降低,d(T18TрT)>d(T10TрT9)>d(TTрT18)。还制备了具有两个和三个磷酰基胍基团的寡核苷酸;但是,反应得到难以分离的产物混合物,从而本发明人得出结论,碘氧化化学反应对制备单取代寡核苷酸最有效的。
如本文所述,H-膦酸酯化学反应可以用于制备具有两个和三个改性基团的寡核苷酸[63]。可以用0.1M碘和20%vol.TMG的吡啶溶液加入或不加入BSA(实施例1.2和1.3)或者用CCl4或CCl3Br和20%vol.TMG的吡啶溶液(实施例1.4和1.5)将CPG-加载的3’,5’-二硫嘧啶-H-膦酸酯氧化成N,N,N’,N’-四甲基磷酰基胍[64]。在碘的情况下转化率(70-75%)高于CCl4或CCl3Br的情况(10-20%)。在BSA的存在下,转化率增加至80-85%。在使用亚磷酰胺法的固相合成之后,以良好的产率得到具有四甲基磷酰基胍基团的六胸苷酸5’-d(TTTTTpT),以及副产物dT5和dT6(实施例1.3)。本发明人通过碘/TMG/BSA氧化成功得到了二取代-和三取代的磷酰基胍5’-d(TTTTрTрT)(实施例3.1)和5’-d(TTTрTрTрT)(实施例4.1),但是后以情况的产率较低。
为了提高寡核苷磷酰基胍的产率,本发明人开发了在N,N-二甲基甲酰胺或乙腈中在存在或不存在BSA的情况下CPG-结合的二核苷β-氰基乙基亚磷酸酯和四烷基叠氮碳鎓盐之间的新型反应。该反应可以在室温下或在40-45℃下进行。加入5%三乙基胺和BSA可提高产率。该方法证明对制备具有多个四烷基磷酰基胍基团的寡核苷酸是有效的(Fig.1)。该方法的自动模式的DNA合成器被用于制备完全改性的寡核苷磷酰基胍(实施例47)。
连同电中性或阳离子性的磷酰基胍,本发明人还制备了含有可离子化的N-氰基亚胺基磷酸酯基团的寡核苷酸。在这种情况下,CPG-结合的二核苷亚磷酸酯在室温下与0.25M叠氮化氰乙腈溶液反应。结果表明,寡核苷酸的产率取决于所使用的脱保护方法。当用乙二胺和乙醇混合物(1:1v/v)[65]代替氨水来使具有N-氰基亚胺基磷酸酯基的寡核苷酸70℃脱保护1h的情况下,得到良好的结果(实施例40和41)。
所得到的N-氰基亚胺基六胸苷酸5’-d(TTTTTpT)和5’-d(TpTTTTT)的电泳移动性与dT6非常相似,这表明N-氰基亚胺基在生理pH下带负电。该寡核苷酸与未改性的六胸苷酸相比仅略显示疏水性。RP-HPLC检测中观察到两种非对映异构体(Fig.5)。
发现一系列的改性寡核苷酸与磷酰基胍改性兼容,特别是核糖核苷酸衍生物,如寡-2’-O-甲基核糖核苷酸(Fig.4)、LNA(Fig.3)和RNA自身(实施例46)。硫代磷酸酯基团可以成功地与磷酰基胍基团一起结合至寡核苷酸(实施例32-35)。一系列其它改性例如荧光素、脱碱基位点、非核苷插入或或黑洞淬灭剂是可以忍受的。还制备了具有3’-或5’-磷酰基胍基的单核苷酸(实施例42和44,Fig.6)。
定义
术语“核苷酸”表示含有核苷或改性核苷且至少一个磷酸酯基或改性磷酸酯基通过共价键与其连接的化合物。示例性的共价键包括但不限于核苷的3’、2’或5’羟基与磷酸酯基之间的酯键。
术语“寡核苷酸”表示含有两个或多个核苷酸连接在一起形成聚合链的化合物。寡核苷酸可以是脱氧核糖核酸或核糖核酸。寡核苷酸可以是单链的或双链的。在双链寡核苷酸的情况下,一个或两个链可以含有本发明的改性磷酸酯。
寡核苷酸可以是两种或多种核苷酸的聚合物,但是y可以具有任一长度。例如,寡核苷酸可以具有以下最小长度中的一种:2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,或40个核苷酸。任选地,其可以具有以下最大长度中的任一种:10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43,44,45,46,47,48,49,50,51,52,53,54,55,56,57,58,59,60,61,62,63,64,65,66,67,68,69,70,71,72,73,74,75,76,77,78,79,80,81,82,83,84,85,86,87,88,89,90,91,92,93,94,95,96,97,98,99,100,110,120,130,140,150,160,170,180,190,200,210,220,230,240,250,260,270,280,290,300,310,320,330,340,350,360,370,380,390,400,410,420,430,440,450,460,470,480,490或500个核苷酸,但是在一些实施方式中也提供更长的寡核苷酸。纯粹地,通过实施例的方式提供具有以下长度的寡核苷酸:2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43,44,45,46,47,48,49,50,51,52,53,54,55,56,57,58,59,60,61,62,63,64,65,66,67,68,69,70,71,72,73,74,75,76,77,78,79,80,81,82,83,84,85,86,87,88,89,90,91,92,93,94,95,96,97,98,99或100个核苷酸。
在本发明的寡核苷酸中,一个、若干个(e.g.2,3,4,5,6,7,8,9,10个或更多个)核苷酸或每个核苷酸可以包含本发明的改性磷酸酯。
本发明的核苷酸和寡核苷酸可以包含本文所述的化学改性,例如在糖位置、磷酸酯位置和/或核酸的碱基位置的化学取代,包括,例如,引入改性的核苷酸、引入封端模体(e.g.3’封端)、结合至高分子量、非免疫性化合物(e.g.聚乙二醇(PEG))、结合至低分子量化合物(e.g.胆固醇)、结合至肽(e.g.a细胞穿透性肽)、磷酸酯基上的取代(e.g.硫代磷酸酯)。碱基改性可以包括5-位嘧啶改性、在环外胺处的改性、4-硫脲苷的取代、5-溴-或5-碘-尿嘧啶的取代、骨架改性。糖改性可以包括2’-氨基核苷酸(2’-NH2)、2’-氟核苷酸(2’-F)、2’-O-甲基(2’-OMe)核苷酸、2’-O-烯丙基核苷酸、2’-O-β-甲氧基乙基核苷酸、“锁定”核苷酸(e.g.LNA)或三环-DNA核苷酸。磷酸酯的中心磷原子与核苷之间或各核苷之间的结合可以合适地经由氧,即核苷的3’端和/或5’端为醇。但是,也估计存在核苷的3’端和/或5’端不是醇的核苷类似物也是合适的类似物的情况。例如,核苷的3’端和/或5’端可以为硫醇、硒醇或胺。
本发明的核苷酸和寡核苷酸可以以分离或纯化的形式提供。
术语“核苷”表示含有糖部分和核碱基的化合物。示例性的糖包括但不限于核糖、2-脱氧核糖、阿拉伯糖等。示例性的核碱基包括但不限于胸腺嘧啶、尿嘧啶、胞嘧啶、腺嘌呤、鸟嘌呤、嘌呤、次黄嘌呤、黄嘌呤、2-氨基嘌呤、2,6-二氨基嘌呤、5-甲基胞嘧啶、4-氟尿嘧啶、5-氯尿嘧啶、5-溴尿嘧啶、5-碘尿嘧啶、5-三氟甲基尿嘧啶、5-氟胞嘧啶、5-氯胞嘧啶、5-溴胞嘧啶、5-碘胞嘧啶、5-丙炔基尿嘧啶、5-丙炔基胞嘧啶、7-脱氮腺嘌呤、7-脱氮鸟嘌呤、7-脱氮-8-氮腺嘌呤、7-脱氮-8-氮鸟嘌呤、异胞嘧啶、异鸟嘌呤等。
本文所用的术语“核苷类似物”表示糖部分被环结构或非环结构代替的改性的核苷。糖部分被其它环结构代替的示例性的核苷类似物包括但不限于吗啉代的单体单元(PMO)和三环-DNA。糖部分被非环结构代替的示例性的核苷类似物包括但不限于肽核酸(PNA)和甘油核酸(GNA)的单体单元。术语“核苷类似物”还表示任一部分被任何性质的化学基团代替的核苷。示例性的这样的核苷类似物包括但不限于2’-代核苷,如2’-氟、2-脱氧、2’-O-甲基、2’-O-β-甲氧基乙基、2’-O-烯丙基核糖体核糖核苷、2’-氨基、锁定的核酸(LNA)单体等。
适当地,核苷类似物可以包括下述的糖部分被吗啉环代替的核苷类似物。
应当理解,在这种类型的结构中,也类似的采用在一般糖化学中采用的标记3’和5’。即,在所述结构中,环上的羟基甲基取代基被认为是5’端,三价氮被认为是3’端。
本文所用的术语“寡核苷酸类似物”表示其磷酸酯基团被化学改性或其核苷被改性核苷类似物代替的改性寡核苷酸。示例性的寡核苷酸类似物包括但不限于硫代磷酸酯寡核苷酸(PS)、磷酰二胺吗啉代寡核苷酸(吗啉代,PMO)、三环-DNA和肽核酸(PNA)。
术语“肽核酸”通常表示用肽键取代磷酸酯基团的寡核苷酸类似物。但是,如本文所述,其包括可以引入本发明的改性磷酸酯基团的化合物。应当理解,这些化合物也可以包含在本申请中。
本文所使用的术语“磷酸酯基”表示磷酸H3PO4的氢原子被分别被一个、两个或三个有机基团取代而形成磷酸酯、磷酸二酯或磷酸三酯。
术语“改性磷酸酯基”表示与磷连接的任一氧原子被任何性质的化学基团代替的磷酸酯基团。合适的代替可以包括硫、硒、亚胺基(NR)和硼烷(-BH3-)。例如,该基团可以是硫代磷酸酯基、硒代磷酸酯或硼烷磷酸酯基。优选地,“改性磷酸酯基”为硫代磷酸酯基。
应当理解,根据它们的取代,本文所述的磷酸酯和取代磷酸酯可以是手性的。在未标明立体化学的情况下,结构包括Rp构型和Sp构型,各构型的分离体和其混合物(例如,外消旋混合物)。例如,但不限于以下结构:
如前所述,包括
应当理解,本文所述的化合物可以包含大于1个的手性中心。除非另有说明,否则是指包含所有对映异构体和非对映异构体。
本文所使用的术语“保护的寡核苷酸”是指引入了一个或多个保护基团的寡核苷酸。
本文所使用的术语“脱保护的寡核苷酸”是指一个或多个保护基团被移除了的寡核苷酸。
应当理解,提及核苷、核苷酸和寡核苷酸,包括其被保护的形式。
术语“保护基团”是指用于暂时阻断化合物活性位点的化学基团。保护基团在特定条件下会被移除。示例性的保护基团包括但不限于乙酰基(Ac)、苯甲酰基(Bz)、异丁酰基(Ibu)、叔丁基苯氧基乙酰基(Tac)、乙酰丙酰基(Lev)、甲基(Me)、2-氰基乙基(CE)、烯丙基(All)、2-氯苯基(o-ClPh)、4,4’-二甲氧基三苯甲基(DMTr)、4-甲氧基三苯甲基(MMTr)、叔丁基二甲基甲硅烷基(TBDMS)、三异丙基甲硅烷基氧基甲基(TOM)等。
本文所使用的术语“连接基”包括将化合物与固体载体连接并且在特定条件下断裂而从所述载体释放所述化合物的化学基团。在固相寡核苷酸合成中使用的示例性的连接基包括但不限于琥珀酰基、二乙醇酰基、乙二酰基、氢醌-O,O’-二乙酰基(Q-连接基)、邻苯二甲酰基、4,5-二氯邻苯二甲酰基、丙二酰基、戊二酰基、二异丙基甲硅烷基、1,1,3,3-四异丙基二硅氧烷-1,3-二基等。
其它连接基可以包括插入到寡核苷酸或改性寡核苷酸中的非核苷酸化学基团(“核苷间/核苷酸间连接基”),或在核苷酸与其它化学基团之间形成连接的非核苷酸化学基团,例如标签或淬灭剂。合适的连接基是本领域已知的并且包括1,12-十二烷二醇磷酸酯(DD)。
术语“固体载体”表示在固相寡核苷酸合成中使用的聚合物载体。示例性的固体载体包括但不限于可控多孔玻璃(CPG)、聚苯乙烯树脂、树脂、TSK树脂、聚乙烯醇树脂等。本文所用的术语“固体载体”还表示所使用的非树脂型固体载体,例如,在多重寡核苷酸合成中,包括但不限于滤片、多芯体系、多孔板等。
本文所使用的术语“有机基团”表示含有一个或多个与其它原子连接的碳原子且在碳原子上具有游离键的化学基团。其它原子的实例包括但不限于氢、氮、氧、氟、硅、磷、硫、氯、溴和碘。
本文所使用的术语“烷基”表示直链或支链环形式或非环形式。术语“烷基”包括一价直链或支链的饱和的非环烃基。C1-4烷基包括但不限于甲基、乙基、正丙基、异丙基或叔丁基。
术语“烯基”包括具有至少一个碳碳双键的一价直链或支链的不饱和非环烃基,在一些实施方式中,不包含碳碳三键。在一些实施方式中,烯基为C2-10烯基,在一些实施方式中为C2-6烯基,在一些实施方式中C2-4烯基。
术语“炔基”包括具有至少一个碳碳三键的一价直链或支链不饱和烃基,在一些实施方式中,不包含碳碳双键。在一些实施方式中,炔基为C2-10炔基,在一些实施方式中为C2-6炔基,在一些实施方式中为C2-4炔基。
术语“杂环化合物”表示包含杂环基的化合物。术语“杂环基”表示包含一个或多个(例如1,2,3,4或5个)环杂原子的饱和、部分不饱和或不饱和(e.g.芳香)一元环或二元环的基团,所述环杂原子选自O、S(O)t(其中t为0,1,或2)或N,所述杂环基包括未取代的基团或用一个或多个取代基(例如1,2,3,4或5个取代基)取代的基团,任选地其中一个或多个一起形成环体系。除非另有说明,否则在杂环基键合至另一基团的情况下,杂环基可以是C-连接的或N-连接的,即,其可以通过环碳原子或通过环氮原子(即环内氮原子)连接至分子的其它部分。术语杂环基因此包括本文所定义的任选取代的杂环烷基、杂环烯基和杂芳基。
术语“芳基”包括一价芳香环状烃基,如苯基或萘基(e.g.1-萘基或2-萘基)。通常,芳基可以是单环或多环的稠合环芳香族基团。
术语“杂芳基”包括一个或多个碳原子被独立地选自O、S、N和NRN代替的芳基,其中RN如本文所定义。
术语“卤素”表示-F、-Cl、-Br和-I。在一些实施方式中,卤素为-F、-Cl或-Br。在一些实施方式中,卤素为–F或–Cl,例如Cl。
一般而言,杂芳基可以是单环或多环(e.g.二环)稠合环状杂芳基。典型地,杂芳基含有5-10个环原子,其中1、2、3或4个环原子独立地选自O、S、N和NRN。
如本文中所使用的,术语“任选取代的”表示可以被一个或多个(最多为该取代基上的自由价的最大数)取代基取代的取代基。所述取代基可以选自:
-C1-4烷基,
-F,-Cl,-Br,-I
-CF3,-℃F3,-SCF3,
-OH,-L-OH,-O-L-OH,-NH-L-OH,-NR30-L-OH,
-℃1-4烷基,-L-℃1-4烷基,-O-L-℃1-4烷基,-NH-L-℃1-4烷基,-NR30-L-OC1-4烷基,
-SH,-SC1-4烷基,
-CN,
-NH2,-NHC1-4烷基,-N(C1-4烷基)2,
-L-NH2,-L-NHC1-4烷基,-L-N(C1-4烷基)2,
-℃(O)C1-4烷基,
-C(O)OH,-C(O)℃1-4烷基,
-C(O)C1-4烷基,
-C(O)NH2,-C(O)NHC1-4烷基,-C(O)N(C1-4烷基)2,
-NHC(O)C1-4烷基,-N(C1-4烷基)C(O)C1-4烷基;和
=O;
其中各-L-为键或C1-4亚烷基,R30为-C1-10烷基,-C2-10烯基,-C2-10炔基,-C6-10芳基或-C5-10杂芳基。
在一些实施方式中,这些任选取代基选自-C1-4烷基,-F,-Cl,-CF3,-OH,-℃1-4烷基,-NH2,-NHC1-4烷基和-N(C1-4烷基)2。
本文所使用的术语“室温”表示15–29℃范围的温度,优选为20–25℃范围的温度。
反应
如本文所述,本发明的改性磷酸酯部分的一个具体优点如本发明人所描述的那样是便于引入这些部分。例如,在基于H-膦酸酯或亚磷酰胺化学反应的序列寡核苷酸合成中,式VI的改性磷酸酯部分可以方便地引入至寡核苷酸。因此,本发明提供合成本发明化合物的方法。这些方法可以使用固体加载的反应试剂,并且可以在DNA合成器中进行。
应当理解,磷酰基异脲、磷酰基异硫脲、磷酰亚胺酸酯和磷酰基硫代亚胺酸酯是活性中间体,其通过与伯胺或仲胺反应可以转化成本文所述的磷酰基胍或磷酰基脒(参见,例如,实施例7和8)。因此,本发明还提供具有磷酰基胍或磷酰基脒基团的本文所述的化合物的合成方法,该方法包括使具有磷酰基异脲、磷酰基异硫脲、磷酰亚胺酸酯或磷酰基硫代亚胺酸酯基团的本文所述的化合物与伯胺或仲胺反应。
H-膦酸酯化学反应
H-膦酸酯化学反应是方便的且已建立的化学寡核苷酸合成方法。适当地,经由连接基固定于固体载体的5’-DMT-保护的核苷酸经历连续脱保护,然后与H-膦酸单酯发生耦合反应形成H-膦酸二酯。在脱三苯基然后耦合的步骤之后,可以在序列中加入其它核苷单元,在与氧化剂典型地与碘组合结束时发生核苷间H-膦酸二酯连接被氧化成磷酸二酯连接。
如本文所述,本发明人已经证明本发明的改性磷酸酯基能够容易地引入到使用H-膦酸酯化学反应组装的寡核苷酸中。如本文所述,为了引入改性的磷酸酯,可以在合适的胍、脒、异脲、异硫脲、亚胺酯或硫代亚胺酯的存在下用合适的氧化剂进行所述氧化,所述胍、脒、异脲、异硫脲、亚胺酯或硫代亚胺酯可以以游离碱或其盐如盐酸盐或其它盐的形式存在。合适的氧化剂包括碘I2、溴Br2、氯Cl2、氯化碘Icl、N-溴琥珀酰亚胺、N-氯琥珀酰亚胺、N-碘琥珀酰亚胺、四氯化碳CCl4、溴溴三氯甲烷CCl3Br、四溴甲烷CBr4,四碘甲烷CI4、三碘甲烷CHI3、六氯乙烷C2Cl6和六氯丙酮(CCl3)2CO。优选的氧化剂为碘。
当然,应当理解,在氧化之后,为了引入一个或多个改性的磷酸酯基,可以恢复脱三苯基然后耦合的循环,在链组装过程中在合适的时刻进行进一步的氧化步骤。以这种方式,可以在链组装过程中在合适的位置引入本发明的改性磷酸酯基。
可以使用各种本领域已知的溶剂,包括吡啶、2-甲基吡啶、3-甲基吡啶、4-甲基吡啶、喹啉、四氢呋喃(THF)、1,4-二噁烷、1,2-二甲氧基乙烷(DME)、乙腈。优选的溶剂是吡啶。
可以优选在氧化步骤中加入碱。适当地,所述碱为胺碱,例如,三乙胺、N,N-二异丙基乙基胺(DIEA)、N-甲基吗啉、N-乙基吗啉、三丁基胺、1,4-二氮杂双环[2.2.2]辛烷(DABCO)、N-甲基咪唑(NMI)、吡啶、2,6-二甲基吡啶、2,4,6-三甲基吡啶、4-二甲基氨基吡啶(DMAP)、1,8-双(二甲基氨基)萘(“质子海绵”)、1,8-二氮杂双环[5.4.0]十一碳-7-烯(DBU)、1,5-二氮杂双环[4.3.0]壬-5-烯(DBN)、7-甲基-1,5,7-三氮杂双环[4.4.0]癸-5-烯(MTBD)、2-叔丁基-1,1,3,3-四甲基胍、2,8,9-三甲基-2,5,8,9-四氮杂-1-磷杂双环[3.3.3]十一烷或磷腈碱。例如,所述碱可以是三乙胺或DBU。
本发明人发现在引入改性磷酸酯模体的氧化过程中加入甲硅烷基化剂可能是优选的。因此,可以加入N,O-双(三甲基甲硅烷基)乙酰胺(BSA),N,O-双(三甲基甲硅烷基)三氟乙酰胺(BSTFA),氯三甲基硅烷,溴三甲基硅烷,碘三甲基硅烷,三乙基甲硅烷基氯化物,三苯基甲硅烷基氯化物,六甲基二硅氮烷,三甲基甲硅烷基三氟甲磺酸酯(TMSOTf),二甲基异丙基甲硅烷基氯化物,二乙基异丙基甲硅烷基氯化物,叔丁基二甲基甲硅烷基氯化物,叔丁基二苯基甲硅烷基氯化物,三异丙基甲硅烷基氯化物,二甲基二氯硅烷,二苯基二氯硅烷或类似物。优选的甲硅烷基化剂为N,O-双(三甲基甲硅烷基)乙酰胺(BSA)。
亚磷酰胺化学反应
亚磷酰胺化学反应也是化学合成寡核苷酸的有用的方法。与基于亚磷酰胺化学反应的寡核苷酸化学反应相关的循环在本领域是已知的。简言之,将固体加载的核苷酸脱三苯基化,然后与适当活化的核苷亚磷酰胺耦合形成亚磷酸三脂连接。然后可以发生封端,然后用氧化剂典型地用碘氧化亚磷酸三脂。然后重复该循环来组装成链。
如本文所述,本发明人发现,在合适的胍、脒、异脲或异硫脲的存在下进行所属氧化步骤可以制备期望的改性磷酸酯基,所述胍、脒、异脲或异硫脲可以以其盐的形式例如盐酸盐的形式存在。移除β-氰基乙基亚磷酸酯保护基团从而完成该合成。如前所述,对于该氧化步骤而言,在H-膦酸酯方法中,期望加入碱和/或甲硅烷基化剂。
有机叠氮化物的使用
在这里还描述了通过二核苷β-氰基乙基亚磷酸酯和合适的有机叠氮化物任选地在甲硅烷基化剂如BSA的存在下反应获得本发明的改性磷酸酯基的新型反应。可以加入碱例如胺碱,例如三乙胺。
本发明人已经证明该方法对于制备具有各种磷酰基胍取代方式的寡核苷酸是有效的,所述磷酰基胍取代方式例如有未取代、单取代、二取代、三取代和四取代磷酰基胍基团,以及对具有多种这类改性磷酸酯基的寡核苷酸是有效的。
适当地,有机叠氮化物可以是式R1-C+(N3)-R2的叠氮化物,例如双(二取代氨基)-1-叠氮碳鎓盐、1-(二取代氨基)-1-叠氮碳鎓盐等,或1-(二取代氨基)-1-叠氮-乙烯、N-取代的-1-叠氮基胍;或以下式的叠氮化物:(N3)2C=NR2、(N3)2C=N+R1AR1B或叠氮化氰N3–CN。有机叠氮化物可以使用本领域已知的方法制备。例如,四烷基脲可以转化为叠氮双(二烷基氨基)碳鎓盐[60],二烷基酰胺可以转化为N,N-二烷基-叠氮碳鎓盐[61],三烷基脲或单烷基酰胺可以得到中性叠氮化物[62]。
适当地,有机叠氮化物可以选自:
其中R1,R2,R1A,R1B,R2A和R2B如本文所定义。在一些实施方式中,R2还可以是-N3。
例如,叠氮化物可以选自:
其中,各R1A,R1B,R2A,R2B独立地为-H或任选取代的C1-10烷基,-C2-10烯基,-C2-10炔基,-C6-10芳基或-C5-10杂芳基;和/或
任选地,其中R1A和R2A一起形成2-4个原子长度的亚烷基或杂亚烷基链;任选地,其中R1A和R2A一起形成-CH2-CH2-,且R1B和R2B各自独立地选自-H和甲基。
任选地,其中R1A和R1B与它们所结合的原子一起形成5-8元杂环;或者
任选地,其中R2A和R2B与它们所结合的原子一起形成5-8元杂环,任选地形成吡咯烷;
或者
其中,各R1A和R1B独立地为-H或任选取代的C1-10烷基,-C2-10烯基,-C2-10炔基,-C6-10芳基或-C5-10杂芳基;或者R1A和R1B与它们所结合的原子一起形成5-8元杂环,且R2选自-H,-F,-OPG,Cl,-Br,-I,-CN,-N3,-O-C1-10烷基,-SPG和-S-C1-10烷基,其中PG为保护基团。
在一些优选的反应中,有机叠氮化物为:
具有合适的反离子,例如氯离子。
合适的反离子包括但不限于氯Cl─,溴Br─,碘I─,三氟甲磺酸根(三氟甲磺酸)CF3SO3─,对甲苯磺酸根C7H7SO3─,二氯磷酸根PO2Cl2─,高氯酸根ClO4─,四氟硼酸根BF4─,四苯基硼酸根BPh4─,六氟磷酸根PF6─等。在一些实施方式中,各R1A,R1B,R2A和R2B独立地为-H或任选取代的C1-10烷基,例如,H或任选取代的C1-4烷基,例如,-H或甲基。在一些实施方式中,各R1A,R1B,R2A和R2B为甲基,即,得到用四甲基胍改性的磷酸酯。在一些实施方式中,R1A和R2A一起形成2-4个原子长度的亚烷基或杂亚烷基链,且R1B和R2B各自独立地选自-H和C1-4烷基。在一些实施方式中,R1A和R2A一起形成-CH2-CH2-。在一些实施方式中,R1A和R2A一起形成-CH2-CH2-,且R1B和R2B为-H或甲基。
在一些实施方式中,R1A和R1B与它们所结合的原子一起形成5-8元杂环,优选形成吡咯烷,哌啶,哌嗪或吗啉。例如它们可以与它们所结合的原子一起形成5元杂环,优选形成吡咯烷。
在一些实施方式中,R2A和R2B与它们所结合的原子一起形成5-8元杂环,优选形成吡咯烷,哌啶,哌嗪或吗啉。例如,它们可以与它们所结合的原子一起形成5元杂环,优选形成吡咯烷。
工序A和工序B
本文所述的化合物可以使用本文所述的工序A或工序B来合成。这些工序可以在自动寡核苷酸合成中使用,如这里所述以及在后文实施例中所描述的那样。
工序A包括:
(i)在含有所述氧化剂、亚胺基衍生物和任选的甲硅烷基化剂、碱和溶剂的混合物中浸渍附着有保护的寡核苷酸或含有所述亚磷酸衍生物的保护改性寡核苷酸的固体载体;
(ii)使该固体载体保持浸渍并将温度保持在所需范围内足够的时间以确保所述亚磷酸衍生物转化为改性磷酸基团,由此制备具有改性磷酸基的式(I)的改性寡核苷酸;
(iii)按照期望的方案继续固相寡核苷酸合成直到下一个期望的改性位点为止,然后重复步骤(i)和(ii),或直到寡核苷酸序列结束;
(iv)进行期望的脱保护和/或从固体载体上脱离,由此制备具有一个或多个改性磷酸酯基的脱保护的式(I)的改性寡核苷酸。
工序B包括:
(i)在含有所述有机叠氮化物、溶剂和任选的甲硅烷基化剂和碱的混合物中浸渍附着有保护的寡核苷酸或含有所述亚磷酸衍生物的保护改性寡核苷酸的固体载体;
(ii)重复工序A中的步骤(ii)至(iv);
在该方法的最后回收改性寡核苷酸。
该方法可以在–20–150℃的温度下进行,优选在0–100℃,更优选在15–80℃下进行。
优选地,工序A在室温下进行。
工序A中亚胺基衍生物的浓度适当地为0.005–3M,更优选0.1–1.5M。
工序B中叠氮化物的浓度适当地为0.005–3M,优选为0.1–1.5M。
任选地,可以加入甲硅烷基化剂。合适的甲硅烷基化剂包括N,O-双(三甲基甲硅烷基)乙酰胺(BSA),N,O-双(三甲基甲硅烷基)三氟乙酰胺(BSTFA),氯三甲基硅烷,溴三甲基硅烷,碘三甲基硅烷,三乙基甲硅烷基氯化物,三苯基甲硅烷基氯化物,六甲基二硅氮烷,三甲基甲硅烷基三氟甲磺酸酯(TMSOTf),二甲基异丙基甲硅烷基氯化物,二乙基异丙基甲硅烷基氯化物,叔丁基二甲基甲硅烷基氯化物,叔丁基二苯基甲硅烷基氯化物,三异丙基甲硅烷基氯化物,二甲基二氯硅烷,二苯基二氯硅烷等。在一些优选的实施方式中,使用N,O-双(三甲基甲硅烷基)乙酰胺(BSA)作为甲硅烷基化剂。
任选地,可以加入碱。合适的碱为胺碱,例如,三乙胺,N,N-二异丙基乙基胺(DIEA),N-甲基吗啉,N-乙基吗啉,三丁基胺,1,4-二氮杂双环[2.2.2]辛烷(DABCO),N-甲基咪唑(NMI),吡啶,2,6-二甲基吡啶,2,4,6-三甲基吡啶,4-二甲基氨基吡啶(DMAP),1,8-双(二甲基氨基)萘(“质子海绵”),1,8-二氮杂双环[5.4.0]十一碳-7-烯(DBU),1,5-二氮杂双环[4.3.0]壬-5-烯(DBN),1,5,7-三氮杂双环[4.4.0]癸-5-烯(TBD),7-甲基-1,5,7-三氮杂双环[4.4.0]癸-5-烯(MTBD),1,1,3,3-四甲基胍(TMG),2-叔丁基-1,1,3,3-四甲基胍,2,8,9-三甲基-2,5,8,9-四氮杂-1-磷杂双环[3.3.3]十一碳烷,磷腈碱等。
优选的碱为三乙胺.
用于工序A的合适的溶剂包括吡啶,2-甲基吡啶,3-甲基吡啶,4-甲基吡啶,喹啉,四氢呋喃(THF),1,4-二噁烷,1,2-二甲氧基乙烷(DME),二乙二醇二甲醚(diglym),二乙醚,乙腈等。
用于工序A的优选的溶剂为吡啶。
用于工序B的合适的溶剂包括乙腈,N,N-二甲基甲酰胺(DMF),N,N-二甲基乙酰胺(DMA),N-甲基吡咯烷酮(NMP),四甲基脲,1,3-二甲基-2-咪唑啉酮,环丁砜,六甲基磷酰三胺(HMPT),1,4-二噁烷,四氢呋喃(THF),丙酮,乙酸乙酯等。
用于工序B的优选溶剂包括N,N-二甲基甲酰胺;N-甲基吡咯烷酮和乙腈。
寡核苷酸应用
根据本发明的寡核苷酸可以在广泛的用途中使用。例如,它们可以在体外例如用作研究或诊断试剂,或在体内例如用作治疗、诊断或研究试剂。因此,本发明的一个方面提供一种方法,该方法包括在体外或体内使根据本发明的寡核苷酸(优选单链)与具有高度序列完整性的寡核苷酸(优选单链)接触并使寡核苷酸杂交,(例如形成双链寡核苷酸)。该方法可以任选进一步包含检测和/或定量所杂交的寡核苷酸的步骤。该方法可以是检测特定寡核苷酸的方法,例如包含突变、变异或单一核苷酸多形态(SNP)的寡核苷酸。该方法可以是诊断患者疾病的方法,例如涉及检测从患者采集的组织或体液样本中的寡核苷酸。
可以设计和合成根据本发明的寡核苷酸来在核酸扩增方法中,例如在聚合酶链反应(PCR)方法中用作引物。
可以以在需要使用寡核苷酸微阵列的方法中所要使用的寡核苷酸微阵列(“DNA芯片”)的方式设计和制造根据本发明的寡核苷酸。
还可以使用本发明的寡核苷酸来设计和合成治疗核酸,如siRNA(Angell&Baulcombe(1997)The EMBO Journal 16,12:3675-3684;and Voinnet&Baulcombe(1997)Nature 389:pg 553);Fire A.et al.,Nature,Vol 391,(1998);Fire(1999)Trends Genet.15:358-363,Sharp(2001)Genes Dev.15:485-490,Hammond et al.(2001)Nature Rev.Genes 2:1110-1119and Tuschl(2001)Chem.Bi℃hem.2:239-245)、核酶、适体(Systematic evolution of ligands by exponential enrichment:RNA ligands to bacteriophage T4DNA polymerase.Science.1990Aug 3;249(4968):505-10);WO91/19813)、脱氧核酶、反义核酸、PMO、PNA、LNA或缺口聚物。基于寡核苷酸的疗法在本领域中已知用于治疗各种疾病,例如包括在病毒感染或病毒介导的疾病、癌症、眼病如年龄相关性黄斑变性、预防不必要的新生血管形成、外显子剪接缺陷症如杜氏肌营养不良的治疗中使用,以及用作抗胆固醇剂。针对这些治疗已知或建议的寡核苷酸试剂的设计可以改性为引入本文所述的改性磷酸酯。
任选地,治疗核酸可以被连接至递送试剂如细胞穿透肽(如在WO2009/147368中所描述的)。
因此,在一个方面中,提供根据本发明的寡核苷酸来在药物治疗方法中使用,或在治疗中使用。在另一个方面中,提供根据本发明的寡核苷酸在制造治疗所述疾病的药物或药物组合物的用途。在另一个方面中,提供一种治疗疾病的方法,该方法包括对需要治疗的患者施用根据本发明的寡核苷酸,由此治疗所述疾病。
可以将根据本发明的寡核苷酸制剂化为药物或药物组合物。药物或药物组合物可以例如以纯化或分离的形式包含本发明的寡核苷酸以及可药用的载体、稀释剂、赋形剂或佐剂。
可以将根据本发明的药物和药物组合物制剂化来通过各种途径施用,所述途径包括但不限于肠外,静脉,动脉,肌内,口腔和鼻腔。该药物或药物组合物可以制剂化为液体或固体形式。液体制剂可以制剂化为通过注射到人体或动物体的选定区域来施用。
施用优选以"治疗有效量"进行,其足以对个体显示药效。所施用的实际量和施用频率以及时间过程取决于要治疗的性质和严重程度。治疗处方,如剂量的决定等由一般医师和其它医生负责,通常要考虑要治疗的疾病、个体患者的情况、递送位点、施用方法以及医师所知的其它因素。以上提到的技术和方案的实例可以参见Remington’s Pharmaceutical Sciences,20th Edition,2000,pub.Lippincott,Williams&Wilkins。
根据本发明的可以在体外或体内进行。术语“体外”是指在实验室条件或培养基中对材料、生物质、细胞和/或组织进行试验,术语“体内”是对完整的多细胞器官进行试验或操作。
治疗的受试者可以是任何动物或人。受试者优选为哺乳动物,更优选为人类。受试者可以是非人类的动物,但是更优选为人类。受试者可以是男性或女性。受试者可以是患者。
---oOo---
本发明包括所述方面和优选特征的组合,除非该组合是明显不允许的或明确避免的。
本文所使用的章节标题是用于文章结构的目的并不应当解释为对发明的限定。
下面将参照附图以实施例的方式描述本发明的方面和实施方式。其它方面和实施方式对本领域技术人员来说将是清楚的。本文所提及的所有文件通过引用而并入本文。
在本说明书中,包括所附权利要求书中,除非上下文需要说明,否则词语“包含”和其变形如“包括”和“含有”将被理解为包含所述的数量或步骤或数量组或步骤组,但不排除任何其它数量或步骤或数量组或步骤组。
必须注意,在说明书和所附权利要求书中使用时,单数形式“一个”、“一种”和“该”包括复数形式,除非上下文有明确说明。在本文中范围可能被表示为从“约”一个具体值,和/或到“约”另一个具体值。当表示为这样的范围时,另一个实施方式包括从从一个具体值和/或到另一个具体值。类似地,当使用前缀“约”近似地表示数值时,应当理解,具体数值形成另一个实施方式。
虽然已经参照其特定的实施方式描述了本发明,但是本领域技术人员应当清楚在不脱离本发明真实精神和范围的情况下可以进行各种变换。
另外,可以进行许多修改来使具体的情况、材料、物质组成、方法、方法步骤适合本发明的客观精神和范围。所有这些修改包括在所附权利要求的范围内。
下面参照附图通过以下非限定性实施例来描述本发明。
实施例
提供以下实施例是为了说明而不是为了限定本发明。
一般方法
改性寡核苷酸用Biosset自动DNA合成器ASM-800来合成,采用β-氰基乙基亚磷酰胺化学反应[58]或H-膦酸酯化学反应[66],使用标准12μl柱子以0.2μmol的规模进行合成。
所有反应在具有旋盖和橡胶O型圈的1.5ml聚丙烯管中进行。在固相合成之后,将柱子的聚合物载体移至塑料管并用每5mg载体200μl解封溶液的量进行处理。使用浓度(ca.33%)的氨水溶液(Soln A)或乙二胺和纯乙醇的1:1vol混合物(Soln B)作为解封溶液。在解封之后,使用SpeedVac浓缩器真空蒸发上清液,并加入400μl的20mM三乙基乙酸铵,pH 7,通过离心移除载体。
通过DMTr OFF模式或DMTR ON模式的基于Agilent 1200系列色谱的反相(RP)HPLC纯化改性寡核苷酸30min,在Zorbax SB-C18(5μm)柱(4.6×150mm)中采用0.02M三乙基乙酸铵中乙腈梯度0~40%,pH 7,流速2cm3min-1。通过用100μl 80%乙酸处理15min然后用400μl 20mM三乙基乙酸铵,pH 7.0进行中和并用SpeedVac浓缩器进行蒸发,从而移除5’-末端DMTr基团。然后通过添加1ml 1M LiClO4丙酮溶液来使寡核苷酸沉淀,用丙酮清洗颗粒并在空气中干燥20min。采用在20%聚丙烯酰胺凝胶(PAGE)中的变形凝胶电泳利用Stains-All染色可视化的带来检查寡核苷酸的纯度。通过基质辅助激光解吸附电离-飞行时间(MALDI-TOF)质谱来确认改性寡核苷酸的结构,以负离子或正离子模式通过Bruker Reflex III Autoflex Speed质谱仪进行记录,使用3-羟基吡啶甲酸作为基质。
0.5M双(二甲基氨基)叠氮碳鎓二氯磷酸盐溶液的制备.
向双(二甲基氨基)氯碳鎓二氯磷酸盐的干燥MeCN(10ml)溶液(1.105g,4.1mmol)[67]中加入粉末化的干燥NaN3(1.1当量,288mg,4.4mmol)。将悬浮液在室温下搅拌2h,过滤,用干燥MeCN清洗,在真空下蒸发并干燥,得到1.08g(95%)油状产物。将69mg产物溶解于1ml DMF–Et3N95:5(v/v)中,剧烈震荡2min,通过以14,500rpm离心3min来分离沉淀,得到0.5M溶液,该溶液可以在室温下保存最多一周。
制备1M 2-叠氮-1,3-二甲基咪唑啉鎓六氟磷酸盐溶液.
在1.5ml塑料管中称量2-氯-1,3-二甲基咪唑啉鎓六氟磷酸盐(139mg)和NaN3(1.1当量,36mg),加入干燥乙腈(0.5ml),将悬浮液在30℃下震荡2h,然后通过以14,500rpm离心5min来分离沉淀,在–18℃下保存该溶液。
制备1M叠氮二吡咯碳鎓六氟磷酸盐溶液.
在1.5ml塑料管中称量氯二吡咯碳鎓六氟磷酸盐(166mg)和NaN3(1.1当量,36mg),加入干燥乙腈(0.5ml),将悬浮液在30℃下震荡2h,然后通过以14,500rpm离心5min来分离沉淀,在–18℃小保存该溶液。
实施例1.制备具有N,N,N’,N’-四甲基磷酰基胍基(FVIII)的改性寡核苷酸5’-d(TTTTTpT);这里和以下实施例中p表示改性磷酸酯基的位置。
1.1.工序(a)使用β-氰基乙基亚磷酸酯和碘.
在DNA合成器中安装含有5mg of高加载5’-DMTr-dT CPG载体(110μmol g-1)的柱,以0.2μmol规模启动自动β-氰基乙基亚磷酰胺固相DNA合成。在5’-脱三苯基、偶联亚磷酰胺并封端之后中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
通过将碘催化剂以0.2M浓度溶解到干燥吡啶中来制备Soln 1(51mg/ml)。通过混合124μl N,N,N’,N’-四甲基胍(TMG),50μl N,O-双(三甲基甲硅烷基)乙酰胺(BSA)和325μl干燥吡啶来制备Soln 2,并以ca.1/4vol加入分子筛。在塑料管中混合20μl的Soln 1和2的混合试样,加入10μl的BSA,等待1min之后将内容物移至具有聚合物的管中。将该管旋转30s,以14,500rpm离心15s并在室温下震荡5min。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,重复β-氰基乙基亚磷酰胺固相合成直到序列结束。
将寡核苷酸从载体上分离,并在室温下用Soln A移除保护基团1h.
分子质谱:calc.[M]1860.39,exp.[M+H]1860.93,[M-H]1859.14.
1.2.工序(a)使用H-膦酸酯和碘.
在DNA合成器中安装含有5mg 5’-DMTr-dT CPG载体(40μmol g-1)的柱,并以0.2μmol的规模启动利用H-膦酸酯方法的自动固相DNA合成。在5’-脱三苯基和膦酸酯耦合之后中断合成,并从合成器上分离柱子,连接水泵,用MeCN冲洗,并将附着有二核苷H-膦酸酯的载体移至塑料瓶中。通过将碘催化剂以0.2M浓度溶解到干燥吡啶中来制备Soln 1(51mg/ml)。通过混合100μl TMG和400μl干燥吡啶(20%vol)来制备Soln 2,并以ca.1/4vol加入分子筛在具有载体的管中加入20μl的Soln 1和2的等分试样,旋转30s,以14,500rpm离心15s并在室温下震荡30min。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,重复β-氰基乙基亚磷酰胺固相合成直到序列结束。
将寡核苷酸从载体上分离,并在室温下用Soln A移除保护基团1h.分子质谱:calc.[M]1860.39,exp.[M+H]1861.17,[M-H]1857.96.
1.3.工序(a)使用H-膦酸酯,BSA和碘.
在DNA合成器中安装含有5mg 5’-DMTr-dT CPG载体(40μmol g-1)的柱,并以0.2μmol的规模启动利用H-膦酸酯方法的自动固相DNA合成。在5’-脱三苯基和膦酸酯耦合之后中断合成,并从合成器上分离柱子,连接水泵,用MeCN冲洗,并将附着有二核苷H-膦酸酯的载体移至塑料瓶中。通过将碘催化剂以0.2M浓度溶解到干燥吡啶中来制备Soln 1(51mg/ml)。通过混合125μl TMG(2M),50μl BSA(1M)和325μl干燥吡啶(20%vol)来制备Soln 2,并以ca.1/4vol加入分子筛。在具有载体的管中加入20μl的Soln 1和2的等分试样,加入10μl BSA,并将该管旋转30s,以14,500rpm离心15s并在室温下震荡5min.弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,重复β-氰基乙基亚磷酰胺固相合成直到序列结束。
将寡核苷酸从载体上分离,并在室温下用Soln A移除保护基团1h。分子质谱:calc.[M]1860.39,exp.[M+H]1861.17,[M-H]1857.96.
1.4.工序(a)使用H-膦酸酯和CCl4.
在DNA合成器中安装含有5mg 5’-DMTr-dT CPG载体(40μmol g-1)的柱,并以0.2μmol的规模启动利用H-膦酸酯方法的自动固相DNA合成。在5’-脱三苯基和膦酸酯耦合之后中断合成,并从合成器上分离柱子,连接水泵,用MeCN冲洗,并将附着有二核苷H-膦酸酯的载体移至塑料瓶中。
通过在分子筛中保持CCl416h来制备Soln 1。通过混合100μl TMG和400μl干燥吡啶(20%vol)来制备Soln 2,并以ca.1/4vol加入分子筛。在具有载体的管中加入20μl的Soln 1和2的等分试样,旋转30s,以14,500rpm离心15s并在室温下震荡30min.弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,重复β-氰基乙基亚磷酰胺固相合成直到序列结束。
将寡核苷酸从载体上分离,并在室温下用Soln A移除保护基团1h.分子质谱:calc.[M]1860.39,exp.[M+H]1860.78,[M-H]1858.67.
1.5.工序(a)使用H-膦酸酯和CCl3Br.
在DNA合成器中安装含有5mg 5’-DMTr-dT CPG载体(40μmol g-1)的柱,并以0.2μmol的规模启动利用H-膦酸酯方法的自动固相DNA合成。在5’-脱三苯基和膦酸酯耦合之后中断合成,并从合成器上分离柱子,连接水泵,用MeCN冲洗,并将附着有二核苷H-膦酸酯的载体移至塑料瓶中。
通过在分子筛中保持CCl3Br 16h来制备Soln 1。通过混合100μl TMG和400μl干燥吡啶(20%vol)来制备Soln 2,并以ca.1/4vol加入分子筛。在具有载体的管中加入20μl的Soln 1和2的等分试样,旋转30s,以14,500rpm离心15s并在室温下震荡1h。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,重复β-氰基乙基亚磷酰胺固相合成直到序列结束。
将寡核苷酸从载体上分离,并在室温下用Soln A移除保护基团1h.分子质谱:calc.[M]1860.39,exp.[M+H]1861.13,[M-H]1859.25.
1.6.工序(b)使用β-氰基乙基亚磷酸酯和双(二甲基氨基)-1-叠氮碳鎓二氯磷酸盐.
在DNA合成器中安装含有5mg的高加载5’-DMTr-dT CPG载体(110μmol g-1)的柱,并以0.2μmol规模启动自动β-氰基乙基亚磷酰胺固相DNA合成。在5’-脱三苯基,亚磷酰胺耦合和封端之后中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
将40μl 0.5M双(二甲基氨基)-1-叠氮碳鎓二氯磷酸盐的等分试样移至塑料瓶中,加入10μul BSA并将管旋转1min,以14,500rpm离心1min并在室温下放置30min。将内容物移至具有载体的管中,旋转30s,以14,500rpm离心30s并在室温下震荡30min。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,重复β-氰基乙基亚磷酰胺固相合成直到序列结束。
将寡核苷酸从载体上分离,并在室温下用Soln A移除保护基团1h.分子质谱:calc.[M]1860.39,exp.[M+H]1860.35,[M-H]1857.54.
实施例2.制备具有N,N,N’,N’-四甲基磷酰基胍group(FVIII)的改性寡核苷酸5’-d(TpTTTTT).
在DNA合成器中安装含有5mg的高加载5’-DMTr-dT CPG载体(110μmol g-1)的柱,并以0.2μmol规模启动自动β-氰基乙基亚磷酰胺固相DNA合成。在合并4个dT、5’-脱三苯基、亚磷酰胺耦合和封端之后中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
将40μl 0.5M双(二甲基氨基)-1-叠氮碳鎓二氯磷酸盐等分试样移至塑料瓶中,加入10μl BSA并将管旋转1min,以14,500rpm离心1min并在室温下放置30min。将内容物移至具有载体的管中,旋转30s,以14,500rpm离心30s并在室温下震荡30min。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,并通过5’-脱三苯基完成合成。
将寡核苷酸从载体上分离,并在室温下用Soln A移除保护基团1h.分子质谱:calc.[M]1860.39,exp.[M+H]1860.34,[M-H]1858.63.
实施例3.制备具有N,N,N’,N’-四甲基磷酰基胍基(FVIII)的改性寡核苷酸5’-d(TTTTpTpT).
3.1.工序(a)使用H-膦酸酯,BSA和碘.
在DNA合成器中安装含有5mg 5’-DMTr-dT CPG载体(40μmol g-1)的柱,并以0.2μmol的规模启动利用H-膦酸酯方法的自动固相DNA合成.在合并2个dT H-膦酸酯之后中断合成,并从合成器上分离柱子,连接水泵,用MeCN冲洗,并将附着有三核苷二-H-膦酸酯的载体移至塑料瓶中。
通过将碘催化剂以0.2M浓度溶解到干燥吡啶中来制备Soln 1(51mg/ml).通过混合125μl TMG(2M),50μl BSA(1M)和325μl干燥吡啶(20%vol)来制备Soln 2,并以ca.1/4vol加入分子筛。在具有载体的管中加入20μl的Soln 1和2的等分试样,加入10μl BSA,并将该管旋转30s,以14,500rpm离心15s并在室温下震荡10min。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,重复β-氰基乙基亚磷酰胺固相合成直到序列结束。
将寡核苷酸从载体上分离,并在室温下用Soln A移除保护基团1h.分子质谱:calc.[M]1957.55,exp.[M+H]1958.28,[M-H]1956.34.
3.2.工序(b)使用β-氰基乙基亚磷酸酯和双(二甲基氨基)-1-叠氮碳鎓二氯磷酸盐.
在DNA合成器中安装含有5mg的高加载5’-DMTr-dT CPG载体(110μmol g-1)的柱,以0.2umol规模启动β-氰基乙基亚磷酰胺固相DNA合成。在5’脱三苯基,亚磷酰胺耦合和封端之后中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
将80μl 0.5M双(二甲基氨基)-1-叠氮碳鎓二氯磷酸盐的等分试样移至塑料瓶中,加入20μl BSA并将管旋转1min,以14,500rpm离心1min并在室温下放置30min.将50μl的等分试样移至具有载体的管中,旋转30s,以14,500rpm离心30s并在室温下震荡30min。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,偶联另一种dT亚磷酰胺并在氧化之前中断合成。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
将50μl的等分试样移至具有载体的管中,旋转30s,以14,500rpm离心30s并在室温下震荡30min.弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,恢复合成直到序列结束为止.
将寡核苷酸从载体上分离,并在室温下用Soln A移除保护基团1h.
分子质谱:calc.[M]1957.55,exp.[M+H]1958.32,[M-H]1955.44.
实施例4.制备具有N,N,N’,N’-四甲基磷酰基胍基(FVIII)的改性寡核苷酸5’-d(TTTpTpTpT).
4.1.工序(a)使用H-膦酸酯,BSA和碘.
在DNA合成器中安装含有5mg 5’-DMTr-dT CPG载体(40μmol g-1)的柱,并以0.2μmol的规模启动利用H-膦酸酯方法的自动固相DNA合成。在组合了3个dT H-膦酸酯之后中断合成,并从合成器上分离柱子,连接水泵,用MeCN冲洗,附着有四核苷三-H-膦酸酯的载体移至塑料瓶中。
通过将碘催化剂以0.2M浓度溶解到干燥吡啶中来制备Soln 1(51mg/ml).Soln 2was通过混合125μl TMG(2M),50μl BSA(1M)和325μl干燥吡啶(20%vol),并以ca.1/4vol加入分子筛。在具有载体的管中加入20μl的Soln 1和2的等分试样,加入10μl BSA,并将该管旋转30s,以14,500rpm离心15s并在室温下震荡10min。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,重复β-氰基乙基亚磷酰胺固相合成直到序列结束。
将寡核苷酸从载体上分离,并在室温下用Soln A移除保护基团1h.分子质谱:calc.[M]2054.72,exp.[M+H]2055.49.
4.2.工序(b)使用β-氰基乙基亚磷酸酯和双(二甲基氨基)-1-叠氮碳鎓二氯磷酸盐.
在DNA合成器中安装含有5mg的高加载5’-DMTr-dT CPG载体(110μmol g-1)的柱,并以0.2μmol规模启动自动β-氰基乙基亚磷酰胺固相DNA合成.在5’脱三苯基,亚磷酰胺耦合和封端之后中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
将120μl 0.5M双(二甲基氨基)-1-叠氮碳鎓二氯磷酸盐等分试样移至塑料瓶中,加入30μl BSA并将管旋转1min,以14,500rpm离心1min并在室温下放置30min。将50μl的等分试样移至具有载体的管中,旋转30s,以14,500rpm离心30s并在室温下震荡30min。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,耦合另一dT亚磷酰胺并在氧化之前中断合成。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
将50μl的第二等分试样移至具有载体的管中,旋转30s,以14,500rpm离心30s并在室温下震荡30min.弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,耦合另一dT亚磷酰胺并在氧化之前中断合成。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
将50μl第三等分试样移至具有载体的管中,旋转30s,以14,500rpm离心30s并在室温下震荡30min。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,恢复合成直到序列结束为止。
将寡核苷酸从载体上分离,并在室温下用Soln A移除保护基团1h。分子质谱:calc.[M]2054.72,exp.[M+H]2054.49.
实施例5.制备具有磷酰基胍基(FIX)的改性寡核苷酸5’-d(TTTTTpT).
在DNA合成器中安装含有5mg的高加载5’-DMTr-dT CPG载体(110μmol g-1)的柱,并以0.2umol的规模启动自动β-氰基乙基亚磷酰胺固相DNA合成在5’脱三苯基,亚磷酰胺耦合和封端之后中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
通过将碘催化剂以0.2M浓度溶解到干燥吡啶中来制备Soln 1(51mg/ml).通过在塑料管中称量9.6mg干燥胍盐酸盐,加入85μl干燥吡啶,15μl 1,8-二氮杂双环[5.4.0]十一碳-7-烯(DBU),10μl BSA,并将该管旋转5min并超声至澄清(ca.5min)来制备Soln 2。在塑料管中混合20μl的Soln 1和2的混合试样,加入10μl的BSA,等待1min之后将内容物移至具有聚合物的管中。将该管旋转30s,以14,500rpm离心15s并在室温下震荡5min。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,重复β-氰基乙基亚磷酰胺固相合成直到序列结束。
将寡核苷酸从载体上分离,并在室温下用Soln A移除保护基团1h。分子质谱:calc.[M]1804.28,exp.[M+H]1804.62,[M-H]1803.25.
实施例6.制备具有磷酰基胍基(FIX)的改性寡核苷酸5’-d(TpTTTTT).
在DNA合成器中安装含有5mg的高加载5’-DMTr-dT CPG载体(110μmol g-1)的柱,并以0.2umol的规模启动自动β-氰基乙基亚磷酰胺固相DNA合成。在合并了4个dT,5’-脱三苯基,亚磷酰胺耦合并封端之后中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中.
通过将碘催化剂以0.2M浓度溶解到干燥吡啶中来制备Soln 1(51mg/ml).通过在塑料管中称量9.6mg干燥的胍盐酸盐,加入85μl干燥吡啶,15μl DBU,10μl BSA,并将该管旋转5min并超声至澄清(ca.5min)来制备Soln 2。在塑料管中混合20μl的Soln 1和2的混合试样,加入10μl的BSA,等待1min之后将内容物移至具有聚合物的管中。将该管旋转30s,以14,500rpm离心15s并在室温下震荡5min.弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,通过5’-脱三苯基完成合成。
将寡核苷酸从载体上分离,并在室温下用Soln A移除保护基团1h.
分子质谱:calc.[M]1804.28,exp.[M+H]1804.76,[M-H]1803.06.
实施例7.制备具有O-甲基磷酰基异脲基(FX)的改性寡核苷酸5’-d(TTTTTpT).
在DNA合成器中安装含有5mg的高加载5’-DMTr-dT CPG载体(110μmol g-1)的柱,并以0.2μmol规模启动自动β-氰基乙基亚磷酰胺固相DNA合成.在5’脱三苯基,亚磷酰胺耦合和封端之后中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
通过将碘催化剂以0.2M浓度溶解到干燥吡啶中来制备Soln 1(51mg/ml).通过在塑料管中称量8.6mg干燥的O-甲基异脲硫酸氢盐,加入35μl干燥吡啶,15μl 1,8-二氮杂双环[5.4.0]十一碳-7-烯(DBU),5μl BSA,并将该管旋转5min并超声至澄清(ca.10min)然后以14,500rpm离心2min来制备Soln 2。在塑料管中混合20μl的Soln 1和2的混合试样,加入10μl的BSA,等待1min之后将内容物移至具有聚合物的管中。将该管旋转30s,以14,500rpm离心15s并在室温下震荡5min.弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,恢复合成直到序列结束为止。
将寡核苷酸从载体上分离并通过用Soln A在55℃下处理16h来移除保护基团.
分子质谱:calc.[M]1819.29,exp.[M+H]1819.59,[M-H]1818.26.
实施例8.制备具有N-β-氨基乙基磷酰基胍基(FXI)的改性寡核苷酸5’-d(TTTTTpT).
在DNA合成器中安装含有5mg的高加载5’-DMTr-dT CPG载体(110μmol g-1)的柱,并以0.2umol的规模启动自动β-氰基乙基亚磷酰胺固相DNA合成.在5’脱三苯基,亚磷酰胺耦合和封端之后中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
通过将碘催化剂以0.2M浓度溶解到干燥吡啶中来制备Soln 1(51mg/ml)。通过在塑料管中称量8.6mg干燥的O-甲基异脲硫酸氢盐,加入35μl干燥吡啶,15μl 1,8-二氮杂双环[5.4.0]十一碳-7-烯(DBU),5μl BSA,并将该管旋转5min并超声至澄清(ca.10min)然后以14,500rpm离心2min来制备Soln 2。在塑料管中混合20μl的Soln 1和2的混合试样,加入10μl的BSA,等待1min之后将内容物移至具有聚合物的管中.将该管旋转30s,以14,500rpm离心15s并在室温下震荡5min.弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,恢复合成直到序列结束为止。将寡核苷酸从载体上分离,并通过Soln B在55℃下处理16h来移除保护基团。
分子质谱:calc.[M]1847.35,exp.[M+H]1847.16,[M-H]1844.76.
实施例9.制备具有N,N,N’,N’-四甲基磷酰基胍基(FVIII)的改性寡核苷酸5’-d(TCpA).
在DNA合成器中安装含有5mg的5’-DMTr-dA(Bz)CPG载体(110μmol g-1)的柱,并以0.2μmol规模启动自动β-氰基乙基亚磷酰胺固相DNA合成.在5’-脱三苯基,dC亚磷酰胺耦合和封端之后中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
将40μl 0.5M双(二甲基氨基)-1-叠氮碳鎓二氯磷酸盐的等分试样移至塑料瓶中,加入10μl BSA并将管旋转1min,以14,500rpm离心1min并在室温下放置30min。将内容物移至具有载体的管中,旋转30s,以14,500rpm离心30s并在室温下震荡30min。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,恢复合成直到序列结束为止。
将寡核苷酸从载体上分离,并通过用Soln A在室温下处理16小时来移除保护基团。
分子质谱:calc.[M]941.80,exp.[M+H]942.17,[M-H]938.97.
31P NMR(D2O,δ,ppm):“快速”非对映异构体0.37,“慢速”非对映异构体0.21.
实施例10.制备具有N,N,N’,N’-四甲基磷酰基胍基(FVIII)的改性寡核苷酸5’-d(GCGCCAAACpA).
在DNA合成器中安装含有5mg的5’-DMTr-dA(Bz)CPG载体(110μmol g-1)的柱,并以0.2μmol规模启动自动β-氰基乙基亚磷酰胺固相DNA合成。在5’-脱三苯基,dC亚磷酰胺耦合和封端之后中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
将40μl 0.5M双(二甲基氨基)-1-叠氮碳鎓二氯磷酸盐的等分试样移至塑料瓶中,加入10μl BSA并将管旋转1min,以14,500rpm离心1min并在室温下放置30min。将内容物移至具有载体的管中,旋转30s,以14,500rpm离心30s并在室温下震荡30min。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,恢复合成直到序列结束为止。
将寡核苷酸从载体上分离,并通过用Soln A在55℃下处理12h来移除保护基团。寡核苷酸的HPLC曲线示于图1.
分子质谱:calc.[M]3103.21,exp.[M+H]3102.12,[M-H]3100.61.
实施例11.制备具有N,N,N’,N’-四甲基磷酰基胍基(FVIII)的改性寡核苷酸5’-d(GCGCCAAApCpA).
在DNA合成器中安装含有5mg的5’-DMTr-dA(Bz)CPG载体(110μmol g-1)的柱,并以0.2μmol规模启动自动β-氰基乙基亚磷酰胺固相DNA合成。在5’-脱三苯基,dC亚磷酰胺耦合和封端之后中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
将80μl 0.5M双(二甲基氨基)-1-叠氮碳鎓二氯磷酸盐等分试样移至塑料瓶中,加入20μl BSA并将管旋转1min,以14,500rpm离心1min并在室温下放置30min。将50μl的等分试样移至具有载体的管中,旋转30s,以14,500rpm离心30s并在室温下震荡30min。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,耦合dA亚磷酰胺,并在氧化之前中断合成。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
将50μl的第二等分试样移至具有载体的管中,旋转30s,以14,500rpm离心30s并在室温下震荡30min。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,恢复合成直到序列结束为止。
将寡核苷酸从载体上分离并通过用Soln A在55℃下处理12h来移除保护基团。寡核苷酸的HPLC曲线示于图1.
分子质谱:calc.[M]3200.38,exp.[M+H]3199.90,[M-H]3199.00.
实施例12.制备具有N,N,N’,N’-四甲基磷酰基胍基(FVIII)的改性寡核苷酸5’-d(GCGCCAApACpA).
在DNA合成器中安装含有5mg的5’-DMTr-dA(Bz)CPG载体(110μmol g-1)的柱,并以0.2μmol规模启动自动β-氰基乙基亚磷酰胺固相DNA合成。在5’-脱三苯基,dC亚磷酰胺耦合和封端之后中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
将80μl 0.5M双(二甲基氨基)-1-叠氮碳鎓二氯磷酸盐等分试样移至塑料瓶中,加入20μl BSA并将管旋转1min,以14,500rpm离心1min并在室温下放置30min.将50μl的等分试样移至具有载体的管中,旋转30s,以14,500rpm离心30s并在室温下震荡30min。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,然后耦合另一dA亚磷酰胺,然后在耦合另一dA,并中断合成,然后进行最终氧化步骤。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
将50μl的第二等分试样移至具有载体的管中,旋转30s,以14,500rpm离心30s并在室温下震荡30min.弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,恢复合成直到序列结束为止.
将寡核苷酸从载体上分离并通过用Soln A在55℃下处理12h来移除保护基团.
分子质谱:calc.[M]3200.38,exp.[M-H]3199.51.
实施例13.制备具有N,N,N’,N’-四甲基磷酰基胍基(FVIII)的改性寡核苷酸5’-d(GCGCCApAACpA).
在DNA合成器中安装含有5mg的5’-DMTr-dA(Bz)CPG载体(110μmol g-1)的柱,并以0.2μmol规模启动自动β-氰基乙基亚磷酰胺固相DNA合成。在5’-脱三苯基,dC亚磷酰胺耦合和封端之后中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
将80μl 0.5M双(二甲基氨基)-1-叠氮碳鎓二氯磷酸盐等分试样移至塑料瓶中,加入20μl BSA并将管旋转1min,以14,500rpm离心1min并在室温下放置30min。将50μl的等分试样移至具有载体的管中,旋转30s,以14,500rpm离心30s并在室温下震荡30min。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,然后耦合2个dA亚磷酰胺,然后再耦合另一dA,并中断合成,然后进行最终氧化步骤。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
将50μl的第二等分试样移至具有载体的管中,旋转30s,以14,500rpm离心30s并在室温下震荡30min。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,恢复合成直到序列结束为止。
将寡核苷酸从载体上分离并通过用Soln A在55℃下处理12h来移除保护基团.
分子质谱:calc.[M]3200.38,exp.[M-H]3199.15.
实施例14.制备具有N,N,N’,N’-四甲基磷酰基胍基(FVIII)的改性寡核苷酸5’-d(GCGCCAApApCpA).
在DNA合成器中安装含有5mg的5’-DMTr-dA(Bz)CPG载体(110μmol g-1)的柱,并以0.2μmol规模启动自动β-氰基乙基亚磷酰胺固相DNA合成。在5’-脱三苯基,dC亚磷酰胺耦合和封端之后中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
将120μl 0.5M双(二甲基氨基)-1-叠氮碳鎓二氯磷酸盐等分试样移至塑料瓶中,加入30μl BSA并将管旋转1min,以14,500rpm离心1min并在室温下放置30min。将50μl的等分试样移至具有载体的管中,旋转30s,以14,500rpm离心30s并在室温下震荡30min.弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,耦合dA亚磷酰胺,并在氧化之前中断合成。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
将50μl的第二等分试样移至具有载体的管中,旋转30s,以14,500rpm离心30s并在室温下震荡30min.弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,耦合dA亚磷酰胺,并在氧化之前中断合成。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
将50μl第三等分试样移至具有载体的管中,旋转30s,以14,500rpm离心30s并在室温下震荡30min.弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,恢复合成直到序列结束为止。
将寡核苷酸从载体上分离并通过用Soln A在55℃下处理12h来移除保护基团。寡核苷酸的HPLC曲线示于图1.
分子质谱:calc.[M]3297.54,exp.[M-H]3296.80.
实施例15.制备具有N,N,N’,N’-四甲基磷酰基胍基(FVIII)的改性寡核苷酸5’-d(GGAAGGGGAGAGpA).
在DNA合成器中安装含有5mg的5’-DMTr-dA(Bz)CPG载体(110μmol g-1)的柱,并以0.2μmol规模启动自动β-氰基乙基亚磷酰胺固相DNA合成。在5’-脱三苯基,dG亚磷酰胺耦合和封端之后中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
将40μl 0.5M双(二甲基氨基)-1-叠氮碳鎓二氯磷酸盐等分试样移至塑料瓶中,加入10μl BSA并将管旋转1min,以14,500rpm离心1min并在室温下放置30min。将内容物移至具有载体的管中,旋转30s,以14,500rpm离心30s并在室温下震荡30min。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,恢复合成直到序列结束为止。
将寡核苷酸从载体上分离并通过用Soln A在55℃下处理16h来移除保护基团。
分子质谱:calc.[M]4234.94,exp.[M-H]4233.84.
实施例16.制备具有N,N,N’,N’-四甲基磷酰基胍基(FVIII)的改性寡核苷酸5’-d(TTTTTTTTTTTTTTTTTTTpT).
在DNA合成器中安装含有5mg的高加载5’-DMTr-dT CPG载体(110μmol g-1)的柱,并以0.2umol的规模启动自动β-氰基乙基亚磷酰胺固相DNA合成。在5’脱三苯基,亚磷酰胺耦合和封端之后中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
通过将碘催化剂以0.2M浓度溶解到干燥吡啶中来制备Soln 1(51mg/ml).通过混合124μl TMG,50μl BSA和325μl干燥吡啶,并以ca.1/4vol加入分子筛来制备Soln 2。在塑料管中混合20μl的Soln 1和2的混合试样,加入10μl的BSA,等待1min之后将内容物移至具有聚合物的管中。将该管旋转30s,以14,500rpm离心15s并在室温下震荡5min。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,重复β-氰基乙基亚磷酰胺固相合成直到序列结束。
将寡核苷酸从载体上分离并通过用Soln A在室温下处理2h来移除保护基团。
分子质谱:calc.[M]6119.16,exp.[M+H]6121.13,[M-H]6113.80.
实施例17.制备具有N,N,N’,N’-四甲基磷酰基胍基(FVIII)的改性寡核苷酸5’-d(TTTTTTTTTTTpTTTTTTTTT).
在DNA合成器中安装含有5mg的高加载5’-DMTr-dT CPG载体(110μmol g-1)的柱,并以0.2μmol规模启动自动β-氰基乙基亚磷酰胺固相DNA合成。在组合dT接着5’-脱三苯基,再耦合dT亚磷酰胺并封端的8个循环之后中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
通过将碘催化剂以0.2M浓度溶解到干燥吡啶中来制备Soln 1(51mg/ml).通过混合124μl TMG,50μl BSA和325μl干燥吡啶,并以ca.1/4vol加入分子筛来制备Soln 2。在塑料管中混合20μl的Soln 1和2的混合试样,加入10μl的BSA,等待1min之后将内容物移至具有聚合物的管中。将该管旋转30s,以14,500rpm离心15s并在室温下震荡5min。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,重复β-氰基乙基亚磷酰胺固相合成直到序列结束。
将寡核苷酸从载体上分离并通过用Soln A在室温下处理2h来移除保护基团.
分子质谱:calc.[M]6119.16,exp.[M+H]6121.54.
实施例18.制备具有N,N,N’,N’-四甲基磷酰基胍基(FVIII)的改性寡核苷酸5’-d(TTpTTTTTTTTTTTTTTTTTT).
在DNA合成器中安装含有5mg的高加载5’-DMTr-dT CPG载体(110μmol g-1)的柱,并以0.2μmol规模启动自动β-氰基乙基亚磷酰胺固相DNA合成。在并入dT接着5’-脱三苯基,再耦合dT亚磷酰胺并封端的17个循环之后中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
通过将碘催化剂以0.2M浓度溶解到干燥吡啶中来制备Soln 1(51mg/ml)。通过混合124μl TMG,50μl BSA和325μl干燥吡啶,并以ca.1/4vol加入分子筛来制备Soln 2。在塑料管中混合20μl的Soln 1和2的混合试样,加入10μl的BSA,等待1min之后将内容物移至具有聚合物的管中。将该管旋转30s,以14,500rpm离心15s并在室温下震荡5min。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,重复β-氰基乙基亚磷酰胺固相合成直到序列结束。
将寡核苷酸从载体上分离并通过用Soln A在室温下处理2h来移除保护基团。
分子质谱:calc.[M]6119.16,exp.[M+H]6120.01,[M-H]6114.19.
实施例19.制备具有N,N,N’,N’-四甲基磷酰基胍基(FVIII)的改性寡核苷酸5’-d(TTpTTTTTTTTTTTTTTTTTpT).
在DNA合成器中安装含有5mg的高加载5’-DMTr-dT CPG载体(110μmol g-1)的柱,并以0.2umol的规模启动自动β-氰基乙基亚磷酰胺固相DNA合成。在5’-脱三苯基,dT亚磷酰胺耦合和封端之后中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
将80μl 0.5M双(二甲基氨基)-1-叠氮碳鎓二氯磷酸盐等分试样移至塑料瓶中,加入20μl BSA并将管旋转1min,以14,500rpm离心1min并在室温下放置30min。将50μl的等分试样移至具有载体的管中,旋转30s,以14,500rpm离心30s并在室温下震荡30min。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,通过组合17个dT核苷酸来恢复合成,并在耦合另一dT并封端之后但在氧化之前停止合成。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
将50μl的第二等分试样移至具有载体的管中,旋转30s,以14,500rpm离心30s并在室温下震荡30min。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,恢复合成直到序列结束为止。
将寡核苷酸从载体上分离并通过用Soln A在室温下处理2h来移除保护基团.
分子质谱:calc.[M]6216.33,exp.[M-H]6221.11.
实施例20.制备具有N,N,N’,N’-四甲基磷酰基胍基(FVIII)的改性寡核苷酸5’-d(TTрTTTTTTTTTpTTTTTTTTрT).
在DNA合成器中安装含有5mg的高加载5’-DMTr-dT CPG载体(110μmol g-1)的柱,并以0.2μmol规模启动自动β-氰基乙基亚磷酰胺固相DNA合成。在5’-脱三苯基,dT亚磷酰胺耦合和封端之后中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
将120μl 0.5M双(二甲基氨基)-1-叠氮碳鎓二氯磷酸盐等分试样移至塑料瓶中,加入30μl BSA并将管旋转1min,以14,500rpm离心1min并在室温下放置30min。将50μl的等分试样移至具有载体的管中,旋转30s,以14,500rpm离心30s并在室温下震荡30min。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,组合8个dT核苷酸在组合最后一个dT后中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
将50μl的第二等分试样移至具有载体的管中,旋转30s,以14,500rpm离心30s并在室温下震荡30min。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,组合9个dT核苷酸并在并入最后一个dT后中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
将50μl第三等分试样移至具有载体的管中,旋转30s,以14,500rpm离心30s并在室温下震荡30min.弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,并回复合成来并入最后一个dT核苷酸。
将寡核苷酸从载体上分离并通过用Soln A在室温下处理2h来移除保护基团.
分子质谱:calc.[M]6313.49,exp.[M-H]6310.71.
实施例21.制备具有磷酰基胍基(FIX)的改性寡核苷酸5’-d(TTTTTTTTTTTTTTTTTTTpT).
在DNA合成器中安装含有5mg的高加载5’-DMTr-dT CPG载体(110μmol g-1)的柱,并以0.2μmol规模启动自动β-氰基乙基亚磷酰胺固相DNA合成。在组合4个dT后进行5’-脱三苯基,亚磷酰胺耦合以及封端之后中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
通过将碘催化剂以0.2M浓度溶解到干燥吡啶中来制备Soln 1(51mg/ml).通过在塑料管中称量9.6mg干燥的胍盐酸盐,加入85μl干燥吡啶,15μl DBU,10μl BSA,并将该管旋转5min并超声至澄清(ca.5min)来制备Soln 2。在塑料管中混合20μl的Soln 1和2的混合试样,加入10μl的BSA,等待1min之后将内容物移至具有聚合物的管中。将该管旋转30s,以14,500rpm离心15s并在室温下震荡5min。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,恢复合成直到序列结束为止。
将寡核苷酸从载体上分离,并在室温下用Soln A移除保护基团1h.
分子质谱:calc.[M]6063.05,exp.[M+H]6065.02,[M-H]6058.30.
实施例22.制备具有N,N,N’,N’-四甲基磷酰基胍基(FVIII)的改性寡脱氧核糖核苷酸5’-d(TTTT)tpdT;这里及以下实施例中t表示LNA-T核苷酸的位置.
在DNA合成器中安装含有5mg的高加载5’-DMTr-dT CPG载体(110μmol g-1)的柱,并以0.2μmol规模启动自动β-氰基乙基亚磷酰胺固相DNA合成。将组合LNA-T的耦合步骤持续至6min。在5’-脱三苯基,LNA-T亚磷酰胺耦合和封端之后中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
将40μl 0.5M双(二甲基氨基)-1-叠氮碳鎓二氯磷酸盐等分试样移至塑料瓶中,加入10μl BSA并将管旋转1min,以14,500rpm离心1min并在室温下放置30min。然后将内容物移至具有载体的管中,旋转30s,以14,500rpm离心30s,并在40℃下震荡1h。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,恢复合成直到序列结束为止。
将寡核苷酸从载体上分离,并在室温下用Soln A移除保护基团1h。寡核苷酸的RP-HPLC曲线示于图3。
分子质谱:calc.[M]1888.40,exp.[M+H]1888.15,[M-H]1886.86.
实施例23.制备具有N,N,N’,N’-四甲基磷酰基胍基(FVIII)的改性寡脱氧核糖核苷酸5’-tpd(TTTTT);p表示改性磷酸基团的位置;t表示LNA-T核苷酸的位置.
在DNA合成器中安装含有5mg的高加载5’-DMTr-dT CPG载体(110μmol g-1)的柱,并以0.2μmol规模启动自动β-氰基乙基亚磷酰胺固相DNA合成。组合LNA-T的耦合步骤持续至6min。在dT组合,5’-脱三苯基,LNA-T亚磷酰胺耦合和封端的4个循环之后中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
将40μl 0.5M双(二甲基氨基)-1-叠氮碳鎓二氯磷酸盐等分试样移至塑料瓶中,加入10μl BSA并将管旋转1min,以14,500rpm离心1min并在室温下放置30min。将内容物移至具有载体的管中,旋转30s,以14,500rpm离心30s,并在40℃下震荡1h。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,并通过5’-脱三苯基完成合成。
将寡核苷酸从载体上分离,并在室温下用Soln A移除保护基团1h。寡核苷酸的RP-HPLC曲线示于图3。
分子质谱:calc.[M]1888.40,exp.[M+H]1888.27,[M-H]1887.44.
实施例24.制备具有N,N,N’,N’-四甲基磷酰基胍基(式XIV)的改性寡核苷酸5’-d(AACGTCAGGGTCTTCCp)BHQ.这里及以下实施例中,BHQ为BlackHoleQuencherTM(FXII).
在DNA合成器中安装含有5mg的BHQ CPG载体(42μmol g-1)的柱,并以0.2μmol规模启动自动β-氰基乙基亚磷酰胺固相DNA合成。在5’-脱三苯基,dC亚磷酰胺耦合和封端之后中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
将40μl 0.5M双(二甲基氨基)-1-叠氮碳鎓二氯磷酸盐等分试样移至塑料瓶中,加入10μl BSA并将管旋转1min,以14,500rpm离心1min并在室温下放置30min。然后将内容物移至具有载体的管中,旋转30s,以14,500rpm离心30s并在室温下震荡30min。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,恢复合成直到序列结束为止。
将寡核苷酸从载体上分离并通过用Soln A在55℃下处理12h来移除保护基团.
分子质谱:calc.[M]5510.92,exp.[M-H]5509.50.
实施例25.制备具有N,N,N’,N’-四甲基磷酰基胍基(FVIII)的改性寡核苷酸5’-Flud(GGAAGDDCCCTGACGTTp)BHQ.DD为1,12-十二烷二醇磷酸酯(FXIII),Flu为5(6)-羧基荧光素标记(FXIV).
在DNA合成器中安装含有5mg的BHQ CPG载体(42μmol g-1)的柱,并以0.2μmol规模启动自动β-氰基乙基亚磷酰胺固相DNA合成。在5’-脱三苯基,dT亚磷酰胺耦合和封端之后中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
将40μl 0.5M双(二甲基氨基)-1-叠氮碳鎓二氯磷酸盐等分试样移至塑料瓶中,加入10μl BSA并将管旋转1min,以14,500rpm离心1min并在室温下放置30min。然后将内容物移至具有载体的管中,旋转30s,以14,500rpm离心30s并在室温下震荡30min。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,恢复合成直到序列结束为止,使用相应的1,12-十二烷二醇和荧光素亚磷酰胺作为改性剂。
将寡核苷酸从载体上分离并通过用Soln A在55℃下处理12h来移除保护基团。
分子质谱:calc.[M]6078.50,exp.[M+H]6084.38.
实施例26.制备具有N,N,N’,N’-四甲基磷酰基胍基(式XIV)的改性寡核苷酸5’-d(TCTCTCpFCCTTCpC).在这里以及下一实施例中F为2-羟基甲基-3-羟基四氢呋喃(脱嘌呤/脱嘧啶位点)磷酸酯(FXV).
在DNA合成器中安装含有5mg的5’-DMTr-dC(Bz)CPG载体(110μmol g-1)的柱,并以0.2μmol规模启动自动β-氰基乙基亚磷酰胺固相DNA合成。在5’-脱三苯基,dC亚磷酰胺耦合和封端之后中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
将80μl 0.5M双(二甲基氨基)-1-叠氮碳鎓二氯磷酸盐等分试样移至塑料瓶中,加入20μl BSA并将管旋转1min,以14,500rpm离心1min并在室温下放置30min。将50μl的等分试样移至具有载体的管中,旋转30s,以14,500rpm离心30s并在室温下震荡30min。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,组合5个核苷酸,包括dF单元,直到组合下一个dC核苷酸,中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
将50μl的第二等分试样移至具有载体的管中,旋转30s,以14,500rpm离心30s并在室温下震荡30min。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,恢复合成直到序列结束为止。
将寡核苷酸从载体上分离,并通过在室温下用Soln A处理16h来移除保护基团。
分子质谱:calc.[M]3857.76,exp.[M-H]3856.74.
实施例27.制备具有1,3-二甲基-2-(磷酰基亚胺基)咪唑烷基(FXVI)的改性寡核苷酸5’-d(GCGCCAAACpA).
在DNA合成器中安装含有5mg的5’-DMTr-dA(Bz)CPG载体(110μmol g-1)的柱,并以0.2μmol规模启动自动β-氰基乙基亚磷酰胺固相DNA合成。在5’-脱三苯基,dC亚磷酰胺耦合和封端之后中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
在100μl 1M 2-叠氮-4,5-二氢-1,3-二甲基-1H-咪唑鎓六氟磷酸盐中加入25μl BSA和5μl三乙胺,并将管旋转1min,以14,500rpm离心1min并在室温下放置30min。将内容物移至具有载体的管中,旋转30s,以14,500rpm离心30s并在室温下震荡1h。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,恢复合成直到序列结束为止。
将寡核苷酸从载体上分离并通过用Soln A在55℃下处理12h来移除保护基团.
分子质谱:calc.[M]3101.20,exp.[M-H]3101.55.
实施例28.制备具有N,N’-双(四亚甲基)-N”-磷酰基胍基(FXVII)的改性寡核苷酸5’-d(GCGCCAAACpA).
在DNA合成器中安装含有5mg的5’-DMTr-dA(Bz)CPG载体(110μmol g-1)的柱,并以0.2μmol规模启动自动β-氰基乙基亚磷酰胺固相DNA合成.在5’-脱三苯基,dC亚磷酰胺耦合和封端之后中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
在100μl 1M叠氮二吡咯碳鎓六氟磷酸盐中加入25μl BSA和5μl三乙胺,并将管旋转1min,以14,500rpm离心1min并在室温下放置30min。将内容物移至具有载体的管中,旋转30s,以14,500rpm离心30s并在室温下震荡1h。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,恢复合成直到序列结束为止。
将寡核苷酸从载体上分离并通过用Soln A在55℃下处理12h来移除保护基团.
分子质谱:calc.[M]3155.29,exp.[M-H]3153.75.
实施例29.制备具有N,N,N’,N’-四甲基磷酰基胍基(FVIII)的改性寡-2’-O-甲基核糖核苷酸5’-AUCGpU.
在DNA合成器中安装含有5mg的5’-DMTr-2’-OMe-rU CPG载体(40μmol g-1)的柱,并以0.2μmol规模启动自动β-氰基乙基亚磷酰胺固相寡-2’-O-甲基核糖核苷酸合成。在5’-脱三苯基,2’-OMe-rG亚磷酰胺耦合和封端之后中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
将40μl 0.5M双(二甲基氨基)-1-叠氮碳鎓二氯磷酸盐等分试样移至塑料瓶中,加入10μl BSA并将管旋转1min,以14,500rpm离心1min并在室温下放置30min。将内容物移至具有载体的管中,旋转30s,以14,500rpm离心30s并在室温下震荡30min。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,恢复合成直到序列结束为止。
将寡核苷酸从载体上分离并通过用Soln A在55℃下处理16h来移除保护基团.
分子质谱:calc.[M]1697.28,exp.[M+H]1697.59,[M-H]1694.77.
实施例30.制备具有N,N,N’,N’-四甲基磷酰基胍基(FVIII)的改性寡-2’-O-甲基核糖核苷酸5’-GCGCCAAACpA.
在DNA合成器中安装含有5mg的5’-DMTr-2’-OMe-rA(Bz)CPG载体(60μmol g-1)的柱,并以0.2μmol规模启动自动β-氰基乙基亚磷酰胺固相寡-2’-O-甲基核糖核苷酸合成。在5’-脱三苯基,2’-OMe-rC亚磷酰胺耦合和封端之后中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
将40μl 0.5M双(二甲基氨基)-1-叠氮碳鎓二氯磷酸盐等分试样移至塑料瓶中,加入10μl BSA并将管旋转1min,以14,500rpm离心1min并在室温下放置30min。将内容物移至具有载体的管中,旋转30s,以14,500rpm离心30s,并在40℃下震荡1h。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,恢复合成直到序列结束为止。
将寡核苷酸从载体上分离并通过用Soln A在55℃下处理12h来移除保护基团。
分子质谱:calc.[M]3403.48,exp.[M-H]3402.55.
实施例31.制备具有N,N,N’,N’-四甲基磷酰基胍基(FVIII)的改性寡-2’-O-甲基核糖核苷酸5’-GCGCCAAApCpA.
在DNA合成器中安装含有5mg的5’-DMTr-2’-OMe-rA(Bz)CPG载体(60μmol g-1)的柱,并以0.2μmol规模启动自动β-氰基乙基亚磷酰胺固相寡-2’-O-甲基核糖核苷酸合成。在5’-脱三苯基,2’-OMe-rC亚磷酰胺耦合和封端之后中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
将80μl 0.5M双(二甲基氨基)-1-叠氮碳鎓二氯磷酸盐等分试样移至塑料瓶中,加入20μl BSA并将管旋转1min,以14,500rpm离心1min并在室温下放置30min.将50μl的等分试样移至具有载体的管中,旋转30s,以14,500rpm离心30s,并在40℃下震荡1h。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,耦合2’-OMe-rU亚磷酰胺并中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
将50μl的第二等分试样移至具有载体的管中,旋转30s,以14,500rpm离心30s,并在40℃下震荡1h。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,恢复合成直到序列结束为止。
将寡核苷酸从载体上分离并通过用Soln A在55℃下处理12h来移除保护基团。
分子质谱:calc.[M]3500.64,exp.[M+H]3199.90,[M-H]3499.75.
实施例32.制备具有N,N,N’,N’-四甲基磷酰基胍基(式XIV)的改性寡-2’-O-甲基核糖核苷酸硫代磷酸酯5’-GSASCSASUSCSCSASUSUSCSASASASUSGSGSUSUрUрG;这里和以下实施例中s表示硫代磷酸酯残基(FXVIII)
在DNA合成器中安装含有5mg的5’-DMTr-2’-OMe-rG(Tac)CPG载体(60μmol g-1)的柱,并以0.2μmol规模启动自动β-氰基乙基亚磷酰胺固相寡-2’-O-甲基核糖核苷酸合成。在5’-脱三苯基,2’-OMe-rU亚磷酰胺耦合和封端之后中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
将80μl 0.5M双(二甲基氨基)-1-叠氮碳鎓二氯磷酸盐等分试样移至塑料瓶中,加入20μl BSA并将管旋转1min,以14,500rpm离心1min并在室温下放置30min。将50μl的等分试样移至具有载体的管中,旋转30s,以14,500rpm离心30s,并在40℃下震荡1h.弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,耦合2’-OMe-rA亚磷酰胺并中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
将50μl的第二等分试样移至具有载体的管中,旋转30s,以14,500rpm离心30s,并在40℃下震荡1h。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,用0.1M 3-[(二甲基氨基亚甲基)亚胺基]-3H-1,2,4-二噻唑-3-硫酮的干燥吡啶溶液进行硫化来代替碘氧化,从而恢复合成直到序列结束。
将寡核苷酸从载体上分离,通过用Soln A在70℃下处理3h来移除保护基团。
分子质谱:calc.[M]7436.14,exp.[M-H]7433.89.
实施例33.制备具有N,N,N’,N’-四甲基磷酰基胍基(FVIII)的改性寡-2’-O-甲基核糖核苷酸硫代磷酸酯5’-Flu GSASCSASUSCSCSASUSUSCSASASASUSGSGSUSUрUрG;Flu表示5’-荧光素标记(FXIXV);s表示硫代磷酸酯残基(FXVIII).
在DNA合成器中安装含有5mg的5’-DMTr-2’-OMe-rG(Tac)CPG载体(60μmol g-1)的柱,并以0.2μmol规模启动自动β-氰基乙基亚磷酰胺固相寡-2’-O-甲基核糖核苷酸合成。在5’-脱三苯基,2’-OMe-rU亚磷酰胺耦合和封端之后中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
将80μl 0.5M双(二甲基氨基)-1-叠氮碳鎓二氯磷酸盐等分试样移至塑料瓶中,加入20μl BSA并将管旋转1min,以14,500rpm离心1min并在室温下放置30min。将50μl的等分试样移至具有载体的管中,旋转30s,以14,500rpm离心30s,并在40℃下震荡1h。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,耦合2’-OMe-rA亚磷酰胺并中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
将50μl的第二等分试样移至具有载体的管中,旋转30s,以14,500rpm离心30s,并在40℃下震荡1h。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,使用0.1M 3-[(二甲基氨基亚甲基)亚胺基]-3H-1,2,4-二噻唑-3-硫酮的干燥吡啶中的溶液进行硫化来代替碘氧化,从而恢复合成直到序列结束。在DMTr ON模式下通过引入相应的荧光素亚磷酰胺来完成合成
将寡核苷酸从载体上分离and保护基团s removed by Soln A for 3h at70℃.
分子质谱:calc.[M]8003.63,exp.[M-H]8001.25.
实施例34.制备具有N,N,N’,N’-四甲基磷酰基胍基(FVIII)的改性寡-2’-O-甲基核糖核苷酸硫代磷酸酯5’-Flu GSGSCSCSASASASCSCSUSCSCSGSCSUpUpACрCрU;Flu表示5’-荧光素标记(FXIX);s表示硫代磷酸酯残基(FXVIII).
在DNA合成器中安装含有5mg的5’-DMTr-2’-OMe-rU CPG载体(40μmol g-1)的柱,并以0.2μmol规模启动自动β-氰基乙基亚磷酰胺固相寡-2’-O-甲基核糖核苷酸合成.5’-脱三苯基,2’-OMe-rC亚磷酰胺耦合和封端之后中断合成,然后氧化.从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
将160μl 0.5M双(二甲基氨基)-1-叠氮碳鎓二氯磷酸盐等分试样移至塑料瓶中,加入40μl BSA并将管旋转1min,以14,500rpm离心1min并在室温下放置30min。将50μl的等分试样移至具有载体的管中,旋转30s,以14,500rpm离心30s,并在40℃下震荡1h。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,耦合2’-OMe-rC亚磷酰胺并终止合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
将50μl的第二等分试样移至具有载体的管中,旋转30s,以14,500rpm离心30s,并在40℃下震荡1h。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,耦合2’-OMe-rA亚磷酰胺然后耦合2’-OMe-rU并中断合成,然后进行最终氧化步骤。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
将50μl第三等分试样移至具有载体的管中,旋转30s,以14,500rpm离心30s,并在45℃下震荡1.5h at 45℃.弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,耦合2’-OMe-rU亚磷酰胺并中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
将50μl第四等分试样移至具有载体的管中,旋转30s,以14,500rpm离心30s,并在45℃下震荡1.5h。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,使用0.1M 3-[(二甲基氨基亚甲基)亚胺基]-3H-1,2,4-二噻唑-3-硫酮的干燥吡啶溶液进行硫化来代替碘氧化,从而恢复合成,直到序列结束。在DMTr ON模式下通过引入相应的荧光素亚磷酰胺来完成合成。
将寡核苷酸从载体上分离,通过使用Soln A在70℃在下处理3h来移除保护基团.
分子质谱:calc.[M]7763.48,exp.[M-H]7759.37.
实施例35.制备具有N,N,N’,N’-四甲基磷酰基胍基(FVIII)的混合LNA-寡-2’-O-甲基核糖核苷酸硫代磷酸酯5’-Flu GSgSCSgSASaSASCScSUSCSCScSCSUpUpaCрCрU;Flu表示5’-荧光素标记(FXIX);s表示硫代磷酸酯残基(FXVIII).分别用小写字母a,c和g表示LNA核苷酸A、5-Me-C和G are.
在DNA合成器中安装含有5mg的5’-DMTr-2’-OMe-rU CPG载体(40μmol g-1)的柱,并以0.2μmol规模启动自动β-氰基乙基亚磷酰胺固相寡-2’-O-甲基核糖核苷酸合成。5’-脱三苯基,2’-OMe-rC亚磷酰胺耦合和封端之后中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
将160μl 0.5M双(二甲基氨基)-1-叠氮碳鎓二氯磷酸盐等分试样移至塑料瓶中,加入40μl BSA并将管旋转1min,以14,500rpm离心1min并在室温下放置30min。将50μl的等分试样移至具有载体的管中,旋转30s,以14,500rpm离心30s,并在40℃下震荡1h。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,耦合2’-OMe-rC亚磷酰胺并中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
将50μl的第二等分试样移至具有载体的管中,旋转30s,以14,500rpm离心30s,并在40℃下震荡1h。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,耦合LNA-A亚磷酰胺然后再耦合2’-OMe-rU并中断合成,然后进行最终氧化步骤.从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
将50μl第三等分试样移至具有载体的管中,旋转30s,以14,500rpm离心30s,并在45℃下震荡1.5h弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,耦合2’-OMe-rU亚磷酰胺并中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
将第四等分试样50μl移至具有载体的管中,旋转30s,以14,500rpm离心30s,并在45℃下震荡1.5h.弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,使用0.1M 3-[(二甲基氨基亚甲基)亚胺基]-3H-1,2,4-二噻唑-3-硫酮的干燥吡啶溶液进行硫化来代替碘氧化,并使用LNA和2’-OMe亚磷酰胺恢复合成,直到序列结束。在DMTr ON模式下通过引入相应的荧光素亚磷酰胺来完成合成。
将寡核苷酸从载体上分离,通过在70℃下用Soln A处理3小时可以移除保护基团。
分子质谱:calc.[M]7793.47,exp.[M-H]7792.92.
实施例36.制备具有1,3-二甲基-2-(磷酰基亚胺基)咪唑烷基(FXVI)的改性寡-2’-O-甲基核糖核苷酸5’-UUUUUpU.
在DNA合成器中安装含有5mg的5’-DMTr-2’-OMe-rU CPG载体(40μmol g-1)的柱,并以0.2μmol规模启动自动β-氰基乙基亚磷酰胺固相寡-2’-O-甲基核糖核苷酸合成。5’-脱三苯基,2’-OMe-rU亚磷酰胺耦合和封端之后中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
在100μl 1M 2-叠氮-4,5-二氢-1,3-二甲基-1H-咪唑鎓六氟磷酸盐中加入25μl BSA和5μl三乙胺,并将管旋转1min,以14,500rpm离心1min并在室温下放置30min。将内容物移至具有载体的管中,旋转30s,以14,500rpm离心30s并在室温下震荡1h。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,恢复合成直到序列结束为止。
将寡核苷酸从载体上分离,并在室温下用Soln A移除保护基团1h。寡核苷酸的RP-HPLC曲线示于图4.
分子质谱:calc.[M]1954.37,exp.[M-H]1953.37.
实施例37.制备具有N,N’-双(四亚甲基)-N”-磷酰基胍基(FXVII)的改性寡-2’-O-甲基核糖核苷酸5’-UUUUUpU.
在DNA合成器中安装含有5mg的5’-DMTr-2’-OMe-rU CPG载体(40μmol g-1)的柱,并以0.2μmol规模启动自动β-氰基乙基亚磷酰胺固相寡-2’-O-甲基核糖核苷酸合成。5’-脱三苯基,2’-OMe-rU亚磷酰胺耦合和封端之后中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
在100μl 1M叠氮二吡咯碳鎓六氟磷酸盐中加入25μl BSA和5μl三乙胺,并将管旋转1min,以14,500rpm离心1min并在室温下放置30min。将内容物移至具有载体的管中,旋转30s,以14,500rpm离心30s并在室温下震荡1h。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,恢复合成直到序列结束为止。
将寡核苷酸从载体上分离,并在室温下用Soln A移除保护基团1h。寡核苷酸的RP-HPLC曲线示于图4.
分子质谱:calc.[M]2008.46,exp.[M-H]2007.57.
实施例38.制备改性寡核苷酸5’-d(TTTTTpT)with the N,N-二甲基磷酰基胍group(FXX).
在DNA合成器中安装含有5mg的高加载5’-DMTr-dT CPG载体(110μmol g-1)的柱,并以0.2μmol规模启动自动β-氰基乙基亚磷酰胺固相DNA合成。在5’脱三苯基,亚磷酰胺耦合和封端之后中断合成,然后氧化.从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
在塑料管中加入12mg的(氯亚甲基)二甲基氯化铵和4mg(1.1当量)NaN3,加入100μl干燥MeCN并在30℃下将管震荡2h,以14,500rpm离心5min,加入25μl BSA,将管旋转1min,以14,500rpm离心1min,将上清液移至具有载体的管中,旋转30s,以14,500rpm离心30s并在室温下震荡30min.弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,重复β-氰基乙基亚磷酰胺固相合成直到序列结束。
将寡核苷酸从载体上分离,使用Soln A在55℃下处理18h来移除保护基团。
分子质谱:calc.[M]1832.22,exp.[M-H]1831.57.
实施例39.制备具有N-磷酰基甲脒基(FXXI)的改性寡核苷酸5’-d(TTTTTpT).
在DNA合成器中安装含有5mg的高加载5’-DMTr-dT CPG载体(110μmol g-1)的柱,并以0.2μmol规模启动自动β-氰基乙基亚磷酰胺固相DNA合成。在5’脱三苯基,亚磷酰胺耦合和封端之后中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
通过将碘催化剂以0.2M浓度溶解到干燥吡啶中来制备Soln 1(51mg/ml).通过在塑料管中称量40mg干燥甲脒盐酸盐,加入375μl干燥吡啶,75μl DBU和50μl BSA,并将管旋转3-4分钟并超声至澄清(ca.3-4min)来制备Soln 2。在塑料管中混合20μl的Soln 1和2的混合试样,加入10μl的BSA,等待1min之后将内容物移至具有聚合物的管中。将该管旋转30s,以14,500rpm离心15s并在室温下震荡5min。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,重复β-氰基乙基亚磷酰胺固相合成直到序列结束。
将寡核苷酸从载体上分离,并在室温下用Soln A移除保护基团1h。
分子质谱:calc.[M]1789.27,exp.[M-H]1788.60.
实施例40.制备具有N-氰基亚胺基磷酸酯基(FXXII)的改性寡核苷酸5’-d(TTTTTpT).
在DNA合成器中安装含有5mg的高加载5’-DMTr-dT CPG载体(110μmol g-1)的柱,并以0.2umol的规模启动自动β-氰基乙基亚磷酰胺固相DNA合成.在5’脱三苯基,亚磷酰胺耦合和封端之后中断合成,然后氧化.从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中.
在20μl按照McMurry所描述的方式制备的0.25M叠氮化氰的干燥MeCN溶液中[51]加入5μl BSA并将管在室温下保持15min,将内容物移至具有载体的管中,旋转30s,以14,500rpm离心15s并在室温下震荡5min。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,重复β-氰基乙基亚磷酰胺固相合成直到序列结束。
将寡核苷酸从载体上分离,通过用Soln B在70℃下处理1h来移除保护基团。
分子质谱:calc.[M]1787.25,exp.[M+H]1787.27,[M-H]1785.19.
实施例41.制备具有N-氰基亚胺基磷酸酯基(FXXII)的改性寡核苷酸5’-d(TpTTTTT).
在DNA合成器中安装含有5mg的高加载5’-DMTr-dT CPG载体(110μmol g-1)的柱,并以0.2μmol规模启动自动β-氰基乙基亚磷酰胺固相DNA合成。在组合dT,5’-脱三苯基,dT亚磷酰胺耦合和封端的4个循环之后中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
在20μl按照McMurry的描述制备的0.25M叠氮化氰的干燥MeCN溶液中[51]加入5μl BSA并将管在室温下保持15min,将内容物移至具有载体的管中,旋转30s,以14,500rpm离心15s并在室温下震荡5min。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,重复β-氰基乙基亚磷酰胺固相合成直到序列结束。
将寡核苷酸从载体上分离,并通过用Soln B在70℃下处理1h来移除保护基团。寡核苷酸的RP-HPLC曲线示于图5。
分子质谱:calc.[M]1787.25,exp.[M+H]1787.19,[M-H]1785.11.
实施例42.制备具有3’-N,N’-双(四亚甲基)-N”-胍基磷酸酯基(FXXIII)的改性核苷dTp.
在DNA合成器中安装含有5mg的3’-磷酸酯CPG载体(30-40μmol g-1)的柱,并以0.2μmol规模启动自动β-氰基乙基亚磷酰胺固相DNA合成。5’-脱三苯基,dT亚磷酰胺耦合和封端之后中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
在100μl 1M叠氮二吡咯碳鎓六氟磷酸盐中加入25μl BSA和5μl三乙胺,并将管旋转1min,以14,500rpm离心1min并在室温下放置30min。将内容物移至具有载体的管中,旋转30s,以14,500rpm离心30s并在室温下震荡1h。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,并通过5’-脱三苯基来完成合成。
通过用Soln A在室温下处理1h来使核苷酸从载体上脱离。
分子质谱:calc.[M]471.45,exp.[M-H]471.08.
实施例43.制备具有3’-N,N’-双(四亚甲基)-N”-胍基磷酸酯基(FXXIII)的改性寡核苷酸5’-d(TTTTTT)p.
在DNA合成器中安装含有5mg的3’-磷酸酯CPG载体(30-40μmol g-1)的柱,并以0.2μmol规模启动自动β-氰基乙基亚磷酰胺固相DNA合成。5’-脱三苯基,dT亚磷酰胺耦合和封端之后中断合成,然后氧化.从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
在100μl 1M叠氮二吡咯碳鎓六氟磷酸盐中加入25μl BSA和5μl三乙胺,并将管旋转1min,以14,500rpm离心1min并在室温下放置30min。将内容物移至具有载体的管中,旋转30s,以14,500rpm离心30s并在室温下震荡1h。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,恢复合成直到序列结束为止。
通过用Soln A在室温下处理1h来使核苷酸从载体上脱离。寡核苷酸的RP-HPLC示于图6。
分子质谱:calc.[M]1992.44,exp.[M-H]1991.46.
实施例44.制备具有5’-N,N’-双(四亚甲基)-N”-磷酰基胍基和荧光素标记(FXXIV)的改性胸苷核苷.
在DNA合成器中安装含有5mg的高加载5’-DMTr-dT CPG载体(110μmol g-1)的柱,以0.2μmol启动自动β-氰基乙基亚磷酰胺固相DNA合成,使用与实施例25中相同的荧光素亚磷酰胺。中断合成,然后氧化,从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
在100μl 1M叠氮二吡咯碳鎓六氟磷酸盐中加入25μl BSA和5μl三乙胺,并将管旋转1min,以14,500rpm离心1min并在室温下放置30min。将内容物移至具有载体的管中,旋转30s,以14,500rpm离心30s并在室温下震荡1h.弃去上清液,用2×200μl MeCN冲洗载体,并在空气中干燥5min。
通过使用Soln A在室温下处理1h使核苷酸从载体脱离。寡核苷酸的RP-HPLC示于图6.
分子质谱:calc.[M]1263.32,exp.[M-H]1262.22.
实施例45.制备具有5’-N,N’-双(四亚甲基)-N”-磷酰基胍基和荧光素标记(FXXIV)的改性寡核苷酸5’-Flu pd(TTTTTT).
在DNA合成器中安装含有5mg的高加载5’-DMTr-dT CPG载体(110μmol g-1)的柱,以0.2μmol启动自动β-氰基乙基亚磷酰胺固相DNA合成。组合5个dT残基和一个荧光素标签Flu’(XXV)然后中断合成,然后进行最后的氧化步骤。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
在100μl 1M叠氮二吡咯碳鎓六氟磷酸盐中加入25μl BSA和5μl三乙胺,并将管旋转1min,以14,500rpm离心1min并在室温下放置30min。将内容物移至具有载体的管中,旋转30s,以14,500rpm离心30s并在室温下震荡1h。弃去上清液,用2×200μl MeCN冲洗载体,并在空气中干燥5min。
通过用Soln A在室温下处理1h来将寡核苷酸从载体上分离。寡核苷酸的RP-HPLC示于图6.
分子质谱:calc.[M]2784.31,exp.[M-H]2782.96.
实施例46.制备具有1,3-二甲基-2-(磷酰基亚胺基)咪唑烷基(FXVI)的改性杂交DNA-RNA寡核苷酸5’-d(TTTT)rUpdT.
在DNA合成器中安装含有5mg的高加载5’-DMTr-dT CPG载体(110μmol g-1)的柱,以0.2μmol规模启动自动β-氰基乙基亚磷酰胺固相寡核苷酸合成。5’-脱三苯基,2’-TOM-rU亚磷酰胺耦合和封端之后中断合成,然后氧化。从合成器上分离柱子,连接水泵,用MeCN冲洗,将附着有亚磷酸酯的载体移至所料管中。
在100μl 1M 2-叠氮-4,5-二氢-1,3-二甲基-1H-咪唑鎓六氟磷酸盐中加入25μl BSA和5μl三乙胺,并将管旋转1min,以14,500rpm离心1min并在室温下放置30min。将内容物移至具有载体的管中,旋转30s,以14,500rpm离心30s并在室温下震荡1h。弃去上清液,用2×200μl MeCN冲洗载体,移至合成器柱中,恢复合成直到序列结束为止。
将寡核苷酸从载体上分离,并在室温下用Soln A移除保护基团1h。通过通过用三乙胺三氢氟酸盐–三乙胺–NMP(4:3:6v/v/v)在65℃处理2h来移除TOM基团。
分子质谱:calc.[M]1860.34,exp.[M-H]1859.21.
实施例47.用自动DNA合成器制备用1,3-二甲基-N-磷酰基亚胺基-2-咪唑烷基(FXVI)改性的寡脱氧核糖核苷酸5’-d(TTTTTрT),5’-d(TTTTpTрT),5’-d(TTTpTpTрT),5’-d(TTpTpTpTрT),5’-d(TpTpTpTpTрT)и5’-d(GpCpGpCpCpApApApCpA)的方案。
在DNA合成器中安装含有5mg的5’-DMTr-dT或dA CPG载体(35-110μmol g-1)的柱并以0.2μmol规模启动自动β-氰基乙基亚磷酰胺固相DNA合成,以利用1M 2-叠氮-4,5-二氢-1,3-二甲基-1H-咪唑鎓六氟磷酸盐的乙腈溶液进行处理来代替序列中对应位点(p)的碘氧化。
通过用Soln A在55℃下处理12h来使寡核苷酸从载体脱离,对于寡核苷酸5’-d(GpCpGpCpCpApApApCpA)或对于寡胸苷酸,在室温下处理1h。寡核苷酸的RP-HPLC示于图7和8。
分子质谱:
5’-d(TTTTTрT)–calc.[M]1858.37,exp.[M-H]1857.57;
5’-d(TTTTpTрT)–calc.[M]1953.32,exp.[M-H]1952.57;
5’-d(TTTpTpTрT)–calc.[M]2048.67,exp.[M-H]2047.77;
5’-d(TTpTpTpTрT)–calc.[M]2143.82,exp.[M-H]2142.77;
5’-d(TpTpTpTpTрT)–calc.[M]2238.96,exp.[M-H]2237.97;
5’-d(GpCpGpCpCpApApApCpA)–calc.[M]3862.38,exp.[M-H]3860.50.
参考文献
为了更充分地描述和公开本发明以及本发明所述的技术领域,本文引用了许多出版物。以下给出了这些文献的完整引用信息。这些文献中的每一个都通过引用将其整体并入本公开中,已达到每个独立的参考文献被具体且独立地表明通过引用而被并入本公开的程度。
(1)Therapeutic寡核苷酸,J.Goodchild(ed.),Methods Mol.Biol.764,Humana Press,2011.
(2)Bell,N.M.;Micklefield,J.ChemBi℃hem 2009,10,2691.
(3)Mulamba,G.B.;Hu,A.;Azad,R.F.;Anderson,K.P.;Coen,D.M.Antimicrob.Agents Chemother.1998,42,971.
(4)Vinores,S.A.Int.J.Nanomed.2006,1,263.
(5)Merki,E.:Graham,M.J.;Mullick,A.E.et al.Circulation 2008,118,743.
(6)Duca,M.;Vekhoff,P.;Oussedik,K.;Halby,L.;Arimondo,P.B.Nucl.Acids Res.2008,36,5123.
(7)Nielsen,P.E.Curr.Opin.Mol.Ther.2010,12,184.
(8)Zamecnik,P.C.;Stephenson,M.L.Pr℃.Natl.Acad.Sci.USA 1978,75,280.
(9)Behlke,M.A.寡核苷酸2008,18,305.
(10)Xu,Z.J.;Yang,L.F.;Sun,L.Q.;Cao,Y.Chin.Sci.Bull.2012,57,3404.
(11)Wilson,C.;Keefe,A.D.Curr.Opin.Chem.Biol.2006,10,607.
(12)Lee,J.F.;Stovall,G.M.;Ellington,A.D.Curr.Opin.Chem.Biol.2006,10,282.
(13)Du,L.;Gatti,R.A.Curr.Opin.Mol.Ther.2009,11,116;Pérez,B.;Laura Rodríguez-Pascau,L.;Vilageliu,L.;Grinberg,D.;Ugarte,M.;Desviat,L.R.J.Inherit.Metabol.Disease 2010,33,397.
(14)Ruckman,J.;Green,L.S.;Beeson,J.;Waugh,S.;Gillette,W.L.;Henninger,D.D.;Claesson-Welsh,L.;N.J.Biol.Chem.1998,273,20556.
(15)Lamond,A.I.;Sproat,B.S.FEBS Lett.1993,325,123.
(16)Chi,K.N.;Eisenhauer,E.;Jones,E.C.;Goldenberg,S.L.,Powers,J.;Tu,D.;Gleave,M.E.J.Natl.Cancer Inst.2005,97,1287.
(17)Kaur,H.;Babu,B.R.;Maiti,S.Chem.Rev.2007,107,4672.
(18)A.;Engels,J.Tetrahedron Lett.1984,25,1437.
(19)Hau,J.F.;Asseline,U.;Thuong,N.T.Tetrahedron Lett.1991,32,2497.
(20)Jager,A.;Levy,M.J.;Hecht,S.M.Bi℃hemistry 1988,27,7237.
(21)Egholm.M.;Buchardt,O.;Nielsen,P.E.;Berg,R.H.J.Am.Chem.S℃.1992,114,1895.
(22)Summerton,J.;Weller,D.Antisense Nucl.Acid Drug Dev.1997,7,187.
(23)Stein,C.A.;Subasinghe,C.;Shinozuka,K.;Cohen,J.S.Nucl.AcidsRes.1988,16,3209.
(24)B.M.;Hudson,R.H.E.;Damha,M.J.Bi℃onjugate Chem.2007,18,421.
(25)Crooke,S.T.Methods Enzymol.2000,313,3.
(26)Behlke,M.A.寡核苷酸2008,18,305.
(27)Xu,Z.J.;Yang,L.F.;Sun,L.Q.;Cao,Y.Chin.Sci.Bull.2012,57,3404.
(28)Stec,W.J.;Zon,G.;Egan,W.;Stec,B.J.Am.Chem.S℃.1984,106,6077.
(29)Seeberger,P.H.;Caruthers,M.H.J.Am.Chem.S℃.1995,117,1472.
(30)Hall,A.H.;Wan,J.;Spes℃k,A.;Sergueeva,Z.;Shaw,B.R.;Alexander,K.A.核酸s Res.2006,34,2773.
(31)Beaucage,S.L.;Caruthers,M.H.Tetrahedron Lett.1981,22,1859.
(32Sazani,P.;Kang,S.-H.;Maier,M.A.;Wei,C.;Dillman,J.;Summerton,J.;Manoharan,M.;Kole,R.Nucl.Acids Res.2001,29,3965.
(33)Froehler,B.;Ng,P.;Matteucci,M.Nucl.Acids Res.1988,16,4831.
(34)Dolinnaya,N.G.;Sokolova,N.I.;Gryaznova,O.I.;Shabarova,Z.A.Nucl.Acids Res.1988,16,3721.
(35)Mignet,N.;Gryaznov,S.M.Nucl.Acids Res.1998,26,431.
(36)Letsinger,R.L.;Singman,C.N.;Histand,G.;Salunkhe,M.J.Am.Chem.S℃.1988,110,4470.
(37)Summerton,J.;Weller,D.Antisense Nucl.Acid Drug Dev.1997,7,187.
(38)Dellinger et al.J.Am.Chem.S℃.2003,125,940.
(39)Yamada et al.J.Am.Chem.S℃.2006,128,5251.
(40)Krishna,H.;Caruthers,M.H.J.Am.Chem.S℃.2012,134,11618.
(41)WO2007/059816A1and WO2008/128686A1.
(42)Summerton,J.;Weller,D.Antisense Nucl.Acid Drug Dev.1997,7,187.
(43)Mendell,J.;Rodino-Klapac,L.R.;Sahenk,Z.;Roush,K.;Bird,L.;Lowes,L.P.;Alfano,L.;Gomez,A.M.;Lewis,A.;Kota,J.et al.Ann.Neurol.2013,74,637;www.clinicaltrials.gov/ct2/show/NCT01396239.
(44)
mail.pipelinereview.com/index.php/2014021053402/DNA-RNA-and-Cells/Sarepta-Therapeutics-Announces-Positive-Safety-Results-from-Phase-I-Clinical-Study-of-Marburg-Drug-Candidate.html.
(45)Summerton,J.E.In肽核酸s,Morpholinos和Related Antisense Biomolecules(Janson,C.G.;During,M.J.,Eds),2003,Kluwer Academic/Plenum Publishers,Chapter 6.
(46)Summerton,J.;Weller,D.Antisense Nucl.Acid Drug Dev.1997,7,187.
(47)Reese,C.B.,Ubasawa,A.Tetrahedron Lett.1980,21,2265.
(48)Jones,S.S.;Reese,C.B.;Sibanda,S.;Ubasawa,A.Tetrahedron Lett.1981,22,4755.
(49)Swenson,D.L.;Warfield,K.L.;Warren,T.K.;Lovejoy,C.;Hassinger,J.N.;Ruthel,G.;Blouch,R.E.;Moulton,H.M.;Weller,D.D.;Iversen,P.L.;Bavari,S.Antimicrob.Agents Chemother.2009,53,2089;Mellbye,B.M.;Weller,D.D.;Hassinger,J.N.;Reeves,M.D.;Lovejoy,C.E.;Iversen,P.L.;Geller,B.L.J.Antimicrob.Chemother.2010,65,98.
(50)Jearawiriyapaisarn,N.;Moulton,H.M.;Buckley,B.;Roberts,J.;Sazani,P.;Fucharoen,S.;Iversen,P.L.;Kole,R.Mol.Ther.2008,16,1624;Wu,B.;Moulton,H.M.;Iversen,P.L.;Juang,J.;Li,J.;Spurney,C.F.;Sali,A.;Guerron,A.D.;Nagaraju,K.;Doran,T.et al.Pr℃.Natl.Acad.Sci.USA 2008,105,14814;Yin,H.;Moulton,H.M.;Seow,Y.;Boyd,C.;Boutilier,J.;Iversen,P.;Wood,M.J.A.Human Mol.Genetics 2008,17,3909.
(51)McMurry,J.E.;Coppolino,A.P.J.Org.Chem.1973,38,2821.
(52)Alimov,P.I.;Levkova,L.N.Izv.Аkаd.Nauk SSSR,Ser.Khim.1964,1889;Cates,L.A.;Ferguson,N.M.J.Pharm.Chem.1966,55,966.
(53)Rathgeb,P.,US patent 4154826A,priority date 30th December 1976.
(54)Sherif,F.G.,US patent 3634555A,priority date 31st July 1969.
(55)Anatol,J.;Vidalenc,H.;Loiseau,G.,US patent 3769406A,priority date 19th June 1970.
(56)Lin,W.O.;Guimarātes,C.N.;De Souza,J.B.N.;Alt,H.G.Phosphorus Sulfur 1994,92,1.
(57)A.;Levy,M.J.;Hecht,S.M.Bi℃hemistry 1988,27,7237.
(58)Sinha,N.D.;Biernat,J.;McManus,J.;H.核酸s Res.1984,12,4539.
(59)Xi,S.-K.;Zhao,Y.-F.Synth.Commun.1990,20,3295.
(60)Kitamura,M.;Yano,M.;Tashiro,N.;Miyagawa,S.;Sando,M.;Okauchi,T.Eur.J.Org.Chem.2011,458.
(61)Kokel,B.;Viehe,H.G.Angew.Chem.Int.Ed.Engl.1980,19,716.
(62)Boyd,G.V.;Lindley,P.F.;Mitchell,J.C.;Nicolaou,G.A.J.Chem.S℃.Chem.Commun.1985,1522.
(63)Garegg,P.J.;Lindh,I.;Regberg,T.;Stawinski,J.;R.Tetrahedron Lett.1986,27,4051.
(64)Atherton,F.R.;Openshaw,H.T.;Todd,A.R.J.Chem.S℃.1945,660.
(65)Barnett,R.W.;Letsinger,R.L.Tetrahedron Lett.1981,22,991.
(66)Froehler,B.C.;Ng,P.G.;Matteucci,M.D.核酸s Res.1986,14,5399.
(67)Bezgubenko,L.V.;Pipko,S.E.;Shalimov,A.A.;Sinitsa,A.D.Heteroatom Chemistry 2008,19,408.
序列表
<110> NooGen LLC
<120> 改性寡核苷酸及其制备方法
<130> RIC/FP6992291
<160> 10
<170> PatentIn version 3.3
<210> 1
<211> 10
<212> DNA
<213> 人工序列
<220>
<223> 合成改性寡核苷酸
<220>
<221> misc_feature
<222> 1..2, 2..3, 3..4, 4..5, 5..6, 6..7, 7..8, 8..9, 9..10
<223> 在一个实施方式中, N,N,N',N'-四甲基磷酰基胍基
<220>
<221> misc_feature
<222> 6..7, 9..10
<223> 在一个实施方式中, N,N,N',N'-四甲基磷酰基胍基
<220>
<221> misc_feature
<222> 7..8, 9..10
<223> 在一个实施方式中, N,N,N',N'-四甲基磷酰基胍基
<220>
<221> misc_feature
<222> 7..8, 8..9, 9..10
<223> 在一个实施方式中, N,N,N',N'-四甲基磷酰基胍基
<220>
<221> misc_feature
<222> 8..9, 9..10
<223> 在一个实施方式中, N,N,N',N'-四甲基磷酰基胍基
<220>
<221> misc_feature
<222> (9)..(10)
<223> 在一个实施方式中, N,N,N',N'-四甲基磷酰基胍基
<220>
<221> misc_feature
<222> (9)..(10)
<223> 在一个实施方式中, 1,3-二甲基-2-(磷酰基亚胺基)咪唑烷
<220>
<221> misc_feature
<222> (9)..(10)
<223> 在一个实施方式中, N,N'-双(四亚甲基)-N"-磷酰基胍基
<400> 1
gcgccaaaca 10
<210> 2
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 合成改性寡核苷酸
<220>
<221> misc_feature
<222> (2)..(3)
<223> 在一个实施方式中, N,N,N',N'-四甲基磷酰基胍基
<220>
<221> misc_feature
<222> 2..3, 19..20
<223> 在一个实施方式中, N,N,N',N'-四甲基磷酰基胍基
<220>
<221> misc_feature
<222> 2..3, 11..12, 19..20
<223> 在一个实施方式中, N,N,N',N'-四甲基磷酰基胍基
<220>
<221> misc_feature
<222> (11)..(12)
<223> 在一个实施方式中, N,N,N',N'-四甲基磷酰基胍基
<220>
<221> misc_feature
<222> (19)..(20)
<223> 在一个实施方式中, N,N,N',N'-四甲基磷酰基胍基
<220>
<221> misc_feature
<222> (19)..(20)
<223> 在一个实施方式中, 磷酰基胍基
<400> 2
tttttttttt tttttttttt 20
<210> 3
<211> 13
<212> DNA
<213> 人工序列
<220>
<223> 合成改性寡核苷酸
<220>
<221> misc_feature
<222> (12)..(13)
<223> 在一个实施方式中, N,N,N',N'-四甲基磷酰基胍基
<400> 3
ggaaggggag aga 13
<210> 4
<211> 16
<212> DNA
<213> 人工序列
<220>
<223> 合成改性寡核苷酸
<220>
<221> misc_feature
<222> (16)..(16)
<223> 经由N,N,N',N'-四甲基磷酰基胍基共价连接至BHQ
<400> 4
aacgtcaggg tcttcc 16
<210> 5
<211> 15
<212> DNA
<213> 人工序列
<220>
<223> 合成改性寡核苷酸
<220>
<221> misc_feature
<222> (1)..(1)
<223> 连接至Flu, 5(6)-羟基荧光素标记
<220>
<221> misc_feature
<222> (5)..(6)
<223> 通过1,12-十二烷二醇磷酸酯连接
<220>
<221> misc_feature
<222> (15)..(15)
<223> 经由N,N,N',N'-四甲基磷酰基胍基共价连接至BHQ
<400> 5
ggaagccctg acgtt 15
<210> 6
<211> 12
<212> DNA
<213> 人工序列
<220>
<223> 合成改性寡核苷酸
<220>
<221> misc_feature
<222> (6)..(7)
<223> (N,N,N',N'-四甲基磷酰基胍基) -
(2-羟基甲基-3-羟基四氢呋喃 (脱嘌呤/脱嘧啶
位点) 磷酸酯)
<220>
<221> misc_feature
<222> (11)..(12)
<223> N,N,N',N'-四甲基磷酰基胍基
<400> 6
tctctccctt cc 12
<210> 7
<211> 10
<212> RNA
<213> 人工序列
<220>
<223> 合成改性寡-2'-O-甲基核糖核苷酸
<220>
<221> misc_feature
<222> 8..9, 9..10
<223> 在一个实施方式中, N,N,N',N'-四甲基磷酰基胍基
<220>
<221> misc_feature
<222> (9)..(10)
<223> 在一个实施方式中, N,N,N',N'-四甲基磷酰基胍基
<400> 7
gcgccaaaca 10
<210> 8
<211> 21
<212> RNA
<213> 人工序列
<220>
<223> 合成改性寡-2'-O-甲基核糖核苷酸
<220>
<221> misc_feature
<222> 1..2, 2..3, 3..4, 4..5, 5..6, 6..7, 7..8, 8..9, 9..10, 10..11
<223> 在实施例32和33的实施方式中, 硫代磷酸酯残基
<220>
<221> misc_feature
<222> (1)..(1)
<223> 在实施例33的实施方式中, 连接至Flu,
5(6)-羧基荧光素标记
<220>
<221> misc_feature
<222> 11..12, 12..13, 13..14, 14..15, 15..16, 16..17, 17..18, 18..19
<223> 在实施例32和33的实施方式中, 硫代磷酸酯残基
<220>
<221> misc_feature
<222> 19..20, 20..21
<223> 在实施例32和33的实施方式中, N,N,N',N'-四甲基
磷酰基胍基
<400> 8
gacauccauu caaaugguuu g 21
<210> 9
<211> 20
<212> RNA
<213> 人工序列
<220>
<223> 合成改性的寡-2'-O-甲基核糖核苷酸
<220>
<221> misc_feature
<222> (1)..(1)
<223> 连接至Flu, 5(6)-羧基荧光素标记
<220>
<221> misc_feature
<222> 1..2, 2..3, 3..4, 4..5, 5..6, 6..7, 7..8, 8..9, 9..10
<223> 硫代磷酸酯残基
<220>
<221> misc_feature
<222> 10..11, 11..12, 12..13, 13..14, 14..15
<223> 硫代磷酸酯残基
<220>
<221> misc_feature
<222> 15..16, 16..17, 18..19, 19..20
<223> N,N,N',N'-四甲基磷酰基胍基
<400> 9
ggccaaaccu ccgcuuaccu 20
<210> 10
<211> 20
<212> RNA
<213> 人工序列
<220>
<223> 合成的混合LNA-寡-2'-O-甲基核糖核苷酸
硫代磷酸酯
<220>
<221> misc_feature
<222> (1)..(1)
<223> 连接至Flu, 5(6)-羧基荧光素标记
<220>
<221> misc_feature
<222> 1..2, 2..3, 3..4, 4..5, 5..6, 6..7, 7..8, 8..9, 9..10
<223> 硫代磷酸酯残基
<220>
<221> misc_feature
<222> 2, 4, 6, 9, 13, 17
<223> LNA base
<220>
<221> misc_feature
<222> 10..11, 11..12, 12..13, 13..14, 14..15
<223> 硫代磷酸酯残基
<220>
<221> modified_base
<222> 9, 13
<223> m5c
<220>
<221> misc_feature
<222> 15..16, 16..17, 18..19, 19..20
<223> N,N,N',N'-四甲基磷酰基胍基
<400> 10
ggcgaaaccu ccccuuaccu 20
- 还没有人留言评论。精彩留言会获得点赞!
- 基于DNA酶嵌合引物的核酸筛查生物传感器的制造方法与工艺
- 一种高密度、高稳定性的核酸芯片及其制备方法与流程
- CYP2C9*3基因多态性快速检测的引物、分子信标、试剂盒及其检测方法与流程
- 黄牛ADNCR基因单核苷酸多态性的四引物扩增受阻突变体系PCR检测方法及其应用与制造工艺
- 一种原位杂交探针及其对大麦染色体组鉴定的方法与制造工艺
- 一种大麦亚端粒寡核苷酸探针及其应用的制造方法与工艺
- 一种核酸检测的复合物及其制备方法与核酸检测的方法与制造工艺
- 用于检测人类ROS1融合基因的核酸、试剂盒及方法与制造工艺
- 一种特异性结合GPC3的核酸适配体及其应用的制造方法与工艺
- 一种单链核酸分子、聚合酶活性测定方法及试剂盒与制造工艺
- 一种基于短链核酸探针和双链特异性核酸内切酶的高特异性microRNA荧光检测方法与流程
- IL‑1‑α和‑β双特异性双重可变结构域免疫球蛋白及其用途的制造方法与工艺
- 一种特异性标记家蚕微孢子虫的核酸探针及其原位荧光杂交检测方法与流程
- 核酸的等位基因特异性扩增的制造方法与工艺
- 一种特异性检测弓形虫核酸的荧光PCR方法和试剂盒与流程
- 一种特异性检测人类微小病毒B19核酸的荧光PCR方法和试剂盒与流程
- 一种特异性结合新城疫病毒的核酸适配体及其筛选方法和应用与流程
- 球形核酸纳米颗粒缀合物的序列特异性细胞摄取的制造方法与工艺
- 一种鸭特异性CpG寡脱氧核苷酸及其应用的制造方法与工艺
- 一种IgE特异性核酸适配子、其应用及适配子药物的制造方法与工艺