突变的泛素化特异性蛋白酶33基因及其应用的制作方法
本发明属于分子生物学领域,具体涉及一种突变的泛素化特异性蛋白酶33基因及其在生产治疗结直肠癌药物中的应用。
背景技术:
结直肠癌(colorectal cancer)现已成为全球三大常见肿瘤之一。按照世界卫生组织(WHO)公布的数据显示,结直肠癌在男性中为第三大易发肿瘤,仅次于肺癌、胃癌;在女性中为第二大易发肿瘤,仅次于乳腺癌,目前全球每年新增结直肠癌病例超过100万。在我国,结直肠癌的死亡率仅次于肺癌、胃癌、肝癌、食管癌,位居第5位,严重危害居民健康,给社会和家庭经济造成沉重负担。其中由癌细胞转移导致的死亡是结直肠癌致死的主要原因之一。结直肠癌的转移发生涉及到细胞内一系列复杂的生物化学反应,在深入研究结直肠癌发生和发展的分子机制基础上,进一步探索促进结直肠癌细胞增殖和侵袭迁移的分子机制及分子靶标,揭示其作用机制是肿瘤领域的研究热点,具有重要的科学意义和临床价值,更具有潜在的经济效应和社会效应。
赖氨酸去甲基化酶5B(lysine-specific demethylase 5B,KDM5B),又叫JARID1B,是一重要的组蛋白去甲基化酶,属于JARID1家族蛋白之一。JARID1家族共有4种蛋白,分别为:KDM5A,KDM5B,KDM5C,KDM5D。JARID1家族蛋白的特点是含有进化保守的5个蛋白结构域,其对基因的转录与调控起重要作用。
USP33(ubiquitin specific protease 33),即泛素化特异性蛋白酶33,是一种去泛素化酶。USP33通过Slit2-Robo信号通路参与神经细胞的生长发育、肿瘤细胞的侵袭与迁移。正常细胞内,USP33可以将泛素化的Robo受体去泛素化,从而稳定Robo,并通过Slit2-Robo信号通路影响胞浆中Actin cytoskeleton结构,而抑制细胞的迁移;但在肿瘤细胞内,由于USP33的表达量低下,导致泛素化的Robo受体不能及时去泛素化而被降解,Slit2-Robo信号通路不能正常发挥作用而引起肿瘤细胞的侵袭和迁移。
技术实现要素:
本发明提供了一种突变的泛素化特异性蛋白酶33基因及其在生产治疗结直肠癌药物中的应用。
突变的泛素化特异性蛋白酶33基因,它的碱基序列如序列表SEQ ID NO.2所示。
一种表达载体,它是表达载体中插入了如序列表SEQ ID NO.2所示的基因。
所述的表达载体为pGL4.15。
突变的泛素化特异性蛋白酶33基因在生产治疗结直肠癌药物中的应用。
本发明提供了一种突变的泛素化特异性蛋白酶33基因及其在生产治疗结直肠癌药物中的应用,经研究发现,KDM5B在结肠癌临床样本和结肠癌细胞系中高表达,通过抑制USP33进而促进结肠癌细胞的增殖。KDM5B抑制剂或其单克隆抗体,能够显著抑制结肠癌细胞的增殖。进一步研究证明,KDM5B与USP33基因启动子区结合,抑制USP33基因的表达是通过结合其上游特异性调控序列GCACA/C或G/TGTGC来实现的。定点突变PCR技术获得的突变的泛素化特异性蛋白酶33基因,可以抵抗KDM5B的抑制作用。从而抑制结肠癌细胞系的生长。
附图说明
图1结直肠癌临床组织样本KDM5B和USP33的免疫组化检测结果;
图2结直肠癌细胞系中KDM5B和USP33蛋白水平检测结果;
图3 KDM5B与USP33启动子区结合的检测结果;
图4 KDM5B抑制USP33转录的检测结果;
图5 KDM5B瞬时转染后抑制USP33转录的检测结果;
图6 KDM5B抑制剂PBIT抑制肿瘤细胞增殖的检测结果;
图7 KDM5B抑制剂PBIT下调KDM5B抑制USP33基因转录的检测结果;
图8 KDM5B抑制剂PBIT促进USP33基因转录的检测结果;
图9 KDM5B抑制原始USP33-1kb序列、突变的USP33-1kb序列转录结果。
具体实施方式
实施例1 KDM5B在结直肠癌细胞中高表达,且下调USP33的表达
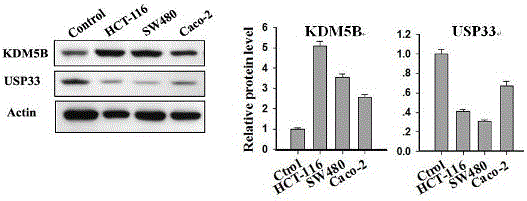
对临床273例结直肠癌组织病例样本进行常规免疫组化分析。结果表明,KDM5B在结直肠癌组织中明显高表达,而USP33明显低表达,如图1所示。
常规细胞培养技术,培养人结直肠癌细胞系HCT-16、SW480、Caco-2和人正常结肠细胞NCM460,待细胞生长状态良好时,收获细胞。采用常规细胞蛋白制备技术,获得各类细胞裂解液,经常规Western-blot技术,检测上述细胞中KDM5B和USP33的表达水平,结果表明,结肠癌细胞中KDM5B与USP33的表达呈负相关,如图2所示。Western-blot所用到的抗体,KDM5B抗体购自于Sigma(Cat No:HPA0271),USP33抗体购自Sigma(Cat No:SAB1410400),Rabbit IgG-HRP(Santa,sc-2004),Actin (sc-1616-R, Santa Cruz)。
实施例2 KDM5B与USP33基因启动子区结合
为明确KDM5B是否与USP33基因启动子区结合,采用qChIP实验方案。具体如下:
(1)室温收集培养的结肠癌细胞,2000g,5min离心收集4×107个细胞,用4℃预冷的细胞培养液重悬细胞,并转移至15ml离心管中,置于冰中10min。
(2)用1%的甲醛溶液进行交联反应,目的是稳固蛋白质因子与DNA的结合,交联反应结束后用0.125M甘氨酸终止。
(3)离心获得细胞沉淀,先用10ml的L1溶液(50 mMHepes KOH,pH7.5,140 mMNaCl,1 mM EDTA,10% Glycerol,0.5% NP-40,0.25% Triton X-100)进行裂解,4℃,10min。L1裂解之后离心,3000rpm,10min,4℃。
(4)将获得的细胞沉淀用10ml的L2溶液(0.2 M NaCl,1 mM EDTA pH 8.0,0.5 mM EGTA pH8.0,10 mMTris pH 8.0)进一步裂解,室温,10min。裂解后离心,3000 rpm,10min,4℃。
(5)用900μl超声裂解液(1mM EDTA pH 8.0,0.5 mM EGTA pH8.0,10mMTris pH 8.0)重悬细胞沉淀,然后均等分成3管进行超声裂解。
(6)超声之后,离心去除残余的细胞碎片,然后加10%的甘油。
(7)ChIP反应体系的配置:DNA样品,1% Triton X-100,0.1% deoxycholate,1×TE,以及特异性抗体包被的磁珠,IgG作为阴性对照,4℃,过夜孵育。次日,将DNA-蛋白质-Ab复合物在磁力架上回收,然后用RIPA溶液清洗8次,RIPA溶液:50 mMHepes pH=8.0, 1 mM EDTA pH8.0,1% NP-40,0.7% deoxycholate,0.5M LiCl。ChIP获得的DNA-蛋白质-Ab复合物用洗脱液(10 mMTris pH=8.0, 1 mM EDTA,1% SDS)洗一次,然后在0.6 M NaCl的溶液中进行去交联,反应条件:65℃,过夜。最后获得的ChIPed DNA。抗体Rabbit IgG-HRP(Santa,sc-2004)。
(8)qChIP试验,就是将ChIPed DNA 通过实时定量PCR反应的方法。具体操作方法同普通Real time PCR。最后计算采用公式:2-CTsample/2-CTinput,Input即IgG阴性对照组。qChIP primer根据距离USP33 转录起始位点TSS上游1k、2k、3k分别设计如下:
qChIP primer-1kb: F: 5’-AGCTCACAGCCTCAAACTGCTGC-3’,
R:5’-GAGCCAGGCCCAGGTGCGGGGAC-3’;
qChIP primer-2kb: F: 5’-TATCTT GGCTCACTGCAACCTCTGC-3’,
R:5’-ATGGTGAAACCCCCATCTCTACG-3’;
qChIP primer-3kb: F: 5’-TTTCATTAGAAGAGACTTCAGTAC-3’,
R:5’-ACTGATTCTGGAACAGAATTCTAG-3’;
qChIP primer即qChIP primer-1k。
结果表明,人结直肠癌细胞系HCT-16、SW480、Caco-2的KDM5B在USP33的启动子区均有结合,如图3所示。
实施例3 KDM5B下调USP33基因的转录
为证实KDM5B对USP33基因转录的影响,采用荧光素酶报告试验,具体如下:
(1)荧光素酶试验报告载体的构建。从UCSC网站(http://genome.ucsc.edu/)调取USP33上游3kb序列,根据基因组序列设计上下游引物(见附表),分别调取USP33-3kb、2kb、1kb promoter序列,并插入到pGL4.15载体中KpnI和XhoI酶切位点,分别构建pGL4.15-USP33-3kb、pGL4.15-USP33-2kb和pGL4.15-USP33-1kb。KDM5B表达载体构建,根据KDM5B基因(NM_006618.3)设计引物,然后将其克隆到pcDNA3.1-HA载体NheI和
(2)细胞转染试验。采用常规细胞转染技术,将上述构建的pcDNA3.1-KDM5B与pGL4.15-USP33-3kb,或pGL4.15-USP33-2kb,或pGL4.15-USP33-1kb共转染到HK293T细胞中。转染后24h,收获细胞检测荧光度值,结果表明,随着KDM5B质粒拷贝数的增加,其抑制USP33的转录表达也增强,如图4所示。利用瞬时转染在结直肠癌细胞系中高表达pcDNA3.1-KDM5B,然后检测USP33表达水平也显著降低,如图5所示。充分说明KDM5B下调USP33基因的转录。
实施例3PBIT抑制KDM5B进而抑制结直肠癌肿瘤细胞增殖
按照每孔104细胞/100μl 均匀分加至96孔细胞板中,添加KDM5B的抑制剂PBIT,放置37℃,5% CO2培养。3天后,取出细胞板,每孔加10μl WTS试剂(Roche),放置37℃,5% CO2继续培养4h。摇床摇晃2min,然后用BioTekTMSynergy多用途读板器测取OD440值。结果表明,3μM的PBIT处理人结直肠癌细胞系HCT-116、SW480、Caco-2,可以明显抑制癌细胞的增殖,如图6所示。
进一步采用荧光素酶报告试验证实,随着PBIT剂量的加大,对KDM5B抑制的增强,KDM5B对USP33转录的抑制逐渐减弱,如图7所示。通过10μM PBIT处理结直肠癌细胞系HCT-116、SW480、Caco-2细胞24h后,发现USP33的表达量相对增高,如图8所示。
实施例4突变USP33上游调控序列抵抗KDM5B的抑制作用
KDM5B抑制USP33基因的表达是通过结合其上游特异性调控序列GCACA/C或G/TGTGC来实现的。利用突变的USP33上游调控序列,通过荧光酶报告试验(Luciferase assay)来检验KDM5B对USP33基因的抑制情况。我们分别利用PCR技术、定点突变PCR技术获得原始USP33-1kb序列(如序列表SEQ ID NO.1所示)、突变的USP33-1kb序列(如序列表SEQ ID NO.2所示)。
荧光酶报告试验(Luciferase assay)
荧光素酶试验报告载体的构建。从UCSC网站(http://genome.ucsc.edu/)调取正常USP33-1kb 和利用定点突变技术获得突变的USP33-1kb序列,并插入到pGL4.15载体中KpnI和XhoI酶切位点。KDM5B表达载体构建,根据KDM5B基因(NM_006618.3)设计引物,然后将其克隆到pcDNA3.1-HA载体NheI和EcoRI,为pcDNA3.1-KDM5B。
荧光素酶报告试验按照Dual-Luciferase® Reporter Assay(Promega)说明书操作。具体操作流程简述如下:HEK293T细胞转染相应的Luciferase报告载体。相关试剂配制:Passive buffer 1:5稀释,Lysis buffer,Stop buffer。293T细胞转染24h后,用Passive buffer 室温裂解15-20分钟。取20ul于1.5ml离心管中(注意:尽量避免吸取细胞碎片)。加入50ul Lysis buffer,混匀,测量荧光活性,读数。加入50ul Stop buffer,混匀,测量,读数。数据分析。
从荧光素酶报告试验结果(图9)可以看出,与正常USP33上游序列相比较,突变后的USP33上游调控序列,KDM5B对其抑制明显减弱,USP33的表达明显增高(较正常对照组提高3倍多)。
<110> 新乡医学院
<120> 突变的泛素化特异性蛋白酶33基因及其应用
<160> 2
<210> 1
<211> 1000
<212> DNA
<213> 人工
<400> 1
gcccaggcta gtctcgaact caagtgattc acccgcctcg gcctcccaaa gtgctgggat 60
tacaggcatg aaccatggcg cctgcctgtg aaacttctat tctgtgaaat ttctattctc 120
ctcagtgaac cgaggatagg caatcatttg tggtgcaaat tgaggcctga gtgtcaatcc 180
ctacctagaa ttttgtatca tggttaattt atttcatttt taccataaaa ataagtagaa 240
gcttttatat tttctaccta ttccaatgga gactgagcat cttgcatgat actttggtac 300
atgctcccat tttggagacc aaaaagtcag atgtcatgag acagattgaa actggcaatt 360
ttaacaattt tttattaata taaccttttt tattcataga tttgaacctc aatcgagtgc 420
attttaacag ttacataatt agaaggcagg actccttcca tgctccaggc attaagcaga 480
tactaaggtt tcaataaata tttgatttga tcctcttgat tttagcctaa ggagaaaatg 540
gtgagataaa tttcttcttt gcataggtgg aaaagggaaa cataattgct ttcagagaat 600
ctaggtccta agaagttggg ggaagaaaga tgaaaggagg aaatacaatg ttgaattggg 660
ataagttaag tctaatattt ctttgctcaa gtttggaaac ctgaggccct tcagtggcca 720
gccttaatgc agtttttgta atgcatcgag acaagacctt ataatggtcg tagtgtgtga 780
ctgtgaaaga gaaggagaaa acatgtgaaa aacgaaaaaa aaaaagctca cagcctcaaa 840
ctgctgcaca taccctgtac agttagtttg cagtcagagt agggagccgg cctgggtccc 900
cgcacctggg cctggctccc gtggccccgc ccctggggcg ggctcccatc gaggctccgc 960
ccccacctcc cctatcgccg gagacgcctg cggcggcccc 1000
<160> 2
<210> 2
<211> 990
<212> DNA
<213> 人工
<400> 2
gcccaggcta gtctcgaact caagtgattc acccgcctcg gcctcccaaa gtgctgggat 60
tacaggcatg aaccatggcg cctgcctgtg aaacttctat tctgtgaaat ttctattctc 120
ctcagtgaac cgaggatagg caatcatttg tggtgcaaat tgaggcctga gtgtcaatcc 180
ctacctagaa ttttgtatca tggttaattt atttcatttt taccataaaa ataagtagaa 240
gcttttatat tttctaccta ttccaatgga gactgagcat cttgcatgat actttggtac 300
atgctcccat tttggagacc aaaaagtcag atgtcatgag acagattgaa actggcaatt 360
ttaacaattt tttattaata taaccttttt tattcataga tttgaacctc aatcgagtgc 420
attttaacag ttacataatt agaaggcagg actccttcca tgctccaggc attaagcaga 480
tactaaggtt tcaataaata tttgatttga tcctcttgat tttagcctaa ggagaaaatg 540
gtgagataaa tttcttcttt gcataggtgg aaaagggaaa cataattgct ttcagagaat 600
ctaggtccta agaagttggg ggaagaaaga tgaaaggagg aaatacaatg ttgaattggg 660
ataagttaag tctaatattt ctttgctcaa gtttggaaac ctgaggccct tcagtggcca 720
gccttaatgc agtttttgta atgcatcgag acaagacctt ataatggtcg tagtgtgtga 780
ctgtgaaaga gaaggagaaa acatgtgaaa aacgaaaaaa aaaaagctca cagcctcaaa 840
ctgcttaccc tgtacagtta gtttgcagtc agagtaggga gccggcctgg gtcccctggg 900
cctggctccc gtggccccgc ccctggggcg ggctcccatc gaggctccgc ccccacctcc 960
cctatcgccg gagacgcctg cggcggcccc 990
- 还没有人留言评论。精彩留言会获得点赞!
- 玉米低镁条件下特异性转运镁离子基因ZmMGT10及其应用的制造方法与工艺
- CRISPR‑Cas9特异性敲除猪SLA‑3基因的方法及用于特异性靶向SLA‑3基因的sgRNA与制造工艺
- 毛酸浆的分子特异性标记引物及鉴别方法与制造工艺
- 一种检测CYP2C9基因多态性的ARMS引物的制造方法与工艺
- 构建在海马体区域特异性敲除IKKα基因的小鼠模型的方法及打靶载体和试剂盒与制造工艺
- 使用重叠非等位基因特异性引物和等位基因特异性阻断剂寡核苷酸的组合物进行等位基因特异性扩增的制造方法与工艺
- 一种利用线粒体D-loop区特异区域鉴定鼋的标记引物及方法
- 一种用于检测大豆拟茎点种腐病菌的特异性lamp引物组合物及其应用
- 一种针对膨胀污泥中Eikelboom Type 0092型丝状菌群特异性引物和方法
- 脯氨酸特异性蛋白酶基因及其应用