间充质干细胞的细胞培养方法与流程
本公开涉及在无胎牛血清(fbs)细胞培养期间促进干细胞增殖的方法、细胞培养基和组合物。
背景
已经提出多能间充质干细胞(msc)作为治疗应用的令人瞩目的候选物,因为它们具有高增殖和分化潜能以及免疫调节特性和其它有益特性(caplanai(2007)j.cellphysiol.,213,341-347;prockopdj(2007)clinpharmacolther.,82,241-243)。稀疏的间充质干细胞(msc)群体的离体繁殖通常是产生适合治疗应用的数量所必需的。
用于分离和扩增msc的常规培养基由补充有胎牛血清的确定成分基础培养基(例如杜氏改良伊格尔氏培养基(dulbecco’smodifiedeagle’smedium,dmem)或α改良型最低必需培养基(α-mem))组成,因为胎牛血清具有高含量的刺激生长因子。虽然通常报道这些培养基支持msc的多次传代增殖,但由于与胎牛血清相关的潜在风险,它们已经引起了人们的担心(dimarakis&levicar(2006)stemcells.,24,1407–1408;mannello&tonti(2007)stemcells.,25,1603–1609)。特别是胎牛血清可能含有有害污染物,如朊病毒、病毒和人畜共患病病原体,并且可以引发免疫反应。此外,胎牛血清的性质不稳定,批次间的差异较大,可能会导致培养基的生长支持性质不一致,从而导致难以实现细胞生产过程的标准化。
已经研究人源补充物如人血清和血小板裂解物作为胎牛血清的替代物。人血清由于缺乏可用性和不一致的生长促进潜力而通常不被视为合适的替代物。人血小板源性补充物如血小板裂解物(hpl)和富血小板血浆最近被提出作为优选的替代物(doucet等人(2005)jcellphysiol.,205,228–236;muller等人(2006),cytotherapy.,8,437–444;capelli等人(2007)bonemarrowtransplant.,40,785–91;lange等人(2007)jcellphysiol.,213,18–26;reinisch等人(2007)regenmed.,2,371–82)。虽然这些研究证明了汇集的人血小板衍生物具有相当明显的生长促进性质,但它们对msc生长的影响是不一致的(bieback等人(2008)transfusmedhemother.,35,286–294)。此外,这些hpl制剂的高成本对于商业细胞培养可能是难以接受的。
因此,仍然存在对支持在无胎牛血清细胞培养中分离和快速扩增msc的成本有效的方法的未满足的需要。
概述
本发明人已经发现,在无胎牛血清培养条件下进行msc增殖需要血小板源性生长因子(pdgf)。本发明人还发现成纤维细胞生长因子2(fgf2)和pdgf协同促进无胎牛血清培养条件下的msc增殖。令人惊讶的是,当fgf2以非常低的水平存在时,这种协同作用得以保持。因此,本发明人已经发现,他们能够使用生长因子的特定组合在无胎牛血清培养条件下增加体外干细胞增殖。这些研究结果表明,本公开的方法、培养基和组合物可以提供合适的有成本效益的血清替代物,该替代物也可以适于提高干细胞培养的效率。
因此,在一个实例中,本公开涉及一种促进体外干细胞增殖的方法,所述方法包括在包含pdgf和fgf2的无胎牛血清细胞培养基中培养间充质谱系干细胞群,其中fgf2的水平小于约6ng/ml。在另一个实例中,本公开涉及一种促进体外间充质谱系前体细胞增殖的方法。在另一个实例中,本公开涉及一种促进体外间充质干细胞增殖的方法。
pdgf、fgf2和任何其它培养基组分可以在干细胞培养基中或在用于添加到干细胞培养基的组合物中提供,以用于本公开的方法。因此,在另一个实例中,本公开提供了一种无胎牛血清细胞培养基,所述细胞培养基包含:
基础培养基;
血小板源性生长因子(pdgf);
成纤维细胞生长因子2(fgf2);
其中,培养基中fgf2的水平小于约6ng/ml。
在另一个实例中,培养基中fgf2的水平在约2pg/ml和40pg/ml之间。在另一个实例中,培养基中fgf2的水平为约20pg/ml。
在另一个实例中,pdgf是pdgf-bb或pdgf-ab。在一个实例中,pdgf是pdgf-bb。在另一个实例中,培养基中pdgf-bb的水平在约3.0ng/ml和约120ng/ml之间。在另一个实例中,培养基中pdgf-bb的水平在约9ng/ml和约60ng/ml之间。在另一个实例中,培养基中pdgf-bb的水平为至少约30ng/ml。
本发明人还发现成纤维细胞生长因子2(fgf2)与其它生长因子协同作用以促进msc增殖。因此,这些生长因子也可以用于本公开的方法、细胞培养基和组合物中。在一个实例中,所述细胞培养基还包含表皮生长因子(egf)。在一个实例中,细胞培养基中egf的水平在约0.08ng/ml和约7ng/ml之间。例如,细胞培养基中egf的水平为至少约5ng/ml。在另一个实例中,细胞培养基中egf的水平在约0.2ng/ml和约3.2ng/ml之间。在另一个实例中,细胞培养基中egf的水平在约0.4ng/ml和约1.6ng/ml之间。在另一个实例中,egf的水平为至少约0.8ng/ml。
在另一个实例中,培养基用于培养间充质干细胞。在另一个实例中,培养基用于培养间充质谱系前体细胞。
在一个实例中,基础培养基是α-最低必需培养基或无胎牛血清扩增培养基如stemspantm。
在另一个实例中,细胞培养基使干细胞保持未分化状态。
在另一个实例中,本公开涉及一种用于加入无胎牛血清干细胞培养基中的组合物,所述组合物包含:
血小板源性生长因子(pdgf);
成纤维细胞生长因子2(fgf2);
其中fgf2是以足够以小于约6ng/ml的水平添加到干细胞培养基中的量存在于组合物中。在另一个实例中,fgf2是以足够以约5pg/ml和40pg/ml之间的水平添加到干细胞培养基中的量存在于组合物中。在另一个实例中,fgf2是以足够以约20pg/ml之间的水平添加到干细胞培养基中的量存在于组合物中。
在另一个实例中,组合物中的pdgf是pdgf-bb或pdgf-ab。在一个实例中,组合物中的pdgf是pdgf-bb。在另一个实例中,pdgf-bb是以足够以约7.5ng/ml和约120ng/ml之间的水平添加到干细胞培养基中的量存在于组合物中。在另一个实例中,pdgf-bb是以足够以约15ng/ml和约60ng/ml之间的水平添加到干细胞培养基中的量存在于组合物中。在另一个实例中,pdgf-bb是以足够以约至少30ng/ml的水平添加到干细胞培养基中的量存在于组合物中。
在另一个实例中,细胞组合物还包含表皮生长因子(egf)。在一个实例中,egf是以足够以约0.1ng/ml和约7ng/ml之间的水平添加到干细胞培养基中的量存在于组合物中。例如,egf可以以足够以约5ng/ml的水平添加到干细胞培养基中的量存在于组合物中。在一个实例中,egf是以足够以约0.2ng/ml和约3.2ng/ml之间的水平添加到干细胞培养基中的量存在于组合物中。在另一个实例中,egf是以足够以约0.4ng/ml和约1.6ng/ml之间的水平添加到干细胞培养基中的量存在于组合物中。在另一个实例中,egf是以足够以约至少0.8ng/ml的水平添加到干细胞培养基中的量存在于组合物中。
在另一个实例中,将组合物添加到适于培养间充质谱系前体细胞的培养基中。在另一个实例中,将组合物添加到适于培养间充质干细胞的培养基中。在另一个实例中,将组合物添加到适于培养间充质谱系前体细胞的培养基中。
在另一个实例中,将组合物添加到α-最低必需培养基或无胎牛血清扩增培养基(如stemspantm)中。
附图简述
图1:血小板裂解物百分比对mpc增殖的影响。
图2:生长因子的抗体中和对mpc增殖的影响。
图3:生长因子的组合抗体中和对mpc增殖的影响。
图4:使用补充有不同浓度的pdgf-bb、egf和fgf2的伊格尔氏α-mem在组织培养塑料上培养细胞后的mpc增殖。
图5:使用补充有不同浓度的pdgf-bb、egf和fgf2的伊格尔氏α-mem在纤连蛋白上培养细胞后的mpc增殖。
图6:使用补充有不同浓度的pdgf-bb、egf和fgf2的伊格尔氏α-mem在3%hpl上培养细胞后的mpc增殖。
图7:使用补充有不同浓度的pdgf-bb、egf和fgf2的stemspantm在组织培养塑料上培养细胞后的mpc增殖。
图8:使用补充有不同浓度的pdgf-bb、egf和fgf2的stemspantm在纤连蛋白上培养细胞后的mpc增殖。
图9:使用补充有不同浓度的pdgf-bb、egf和fgf2的stemspantm在3%hpl上培养细胞后的mpc增殖。
图10:在包括pdgf(p)、fgf(f)、egf(e)或其组合(pef)的培养基中的细胞增殖。
图11:细胞增殖后的细胞培养基中的细胞因子水平。
详述
一般技术和定义
除非另外明确定义,否则本文使用的所有技术和科学术语应被视为具有如本领域(例如,细胞培养、分子生物学、干细胞培养、蛋白质化学和生物化学)普通技术人员通常所理解的相同含义。
除非另有说明,否则本公开中所使用的细胞培养技术和测定是本领域技术人员公知的标准程序。此类技术描述和解释于贯穿诸如以下来源的文献中:j.perbal,apracticalguidetomolecularcloning,johnwileyandsons(1984);j.sambrook等,molecularcloning:alaboratorymanual,coldspringharborlaboratorypress(1989);t.a.brown(编者),essentialmolecularbiology:apracticalapproach,第1卷和第2卷,irlpress(1991);d.m.glover和b.d.hames(编者)以及f.m.ausubel等人(编者),currentprotocolsinmolecularbiology,greenepub.associatesandwiley-interscience(1988,包括至今为止的所有更新版本);edharlow和davidlane(编者)antibodies:alaboratorymanual,coldspringharbourlaboratory,(1988);以及j.e.coligan等人(编者)currentprotocolsinimmunology,johnwiley&sons(包括至今为止的所有更新版本)。
术语“和/或”,例如“x和/或y”,应被理解为是指“x和y”或“x或y”,并且应被视为明确地支持两种含义或任何一种含义。
除非另有说明,否则本文中所用的术语“约”是指指定值的+/-10%,更优选+/-5%。
术语“水平”用于定义本公开的细胞培养基和组合物中存在的特定物质的量。例如,可以使用特定的浓度、重量、百分比(例如,体积/体积%)或比例来定义特定物质的水平。
在本公开的上下文中,术语“足够”用于限定当溶解在干细胞培养基中时提供特定浓度的量。“足够量”由所需的培养基体积决定。例如,如果干细胞培养基中fgf2的所需浓度为约10pg/ml,并且需要500ml的细胞培养基,则足够量为约5ng。
在整个说明书中,词语“包含(comprise)”或其变型如“包含(comprises)”或“包含(comprising)”将被理解为暗示包括陈述的元素、整数或步骤,或元素、整数或步骤组,但不排除任何其它元素、整数或步骤,或元素、整数或步骤组。
在整个说明书中,除非另有明确说明或上下文另有要求,否则提及单个步骤、物质组合物、步骤组或物质组合物组应被理解为涵盖一个和多个(即,一个或多个)那些步骤、物质组合物、步骤组或物质组合物组。
本领域技术人员将会理解,除了明确描述的那些之外,本文所述的公开内容易于进行变化和修改。应当理解,本公开包括所有这些变化和修改。本公开还包括在本说明书中单独或共同引用或指出的所有步骤、特征、组合物和化合物,以及所述步骤或特征中的任何两个或更多个的任何和所有组合。
本公开的范围不受本文所述的具体实施方案的限制,这些实施方案只是为了举例的目的。如本文所述,功能上等效的产品、组合物和方法显然在本公开的范围内。
除非另有明确说明,否则本文所公开的任何实例应被视为,如作适当调整,也适用于任何其它实例。
间充质谱系前体细胞
如本文中所用,术语“间充质谱系前体或干细胞”是指未分化的多能细胞,其具有自我更新能力,且同时保持多能性和分化成间充质起源(例如成骨细胞、软骨细胞、脂肪细胞、基质细胞、成纤维细胞和肌腱)或非中胚层起源(例如肝细胞、神经细胞和上皮细胞)的多种细胞类型的能力。为了避免疑问,“间充质谱系前体细胞”是指可以分化成间充质细胞如骨、软骨、肌肉和脂肪细胞以及纤维结缔组织的细胞。
术语“间充质谱系前体或干细胞”包括亲本细胞及其未分化后代。该术语还包括间充质前体细胞、多能基质细胞、间充质干细胞(msc)、血管周围间充质前体细胞及其未分化后代。
间充质谱系前体或干细胞可以是自体的、异种的、同系或同基因的。自体细胞是从将被再植入这些细胞的相同个体分离获得。同种异体细胞是从同一物种的供体分离获得。异种细胞从另一物种的供体分离获得。同系或同基因细胞从基因相同的生物体(如双胞胎、克隆或高度近交的研究动物模型)分离获得。
间充质谱系前体或干细胞主要存在于骨髓中,但也被发现存在于多种宿主组织(包括例如,脐带血和脐带、成人外周血、脂肪组织、小梁骨和牙髓)中。
在一个实例中,间充质谱系前体或干细胞是stro-1+间充质前体细胞。如本文所用,短语“stro-1+多能细胞”应被认为是指能够形成多能细胞集落的stro-1+和/或tnap+祖细胞。
stro-1+多能细胞是发现于骨髓、血液、牙髓细胞、脂肪组织、皮肤、脾、胰腺、脑、肾、肝脏、心脏、视网膜、脑、毛囊、肠、肺、淋巴结、胸腺、骨、韧带、肌腱、骨骼肌、真皮和骨膜中的细胞;并且能够分化成种系如中胚层和/或内胚层和/或外胚层。因此,stro-1+多能细胞能够分化成多种细胞类型,包括但不限于脂肪、骨、软骨、弹性、肌肉和纤维结缔组织。这些细胞所进入的具体谱系定型(lineage-commitment)和分化途径取决于由机械影响和/或内源性生物活性因子(例如生长因子、细胞因子和/或由宿主组织建立的局部微环境条件)产生的各种影响。
可以从宿主组织分离间充质谱系前体或干细胞,并通过选择stro-1+细胞进行富集。例如,来自受试者的骨髓抽吸物可以用stro-1或tnap的抗体进一步处理,以使得能够选择间充质谱系前体或干细胞。在一个实例中,可以通过使用(simmons&torok-storb,1991)中描述的stro-1抗体富集间充质谱系前体或干细胞。
术语“富集的”、“富集”或其变体在本文中用于描述细胞群体,该细胞群体中的一种特定细胞类型的比例或多种特定细胞类型的比例相较于未处理的细胞群体(例如,处于天然环境中的细胞)是增加的。在一个实例中,富集stro-1+细胞的群体包含至少约0.1%或0.5%或1%或2%或5%或10%或15%或20%或25%或30%或50%或75%的stro-1+细胞。在这方面,术语“富集stro-1+细胞的细胞群体”将被视为提供对术语“包含x%stro-1+细胞的细胞群体”的明确支持,其中x%是本文所列举的百分比。在一些实例中,stro-1+细胞可以形成产克隆集落,例如cfu-f(成纤维细胞),或者其子集(例如,50%或60%或70%或80%或90%或95%)可以具有这种活性。
在一个实例中,从包含可选择形式的stro-1+细胞的细胞制备物富集细胞群体。在这方面,术语“可选择形式”将被理解为意指细胞表达允许选择stro-1+细胞的标记物(例如,细胞表面标记物)。标记物可以是stro-1,但并不一定。例如,表达stro-2和/或stro-3(tnap)和/或stro-4和/或vcam-1和/或cd146和/或3g5的细胞(例如,间充质前体细胞)也表达stro-1(并且可以是stro-1亮)。因此,细胞是stro-1+的指示并不意味着所述细胞是通过stro-1表达来选择。在一个实例中,基于至少stro-3表达来选择细胞,例如它们是stro-3+(tnap+)。
提及选择细胞或其群体不一定需要从特定组织来源进行选择。如本文所述,可以从多种来源选择或分离或富集stro-1+细胞。也就是说,在一些实施例中,这些术语支持从包含stro-1+细胞(例如间充质前体细胞)的任何组织或血管化组织或包含周细胞(例如,stro-1+周细胞)的组织或本文所列举的任何一种或多种组织进行选择。
在一个实例中,本公开中使用的间充质谱系前体或干细胞表达单独或共同地选自由tnap+、vcam-1+、thy-1+、stro-2+、stro-4+(hsp-90β)、cd45+、cd146+、3g5+或其任何组合组成的组的一种或多种标记物。
术语“单独地”的使用意指本公开个别地包含所列举的标记物或标记物组,并且尽管个别标记物或标记物组可能未在本文中单独列出,但所附权利要求可以个别地和彼此分开地限定这些标记物或标记物组。
术语“共同地”的使用意指本公开包含任何数量或组合的所列举的标记物或标记物组,并且尽管这些数量或组合的标记物或标记物组可能未在本文中明确列出,但所附权利要求可以将这些组合或子组合与标记物或标记物组的任何其它组合个别地和彼此分开地限定。
在一个实例中,stro-1+细胞是stro-1亮(与stro-1bri同义)。在另一个实例中,相对于stro-1暗或stro-1中间细胞,stro-1bri细胞优先富集。在另一个实例中,stro-1bri细胞另外是tnap+、vcam-1+、thy-1+、stro-2+、stro-4+(hsp-90β)和/或cd146+中的一种或多种。例如,这些细胞是根据一种或多种前述标记物来选择和/或被发现表达一种或多种前述标记物。就此而言,显示表达标记物的细胞不需要被特别地测试,而是可以测试先前富集或分离的细胞,并且随后使用,分离或富集的细胞可以合理地假定也表达相同的标记物。
在一个实例中,间充质前体细胞是wo2004/85630中所定义的血管周围间充质前体细胞,其特征在于存在血管周围标记物3g5。
被称为给定标记物“阳性”的细胞可以根据标记物存在于细胞表面上的程度表达低(lo或暗)或高(亮,bri)水平的该标记物,其中所述术语与荧光强度或细胞分选过程中使用的其它标记物有关。在被分选的特定细胞群体上使用的标记物的上下文中将理解lo(或暗或暗淡)和bri的区别。被称为给定标记物“阴性”的细胞不一定完全不存在于该细胞中。该术语意指该细胞以相对很低的水平表达该标记物,并且其在被可检测地标记时产生非常低的信号或在背景水平(例如使用同种型对照抗体检测的水平)之上检测不到。
本文所用的术语“亮”或“bri”是指细胞表面上的标记物在被可检测地标记时产生相对高的信号。虽然不希望受理论限制,但提出了“亮”细胞比样品中的其它细胞表达更多的靶标记蛋白(例如被stro-1识别的抗原)。例如,与非亮细胞(stro-1暗淡/暗)相比,通过荧光活化细胞分选(facs)分析测得,stro-1bri细胞在用fitc缀合的stro-1抗体标记时产生更大的荧光信号。在一个实例中,“亮”细胞构成起始样品中包含的最明亮标记的骨髓单核细胞的至少约0.1%。在其它实例中,“亮”细胞构成起始样品中含有的最明亮标记的骨髓单核细胞的至少约0.5%、至少约1%、至少约1.5%或至少约2%。在一个实例中,stro-1亮细胞相对于“背景”(即stro-1-细胞)具有高2个对数级的stro-1表面表达。相比之下,stro-1暗和/或stro-1中间细胞具有高不到2个对数级的stro-1表面表达,通常为约1个对数级或小于“背景”。
如本文所用,术语“tnap”旨在包括组织非特异性碱性磷酸酶的所有同种型。例如,该术语包括肝同种型(lap)、骨同种型(bap)和肾同种型(kap)。在一个实例中,tnap是bap。在一个实例中,本文所用的tnap是指可以结合由根据布达佩斯条约(budapesttreaty)的规定在2005年12月19日以保藏收录号pta-7282保藏于atcc的杂交瘤细胞系产生的stro-3抗体的分子。
此外,在一个实例中,stro-1+细胞能够产生产克隆cfu-f。
在一个实例中,相当大比例的stro-1+多能细胞能够分化成至少两种不同的种系。多能细胞可能定型的谱系的非限制性实例包括骨前体细胞;肝细胞祖细胞,其具有分化成胆管上皮细胞和肝细胞的多能性;神经限制性细胞,其可以产生进展为少突胶质细胞和星形胶质细胞的神经胶质细胞前体;进展为神经元的神经元前体;心肌和心肌细胞的前体;分泌葡萄糖反应性胰岛素的胰腺β细胞系。其它谱系包括但不限于:成牙质细胞、牙本质产生细胞和软骨细胞,以及以下各项的前体细胞:视网膜色素上皮细胞、成纤维细胞、皮肤细胞如角化细胞、树突状细胞、毛囊细胞、肾管上皮细胞、平滑肌和骨骼肌细胞、睾丸祖细胞、血管内皮细胞、肌腱、韧带、软骨、脂肪细胞、成纤维细胞、骨髓基质、心肌、平滑肌、骨骼肌、周细胞、血管、上皮、神经胶质、神经元、星形胶质细胞和少突胶质细胞。
在本公开的一个方面,目前描述的间充质谱系前体或干细胞是msc。msc可以是均质组合物,或者可以是富集msc的混合细胞群体。可以通过培养粘附的骨髓或骨膜细胞获得均质的msc细胞组合物,并且可以通过利用独特的单克隆抗体鉴定的特异性细胞表面标记物来识别msc。获得富集msc的细胞群体的方法描述于例如美国专利号5,486,359中。msc的替代来源包括但不限于血液、皮肤、脐带血、肌肉、脂肪、骨和软骨膜。
在另一个实例中,间充质谱系前体或干细胞是cd29+、cd54+、cd73+、cd90+、cd102+、cd105+、cd106+、cd166+、mhc1+msc(例如remestemcel-l)。
分离或富集的间充质谱系前体或干细胞可以通过培养进行体外扩增。分离或富集的间充质谱系前体或干细胞可以被冷冻保存,解冻,随后通过培养进行体外扩增。
在一个实例中,将分离或富集的间充质谱系前体或干细胞以50,000个活细胞/cm2的密度接种在培养基(无血清或补充有血清)中,例如根据本公开的细胞培养基中,并使其在37℃和20%o2下粘附在培养容器上过夜。随后根据需要更换和/或改变培养基并在37℃和5%o2下将细胞再培养68至72小时。
本领域技术人员将理解,培养的间充质谱系前体或干细胞与体内细胞的表型不同。例如,在一个实施方案中,它们表达一种或多种以下标记物:cd44、ng2、dc146和cd140b。培养的间充质谱系前体或干细胞与体内细胞在生物学上也不相同,其相比于体内的大部分非循环(静止)的细胞具有较高的增殖率。
使用本公开的方法培养的间充质谱系前体或干细胞也可以冷冻保存。
促进细胞增殖
本公开的一个方面涉及促进体外细胞培养中的干细胞增殖的方法。在本公开的上下文中,术语“促进(promote/promoting)”用于定义细胞增殖的增加或加速。
本领域技术人员容易获得确定增加和/或加速的细胞增殖的各种方法。例如,可以使用例如常规可用的细胞增殖测定,例如mtt测定、溴脱氧尿苷(brdu)掺入测定或实时增殖测定(例如,来自roche的xcelligencetm系统),基于随时间推移产生的细胞数量来测量细胞增殖的增加或加速。
因此,本领域技术人员可以通过进行本领域中已知的常规增殖测定容易地确定使用本公开的方法是否促进细胞增殖。
在确定是否促进细胞增殖的一个实例中,细胞群可以在根据本公开的细胞培养基中或不含pdgf和fgf2的等效对照培养基(即,具有0pg/mlpdgf和fgf2的本公开的培养基)中进行培养。每种培养基中的细胞增殖可以每天进行评估、在一段培养时间(例如7天)内进行评估或实时追踪。在第0天和第7天之间增加的细胞数量或加速的细胞增殖表明细胞增殖已得到促进。
促进细胞衍生
干细胞不对称地分裂,产生两个不同的子细胞:一个是原始干细胞的拷贝,以及另一个是程序性地分化成非干细胞结局的子细胞。例如,多能干细胞可以分裂产生一个原始干细胞拷贝,以及程序性地分化成间充质细胞类型的间充质谱系前体细胞。
本公开还包括促进体外细胞培养中的干细胞衍生的方法。例如,本公开的方法可用于促进间充质谱系前体细胞从多能干细胞的衍生。在促进细胞衍生的情况下,术语“促进(promote/promoting)”用于定义干细胞衍生的增加或加速。
本公开的一个方面涉及一种促进体外干细胞衍生的方法,所述方法包括在包含血小板源性生长因子(pdgf)和成纤维细胞生长因子2(fgf2)的无胎牛血清细胞培养基中培养干细胞群,其中fgf2的水平小于约6ng/ml。
例如,本公开的方法涉及一种促进体外间充质谱系干细胞衍生的方法,所述方法包括在包含血小板源性生长因子(pdgf)和成纤维细胞生长因子2(fgf2)的无胎牛血清细胞培养基中培养多能干细胞群,其中fgf2的水平小于约6ng/ml。
在另一个实例中,本公开的方法可以用于促进间充质谱系前体细胞从多能干细胞的衍生,且随后促进衍生的间充质谱系前体细胞群的增殖。
本领域技术人员容易获得确定增加和/或加速的干细胞衍生的各种方法。例如,可以基于随时间从多能干细胞产生的间充质谱系前体细胞的数目来测量增加或加速的间充质谱系前体细胞衍生。间充质谱系前体细胞的特征在于特异性表面标记物,其表达有利于通过免疫选择来分离和纯化这些细胞。这些标记物的实例包括stro-1+、tnap+、vcam-1+、thy-1+、stro-2+、stro-4+(hsp-90β)、cd146+、3g5+或其组合。因此,本领域技术人员可以使用免疫选择来纯化群体中的间充质谱系前体细胞并进行计数。可以使用细胞数来鉴定随时间产生的间充质谱系前体细胞的数量,并确定间充质谱系前体细胞衍生是否增加或加速。
在确定是否促进细胞衍生的另一个实例中,多能干细胞群可以在根据本公开的细胞培养基中或不含pdgf和fgf2的等效对照培养基(即,具有0pg/mlpdgf和fgf2的本公开的培养基)中进行培养。通过从细胞培养物中免疫选择间充质谱系前体细胞并确定所产生的细胞数量,可以每天或在一段培养时间(例如七天)内评估每种培养基中间充质谱系前体细胞的衍生。在第0天和第7天之间相对于对照细胞数增加的间充质谱系前体细胞数表明细胞衍生得到促进。
细胞培养基
本公开提供了包含促进msc增殖的生长因子的无胎牛血清干细胞培养基。在一个实施方案中,本公开涉及一种无胎牛血清干细胞培养基,所述细胞培养基包含:
基础培养基;
血小板源性生长因子(pdgf);
成纤维细胞生长因子2(fgf2)。
在本公开的上下文中使用的术语“培养基”或“介质”包括细胞周围环境的组分。培养基构成和/或提供适合于允许细胞生长的条件。培养基可以是固体、液体、气体或各种相和材料的混合物。培养基可以包括液体生长培养基以及不维持细胞生长的液体培养基。培养基还包括凝胶状培养基如琼脂、琼脂糖、明胶和胶原基质。示例性气体培养基包括生长在皮氏培养皿(petridish)或其它固体或半固体支持物上的细胞暴露于其中的气相。术语“培养基”还指旨在用于细胞培养中的材料,即使其尚未与细胞接触。
本公开的培养基可以通过使用基础培养基来制备。在本公开的上下文中,“基础培养基”是指适合暴露于细胞(例如msc)的无补充培养基。基础培养基包括例如伊格尔氏最低必需(mem)培养基、α改良mem培养基、stemspantm及其混合培养基,并且没有特别限制,只要其可用于培养干细胞。
此外,本公开的细胞培养基可以含有任何成分,例如脂肪酸或脂质、维生素、细胞因子、抗氧化剂、缓冲剂、无机盐等。
用于本公开的细胞培养基包含所有必需氨基酸,并且还可以含有非必需氨基酸。通常,氨基酸被分为必需氨基酸(thr、met、val、leu、ile、phe、trp、lys、his)和非必需氨基酸(gly、ala、ser、cys、gln、asn、asp、tyr、arg、pro)。
本领域技术人员将理解,为了获得最佳结果,基础培养基必须适合受关注的细胞系,其中关键营养物质具有足够的水平以增强细胞增殖。例如,如果发现葡萄糖这种能量来源被耗尽且因此限制了细胞增殖,则可能必需增加基础培养基中的葡萄糖(或其它能量来源)的水平或在培养过程中添加葡萄糖(或其它能量来源)。
在一个实例中,本公开的细胞培养基含有人源添加剂。例如,可以将人血清和人血小板细胞裂解物添加到用于本公开的方法的细胞培养基中。
在一个实例中,本公开的细胞培养基仅含有人源添加剂。因此,在一个实例中,细胞培养基是无异源物种成分的(xeno-free)。
抗坏血酸
抗坏血酸是用于各种培养细胞的生长和分化的重要补充物。现在应该理解的是,特定抗坏血酸衍生物是“短效”的,因为它们在溶液状态下,尤其是在中性ph和37℃的正常细胞培养条件下不稳定。这些短效衍生物迅速氧化成草酸或苏糖酸。在37℃的培养基(ph7)中,氧化作用使这些短效抗坏血酸衍生物的水平在24小时内降低约80-90%。因此,在各种细胞类型的常规细胞培养中,短效抗坏血酸衍生物已被更稳定的“长效”抗坏血酸衍生物所代替。
在本公开的上下文中,术语“短效”包括在中性ph和37℃的培养条件下培养细胞24小时后被氧化约80-90%的抗坏血酸衍生物。在一个实例中,短效l-抗坏血酸衍生物是l-抗坏血酸盐。例如,在本公开的上下文中,l-抗坏血酸钠盐是“短效”抗坏血酸衍生物。
相反地,术语“长效”包括在中性ph和37℃的培养条件下培养细胞24小时后没有被氧化约80-90%的抗坏血酸衍生物。在一个实例中,在本公开的上下文中,l-抗坏血酸-2-磷酸酯是“长效”抗坏血酸衍生物。长效抗坏血酸衍生物的其它实例包括四己基癸醇抗坏血酸酯、抗坏血酸磷酸酯镁和2-o-α-d-吡喃葡萄糖基-l-抗坏血酸。本公开的细胞培养基可以含有短效抗坏血酸衍生物、长效抗坏血酸衍生物或其混合物。
血清
通常,使用补充有至少约10-15%(体积/体积)血清(通常是胎牛血清(fbs),也称为胎小牛血清(fcs))的培养基将干细胞保持在细胞培养物中。本公开的细胞培养基是无胎牛血清细胞培养基。因此,在一个实施方案中,细胞培养基补充有非胎儿血清。例如,培养基可以补充有新生儿或成人血清。
在另一个实施方案中,细胞培养基补充有人血清。在一个实例中,细胞培养基可以补充有人非胎儿血清。例如,细胞培养基可以补充有至少约1%(体积/体积)、至少约2%(体积/体积)、至少约3%(体积/体积)、至少约4%(体积/体积)、至少约5%(体积/体积)、至少约6%(体积/体积)、至少约7%(体积/体积)、至少约8%(体积/体积)、至少约9%、至少约10%、至少约11%、至少约12%、至少约13%、至少约14%、至少约15%、至少约16%、至少约17%、至少约18%、至少约19%、至少约20%、至少约21%、至少约22%、至少约23%、至少约24%、至少约25%(体积/体积)人非胎儿血清。
在另一个实例中,细胞培养基可以补充有人新生儿血清。例如,细胞培养基可以补充有至少约1%(体积/体积)、至少约2%(体积/体积)、至少约3%(体积/体积)、至少约4%(体积/体积)、至少约5%(体积/体积)、至少约6%(体积/体积)、至少约7%(体积/体积)、至少约8%(体积/体积)、至少约9%(体积/体积)人新生儿血清。在一个实例中,人新生儿血清是从脐带血(“脐血”)获得。
在另一个实例中,细胞培养基可以补充有人成人血清。例如,培养基可以补充有至少约1%(体积/体积)、至少约2%(体积/体积)、至少约3%(体积/体积)、至少约4%(体积/体积)、至少约5%(体积/体积)、至少约6%(体积/体积)、至少约7%(体积/体积)、至少约8%(体积/体积)、至少约9%、至少约10%、至少约11%、至少约12%、至少约13%、至少约14%、至少约15%、至少约16%、至少约17%、至少约18%、至少约19%、至少约20%、至少约21%、至少约22%、至少约23%、至少约24%、至少约25%(体积/体积)人成人血清。
在一个实例中,人成人血清是人ab血清。例如,细胞培养基可以补充有至少约1%(体积/体积)、至少约2%(体积/体积)、至少约3%(体积/体积)、至少约4%(体积/体积)、至少约5%(体积/体积)、至少约6%(体积/体积)、至少约7%(体积/体积)、至少约8%(体积/体积)、至少约9%(体积/体积)人ab血清。在一个实例中,细胞培养基补充有至少约3%人ab血清。
本公开的细胞培养基还可以含有已知的血清替代物。血清替代物可以是例如白蛋白(例如富脂质白蛋白)、转铁蛋白、脂肪酸、胰岛素、胶原前体、微量元素、2-巯基乙醇或3'-硫代甘油、血小板裂解物、富血小板血浆或那些适当地含有血清等效物的物质。这样的血清替代物可以例如通过国际公开wo93/30679中描述的方法制备,并且也可以使用市售产品。
有丝分裂因子
本发明人发现pdgf和fgf2协同促进体外无胎牛血清细胞培养中的干细胞增殖。
pdgf是结合血小板源性生长因子受体(pdgfr)的细胞生长和分裂调节剂。在化学上,pdgf是由两个a(-aa)或两个b(-bb)链或这两者(-ab)的组合组成的二聚糖蛋白。已发现pdgf-ab结合pdgfα和β受体亚基以形成pdgfαβ和αα受体二聚体。在本发明的上下文中,pdgf包括pdgf-bb和pdgf-ab。
碱性成纤维细胞生长因子(fgf2)(也称为bfgf、fgfb、hbgf-2)是成纤维细胞生长因子(fgf)家族的成员。fgf2还是细胞生长和分裂的调节剂。pdgf和fgf2都可以被分类为有丝分裂原,因为它们促使细胞开始细胞分裂。
在一个实例中,本公开的方法包括在包含血小板源性生长因子(pdgf)和成纤维细胞生长因子2(fgf2)的无胎牛血清细胞培养基中培养干细胞群,其中fgf2的水平小于约6ng/ml。例如,fgf2的水平可以小于约5ng/ml、小于约4ng/ml、小于约3ng/ml、小于约2ng/ml、小于约1ng/ml。在其它实例中,fgf2的水平小于约0.9ng/ml、小于约0.8ng/ml、小于约0.7ng/ml、小于约0.6ng/ml、小于约0.5ng/ml、小于约0.4ng/ml、小于约0.3ng/ml、小于约0.2ng/ml。
在另一个实例中,fgf2的水平在约1pg/ml和100pg/ml之间。在另一个实例中,fgf2的水平在约5pg/ml和80pg/ml之间。在另一个实例中,fgf2的水平在约10pg/ml和40pg/ml之间。在另一个实例中,fgf2的水平为至少约10pg/ml。在另一个实例中,fgf2的水平为至少约11pg/ml。在另一个实例中,fgf2的水平为至少约12pg/ml。在另一个实例中,fgf2的水平为至少约13pg/ml。在另一个实例中,fgf2的水平为至少约14pg/ml。在另一个实例中,fgf2的水平为至少约15pg/ml。在另一个实例中,fgf2的水平为至少约16pg/ml。在另一个实例中,fgf2的水平为至少约17pg/ml。在另一个实例中,fgf2的水平为至少约18pg/ml。在另一个实例中,fgf2的水平为至少约19pg/ml。在另一个实例中,fgf2的水平为至少约20pg/ml。在另一个实例中,fgf2的水平为至少约21pg/ml。在另一个实例中,fgf2的水平为至少约22pg/ml。在另一个实例中,fgf2的水平为至少约23pg/ml。在另一个实例中,fgf2的水平为至少约24pg/ml。在另一个实例中,fgf2的水平为至少约25pg/ml。在另一个实例中,fgf2的水平为至少约26pg/ml。在另一个实例中,fgf2的水平为至少约27pg/ml。在另一个实例中,fgf2的水平为至少约28pg/ml。在另一个实例中,fgf2的水平为至少约29pg/ml。在另一个实例中,fgf2的水平为至少约30pg/ml。
在一个实例中,pdgf是pdgf-bb。在一个实例中,pdgf-bb的水平在约1ng/ml和150ng/ml之间。在另一个实例中,pdgf-bb的水平在约7.5ng/ml和120ng/ml之间。在另一个实例中,pdgf-bb的水平在约15ng/ml和60ng/ml之间。在另一个实例中,pdgf-bb的水平为至少约10ng/ml。在另一个实例中,pdgf-bb的水平为至少约15ng/ml。在另一个实例中,pdgf-bb的水平为至少约20ng/ml。在另一个实例中,pdgf-bb的水平为至少约21ng/ml。在另一个实例中,pdgf-bb的水平为至少约22ng/ml。在另一个实例中,pdgf-bb的水平为至少约23ng/ml。在另一个实例中,pdgf-bb的水平为至少约24ng/ml。在另一个实例中,pdgf-bb的水平为至少约25ng/ml。在另一个实例中,pdgf-bb的水平为至少约26ng/ml。在另一个实例中,pdgf-bb的水平为至少约27ng/ml。在另一个实例中,pdgf-bb的水平为至少约28ng/ml。在另一个实例中,pdgf-bb的水平为至少约29ng/ml。在另一个实例中,pdgf-bb的水平为至少约30ng/ml。在另一个实例中,pdgf-bb的水平为至少约31ng/ml。在另一个实例中,pdgf-bb的水平为至少约32ng/ml。在另一个实例中,pdgf-bb的水平为至少约33ng/ml。在另一个实例中,pdgf-bb的水平为至少约34ng/ml。在另一个实例中,pdgf-bb的水平为至少约35ng/ml。在另一个实例中,pdgf-bb的水平为至少约36ng/ml。在另一个实例中,pdgf-bb的水平为至少约37ng/ml。在另一个实例中,pdgf-bb的水平为至少约38ng/ml。在另一个实例中,pdgf-bb的水平为至少约39ng/ml。在另一个实例中,pdgf-bb的水平为至少约40ng/ml。
在另一个实例中,pdgf是pdgf-ab。在一个实例中,pdgf-ab的水平在约1ng/ml和150ng/ml之间。在另一个实例中,pdgf-ab的水平在约7.5ng/ml和120ng/ml之间。在另一个实例中,pdgf-ab的水平在约15ng/ml和60ng/ml之间。在另一个实例中,pdgf-ab的水平为至少约10ng/ml。在另一个实例中,pdgf-ab的水平为至少约15ng/ml。在另一个实例中,pdgf-ab的水平为至少约20ng/ml。在另一个实例中,pdgf-ab的水平为至少约21ng/ml。在另一个实例中,pdgf-ab的水平为至少约22ng/ml。在另一个实例中,pdgf-ab的水平为至少约23ng/ml。在另一个实例中,pdgf-ab的水平为至少约24ng/ml。在另一个实例中,pdgf-ab的水平为至少约25ng/ml。在另一个实例中,pdgf-ab的水平为至少约26ng/ml。在另一个实例中,pdgf-ab的水平为至少约27ng/ml。在另一个实例中,pdgf-ab的水平为至少约28ng/ml。在另一个实例中,pdgf-ab的水平为至少约29ng/ml。在另一个实例中,pdgf-ab的水平为至少约30ng/ml。在另一个实例中,pdgf-ab的水平为至少约31ng/ml。在另一个实例中,pdgf-ab的水平为至少约32ng/ml。在另一个实例中,pdgf-ab的水平为至少约33ng/ml。在另一个实例中,pdgf-ab的水平为至少约34ng/ml。在另一个实例中,pdgf-ab的水平为至少约35ng/ml。在另一个实例中,pdgf-ab的水平为至少约36ng/ml。在另一个实例中,pdgf-ab的水平为至少约37ng/ml。在另一个实例中,pdgf-ab的水平为至少约38ng/ml。在另一个实例中,pdgf-ab的水平为至少约39ng/ml。在另一个实例中,pdgf-ab的水平为至少约40ng/ml。
本发明人还发现,可以向本公开的细胞培养基中加入其它因子以增加细胞增殖。在一个实例中,本公开的方法包括在进一步包含egf的无胎牛血清细胞培养基中培养干细胞群。egf是通过结合其受体egfr来刺激细胞增殖的生长因子。在一个实例中,本公开的方法包括在进一步包含egf的无胎牛血清细胞培养基中培养干细胞群。在一个实例中,egf的水平在约0.1ng/ml和7ng/ml之间。例如,egf的水平可以为至少约5ng/ml。
在另一个实例中,egf的水平在约0.2ng/ml和3.2ng/ml之间。在另一个实例中,egf的水平在约0.4ng/ml和1.6ng/ml之间。在另一个实例中,egf的水平为约0.2ng/ml之间。在另一个实例中,egf的水平为至少约0.3ng/ml。在另一个实例中,egf的水平为至少约0.4ng/ml。在另一个实例中,egf的水平为至少约0.5ng/ml。在另一个实例中,egf的水平为至少约0.6ng/ml。在另一个实例中,egf的水平为至少约0.7ng/ml。在另一个实例中,egf的水平为至少约0.8ng/ml。在另一个实例中,egf的水平为至少约0.9ng/ml。在另一个实例中,egf的水平为至少约1.0ng/ml。在另一个实例中,egf的水平为至少约1.1ng/ml。在另一个实例中,egf的水平为至少约1.2ng/ml。在另一个实例中,egf的水平为至少约1.3ng/ml。在另一个实例中,egf的水平为至少约1.4ng/ml。
在一个实例中,pdgf-bb的水平为至少约3.2ng/ml,egf的水平为至少约0.8ng/ml,且fgf2的水平为至少约0.002ng/ml。在另一个实例中,pdgf-bb的水平为至少约9.6ng/ml,egf的水平为至少约0.24ng/ml,且fgf2的水平为至少约0.006ng/ml。在另一个实例中,pdgf-bb的水平为至少约16ng/ml,egf的水平为至少约0.40ng/ml,且fgf2的水平为至少约0.01ng/ml。在另一个实例中,pdgf-bb的水平为至少约32ng/ml,egf的水平为至少约0.80ng/ml,且fgf2的水平为至少约0.01ng/ml。
本公开还包括包含pdgf和fgf2的细胞培养基,其中fgf2的水平小于约6ng/ml。例如,fgf2的水平可以小于约5ng/ml、小于约4ng/ml、小于约3ng/ml、、小于约2ng/ml、小于约1ng/ml。在其它实例中,fgf2的水平小于约0.9ng/ml、小于约0.8ng/ml、小于约0.7ng/ml、小于约0.6ng/ml、小于约0.5ng/ml、小于约0.4ng/ml、小于约0.3ng/ml、小于约0.2ng/ml。
在一个实例中,细胞培养基含有约1pg/ml和100pg/ml之间的fgf2。在另一个实例中,细胞培养基含有约5pg/ml和80pg/ml之间的fgf2。在另一个实例中,细胞培养基含有约10pg/ml和40pg/ml之间的fgf2。例如,细胞培养基可以含有至少约10pg/ml的fgf2。例如,细胞培养基可以含有至少约11pg/ml的fgf2。例如,细胞培养基可以含有至少约12pg/ml的fgf2。例如,细胞培养基可以含有至少约13pg/ml的fgf2。例如,细胞培养基可以含有至少约14pg/ml的fgf2。例如,细胞培养基可以含有至少约15pg/ml的fgf2。例如,细胞培养基可以含有至少约16pg/ml的fgf2。例如,细胞培养基可以含有至少约17pg/ml的fgf2。例如,细胞培养基可以含有至少约18pg/ml的fgf2。例如,细胞培养基可以含有至少约19pg/ml的fgf2。例如,细胞培养基可以含有至少约20pg/ml的fgf2。例如,细胞培养基可以含有至少约21pg/ml的fgf2。例如,细胞培养基可以含有至少约22pg/ml的fgf2。例如,细胞培养基可以含有至少约23pg/ml的fgf2。例如,细胞培养基可以含有至少约24pg/ml的fgf2。例如,细胞培养基可以含有至少约25pg/ml的fgf2。例如,细胞培养基可以含有至少约26pg/ml的fgf2。例如,细胞培养基可以含有至少约27pg/ml的fgf2。例如,细胞培养基可以含有至少约28pg/ml的fgf2。例如,细胞培养基可以含有至少约29pg/ml的fgf2。例如,细胞培养基可以含有至少约30pg/ml的fgf2。
在一个实施方案中,本公开的细胞培养基补充有pdgf-bb。例如,细胞培养基可以含有约1ng/ml和150ng/ml之间的pdgf-bb。在另一个实例中,细胞培养基可以含有约7.5ng/ml和120ng/ml之间的pdgf-bb。在另一个实例中,细胞培养基可以含有约15ng/ml和60ng/ml之间的pdgf-bb。例如,细胞培养基可以含有至少约10ng/ml的pdgf-bb。例如,细胞培养基可以含有至少约15ng/ml的pdgf-bb。例如,细胞培养基可以含有至少约20ng/ml的pdgf-bb。例如,细胞培养基可以含有至少约21ng/ml的pdgf-bb。例如,细胞培养基可以含有至少约22ng/ml的pdgf-bb。例如,细胞培养基可以含有至少约23ng/ml的pdgf-bb。例如,细胞培养基可以含有至少约24ng/ml的pdgf-bb。例如,细胞培养基可以含有至少约25ng/ml的pdgf-bb。例如,细胞培养基可以含有至少约26ng/ml的pdgf-bb。例如,细胞培养基可以含有至少约27ng/ml的pdgf-bb。例如,细胞培养基可以含有至少约28ng/ml的pdgf-bb。例如,细胞培养基可以含有至少约29ng/ml的pdgf-bb。例如,细胞培养基可以含有至少约30ng/ml的pdgf-bb。例如,细胞培养基可以含有至少约31ng/ml的pdgf-bb。例如,细胞培养基可以含有至少约32ng/ml的pdgf-bb。例如,细胞培养基可以含有至少约33ng/ml的pdgf-bb。例如,细胞培养基可以含有至少约34ng/ml的pdgf-bb。例如,细胞培养基可以含有至少约35ng/ml的pdgf-bb。例如,细胞培养基可以含有至少约36ng/ml的pdgf-bb。例如,细胞培养基可以含有至少约37ng/ml的pdgf-bb。例如,细胞培养基可以含有至少约38ng/ml的pdgf-bb。例如,细胞培养基可以含有至少约39ng/ml的pdgf-bb。例如,细胞培养基可以含有至少约40ng/ml的pdgf-bb。
在一个实施方案中,本公开的细胞培养基补充有pdgf-ab。例如,细胞培养基可以含有约1ng/ml和150ng/ml之间的pdgf-ab。在另一个实例中,细胞培养基可以含有约7.5ng/ml和120ng/ml之间的pdgf-ab。在另一个实例中,细胞培养基可以含有约15ng/ml和60ng/ml之间的pdgf-ab。例如,细胞培养基可以含有至少约10ng/ml的pdgf-ab。例如,细胞培养基可以含有至少约15ng/ml的pdgf-ab。例如,细胞培养基可以含有至少约20ng/ml的pdgf-ab。例如,细胞培养基可以含有至少约21ng/ml的pdgf-ab。例如,细胞培养基可以含有至少约22ng/ml的pdgf-ab。例如,细胞培养基可以含有至少约23ng/ml的pdgf-ab。例如,细胞培养基可以含有至少约24ng/ml的pdgf-ab。例如,细胞培养基可以含有至少约25ng/ml的pdgf-ab。例如,细胞培养基可以含有至少约26ng/ml的pdgf-ab。例如,细胞培养基可以含有至少约27ng/ml的pdgf-ab。例如,细胞培养基可以含有至少约28ng/ml的pdgf-ab。例如,细胞培养基可以含有至少约29ng/ml的pdgf-ab。例如,细胞培养基可以含有至少约30ng/ml的pdgf-ab。例如,细胞培养基可以含有至少约31ng/ml的pdgf-ab。例如,细胞培养基可以含有至少约32ng/ml的pdgf-ab。例如,细胞培养基可以含有至少约33ng/ml的pdgf-ab。例如,细胞培养基可以含有至少约34ng/ml的pdgf-ab。例如,细胞培养基可以含有至少约35ng/ml的pdgf-ab。例如,细胞培养基可以含有至少约36ng/ml的pdgf-ab。例如,细胞培养基可以含有至少约37ng/ml的pdgf-ab。例如,细胞培养基可以含有至少约38ng/ml的pdgf-ab。例如,细胞培养基可以含有至少约39ng/ml的pdgf-ab。例如,细胞培养基可以含有至少约40ng/ml的pdgf-ab。
在一个实施方案中,本公开的细胞培养基还可以补充有egf。例如,细胞培养基可以含有约0.1ng/ml和7ng/ml之间的egf。例如,egf的水平可以为至少约5ng/ml。
在另一个实例中,细胞培养基可以含有约0.2ng/ml和3.2ng/ml之间的egf。在另一个实例中,细胞培养基可以含有约0.4ng/ml和1.6ng/ml之间的egf。例如,细胞培养基可以含有至少约0.2ng/ml的egf。例如,细胞培养基可以含有至少约0.3ng/ml的egf。例如,细胞培养基可以含有至少约0.4ng/ml的egf。例如,细胞培养基可以含有至少约0.5ng/ml的egf。例如,细胞培养基可以含有至少约0.6ng/ml的egf。例如,细胞培养基可以含有至少约0.7ng/ml的egf。例如,细胞培养基可以含有至少约0.8ng/ml的egf。例如,细胞培养基可以含有至少约0.9ng/ml的egf。例如,细胞培养基可以含有至少约1.0ng/ml的egf。例如,细胞培养基可以含有至少约1.1ng/ml的egf。例如,细胞培养基可以含有至少约1.2ng/ml的egf。例如,细胞培养基可以含有至少约1.3ng/ml的egf。例如,细胞培养基可以含有至少约1.4ng/ml的egf。
例如,细胞培养基可以含有至少约3.2ng/mlpdgf-bb,至少约0.08ng/mlegf和至少约0.002ng/mlfgf2。在另一个实例中,细胞培养基可以含有至少约9.6ng/mlpdgf-bb,至少约0.24ng/mlegf和至少约0.006ng/mlfgf2。在另一个实例中,细胞培养基可以含有至少约16ng/mlpdgf-bb,至少约0.40ng/mlegf和至少约0.01ng/mlfgf2。在另一个实例中,细胞培养基可以含有至少约32ng/mlpdgf-bb,至少约0.80ng/mlegf和至少约0.02ng/mlfgf2。
可以向本公开的细胞培养基中加入其它因子以增加细胞增殖。例如,细胞培养基中可以补充一种或多种选自由表皮生长因子(egf)、1α,25-二羟基维生素d3(1,25d)、肿瘤坏死因子α(tnf-α)、白细胞介素-1β(il-1β)和基质衍生因子1α(sdf-1α)组成的组的刺激因子。在另一个实施方案中,还可以在足以支持细胞生长的量的至少一种细胞因子的存在下培养细胞。在另一个实施方案中,可以在肝素或其衍生物的存在下培养细胞。例如,细胞培养基可以含有约50ng/ml肝素。在其它实例中,细胞培养基含有约60ng/ml肝素、约70ng/ml肝素、约80ng/ml肝素、约90ng/ml肝素、约100ng/ml肝素、约110ng/ml肝素、约110ng/ml肝素、约120ng/ml肝素、约130ng/ml肝素、约140ng/ml肝素、约150ng/ml肝素或其衍生物。在一个实例中,肝素衍生物是硫酸盐)。各种形式的硫酸肝素是本领域中已知的,并且包括硫酸肝素2(hs2)。hs2可以来自各种来源,包括例如雄性和/或雌性哺乳动物的肝脏。因此,示例性硫酸肝素包括雄性肝脏硫酸肝素(mmlhs)和雌性肝脏硫酸肝素(fmlhs)。
在另一个实例中,本公开的方法和细胞培养基在使干细胞保持未分化状态的同时促进干细胞增殖。当干细胞没有定型为特定分化谱系时,它们被认为是未分化的。如上所述,干细胞显示将其与分化细胞区分开的形态特征。此外,未分化的干细胞表达可以用作检测分化状态的标记物的基因。多肽产物也可以用作检测分化状态的标记物。因此,本领域技术人员可以使用常规形态学、遗传和/或蛋白质组学分析容易地确定本公开的方法是否使干细胞保持未分化状态。
组合物/试剂盒
本公开的细胞培养基可以作为完全培养基提供,其中在细胞培养之前已将基础培养基和生长因子混合在一起。或者,细胞培养基组分可以分开提供并在细胞培养之前或细胞培养期间与合适的基础培养基混合。因此,在一个实施方案中,本公开提供了用于添加到干细胞培养基中的血清替代组合物,所述组合物包含:
血小板源性生长因子(pdgf);
成纤维细胞生长因子2(fgf2);
其中,当将所述组合物添加到干细胞培养基中并在细胞培养基中培养干细胞群时,培养基中的fgf2水平小于约6ng/ml。在其它实例中,当将组合物添加到干细胞培养基中并在细胞培养基中培养干细胞群时,fgf2水平可以小于约5ng/ml、小于约4ng/ml、小于约3ng/ml、小于约2ng/ml、小于约1ng/ml。在其它实例中,fgf2的水平小于约0.9ng/ml、小于约0.8ng/ml、小于约0.7ng/ml、小于约0.6ng/ml、小于约0.5ng/ml、小于约0.4ng/ml、小于约0.3ng/ml、小于约0.2ng/ml。
在一个实例中,fgf2是以足够以约1pg/ml和100pg/ml之间的水平添加到干细胞培养基中的量存在。在另一个实例中,fgf2是以足够以约5pg/ml和80pg/ml之间的水平添加到干细胞培养基中的量存在。在另一个实例中,fgf2是以足够以约10pg/ml和40pg/ml之间的水平添加到干细胞培养基中的量存在。例如,fgf2可以以足够以至少约10pg/ml的水平添加到干细胞培养基中的量存在。例如,fgf2可以以足够以至少约11pg/ml的水平添加到干细胞培养基中的量存在。例如,fgf2可以以足够以至少约12pg/ml的水平添加到干细胞培养基中的量存在。例如,fgf2可以以足够以至少约13pg/ml的水平添加到干细胞培养基中的量存在。例如,fgf2可以以足够以至少约14pg/ml的水平添加到干细胞培养基中的量存在。例如,fgf2可以以足够以至少约15pg/ml的水平添加到干细胞培养基中的量存在。例如,fgf2可以以足够以至少约16pg/ml的水平添加到干细胞培养基中的量存在。例如,fgf2可以以足够以至少约17pg/ml的水平添加到干细胞培养基中的量存在。例如,fgf2可以以足够以至少约18pg/ml的水平添加到干细胞培养基中的量存在。例如,fgf2可以以足够以约19pg/ml的水平添加到干细胞培养基中的量存在。例如,fgf2可以以足够以至少约20pg/ml的水平添加到干细胞培养基中的量存在。例如,fgf2可以以足够以至少约21pg/ml的水平添加到干细胞培养基中的量存在。例如,fgf2可以以足够以至少约22pg/ml的水平添加到干细胞培养基中的量存在。例如,fgf2可以以足够以至少约23pg/ml的水平添加到干细胞培养基中的量存在。例如,fgf2可以以足够以至少约24pg/ml的水平添加到干细胞培养基中的量存在。例如,fgf2可以以足够以至少约25pg/ml的水平添加到干细胞培养基中的量存在。例如,fgf2可以以足够以至少约26pg/ml的水平添加到干细胞培养基中的量存在。例如,fgf2可以以足够以至少约27pg/ml的水平添加到干细胞培养基中的量存在。例如,fgf2可以以足够以至少约28pg/ml的水平添加到干细胞培养基中的量存在。例如,fgf2可以以足够以至少约29pg/ml的水平添加到干细胞培养基中的量存在。例如,fgf2可以以足够以至少约30pg/ml的水平添加到干细胞培养基中的量存在。
在一个实施方案中,pdgf-bb存在于本公开的组合物中。例如,pdgf-bb可以以足够以约1ng/ml至150ng/ml添加到干细胞培养基中的量存在。在另一个实例中,pdgf-bb可以以足够以约7.5ng/ml至120ng/ml添加到干细胞培养基中的量存在。在另一个实例中,pdgf-bb可以以足够以约15ng/ml至60ng/ml添加到干细胞培养基中的量存在。例如,pdgf-bb可以以足够以至少约10ng/ml添加到干细胞培养基中的量存在。例如,pdgf-bb可以以足够以至少约15ng/ml添加到干细胞培养基中的量存在。例如,pdgf-bb可以以足够以至少约20ng/ml添加到干细胞培养基中的量存在。例如,pdgf-bb可以以足够以至少约21ng/ml添加到干细胞培养基中的量存在。例如,pdgf-bb可以以足够以至少约22ng/ml添加到干细胞培养基中的量存在。例如,pdgf-bb可以以足够以至少约23ng/ml添加到干细胞培养基中的量存在。例如,pdgf-bb可以以足够以至少约24ng/ml添加到干细胞培养基中的量存在。例如,pdgf-bb可以以足够以至少约25ng/ml添加到干细胞培养基中的量存在。例如,pdgf-bb可以以足够以至少约26ng/ml添加到干细胞培养基中的量存在。例如,pdgf-bb可以以足够以至少约27ng/ml添加到干细胞培养基中的量存在。例如,pdgf-bb可以以足够以至少约28ng/ml添加到干细胞培养基中的量存在。例如,pdgf-bb可以以足够以至少约29ng/ml添加到干细胞培养基中的量存在。例如,pdgf-bb可以以足够以至少约30ng/ml添加到干细胞培养基中的量存在。例如,pdgf-bb可以以足够以至少约31ng/ml添加到干细胞培养基中的量存在。例如,pdgf-bb可以以足够以至少约32ng/ml添加到干细胞培养基中的量存在。例如,pdgf-bb可以以足够以至少约33ng/ml添加到干细胞培养基中的量存在。例如,pdgf-bb可以以足够以至少约34ng/ml添加到干细胞培养基中的量存在。例如,pdgf-bb可以以足够以至少约35ng/ml添加到干细胞培养基中的量存在。例如,pdgf-bb可以以足够以至少约36ng/ml添加到干细胞培养基中的量存在。例如,pdgf-bb可以以足够以至少约37ng/ml添加到干细胞培养基中的量存在。例如,pdgf-bb可以以足够以至少约38ng/ml添加到干细胞培养基中的量存在。例如,pdgf-bb可以以足够以至少约39ng/ml添加到干细胞培养基中的量存在。例如,pdgf-bb可以以足够以至少约40ng/ml添加到干细胞培养基中的量存在。
在一个实施方案中,本公开的组合物包含pdgf-ab。例如,pdgf-ab可以以足够以约1ng/ml至150ng/ml添加到干细胞培养基中的量存在。在另一个实例中,pdgf-ab可以以足够以约7.5ng/ml至120ng/ml添加到干细胞培养基中的量存在。在另一个实例中,pdgf-ab可以以足够以约15ng/ml至60ng/ml添加到干细胞培养基中的量存在。例如,pdgf-ab可以以足够以至少约10ng/ml添加到干细胞培养基中的量存在。例如,pdgf-ab可以以足够以至少约15ng/ml添加到干细胞培养基中的量存在。例如,pdgf-ab可以以足够以至少约20ng/ml添加到干细胞培养基中的量存在。例如,pdgf-ab可以以足够以至少约21ng/ml添加到干细胞培养基中的量存在。例如,pdgf-ab可以以足够以至少约22ng/ml添加到干细胞培养基中的量存在。例如,pdgf-ab可以以足够以至少约23ng/ml添加到干细胞培养基中的量存在。例如,pdgf-ab可以以足够以至少约24ng/ml添加到干细胞培养基中的量存在。例如,pdgf-ab可以以足够以至少约25ng/ml添加到干细胞培养基中的量存在。例如,pdgf-ab可以以足够以至少约26ng/ml添加到干细胞培养基中的量存在。例如,pdgf-ab可以以足够以至少约27ng/ml添加到干细胞培养基中的量存在。例如,pdgf-ab可以以足够以至少约28ng/ml添加到干细胞培养基中的量存在。例如,pdgf-ab可以以足够以至少约29ng/ml添加到干细胞培养基中的量存在。例如,pdgf-ab可以以足够以至少约30ng/ml添加到干细胞培养基中的量存在。例如,pdgf-ab可以以足够以至少约31ng/ml添加到干细胞培养基中的量存在。例如,pdgf-ab可以以足够以至少约32ng/ml添加到干细胞培养基中的量存在。例如,pdgf-ab可以以足够以至少约33ng/ml添加到干细胞培养基中的量存在。例如,pdgf-ab可以以足够以至少约34ng/ml添加到干细胞培养基中的量存在。例如,pdgf-ab可以以足够以至少约35ng/ml添加到干细胞培养基中的量存在。例如,pdgf-ab可以以足够以至少约36ng/ml添加到干细胞培养基中的量存在。例如,pdgf-ab可以以足够以至少约37ng/ml添加到干细胞培养基中的量存在。例如,pdgf-ab可以以足够以至少约38ng/ml添加到干细胞培养基中的量存在。例如,pdgf-ab可以以足够以至少约39ng/ml添加到干细胞培养基中的量存在。例如,pdgf-ab可以以足够以至少约40ng/ml添加到干细胞培养基中的量存在。
在一个实施方案中,本公开的组合物另外包含egf。例如,egf可以以足够以约0.1ng/ml至7ng/ml添加到干细胞培养基中的量存在。例如,egf可以以足够以至少约5ng/ml添加到干细胞培养基中的量存在。
在另一个实例中,egf可以以足够以约0.2ng/ml至3.2ng/ml添加到干细胞培养基中的量存在。在另一个实例中,egf可以以足够以约0.4ng/ml至1.6ng/ml添加到干细胞培养基中的量存在。例如,egf可以以足够以至少约0.2ng/ml添加到干细胞培养基中的量存在。例如,egf可以以足够以至少约0.3ng/ml添加到干细胞培养基中的量存在。例如,egf可以以足够以至少约0.4ng/ml添加到干细胞培养基中的量存在。例如,egf可以以足够以至少约0.5ng/ml添加到干细胞培养基中的量存在。例如,egf可以以足够以至少约0.6ng/ml添加到干细胞培养基中的量存在。例如,egf可以以足够以至少约0.7ng/ml添加到干细胞培养基中的量存在。例如,egf可以以足够以至少约0.8ng/ml添加到干细胞培养基中的量存在。例如,egf可以以足够以至少约0.9ng/ml添加到干细胞培养基中的量存在。例如,egf可以以足够以至少约1.0ng/ml添加到干细胞培养基中的量存在。例如,egf可以以足够以至少约1.1ng/ml添加到干细胞培养基中的量存在。例如,egf可以以足够以至少约1.2ng/ml添加到干细胞培养基中的量存在。例如,egf可以以足够以至少约1.3ng/ml添加到干细胞培养基中的量存在。例如,egf可以以足够以至少约1.4ng/ml添加到干细胞培养基中的量存在。
在一个实例中,pdgf-bb、egf和fgf2分别以足够以至少约3.2ng/ml、约0.08ng/ml和约0.002ng/ml添加到干细胞培养基中的量存在。在一个实例中,pdgf-bb、egf和fgf2分别以足够以至少约9.6ng/ml、约0.24ng/ml和约0.006ng/ml添加到干细胞培养基中的量存在。在一个实例中,pdgf-bb、egf和fgf2分别以足够以至少约16ng/ml、约0.4ng/ml和约0.02ng/ml添加到干细胞培养基中的量存在。在一个实例中,pdgf-bb、egf和fgf2分别以足够以至少约32ng/ml、约0.8ng/ml和约0.01ng/ml添加到干细胞培养基中的量存在。
在一个实例中,本公开的组合物可以包装在合适的溶剂中或与合适的溶剂一起包装或以冻干形式包装。
本文所公开的细胞培养基和/或组合物可以任选地与用于所需目的(例如,将组合物与细胞培养基混合以提供特定浓度)的书面说明书一起包装在合适的容器中。
本领域技术人员将会理解,可以在不脱离大致描述的本发明的精神或范围的情况下对如特定实施方案中所示的本发明作出多种变化和/或修改。因此,本发明的实施方案在所有方面都被认为是说明性而不是限制性的。
本文所讨论和/或引用的所有出版物整体并入本文中。
关于已经包括在本说明书中的文件、行为、材料、装置、制品等的任何讨论仅仅是为了提供本发明的上下文的目的。这不应被视为承认任何或所有这些事项构成现有技术基础的部分,或者因为其存在于本申请的每个权利要求的优先权日之前而是本发明相关领域中的公知常识。
本申请要求2015年3月4日提交的au2015900752和2015年3月5日提交的au2015900777的优先权,二者的公开内容通过引用并入本文中。
实施例:
实施例1:细胞培养基中的生长因子
为了评估间充质谱系前体细胞(mpc)在人血小板裂解物中的连续繁殖,将细胞在人血小板裂解物中培养7天,然后测量细胞增殖。从两个不同的供应商(供应商a和供应商b)获得血小板裂解物。血小板裂解物百分比的范围为0至10%。第7天的mpc增殖如图1所示。注意到当细胞在从供应商b获得的10%人血小板裂解物中生长时,细胞增殖水平最高。
测量从供应商a和b获得的人血小板裂解物中的生长因子egf、fgf2、vegf、pdgf-aa和pdgf-bb的浓度(pg/ml)。生长因子浓度(pg/ml)示于表1中。应该注意到,供应商b具有最高浓度的egf(8,036pg/ml)、最高浓度的pdgf-bb(46,432pg/ml)和最低浓度的fgf2(199pg/ml)。
表1:
实施例2:生长因子对细胞增殖的影响
为了评估hpl中的生长因子对细胞增殖的影响,将细胞群体暴露于生长因子egf、fgf2、vegf、pdgf-aa和pdgf-bb的抗体拮抗剂。
将细胞群体暴露于单一抗体拮抗剂、所有抗体拮抗剂的组合或ig抗体对照。抗体从r&dsystems获得并以饱和浓度添加。加入抗体后,将细胞在3%hpl(pltmax)中培养5天,然后测量细胞增殖。将暴露于抗体拮抗剂的每个细胞群体中的细胞增殖水平与暴露于ig对照抗体的细胞群体中的细胞增殖水平进行比较。
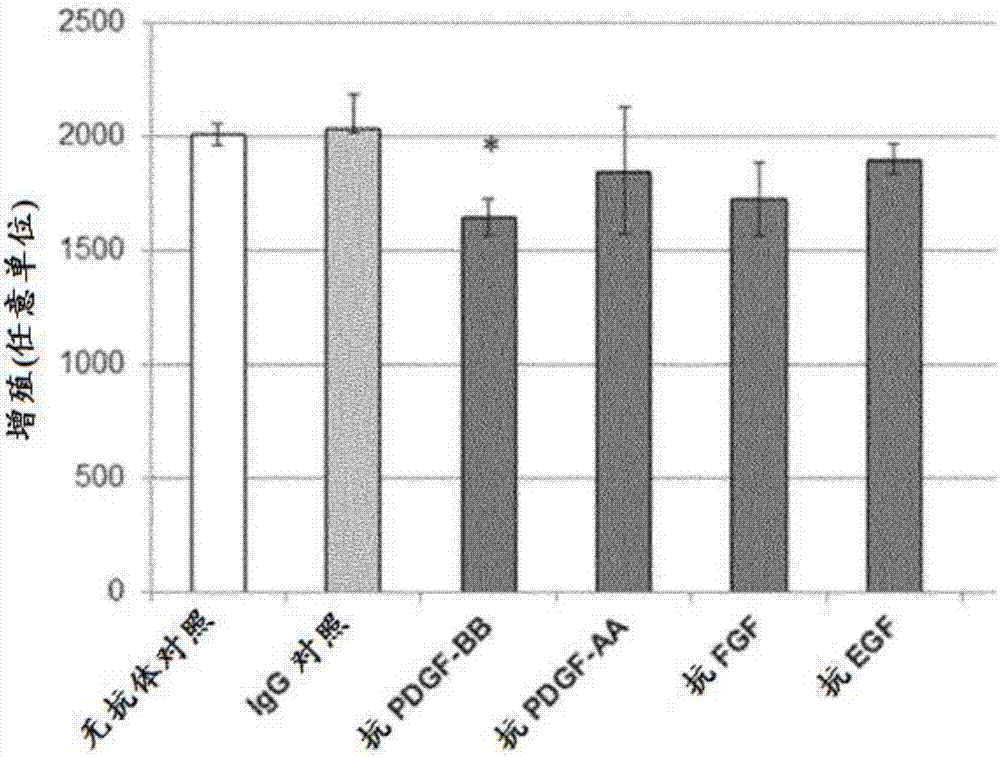
pdgf-bb的抗体中和是唯一导致测试的单一抗有丝分裂原抗体的mpc增殖显著下降的条件(图2)。
所有抗体拮抗剂的组合导致细胞增殖几乎完全被抑制(图2)。因此,在此初步实验中检查的五种生长因子几乎完全涵盖了hpl对细胞增殖的刺激。
这些结果还表明,其它生长因子中的一种促进pdgf-bb驱动的mpc增殖。
实施例3:生长因子对细胞增殖的影响
为了评估哪些其它生长因子有助于pdgf-bb驱动的mpc增殖,使用如图3所示的各种抗体组合培养mpc细胞。
加入抗体后,将细胞在3%hpl(pltmax)中培养5天,然后测量细胞增殖。将暴露于抗体拮抗剂的每个细胞群体中的细胞增殖水平与暴露于ig对照抗体的细胞群体和未暴露于抗体的细胞群体中的细胞增殖水平进行比较(图3)。
本研究表明,pdgf-bb、egf和fgf2刺激hpl对mpc的增殖。此外,pdgf-bb和egf各自与fgf2协同作用以促进细胞增殖。应该注意到,3%hpl中的fgf2浓度为约6pg/ml,这是亚有丝分裂剂量。
如所预期,在用ig对照培养的细胞群和未暴露于抗体的细胞群之间没有观察到细胞增殖的差异。
这些数据是开发化学成分确定的完全人源化的无异源物种成分的细胞培养基的基础,在这样的培养基中,mpc增殖是由重组有丝分裂原驱动。
实施例4:无胎牛血清细胞培养基的开发
起始基础细胞培养基包括α改良伊格尔氏最低必需培养基(mem)或stemspantm。
使用厄尔氏平衡盐获得的α改良伊格尔氏mem(通常被称为伊格尔氏α-mem)包含非必需氨基酸、丙酮酸钠和另外的维生素。这些改良最先被描述为用于生长杂交小鼠和仓鼠细胞(stanners等人,natnewbiol.,230,52–54,1971)。
stemspantm是可从stemcelltechnologies商购的无胎牛血清造血细胞扩增培养基。stemspantm的组成尚未公开。
将包含pdgf-bb、egf和fgf2的组合物添加到每种基础培养基中至以下浓度:
·pdgf-bb(3.2ng/ml)、egf(0.08ng/ml)和fgf2(0.002ng/ml)
·pdgf-bb(9.6ng/ml)、egf(0.24ng/ml)和fgf2(0.006ng/ml)
·pdgf-bb(16ng/ml)、egf(0.4ng/ml)和fgf2(0.01ng/ml)
·pdgf-bb(32ng/ml)、egf(0.8ng/ml)和fgf2(0.02ng/ml)
将msc群体培养在组织培养塑料(图4-αmem;图7-stemspantm)、纤连蛋白(图5-αmem;图8-stemspantm)或3%hpl(图6-αmem;图9-stemspantm)上的每种上述培养基(a-d)中。
将在生长因子补充培养基中培养的细胞群中的细胞增殖与在不含生长因子的基础培养基中培养的细胞群中的细胞增殖进行比较。在培养于补充有pdgf-bb(32ng/ml)、egf(0.8ng/ml)和fgf2(0.02ng/ml)的αmem或stemspantm基础培养基中的细胞中观察到细胞增殖的增加最多。
实施例5:无异源物种成分的细胞培养
将冷冻保存的人mpc解冻并以1,000个细胞/孔接种到96孔板上的补充有重组人生长因子的无异源物种成分的培养基中或不含生长因子的无异源物种成分的培养基中。
生长因子以下列浓度提供:
·pdgf-bb(p)–10ng/ml
·egf(e)–5ng/ml
·fgf2(f)–1ng/ml
·pdgf、egf、fgf2(pef)
在装入设定为5%co2、35-37℃的加湿nuaire孵育箱的incucytezoom实时成像显微镜(essenbioscience)内孵育培养物约120小时。与此同时,每6小时对细胞进行成像,以测量培养期间的汇合水平。将增殖动力学计算为随时间进行的汇合百分比(图10)。
实施例6:mpc细胞培养基中的细胞因子水平的比较
在标准培养基(α-mem+10%fbs)或含有α-mem+3%人ab血清+pdgf-bb、egf和fgf2.的无胎牛血清培养基中连续繁殖来自3个不同供体的mpc。测量细胞增殖后的细胞培养基中的细胞因子水平(图11)。
在无胎牛血清培养基中生长的三个供体细胞群中的两个中,ang1水平升高。在无胎牛血清培养基中生长的所有供体细胞群中,ang1:vegf比率增加。
- 还没有人留言评论。精彩留言会获得点赞!