猪圆环病毒3型SYBRGreenI实时荧光定量PCR检测引物对及试剂盒的制作方法
本发明属于生物技术领域,涉及猪圆环病毒3型的检测方法,具体涉及猪圆环病毒3型的sybrgreeni实时荧光定量pcr检测引物对及试剂盒。
背景技术:
猪圆环病毒(porcinecircovirus,pcv)是已知的能在哺乳动物细胞中进行自我复制的最小的病毒,属于圆环病毒科(circoviridae)圆环病毒属(circovirus)成员,它是一种无囊膜、单链环状dna病毒,主要感染单核/巨噬细胞系细胞,其中猪肺泡巨噬细胞是其主要的靶细胞。根据pcv的抗原性、致病性及核苷酸序列的差异,将pcv划分为pcv-1、pcv-2和pcv-3三种基因型,其中pcv-1无致病性,但广泛存在于猪体和猪源细胞系;pcv-2具有致病性,可引起猪的多种疾病,包括断奶仔猪多系统衰竭综合征、猪皮炎与肾病综合征和繁殖障碍等疾病,并在我国大部分地区呈暴发趋势;pcv-3致病性还不明了,仅在流产胎儿、有肺炎的猪只中检测出来。
目前,普遍应用常规pcr检测方法检测pcv-3,但普通pcr检测的灵敏度相对较低,且不能够定量病毒含量等弊端,而临床上猪只发病又与病毒含量成一定的正相关关系。因此,建立猪圆环病毒3型sybrgreeni实时荧光定量pcr检测引物对及试剂盒十分必要。本发明根据猪圆环病毒3型的orf2基因设计引物,可用于建立高效、准确、快速的分子生物学诊断技术。
技术实现要素:
本发明的目的在于,提供一种高敏感性、特异性和准确性的猪圆环病毒3型sybrgreeni实时荧光定量pcr检测引物对及试剂盒。
本发明的技术方案之一是,提供一种猪圆环病毒3型的sybrgreeni实时荧光定量pcr检测引物对,包括:seqidno:1所示核苷酸序列的正向引物,和seqidno:2所示核苷酸序列的反向引物。
在本发明的实施例中,所述引物对的退火温度是58℃。
本发明提供的引物对用于扩增猪圆环病毒3型的orf2基因部分片段,扩增出的目的基因片段大小为131bp。
本发明的技术方案之二是,提供一种猪圆环病毒3型的sybrgreeni实时荧光定量pcr检测试剂盒,其包括:seqidno:1所示核苷酸序列的正向引物;和seqidno:2所示核苷酸序列的反向引物。
作为优化的技术方案,所述seqidno:1所示核苷酸序列的正向引物的浓度为10μmol/l;所述seqidno:2所示核苷酸序列的反向引物的浓度为10μmol/l。
作为优化的技术方案,本发明提供的试剂盒还包括sybrpremixextaq预混液、ddh2o、阴性质控品和阳性质控品。
优选地,所述的阴性质控品为ddh2o;所述阳性质控品为猪圆环病毒3型的阳性质粒。
本发明的技术方案之三是,提供所述试剂盒的使用方法,包括以下步骤:以待测样品的dna为模板,在seqidno:1所示核苷酸序列的正向引物,和seqidno:2所示核苷酸序列的反向引物存在下,经过sybrgreeni实时荧光定量pcr检测,根据检测结果判断猪圆环病毒3型的存在情况和含量。
在本发明的实施例中,所述seqidno:1所示核苷酸序列的正向引物的浓度为10μmol/l;所述seqidno:2所示核苷酸序列的反向引物的浓度为10μmol/l。
在本发明实施例中,所述pcr检测的反应体系为20μl,该反应体系包括:
(1)10μmol/lseqidno:1所示核苷酸序列的正向引物1μl;和10μmol/lseqidno:2所示核苷酸序列的反向引物1μl;
(2)待测样品的dna模板2μl;
(3)sybrpremixextaq预混液10μl;
(4)ddh2o6μl。
在本发明实施例中,所述sybrgreeni实时荧光定量pcr检测的扩增程序为:
(1)95℃预变性90s;
(2)94℃变性5s,58℃退火30s,40个循环;
(3)95℃变性15s,58℃延伸1min;95℃变性30s,58℃延伸15s。
本发明的有益效果是:本发明提供的猪圆环病毒3型sybrgreeni实时荧光定量pcr检测引物对及试剂盒,所述引物对包括seqidno:1所示核苷酸序列的正向引物,和seqidno:2所示核苷酸序列的反向引物。所述引物对用于扩增猪圆环病毒3型的orf2基因部分片段,扩增出的目的基因片段大小为131bp。本发明还提供猪圆环病毒3型的sybrgreeni实时荧光定量pcr检测试剂盒及该试剂盒的使用方法。利用本发明所述的引物对对猪圆环病毒3型的检测特异性好,不和猪相关病毒发生反应,仅猪圆环病毒3型为阳性,检测的灵敏度高,为1.0×101拷贝/μl。可用于猪圆环病毒3型的病原学调查。
附图说明
图1为猪圆环病毒3型荧光定量pcr扩增标准曲线;其中,1-6对应不同浓度的样品的pcr产物;样品的浓度自左向右依次为:1.0×108、1.0×107、1.0×106、1.0×105、1.0×104、1.0×103拷贝/μl;
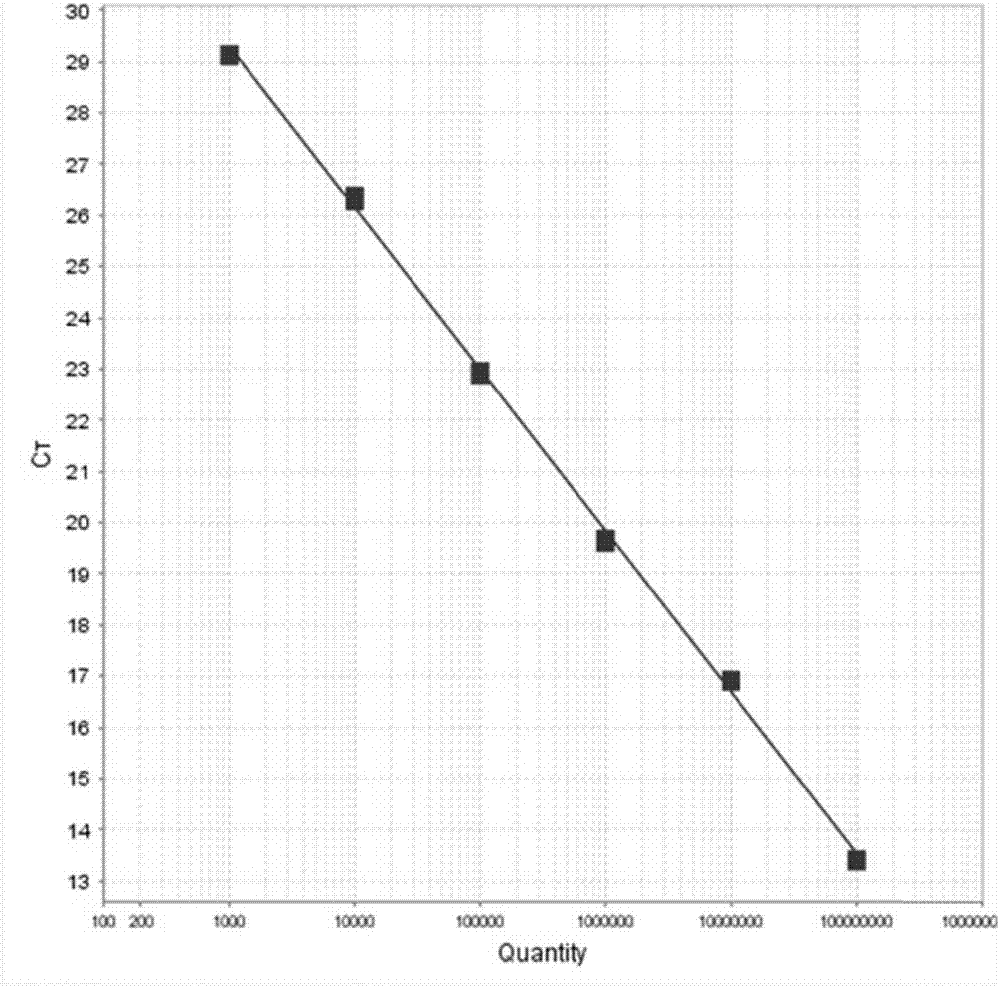
图2为猪圆环病毒3型荧光定量pcr标准曲线;
图3为猪圆环病毒3型荧光定量pcr扩增熔解曲线;
图4为猪圆环病毒3型荧光定量pcr敏感性试验结果;其中,1-9对应不同浓度的样品的pcr产物;样品的浓度自左向右依次为:1.0×108、1.0×107、1.0×106、1.0×105、1.0×104、1.0×103、1.0×102、1.0×101、1.0×100拷贝/μl;10为阴性对照;
图5为猪圆环病毒3型荧光定量pcr特异性试验结果;其中,1-10对应不同病毒样品的pcr产物,病毒样品自左向右依次为pcv-3、pcv-1、pcv-2、prv、csfv、prrsv、pedv、pdcov、tgev和pastv。
具体实施方式
提供下述实施例是为了更好地进一步理解本发明,并不局限于所述最佳实施方式,最佳实施例不对本发明的内容和保护范围构成限制,任何人在本发明的启示下或是将本发明与其他现有技术的特征进行组合而得出的任何与本发明相同或相近似的方法和产品,均落在本发明的保护范围之内。
本发明所涉及的实验材料来源如下,其他未说明的材料均为普通市售品,均可通过市场购买获得:
1、菌株和质粒
大肠杆菌top10感受态细胞购自北京天根生化科技有限公司。
pcv-1(猪圆环病毒1型)、pcv-2(猪圆环病毒2型)、prv(猪伪狂犬病毒)、csfv(猪瘟病毒)、prrsv(猪繁殖与呼吸综合征病毒)、pedv(猪流行性腹泻病毒)、pdcov(猪丁型冠状病毒)、tgev(猪传染性胃肠炎病毒)、pastv(猪星状病毒)均从江西各猪场临床样品中分离获得并由本实验室保存。
2、试剂
酵母提取物、胰蛋白胨、氨苄青霉素均购自北京索莱宝科技有限公司;
病毒rna/dna提取试剂盒(离心柱型)、sybrpremixextaq预混液、dl2000dnamarker、pmd18-t载体均购置takara(大连)公司;
质粒小提试剂盒购自北京天根生化科技有限公司;
胶回收试剂盒购自omega公司。
3、设备
sorvallst16r高速冷冻离心机、legendmicro21r高速冷冻离心机和nanodrop2000均购自美国thermo公司;
appliedbiosystems7500pcr仪购自美国应用生物系统公司;
琼脂糖水平电泳槽购自北京六一生物科技有限公司;
凝胶成像系统购自上海培清科技有限公司。
实施例1:猪圆环病毒3型的sybrgreeni实时荧光定量pcr检测方法建立
1、引物设计与合成
根据genbank中登陆的pcv-3(kx966193)pcv3-us/sd2016毒株的orf2保守区域,应用primerpremier5.0软件设计一对特异性引物,引物由上海生工生物工程技术服务公司合成,所得的引物对的序列如表1所示(其中,“f”代表正向引物,“r”代表反向引物):
表1:引物信息
2、病毒dna提取
根据takara公司的minibestviralrna/dnaextractionkitver.5.0病毒提取试剂盒的操作说明书提取病毒rna/dna,操作步骤如下:
(1)研磨器研磨病料后,离心取上清;
(2)取200μl离心后上清、200μlbuffervgb、20μl蛋白酶k和1μlcarrierrna混匀,于56℃水浴10min;
(3)裂解后的液体加入200μl无水乙醇混匀,转移至spincolumns,离心后分步加入bufferrwa/rwb,离心。
(4)离心后加入30μl无rnaaseddh2o溶解dna/rna,-80℃保存备用。
3、pcr扩增
将上一步提取的dna为模板进行猪圆环病毒3型的orf2基因部分序列pcr扩增,按下述的反应体系和反应程序进行扩增:
该猪圆环病毒3型orf2基因部分序列pcr扩增的反应体系为25μl,包括:
(1)10μmol/lseqidno:1所示核苷酸序列的正向引物1μl;和10μmol/lseqidno:2所示核苷酸序列的反向引物1μl;
(2)待测样品的dna模板2.5μl;
(3)premixtaq预混液12.5μl;
(4)ddh2o8μl。
该pcr检测的反应程序为:
(1)94℃预变性10min;
(2)94℃变性30s,58℃退火30s,72℃延伸30s,36个循环;
(3)72℃再延伸7min。
pcr产物2%琼脂糖凝胶电泳观察电泳结果。扩增pcr产物对应条带大小约为131bp,与猪圆环病毒3型orf2基因片段的长度一致。
4、目的产物胶回收
根据omega公司的胶回收试剂盒的操作说明对上一步pcr扩增得到的目的基因进行胶回收纯化。
5、目的基因克隆
将上一步纯化好的目的基因与pmd18-t载体连接,16℃连接2h或4℃连接过夜,连接体系如下:
6、连接产物的转化
将上一步得到的连接产物按照以下步骤进行连接产物的转化:
(1)从-80℃冰箱中取出大肠杆菌top10感受态细胞,迅速置于冰上或者冰水混合物中解冻。
(2)取5μl连接产物和25μl解冻的大肠杆菌top10感受态细胞置于1.5ml离心管中轻轻搅拌混匀,冰浴30min。并提前开好水浴锅,将温度调至42℃。
(3)42℃水浴热应激60s,并将离心管迅速转移至碎冰中放置5min。
(4)加入900μl预热的lb液体培养基,180rpm振荡培养约90min。
(5)8000rpm常温离心5min,弃800μl上清,重悬菌体取50μl和150μl菌液分别均匀涂布在加有氨苄青霉素的lb固体培养基上,37℃培养箱正置培养10min后倒置培养12-16h。
7、菌落的挑取及pcr鉴定
挑取五个涂布的lb培养基中白色、湿润、光滑的单个菌落至1.5mlep管中,加300μllb液体培养基培养4h,以该菌液为dna模板,按照如下反应体系和反应程序进行pcr检测:
该pcr检测的反应体系为25μl,包括:
(1)10μmol/lseqidno:1所示核苷酸序列的正向引物1μl;和10μmol/lseqidno:2所示核苷酸序列的反向引物1μl;
(2)菌液2.5μl;
(3)premixtaq预混液12.5μl;
(4)ddh2o8μl。
该pcr检测的反应程序为:
(1)94℃预变性10min;
(2)94℃变性30s,58℃退火30s,72℃延伸30s,共36个循环;
(3)72℃总延伸7min。
所得pcr产物2%琼脂糖凝胶电泳观察。挑取2个鉴定为阳性克隆的菌落进行下一步实验。
8、pcv-3orf2基因的序列测定及分析
将上一步获得的2个鉴定为阳性克隆的菌落送至上海生工生物工程技术服务公司进行测序,测序引物为m13,并进行序列比对分析。测序结果经blast比对分析,本发明所述的pcr方法扩增的基因序列与pcv-3毒株的同源性在98%以上,说明本发明提供的引物对扩增的目的基因为pcv-3型。
9、标准曲线的绘制
将鉴定为阳性重组菌的菌落扩大培养后提取质粒,将提取的质粒计算出拷贝数(拷贝数的计算公式为:copies/ml=(6.02×1023)×(g/ml)/(dnalength×660)),做10倍梯度稀释,以1.0×108、1.0×107、1.0×106、1.0×105、1.0×104、1.0×103为标准模板进行pcr扩增,每个梯度做三次重复(做三次重复的目的是保证结果准确性),猪圆环病毒3型荧光定量pcr扩增标准曲线见图1,图1中0.056598为荧光阈值,1-6对应不同浓度的样品的pcr产物;样品的浓度自左向右依次为:1.0×108、1.0×107、1.0×106、1.0×105、1.0×104、1.0×103拷贝/μl;对扩增结果进行结果分析,绘制标准曲线,见图2。
反应结束后逐渐加温,每加温一度,读一次荧光信号。以温度为横坐标,荧光信号的变化为纵坐标,绘制猪圆环病毒3型荧光定量pcr扩增熔解曲线见图3,tm值为84.5℃,熔解曲线为单峰,说明扩增的产物特异性好。
实施例2:猪圆环病毒3型的sybrgreeni实时荧光定量pcr测定方法优化
使用48℃,50℃,52℃,54℃的温度梯度对反应进行优化,通过优化反应条件,确认以下的反应体系和扩增程序为最佳条件:
最佳反应程序:20μl的反应体系,包括:
(1)10μmol/lseqidno:1所示核苷酸序列的正向引物1μl;和10μmol/lseqidno:2所示核苷酸序列的反向引物1μl;
(2)待测样品dna模板2μl;
(3)sybrpremixextaq预混液10μl;
(4)ddh2o6μl。
最佳扩增程序为:
(1)95℃预变性90s;
(2)94℃变性5s,58℃退火30s,40个循环;
(3)95℃变性15s,58℃延伸1min;95℃变性30s,58℃延伸15s。
实施例3:猪圆环病毒3型sybrgreeni实时荧光定量pcr检测的试剂盒制备
本发明提供的猪圆环病毒3型核酸检测试剂盒,包括:sybrpremixextaq预混液、ddh2o、seqidno:1所示核苷酸序列的正向引物、seqidno:2所示核苷酸序列的反向引物、阴性质控品(ddh2o)、阳性质控品(制备的标准质粒)。
本试剂盒制备过程中所用的试剂主要购自宝生物工程(大连)有限公司(takara),其余购自天根生化科技(北京)有限公司、北京化工厂。所述试剂盒的制备过程如下:
1、pcr反应液制备
(1)引物设计与合成
根据genbank已发表的pcv-3orf2基因序列,用mega6.0软件进行序列比对找出保守序列。根据猪圆环病毒3型保守序列用primerpremier5.0软件设计检测猪圆环病毒3型pcr引物。引物由上海生工生物工程有限公司合成,引物包括:seqidno:1所示核苷酸序列的正向引物,和seqidno:2所示核苷酸序列的反向引物。
(2)引物的溶解
取合成好的引物(seqidno:1所示核苷酸序列的正向引物,和seqidno:2所示核苷酸序列的反向引物)干粉管,12,000rpm离心1min,按照引物溶解说明书加入ddh2o将干粉溶解,使两种引物浓度各为10μm,振荡混匀离心,备用;
(3)pcr反应液配制:
按下述比例配制pcr反应液:seqidno:1所示核苷酸序列的正向引物(10μmol/l)1μl,seqidno:2所示核苷酸序列的反向引物(10μmol/l)1μl,sybrpremixextaq预混液10μl,ddh2o6μl。
2、阴性质控品制备
阴性质控品的作用是用来防止因污染而产生的假阳性。本发明采用ddh2o作为阴性质控品,对整个实验过程进行监控。
3、阳性质控品制备
阳性质控品的作用是监控试剂是否失效及性能是否下降。本发明采用pcv-3型的阳性重组质粒作为阳性质控品。按照本技术领域中常用的分子克隆技术,阳性重组质粒的构建和提取方法如下:
首先利用seqidno:1所示核苷酸序列的正向引物,和seqidno:2所示核苷酸序列的反向引物对提取的基因组dna进行pcr扩增;然后采用omegagelextractionkit回收pcr产物作为目的片段;采用大连宝生物的pmd18-tcloningvector试剂盒,将上述目的片段插入pmd18-t载体中,构建重组质粒,通过转化及筛选,得到含插入有上述目的片段的重组质粒的阳性克隆菌;该阳性克隆菌经过扩大培养后,用天根质粒提取试剂盒提取培养菌液中的质粒并用紫外分光光度计进行定量。
4、质控标准:
阴性质控品:阴性;
阳性质控品:阳性。
以上条件应同时满足,否则,此次试验视为无效,全部试验应重新进行。
5、分析判断:
sybrgreeni实时荧光定量pcr检测荧光强弱,有扩增曲线的为阳性,没有扩增曲线的为阴性。并且可以根据样品的ct值和绘制的标准曲线,计算出样品中的病毒核酸含量。
实施例4:猪圆环病毒3型sybrgreeni实时荧光定量pcr检测方法特异性试验
利用本发明建立的猪圆环病毒3型pcr检测方法分别以pcv-3、pcv-1、pcv-2、prv、csfv、prrsv、pedv、pdcov、tgev、pastv核酸为模板进行pcr扩增,结果见图5,图中1-10对应不同病毒样品的pcr产物,病毒样品自左向右依次为pcv-3、pcv-1、pcv-2、prv、csfv、prrsv、pedv、pdcov、tgev和pastv。
结果说明:应用本申请提供的猪圆环病毒3型的sybrgreeni实时荧光定量pcr检测方法对pcv-1、pcv-2、prv、csfv、prrsv、pedv、pdcov、tgev、pastv病毒的检测结果均为阴性,只有pcv-3的pcr检测结果呈阳性,表明该pcr检测方法的特异性良好。
实施例5:猪圆环病毒3型sybrgreeni实时荧光定量pcr检测方法敏感性试验
将实施例1中获得的阳性重组菌扩大培养后提取质粒,提取方法为:将200μlpcr鉴定为阳性且测序结果正确的菌液接种于20ml加有氨苄青霉素的lb液体培养基中,培养8h后,12000rpm离心2min,弃上清;加入2mlpbs重悬,12000rpm离心2min,弃上清后参照质粒小提试剂盒说明书(北京天根)提取质粒,提取后通过超微量分光光度计nanodrop2000测定提取的重组质粒的浓度,再根据重组质粒分子质量和阿伏伽德罗常数将质粒浓度换算成单位体积分子拷贝数,并将重组质粒以1.0×108拷贝/μl为原始浓度后进行10倍梯度稀释,分别以1.0×108、1.0×107、1.0×106、1.0×105、1.0×104、1.0×103、1.0×102、1.0×101拷贝/μl为模板进行实时荧光定量pcr扩增以检验本发明提供的猪圆环病毒3型sybrgreeni实时荧光定量pcr检测方法的灵敏度,检测结果见图4,图中,1-9对应不同浓度样品的pcr产物;样品的浓度自左向右依次为:1.0×108、1.0×107、1.0×106、1.0×105、1.0×104、1.0×103、1.0×102、1.0×101、1.0×100拷贝/μl;10:阴性对照。
结果表明:本发明提供的猪圆环病毒3型的sybrgreeni实时荧光定量pcr检测方法的最低检测量为1.0×101拷贝/μl,表明所建立的pcr方法敏感性良好。
实施例6:猪圆环病毒3型sybrgreeni实时荧光定量pcr检测方法重复性试验
利用本发明所述的猪圆环病毒3型的sybrgreeni实时荧光定量pcr检测方法,以不同浓度的pcv-3型阳性质粒dna为模板,进行三次扩增(间隔五天),以确定检测结果的重复性,结果见表2。
表2:猪圆环病毒3型荧光定量pcr重复性试验结果
结果说明:利用本发明所述的猪圆环病毒3型的sybrgreeni实时荧光定量pcr检测方法以不同浓度的pcv-3型阳性质粒在不同时间点进行测定,批内和批间重复性试验结果统计学分析显示其变异系数范围均小于0.5%,表明本发明所述的方法重复性良好。
实施例7:猪圆环病毒3型sybrgreeni实时荧光定量pcr检测方法对临床样品的检测
利用本发明所述的猪圆环病毒3型的sybrgreeni实时荧光定量pcr检测方法对采自江西32个猪场256份样品(肺、淋巴结、脾脏)进行检测,以验证该方法的实用性。结果5份检测样品呈阳性,检出的阳性率为1.95%。
结果表明:本发明所述的sybrgreeni实时荧光定量pcr检测方法在临床实践上具有可行性。
sequencelisting
<110>江西农业大学
<120>猪圆环病毒3型sybrgreeni实时荧光定量pcr检测引物对及试剂盒
<130>1
<160>2
<170>patentinversion3.3
<210>1
<211>21
<212>dna
<213>人工序列
<400>1
agaggctttgtcctgggtgag21
<210>2
<211>21
<212>dna
<213>人工序列
<400>2
gctccaagacgacccttatgc21
- 还没有人留言评论。精彩留言会获得点赞!