血竭素、血竭素衍生物或其可用盐在制备糖尿病药物中的应用的制作方法
本发明涉及生物医药领域,具体涉及血竭素、血竭素衍生物或其可用盐在制备糖尿病药物中的应用。
背景技术:
糖尿病是一种常见、有遗传倾向、以高血糖为特征的慢性代谢性和全身进行性疾病,具有普遍性、高发病率和高死亡率的特点,现已成为继癌症、心脑血管疾病之后,人类第三大杀手。糖尿病防治在相当长的时期内将是人类面临的严峻挑战。寻找和开发新型、高效、安全治疗糖尿病的药物刻不容缓,是糖尿病治疗领域的首要任务。
糖尿病主要分为I型、II型,其中以II型糖尿病为主,占患糖尿病人数的90%以上。胰岛β细胞功能缺陷是形成II型糖尿病的主要原因之一,II型糖尿病也被称为是由于β细胞功能缺陷而导致的单基因或多基因遗传病。胰岛β细胞功能缺陷的原因主要有胰岛β细胞块的减损和胰岛β细胞分泌功能的衰减。且研究表明,机体长期处于高糖环境中会诱发多种慢性炎症,出现胰岛β细胞数目减少,胰岛素分泌不足。因此,保护胰岛β细胞,调控胰岛素合成和分泌是治疗糖尿病的一种重要手段。
胰十二指肠同源盒1(pancreatic duodenal homeobox-1,Pdx-1)最早又被称为生长抑素活化因子-1(STF-1)、胰岛素启动因子-1(IPF-1)或胰岛素敏感因子(GSF)。其蛋白序列和结构域在不同物种间高度保守,且蛋白结构的氨基末端(N-terminus)是转录激活区,为胰岛素基因转录所必须,无论是在β细胞还是在非β细胞,都能活化胰岛素启动子。同时,Pdx1还能够调节β细胞的生长和增殖,抑制β细胞发生凋亡。Pdx1对β细胞生长和增殖的调控主要是通过Irs1/Irs2-PI3K-Akt信号通路实现的,其中Akt能直接调节其下游靶基因Pdx1的功能。最初,Pdx1与其它同源基因一起,在动物模型中被证实与凋亡之间有一定联系,渐渐许多研究也证实Pdx1表达降低与β细胞凋亡或因此而导致的细胞死亡密切相关,尤其当细胞处于高糖环境时,胰岛组织中Pdx1表达明显减少。Pdx1因而作为促进胰腺发育,调控胰岛素的合成和分泌、胰岛细胞分化的关键转录因子,在治疗糖尿病领域引起极大关注。
通过对Pdx1与II型糖尿病形成关系的研究,发现在II型糖尿病小鼠模型中,高血糖环境下,胰岛β细胞内Pdx1的表达降低,直接影响了胰岛素基因的表达和胰岛素的合成,同时影响了β细胞的增殖,使β细胞数目减少。在人类中发现,Pdx1基因的无义突变与II型糖尿病的形成密切相关,Pdx1基因缺失突变的患者亦表现出严重的糖尿病症状。诸多证据显示在患糖尿病的各个阶段都会发生β细胞功能缺陷,且起主导作用。而Pdx1的活性缺失则是β细胞功能缺陷的根本原因,这使得有正常功能的β细胞数目减少,导致胰岛素分泌不足,进而形成糖尿病。因此,Pdx1在维持β细胞的正常功能和调节糖代谢平衡方面起关键作用,是糖尿病治疗的一个潜在基因靶标,全面了解其与糖尿病发生的关系,进行必要的体外逆转实验,筛选出高效、低毒、低剂量的Pdx1表达激活剂,是一种治疗糖尿病的新方法。
血竭,又名骐驎竭、海蜡、麒麟血、木血竭,棕榈科植物麒麟竭果实和藤茎中的树脂。具有活血散瘀,定痛,止血生肌的功效,血竭素是其主要成分之一,属黄酮类化合物中的花青素类。近来研究发现,血竭素高氯酸盐可以诱导人宫颈癌Hela细胞、胃癌SGC-7901、人乳腺癌MCF-7等癌细胞产生凋亡,同时在防治小鼠糖尿病肾病的肾损伤方面发挥重要作用。目前,尚没有血竭素其他结构修饰物生物活性研究的相关报道。
总之,以往对于血竭素及其结构修饰物的生物药理作用研究还很局限。本发明发现了血竭素及其结构修饰物在保护胰岛β细胞和治疗糖尿病方面的机制,主要是通过经典胰岛素信号通路促进Pdx1的表达,抗胰岛β细胞凋亡,升高体内胰岛素水平,发挥降血糖作用的。
技术实现要素:
本发明的目的之一是设计开发了血竭素或其可用盐在制备糖尿病药物中的应用。
本发明的目的之二是设计开发了血竭素衍生物或其可用盐在制备糖尿病药物中的应用。
本发明提供的技术方案为:
血竭素在制备糖尿病药物中的应用。
优选的是,所述糖尿病为Ⅱ型糖尿病。
优选的是,所述血竭素用于激活转录因子Pdx1的表达进而保护胰岛β细胞。
根据通式(Ⅰ)所示的血竭素药学上可接受的盐在制备糖尿病药物中的应用:
其中,R1,R5为H,R2为OH,R3为CH3,R4为OCH3,X为ClO4—、Cl—或者C6H2N3O7—。
优选的是,所述血竭素衍生物包括:5-甲氧基-6-甲基-2-苯基-7H-色烯-7-酮或者7-羟基-6甲基-2-苯基-铬烯。
根据通式(Ⅰ)所示的血竭素衍生物药学上可接受的盐在制备糖尿病药物中的应用:
优选的是,所述通式(Ⅰ)中R1,R4,R5为H,R2为OH或OCH3,R3为CH3,X为Cl—;或者
R1,R5为H,R2为OCH3,R3为CH3,R4为OH,X为Cl—。
优选的是,所述通式(Ⅰ)中R3,R5为H,R1为CH3,R2为OH或者OCH3,R4为OCH3,X为Cl—;或者
R3,R5为H,R1为CH3,R2为OCH3,R4为OH,X为ClO4—。
优选的是,所述通式(Ⅰ)中R5为H,R1,R3为CH3,R2为OH,R4为OCH3;
R3为H,R1,R5为CH3,R2为OH,R4为OCH3;或者
R1为H,R2为OCH3,R3,R5为CH3,R4为OH;
X为Cl—。
优选的是,所述糖尿病为Ⅱ型糖尿病。
本发明与现有技术相比较所具有的有益效果:Pdx1作为调控胰岛素的合成和分泌、胰岛细胞分化及胰腺发育的关键转录因子,在治疗糖尿病领域引起极大关注。本发明首次以Pdx1作为糖尿病药物作用靶标,建立糖尿病药物筛选系统,对II型糖尿病治疗针对性强,适用性广。此外,本发明所筛选出来的糖尿病治疗药物血竭素为天然产物,能够从动植物体内提取出来,具有多种天然产物的优点,如易被机体吸收利用,毒副作用相对较小,不易产生抗药性等,从而使其成为糖尿病治疗的优良候选药物。而且,本发明还采用糖尿病小鼠模型对血竭素,血竭素盐及其多种衍生物的糖尿病治疗作用进行了探讨,发现了血竭素,血竭素盐及其多种衍生物对糖尿病小鼠显著的降血糖及促进胰岛素分泌的作用。通过以上分析说明,本发明以Pdx1为靶点筛选出的血竭素,血竭素盐及其系列衍生物,能够成为糖尿病治疗的候选药物。
附图说明
图1为血竭素及其衍生物对Pdx1启动子活性的影响,数据表示为:*:与control组相比,P<0.05,**:与control组相比,P<0.01。
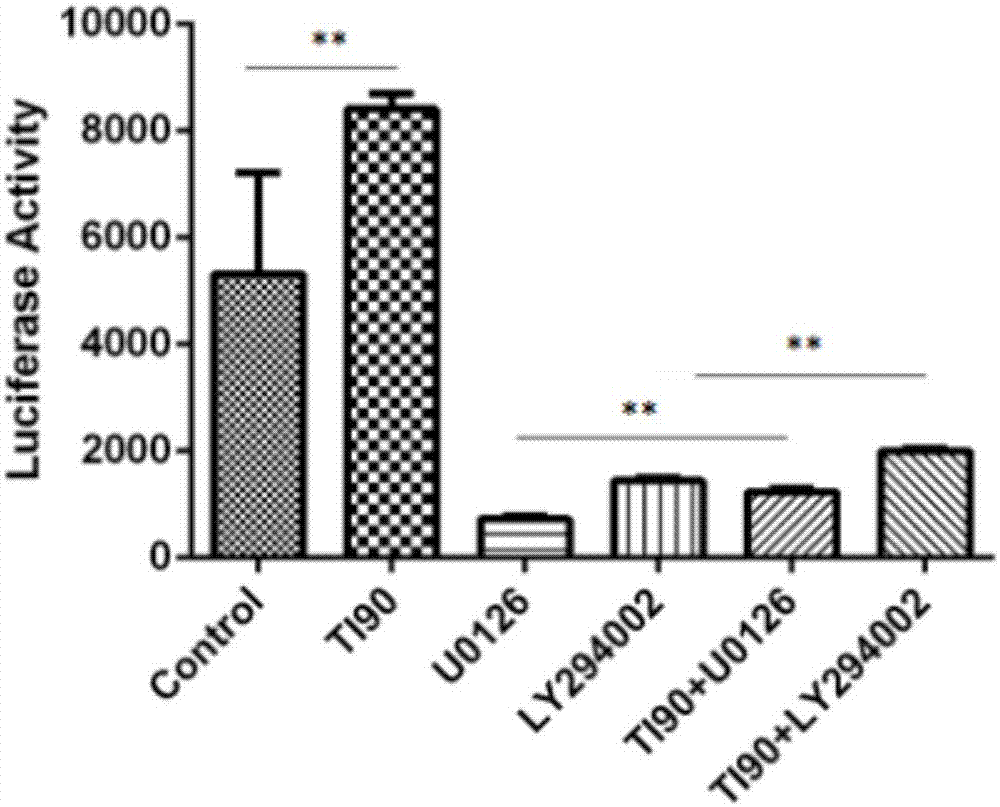
图2为血竭素及其衍生物对经典胰岛素信号通路及Pdx1表达的影响,数据表示:**:与control组相比,P<0.01。
图3为血竭素对高糖损伤胰岛β细胞的保护作用,数据表示:**:与33nM glucose单独处理组相比,P<0.01。
图4为血竭素对高脂损伤胰岛β细胞的保护作用,数据表示:*:与200μM PA单独处理组相比,P<0.05,**:与200μM PA单独处理组相比,P<0.01。
图5为血竭素对糖尿病小鼠血糖水平的影响,数据表示:**:与糖尿病模型组相比,P<0.01。
图6为血竭素对糖尿病小鼠血清中胰岛素水平的影响,数据表示:*:与糖尿病模型组相比,P<0.05。
图7为血竭素对糖尿病小鼠胰岛Pdx1表达的影响,数据表示:**:与糖尿病模型组相比,P<0.01。
具体实施方式
下面结合附图对本发明做进一步的详细说明,以令本领域技术人员参照说明书文字能够据以实施。
本发明所述保护胰岛β细胞及治疗糖尿病的药物为血竭素及其衍生物。其通式如下:
其中,R1,R5为H,R2为OH,R3为CH3,R4为OCH3(血竭素,TI90)
或R1,R5为H,R2为OH,R3为CH3,R4为OCH3,X为ClO4—(血竭素高氯酸盐,TI91)
或R1,R5为H,R2为OH,R3为CH3,R4为OCH3,X为Cl—(血竭素盐酸盐,TI92)
或R1,R5为H,R2为OH,R3为CH3,R4为OCH3,X为C6H2N3O7—(血竭素苦味酸盐,TI94)
或R1,R5为H,R2为O,R3为CH3,R4为OCH3(5-甲氧基-6-甲基-2-苯基-7H-色烯-7-酮,TI95)
或R1,R4,R5为H,R2为OH,R3为CH3(7-羟基-6-甲基-2-苯基-铬烯,TI93)
或R1,R4,R5为H,R2为OH,R3为CH3,X为Cl—(7-羟基-6-甲基-2-苯基-铬烯,盐酸盐,TI96)
或R1,R4,R5为H,R2为OCH3,R3为CH3,X为Cl—(7-甲氧基-6-甲基-2-苯基-铬烯,盐酸盐,TI97)
或R1,R5为H,R2为OCH3,R3为CH3,R4为OH,X为Cl—(5-羟基-7-甲氧基-6-甲基-2-苯基-铬烯,盐酸盐,TI98)
或R3,R5为H,R1为CH3,R2为OH,R4为OCH3,X为Cl—(7-羟基-5-甲氧基-8-甲基-2苯基-铬烯,盐酸盐,TI99)
或R3,R5为H,R1为CH3,R2为OCH3,R4为OH,X为Cl—(5-羟基-7-甲氧基-8-甲基-2-苯基-铬烯,盐酸盐,TI100)
或R3,R5为H,R1为CH3,R2为OCH3,R4为OH,X为ClO4—(5-羟基-7-甲氧基-8-甲基-2-苯基-铬烯,高氯酸盐,TI101)
或R5为H,R1,R3为CH3,R2为OH,R4为OCH3,X为Cl—(7-羟基-5-甲氧基-6,8-二甲基-2-苯基-铬烯,盐酸盐,TI102)
或R3为H,R1,R5为CH3,R2为OH,R4为OCH3,X为Cl—(7-羟基-5-甲氧基-4,8-二甲基-2-苯基-铬烯,盐酸盐,TI103)
或R1为H,R2为OCH3,R3,R5为CH3,R4为OH,X为Cl—(5-羟基-7-甲氧基-4,6二甲基-2苯基-铬烯,盐酸盐,TI104)
本发明所述的血竭素及其衍生物包括血竭素、血竭素高氯酸盐、血竭素盐酸盐、血竭素苦味酸盐、5-甲氧基-6-甲基-2-苯基-7H-色烯-7-酮、7-羟基-6-甲基-2-苯基-铬烯、7-羟基-6-甲基-2-苯基-铬烯盐酸盐、7-甲氧基-6-甲基-2-苯基-铬烯盐酸盐、5-羟基-7-甲氧基-6-甲基-2-苯基-铬烯盐酸盐、7-羟基-5-甲氧基-8-甲基-2-苯基-铬烯盐酸盐、5-羟基-7-甲氧基-8-甲基-2-苯基-铬烯盐酸盐、5-羟基-7-甲氧基-8甲基-2-苯基-铬烯高氯酸盐、7-羟基-5-甲氧基-6,8-二甲基-2-苯基-铬烯盐酸盐、7-羟基-5-甲氧基-4,8-二甲基-2-苯基-铬烯盐酸盐、5-羟基-7-甲氧基-4,6-二甲基-2-苯基-铬烯盐酸盐。
本发明所述血竭素及其衍生物对胰岛β细胞的保护作用,降低高糖、高脂对胰岛β细胞的毒性作用,抑制高糖、高脂诱导的胰岛β细胞凋亡,本发明所述的糖尿病是指II型糖尿病;本发明所述血竭素及其衍生物主要是通过降低糖尿病血糖水平,或升高胰岛素水平,或促进胰岛β细胞中调控胰岛素基因的转录因子Pdx1表达,或激活胰岛β细胞中AKT和ERK信号通路来发挥其对糖尿病的治疗作用。
本发明的血竭素及其衍生物对胰岛β细胞的保护作用及对糖尿病的治疗作用及相关机制研究是通过以下方法进行的:
1、血竭素及其衍生物的获得
血竭素及其衍生物可通过商品购买获得或通过以下方法制备:
血竭素、血竭素高氯酸盐、血竭素盐酸盐的制备方法见专利201610059078.X。
血竭素苦味酸盐的制备方法见Brockmann H,Junge H,Eckhardt I.Berichte der deutschen chemischen Gesellschaft(A and B Series),1944,77(5):347-353.
5-甲氧基-6-甲基-2-苯基-7H-色烯-7-酮的制备方法见Robertson A,Whalley W B.383.Journal of the Chemical Society(Resumed),1950:1882-1884.
7-羟基-6-甲基-2-苯基-铬烯制备方法见Jurd L.Tetrahedron,1972,28(3):493-504.
7-羟基-6-甲基-2-苯基-铬烯盐酸盐制备方法见Journal of the chemical Society,1950,P.1876,1880.
7-甲氧基-6-甲基-2-苯基-铬烯盐酸盐制备方法见Journal of the chemical Society,1950,P.1876,1880.
5-羟基-7-甲氧基-6-甲基-2-苯基-铬烯盐酸盐、5-羟基-7-甲氧基-8-甲基-2苯基-铬烯盐酸盐制备方法见Brockmann H,Junge H.Berichte der deutschen chemischen Gesellschaft(A and B Series),1943,76(8):751-763.
7-羟基-5-甲氧基-8-甲基-2-苯基-铬烯盐酸盐制备方法见Brockmann H,Junge H,Eckhardt I.Berichte der deutschen chemischen Gesellschaft(A and B Series),1944,77(5):347-353.
5-羟基-7-甲氧基-8-甲基-2-苯基-铬烯高氯酸盐(Brockmann H,Junge H,Eckhardt I.Berichte der deutschen chemischen Gesellschaft(A and B Series),1944,77(5):347-353.
7-羟基-5-甲氧基-6,8-二甲基-2-苯基-铬烯盐酸盐Brockmann H,Junge H,Eckhardt I.Berichte der deutschen chemischen Gesellschaft(A and B Series),1944,77(5):347-353.
7-羟基-5-甲氧基-4,8-二甲基-2-苯基-铬烯盐酸盐Chemische Berichte,1944,vol.77/79,p.44,46,Anm.9.
5-羟基-7-甲氧基-4,6-二甲基-2-苯基-铬烯盐酸盐(Journal of the chemical Society,1950,P.1876,1880.
2、血竭素及其衍生物对Pdx1启动子活性的影响
首先钓取Pdx1启动子并克隆入pGL3中,从而构建出pGL3-Pdx1报告质粒。HEK293T细胞以5×104的密度接种于24孔板中。按脂质体转染方法将Pdx1启动子报告质粒pGL3-Pdx1或空载pGL3与pCMV-β-gal质粒共转染HEK293T细胞,在细胞培养箱中培养4~6h后弃去旧的培养基,换成新鲜的10%FBS DMEM培养基。24h后,改用加有10μg/mL化合物的含3%血清的DMEM培养基继续培养12~24h,之后进行荧光素酶活性检测;当所述筛选细胞内报告基因表达强度升高,所述待筛选化合物促进人Pdx1的表达;当所述筛选细胞内报告基因表达强度降低,所述待筛选化合物抑制人Pdx1的表达。
如图1所示,鉴于血竭素,血竭素高氯酸盐,血竭素盐酸盐,7-羟基-6甲基-2-苯基-铬烯均具能够较好地促进Pdx1启动子活性,所以我们认为是它们结构中的共同部分在发挥此作用,而且据此我们可以推断其它具有这个共同结构的血竭素衍生物,即具有以下通式的化合物也应该具有相同的活性,可以作为一种人Pdx1基因的表达激动剂。
3、血竭素及其衍生物通过经典胰岛素信号通路对Pdx1表达的影响
胰岛β细胞上存在着胰岛素受体和胰岛素受体底物,这些蛋白与Pdx1及下游相关蛋白一起,调控着胰岛素的合成和分泌,维持着β细胞的生长、增殖和存活,而PI3K/Akt和ERK信号通路在这些生命活动中发挥着重要作用。许多Pdx1的刺激剂,如胰岛素和葡萄糖,能够激活Akt和ERK磷酸化位点,这反过来促进了Pdx1的磷酸化和其在细胞质和细胞核之间的穿梭位移。为了验证血竭素及其衍生物激活的这两条信号通路是否与Pdx1的表达有关,本发明首先检测了应用这两个通路的抑制剂是否影响Pdx1报告基因的表达,然后检测这两个通路的抑制剂是否解除血竭素及其衍生物对Pdx1表达的影响。
钓取Pdx1启动子并克隆入pGL3中,从而构建出pGL3-Pdx1报告质粒。向INS-1细胞中转染pGL3-Pdx1报告质粒,然后分别加入各种试剂如血竭素及其衍生物(10μg/mL),ERK抑制剂U0126(10μM),Akt抑制剂LY294002(10μM)等。比较加入10μg/mL的血竭素或其衍生物与加入抑制剂U0126或LY294002后,报告基因的活性。
4、血竭素及其衍生物对胰岛β细胞的保护作用
(1)胰岛β细胞高糖损伤模型的建立
主要采用INS-1细胞体外模拟高糖对β细胞的毒性作用,建立高糖损伤模型,即分别用含有不同浓度葡萄糖的培养基培养INS-1细胞一段时间后,通过MTT法考察不同浓度的葡萄糖对不同培养时间的INS-1细胞的毒性。
(2)胰岛β细胞高脂损伤模型的建立
主要采用INS-1细胞体外模拟高脂对β细胞的毒性作用,建立高脂损伤模型,即分别用含有不同浓度棕榈酸(Palmitic acid,PA)的培养基培养INS-1细胞24h后,通过MTT法考察不同浓度的棕榈酸对INS-1细胞的毒性。
(3)血竭素及其衍生物对高糖损伤胰岛β细胞的保护作用
将不同浓度的血竭素及其衍生物加入到33mM高糖培养基条件下的胰岛β细胞高糖损伤模型内,72小时后采用MTT法考察不同浓度的血竭素及其衍生物对高糖损伤INS-1细胞生长的影响以反映血竭素及其衍生物对高糖损伤胰岛β细胞的保护作用。
(4)血竭素及其衍生物对高脂损伤胰岛β细胞的保护作用
将不同浓度的血竭素及其衍生物加入到200μM棕榈酸培养条件下的胰岛β细胞高脂损伤模型内,24小时后采用MTT法,考察不同浓度的血竭素及其衍生物对高脂损伤INS-1细胞生长的影响以反映血竭素及其衍生物对高脂损伤胰岛β细胞的保护作用。
(5)血竭素及其衍生物的抗凋亡作用
为研究血竭素及其衍生物对高糖(高脂)诱导的INS-1细胞凋亡的保护作用,本发明主要采用了DAPI染色实验,这是被广泛运用的检测细胞凋亡的技术。
将INS-1细胞种到96孔板中,培养24h后弃去旧培养基,同时加入新培养基,分四组处理:普通培养基组,普通培养基+10μg/mL血竭素组,33mM高糖培养基组(高脂模型为200μM棕榈酸组),33mM高糖培养基+10μg/mL血竭素组(高脂模型为200μM棕榈酸+10μg/mL血竭素)。继续孵育72h后,用PBS清洗细胞3遍,然后用4%的多聚甲醛(溶解在PBS中,PH7.4;Sigma)室温下固定30min。将固定后的细胞用PBS清洗3次后,37℃避光条件下用DAPI染色20min,然后在Olympus BX50荧光显微镜(Olympus,Tokyo,Japan)下观察细胞并拍照。观察细胞形态并计数凋亡细胞数目,考察血竭素及其衍生物对高糖或高脂诱发的细胞凋亡的影响。
(6)血竭素及其衍生物的抗凋亡作用与pdx1表达的关系
为了确定血竭素及其衍生物的抗凋亡作用过程中是否有Pdx1的参与,本发明主要通过蛋白免疫印迹的方法考察了在高糖、高脂或普通培养条件下培养的INS-1细胞内Pdx1的表达情况。
将INS-1细胞种到96孔板中,培养24h后弃去旧培养基,同时加入新培养基,分四组处理:普通培养基组,普通培养基+10μg/mL血竭素及其衍生物组,33mM高糖培养基组(高脂模型为200μM棕榈酸组),33mM高糖培养基+10μg/mL血竭素组(高脂模型为200μM棕榈酸+10μg/mL血竭素组)。继续孵育72h后分别收集上述四组细胞,提取蛋白,然后在12%分离胶-5%浓缩胶的胶板中进行蛋白电泳,经转膜、封闭、洗涤后,最后用化学发光仪进行显影。分析比较Pdx1的蛋白表达情况以考察血竭素及其衍生物的抗凋亡作用与Pdx1表达的关系。
5、血竭素及其衍生物对糖尿病小鼠血糖的影响
(1)糖尿病小鼠模型的建立
为了验证血竭素及其衍生物是否具有降血糖作用,本发明使用了雄性C57BL/6J糖尿病模型小鼠,来开展后续实验。
糖尿病小鼠模型建立方法为:在7周大的雄性C57BL/6J小鼠腹腔内注射100mg/kg的STZ,同时高糖高脂饮食(59%基本饲料,20%蔗糖,18%猪油,3%的蛋黄)。2周后,取小鼠尾静脉血液,测量空腹6h后小鼠体内血糖含量,连续3天测得的小鼠空腹血糖≥7.0mmol/L,代表本发明中患糖尿病的C57BL/6J小鼠造模成功。
(2)血竭素及其衍生物对糖尿病小鼠的降血糖作用
首先将C57BL/6J小鼠随机分为以下几组:正常对照组:血糖水平正常的C57BL/6J小鼠,用普通饲料喂养;糖尿病对照组:造模成功的C57BL/6J糖尿病小鼠,腹腔注射生理盐水并高糖高脂饮食;实验组:造模成功的C57BL/6J糖尿病小鼠,腹腔注射不同浓度的血竭素(5mg/kg、10mg/kg和20mg/kg)并高脂饮食。其中实验组小鼠按加入血竭素及其衍生物的浓度分为3组,和正常对照组及糖尿病对照组一起共分为5组,每组6只小鼠。各组小鼠每隔一天向腹腔注射不同浓度的血竭素及其衍生物或等量的生理盐水,持续4周,之后检测小鼠体内血浆血糖水平。
(3)血竭素及其衍生物对糖尿病小鼠血清胰岛素水平的影响
实验小鼠分组同上,然后分别于小鼠眼部取血,5000rpm离心5min,取上清,即为血清。用Mercodia Rat Insulin ELISA试剂盒测血清的胰岛素含量,实验方法参照说明书。通过不同组糖尿病小鼠的血清胰岛素水平差异值判断血竭素及其衍生物对糖尿病小鼠血清胰岛素水平的影响。
(4)血竭素及其衍生物对糖尿病小鼠胰岛Pdx1表达的影响
为了验证血竭素及其衍生物对体内高糖环境下β细胞的保护作用是否也是通过能促进Pdx1蛋白表达实现的。本发明采用了蛋白免疫印迹的方法考察了血竭素及其衍生物对糖尿病小鼠胰岛Pdx1表达的影响。结果发现:糖尿病对照组小鼠Pdx1蛋白的表达量明显少于正常对照组,当糖尿病小鼠经10mg/kg的血竭素及其衍生物处理后,Pdx1蛋白的表达得以恢复。表明不仅在体外血竭素及其衍生物能促进Pdx1的表达,在体内同样能促进糖尿病小鼠胰岛中Pdx1蛋白的表达。即血竭素及其衍生物通过促进Pdx1的表达,抑制II型糖尿病小鼠体内β细胞的凋亡,维持一定的β细胞数目,使得β细胞能分泌足够的胰岛素来发挥其降血糖作用。
药物组合物和治疗方法
药物组合物以及治疗人Pdx1基因相关疾病如糖尿病等的方法亦在本发明的范围之内。所述药物组合物包括有效量的本发明的血竭素及其衍生物以及可药用载体。“可药用载体”包括溶剂、分散剂、包衣、抗细菌和抗真菌剂以及等张剂和吸收延迟剂等。
本发明的药物组合物可通过传统方法制成各种适应于不同给药途径的药物剂型。例如,它可制成口服胶囊或片剂。胶囊可包含任何标准的可药用物质如明胶、纤维素等。片剂可按传统方法即将药物组合物与固相载体以及润滑剂压缩制得。固相载体包括淀粉和糖斑脱土。本发明的药物组合物还可制成硬壳片剂或包含捆绑剂如乳糖或甘露醇、常规填充剂以及压片剂的胶囊。本发明的药物组合物还可通过非肠道途径给药。非肠道途径给药剂型包括本发明的药物组合物的水剂、等张盐溶液或5%的糖溶液以及与其他本领域公知的可药用赋形剂形成的制剂。环式糊精或其他本领域技术人员所公知的促溶剂均可作为药用赋形剂来递呈本发明的药物组合物。
概括地讲,本发明的血竭素及其衍生物可悬溶于可药用载体(如生理溶液)中,通过口服或静脉输液,或通过皮下、肌下、胸内、腹膜内、直肠内、阴道内、鼻内、胃内、气道内、肺内注射或输液等途径给药。剂型的选择受到给药途径、制剂类型、患者(病种、病情、体形、体重、体表面积、年龄、性别)、药物相互影响以及收治医师的诊断等诸多因素的影响。适用的制剂用量范围为0.01~100.00mg/kg。用量范围可随病人情况与给药途径的不同而做相应的调整。其将主要取决于收治医师的诊断。例如,口服剂量一般要高于静脉注射剂量。所述剂量可通过本领域公知的经验优化方法进行调整。将本发明的药物组合物包裹于适宜的药物递呈载体(如聚合微粒体或输入设备)可提高给药,特别是口服给药的效率。
本发明的药物组合物的活性可通过体外和体内实验进行评价。简而言之,本发明的药物组合物的药理活性反映在其调节人Pdx1基因表达活性的能力上。在体内实验中,所述药物组合物被注射入动物(如小鼠模型)体内以评价其药理活性。在此基础上,合适的剂量范围和给药途径遂得以确定。
为了便于理解本发明,特列举以下实施例。其作用应被理解为是对本发明的阐释而非对本发明的任何形式的限制。
主要实验材料和仪器
1、细胞
HepG2细胞、HEK293T细胞和INS-1细胞购自中科院上海细胞库;pGL3载体购自BioVector质粒载体菌种细胞基因保藏中心-NTCC典型培养物保藏中心。
2、试剂、酶与药品
蛋白酶K(20mg/mL)购自Sigma公司;λ-HindIII DNA Marker和DL2000DNA Marker购自TaKaRa公司;HIFI Taq DNA polymerase、10×Taq Buffer和dNTPs购自北京全式金公司;限制性内切酶XhoI、HindIII和T4DNA连接酶购自TaKaRa公司;Promega TA克隆试剂盒购自美国promega公司;LB培养液购自上海杰美基因医药科技有限公司;Amp抗生素(氨苄青霉素)购自百灵威科技有限公司;MTT(3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐,噻唑蓝)购自Sigma-Aldrich公司;ERK抑制剂U0126购自上海翊圣生物科技有限公司;Akt抑制剂LY294002购自购自上海翊圣生物科技有限公司;棕榈酸(PA)购自国家标准物质信息中心;DAPI购自北京鼎国昌盛生物技术有限责任公司;STZ(链脲菌素)购自北京鼎国昌盛生物技术有限责任公司;Mercodia Rat Insulin ELISA试剂盒购自瑞典Mercodia公司。
其他生化试剂包括甲醇、乙醇、冰醋酸、氯仿、异丙醇及多聚甲醛、二甲基亚砜、氯化钠、氯化钾、氢氧化钠等均购自北京化工厂,均为国产分析纯;水为双蒸水。
实施例
1、血竭素及其衍生物对Pdx1启动子活性的影响
首先钓取Pdx1启动子并克隆入pGL3中,从而构建出pGL3-Pdx1报告质粒。HEK293T细胞以5×104的密度接种于24孔板中。按脂质体转染方法将Pdx1启动子报告质粒pGL3-Pdx1或空载pGL3与pCMV-β-gal质粒共转染HEK293T细胞,在细胞培养箱中培养4~6h后弃去旧的培养基,换成新鲜的10%FBS DMEM培养基。24h后,改用加有10μg/mL化合物的含3%血清的DMEM培养基继续培养12~24h,之后进行荧光素酶活性检测。实验组与对照组的荧光值比值的相对倍数值,即为所有化合物对Pdx1启动子活性促进或抑制的效果。荧光素酶(firefly luciferase)的活性与β半乳糖苷酶(β-gal)的活性之比,剔除了样本转染效率的差异,可比较客观地反映样本间启动子活性的差异。不同样品的荧光素酶相对活性为每一样品荧光素酶活性与每一样品β半乳糖苷酶活性的比值。结果如图1所示,本发明所提及的血竭素及其衍生物均可不同程度地促进Pdx1启动子的活性;如表1所示,血竭素及其衍生物对Pdx1启动子活性的影响。
表1血竭素及其结构类似物对Pdx1启动子活性的影响
在本实施例中,Pdx1启动子区的钓取包括如下步骤:
步骤一、引物设计
从NCBI Genbank中找出Pdx1的基因组序列,选取转录起始位点上游约2000bp的基因调控序列。用Primer5.0软件设计引物,并利用BLAST软件进行比对。Pdx1启动子的引物序列如下:上游端引物为:5'-ATTACTCGAGCGTCGCCAAGTCAACCCTCGG-3'(SEQ ID NO.2);下游端引物为:5'-TTAAGCTTGGGGATTTGGCACTGTGTGGCGTTC-3'(SEQ ID NO.3)。
步骤二、细胞全基因组提取
将6孔板中一孔密度约为90%的HEK293T细胞收集,并用PBS洗涤后,转入1.5mL离心管中,4℃和4000rpm,离心5min;弃上清,在离心管中加入700μL DNA裂解液,混匀后,加入3.5μl蛋白酶K(20mg/mL),使终浓度达到100μg/mL,50℃恒温水浴2h;加入700μL等体积的饱和酚至样品裂解液中,温和、充分混匀3min,12000rpm离心5min;取上层水相至另一1.5mL离心管中,加等体积酚/氯仿/异戊醇(25/24/1),颠倒混匀,12000rpm离心5min;将上层水相转移至新的离心管中,加等体积氯仿/异戊醇(24/1),颠倒混匀,12000rpm离心5min(如水相仍不清澈,可重复此步骤);取上层水相至新的离心管,加入1/10体积的3M醋酸钠、2.5倍体积无水乙醇,轻轻颠倒混匀;室温静置10min左右,待絮状物出现后,12000rpm离心10min;弃上清,用1mL 75%乙醇洗涤沉淀,12000rpm离心5min;弃上清,室温下挥发乙醇,待沉淀近透明后加入适量体积的无菌水,室温溶解30min,-20℃保存备用。
步骤三、PCR扩增Pdx1启动子
以上述细胞基因组DNA为模板,利用SEQ ID NO.2和SEQ ID NO.3所示的引物序列通过PCR扩增得到SEQ ID NO.1所示的核苷酸序列的DNA片段,即为人Pdx1基因启动;PCR反应条件为:95℃,5min;95℃,45sec;55℃,45sec;72℃,3min,30个循环;72℃,8min。
步骤四、PCR产物的电泳及回收
上述PCR产物用1%琼脂糖凝胶进行电泳,电泳后将切下的目的胶块放入提前准备好的双层离心管中(内部离心管底部扎孔)一起离心,8000rpm离心5min,弃去上面的离心管,在下面的离心管中加入等体积的平衡酚,充分混匀。-20℃冷冻30min,室温溶解。12000rpm,离心5min,将上层水相转移到新离心管中。加入等量的平衡酚/氯仿(1:1),混匀,12000rpm离心5min。取上清至新离心管,加入1/10体积的3M醋酸钠,2.5倍体积的无水乙醇或等体积的异丙醇,混匀,-20℃放置1h。12000rpm,离心10min,弃上清,75%乙醇洗涤沉淀。至沉淀完全晾干后,加10μl无菌水溶解沉淀,-20℃保存备用。
步骤五、PCR产物的TA克隆
将上述回收产物与TA克隆载体连接,方法按Promega TA克隆试剂盒说明进行,4℃过夜后,将10μL连接产物放入装有100μLDH5α感受态菌液的EP管中用200μL移液器轻轻吹打几次混匀,冰浴30min;42℃热激90s后,立即转移至冰中,冰浴3min;在超净台中加入无抗生素LB培养液800μL,37℃振荡培养30min;5000rpm,离心1min,弃上清,留大约50μL上清重新悬浮菌体沉淀,涂布于含有氨苄抗生素的LB培养皿上,先于37℃正置培养1h,然后倒置培养12~16h。
步骤六、重组质粒的筛选
在细菌超净台中向无菌的15mL菌管中加入4mL含有Amp抗生素的液体培养基,挑取单克隆于菌管中,37℃,180rpm振荡培养10h。碱裂解法提取质粒,用XhoI和HindIII酶切鉴定,将酶切鉴定阳性的质粒进行测序。
步骤七、Pdx1-pGL3重组质粒的构建
将上述TA克隆细菌进行大量扩增后提取质粒,用XhoI和HindIII酶切,回收2Kb片段;同时将pGL3用XhoI和HindIII酶切,回收酶切后的质粒,将回收后的片段和pGL3质粒用TAKARA的连接酶I进行连接,连接方法按TAKARA Ligation Kit说明书进行,16℃连接4小时后,将连接产物按上述连接产物转化并扩大培养后,将细菌涂至具有氨苄青霉素的LB培养基上,37℃孵箱培养过夜。挑单个菌落接种到2ml的LB培养基中,37℃振荡培养过夜,次日提取质粒,用XhoⅠ和HindⅢ酶切鉴定,将酶切鉴定阳性的质粒进行测序。
2、血竭素及其衍生物通过经典胰岛素信号通路对Pdx1表达的影响
钓取Pdx1启动子并克隆入pGL3中,从而构建出pGL3-Pdx1报告质粒。向INS-1细胞中转染pGL3-Pdx1报告质粒,然后分别加入各种试剂如血竭素及其衍生物(10μg/mL),ERK抑制剂U0126(10μM),Akt抑制剂LY294002(10μM)等。结果如图2所示,当加入10μg/mL的血竭素或其衍生物后,报告基因活性升高。当加入抑制剂U0126或LY294002后,报告基因活性明显降低,说明血竭素及其衍生物通过激活ERK与Akt两条信号通路参与Pdx1的表达调控。
3、血竭素及其衍生物对胰岛β细胞的保护作用
(1)胰岛β细胞高糖损伤模型的建立
INS-1细胞分别用含11.1mM葡萄糖的普通培养基、含25mM葡萄糖的高糖培养基和含33mM葡萄糖的高糖培养基培养24h、48h、72h及96h。然后于上述四个检测时间点前4h每孔加入20μL的MTT,在细胞培养箱中继续培养。之后弃去细胞培养基,每孔加入150μLDMSO,震荡混匀15min,用酶标仪检测波长为570nm处的吸光值,即代表该时间点的细胞活力。最终发现无论是25mM还是33mM葡萄糖都能在72h和96h使INS-1细胞大量死亡。INS-1细胞的高糖损伤模型建立成功。
(2)胰岛β细胞高脂损伤模型的建立
INS-1细胞培养基中分别加入不同浓度的棕榈酸(终浓度为150μM,180μM,200μM,220μM,240μM,260μM)培养20h后,每孔加入20μL的MTT,在细胞培养箱中继续培养。4h后弃去细胞培养基,每孔加入100μL DMSO,震荡混匀15min,用酶标仪检测波长为570nm处的吸光值,即代表该时间点的细胞活力。最终发现200-260μM棕榈酸均能在24h使INS-1细胞大量死亡。INS-1细胞的高脂损伤模型建立成功。
(3)血竭素及其衍生物对高糖损伤胰岛β细胞的保护作用
将不同浓度的血竭素及其衍生物加入到33mM高糖培养基条件下的胰岛β细胞高糖损伤模型内,72小时后采用MTT法考察不同浓度的血竭素及其衍生物对高糖损伤INS-1细胞生长的影响。结果如图3所示,血竭素的浓度在5-20μg/mL能显著减轻细胞的糖毒性,对高糖损伤胰岛β细胞具有保护作用;如表2~16所示,血竭素及其衍生物的浓度5-20μg/mL能显著减轻细胞的糖毒性,对高糖损伤胰岛β细胞具有保护作用。
表2 TI90对高糖损伤胰岛β细胞的保护作用
表3 TI91对高糖损伤胰岛β细胞的保护作用
表4 TI92对高糖损伤胰岛β细胞的保护作用
表5 TI93对高糖损伤胰岛β细胞的保护作用
表6 TI94对高糖损伤胰岛β细胞的保护作用
表7 TI95对高糖损伤胰岛β细胞的保护作用
表8 TI96对高糖损伤胰岛β细胞的保护作用
表9 TI97对高糖损伤胰岛β细胞的保护作用
表10 TI98对高糖损伤胰岛β细胞的保护作用
表11 TI99对高糖损伤胰岛β细胞的保护作用
表12 TI100对高糖损伤胰岛β细胞的保护作用
表13 TI101对高糖损伤胰岛β细胞的保护作用
表14 TI102对高糖损伤胰岛β细胞的保护作用
表15 TI103对高糖损伤胰岛β细胞的保护作用
表16 TI104对高糖损伤胰岛β细胞的保护作用
(4)血竭素及其衍生物对高脂损伤胰岛β细胞的保护作用
将不同浓度的血竭素及其衍生物加入到200μM棕榈酸培养条件下的胰岛β细胞高脂损伤模型内,24小时后采用MTT法,考察不同浓度的血竭素及其衍生物对高脂损伤INS-1细胞生长的影响。结果如图4所示,血竭素浓度在10-20μg/mL能显著减轻细胞的高脂毒性,对高脂损伤胰岛β细胞具有保护作用;如表17~31所示,血竭素及其衍生物的浓度10-20μg/mL能显著减轻细胞的高脂毒性,对高脂损伤胰岛β细胞具有保护作用。
表17 TI90对高脂损伤胰岛β细胞的保护作用
表18 TI91对高脂损伤胰岛β细胞的保护作用
表19 TI92对高脂损伤胰岛β细胞的保护作用
表20 TI93对高脂损伤胰岛β细胞的保护作用
表21 TI94对高脂损伤胰岛β细胞的保护作用
表22 TI95对高脂损伤胰岛β细胞的保护作用
表23 TI96对高脂损伤胰岛β细胞的保护作用
表24 TI97对高脂损伤胰岛β细胞的保护作用
表25 TI98对高脂损伤胰岛β细胞的保护作用
表26 TI99对高脂损伤胰岛β细胞的保护作用
表27 TI100对高脂损伤胰岛β细胞的保护作用
表28 TI101对高脂损伤胰岛β细胞的保护作用
表29 TI102对高脂损伤胰岛β细胞的保护作用
表30 TI103对高脂损伤胰岛β细胞的保护作用
表31 TI104对高脂损伤胰岛β细胞的保护作用
(5)血竭素及其衍生物的抗凋亡作用
将INS-1细胞接种到96孔板后中,24h后弃去旧培养基,同时加入新培养基,分四组处理:普通培养基组,普通培养基+10μg/mL血竭素组,33mM高糖培养基组(高脂模型则为200μM棕榈酸组),33mM高糖培养基+10μg/mL血竭素组(高脂模型则为200μM棕榈酸+10μg/mL血竭素组)。继续孵育72h后,用PBS清洗细胞3遍,然后用4%的多聚甲醛(溶解在PBS中,PH7.4;Sigma)室温下固定30min。将固定后的细胞用PBS清洗3次后,37℃避光条件下用DAPI染色20min,然后在Olympus BX50荧光显微镜(Olympus,Tokyo,Japan)下观察细胞并拍照。结果表明在普通培养基培养条件下,INS-1细胞的细胞核呈圆形,核质较均匀,而高糖或高脂环境中培养的INS-1细胞的细胞核浓缩并破碎,可见凋亡小体,说明高糖或高脂培养条件确实能诱导INS-1细胞发生凋亡,而血竭素及其衍生物则在一定程度上抑制了高糖或高脂诱发的细胞凋亡,具有抗凋亡作用。
(6)血竭素及其衍生物的抗凋亡作用及与pdx1表达的关系
将INS-1细胞种到96孔板后中,24h后弃去旧培养基,同时加入新培养基,分四组处理:普通培养基组,普通培养基+10ug/mL血竭素组,33mM高糖培养基组(高脂模型为200μM棕榈酸组),33mM高糖培养基+10μg/mL组(高脂模型为200μM棕榈酸+10μg/mL血竭素组)。继续孵育72h后分别收集上述四组细胞,提取蛋白,然后在12%分离胶-5%浓缩胶的胶板中进行蛋白电泳,经转膜、封闭、洗涤后,最后用化学发光仪进行显影。分析结果发现:INS-1细胞暴露于高糖或高脂环境时Pdx1的表达急剧下降,而加入了10μg/mL的血竭素及其衍生物后Pdx1的表达又恢复到正常水平。由于前期实验已经证明高糖或高脂条件能诱导INS-1细胞发生凋亡,而血竭素及其衍生物则在一定程度上抑制高糖或高脂诱发的细胞凋亡。且文献报道Pdx1表达降低与β细胞凋亡或因此而导致的细胞死亡密切相关。因此血竭素及其衍生物对高糖或高脂条件下INS-1细胞的抗凋亡作用与Pdx1的表达密切相关。
4、血竭素及其衍生物对糖尿病小鼠血糖的影响
(1)糖尿病小鼠模型的建立
在7周大的雄性C57BL/6J小鼠腹腔内注射100mg/kg的STZ,同时高脂饮食(59%基本饲料,20%蔗糖,18%猪油,3%的蛋黄)。2周后,取小鼠尾静脉血液,测量空腹6h后小鼠体内血糖含量,连续3天测得的小鼠空腹血糖≥7.0mmol/L,代表本发明中患糖尿病的C57BL/6J小鼠造模成功。
(2)血竭素及其衍生物对糖尿病小鼠的降血糖作用
首先将C57BL/6J小鼠随机分为以下几组:正常对照组:血糖水平正常的C57BL/6J小鼠,用普通饲料喂养;糖尿病对照组:造模成功的C57BL/6J糖尿病小鼠,腹腔注射生理盐水并高脂饮食;实验组:造模成功的C57BL/6J糖尿病小鼠,腹腔注射低、中、高不同浓度的血竭素(5mg/kg、10mg/kg和20mg/kg)并高脂饮食。其中实验组小鼠按加入血竭素及其衍生物的浓度分为3组,和正常对照组及糖尿病对照组一起共分为5组,每组6只小鼠。各组小鼠每隔一天向腹腔注射不同浓度的血竭素及其衍生物或等量的生理盐水,持续4周,之后检测小鼠体内血浆血糖水平。结果如图5所示,注射10mg/kg血竭素能显著降低CB57BL/6J糖尿病小鼠体内的血浆血糖水平;如表32~35所示,注射5~20mg/kg血竭素及其衍生物对CB57BL/6J糖尿病小鼠体内的血浆血糖水平影响结果。
表32 TI90对糖尿病小鼠血糖水平的影响
表33 TI91对糖尿病小鼠血糖水平的影响
表34 TI92对糖尿病小鼠血糖水平的影响
表35 TI93对糖尿病小鼠血糖水平的影响
(3)血竭素及其衍生物对糖尿病小鼠血清胰岛素水平的影响
实验小鼠分组同上,然后分别于小鼠眼部取血,5000rpm离心5min,取上清,即为血清。用Mercodia Rat Insulin ELISA试剂盒测血清的胰岛素含量,实验方法参照说明书。结果表明:与正常对照组小鼠相比,糖尿病小鼠的血清胰岛素水平显著下降,但10mg/kg血竭素及其衍生物处理后,糖尿病小鼠的血清胰岛素水平又能恢复到正常水平。结果如图6所,10mg/kg的血竭素可以显著升高糖尿病小鼠体内胰岛素水平;如表36~40所示,10mg/kg的血竭素及其衍生物可以显著升高糖尿病小鼠体内胰岛素水平。
表36 TI90对糖尿病小鼠血清胰岛素水平的影响
表37 TI91对糖尿病小鼠血清胰岛素水平的影响
表38 TI92对糖尿病小鼠血清胰岛素水平的影响
表39 TI93对糖尿病小鼠血清胰岛素水平的影响
(4)血竭素及其衍生物对糖尿病小鼠胰岛Pdx1表达的影响
收集不同组小鼠的胰岛组织,称重后,加入组织蛋白提取液,冰上裂解15分钟后,5000rpm,离心5min,吸取上清于新的EP管中,加入4×蛋白上样缓冲液30μL;沸水煮10min,室温冷却,-80℃保存备用。电泳时取出一管加入4×蛋白上样缓冲液,煮沸10分钟,冰上致冷,瞬时离心,上样电泳。电泳完后关闭电源,将胶体从电泳槽中取出,根据目的蛋白大小切胶,浸入转膜缓冲液中;依照胶块的大小剪PVDF膜,将此膜放入甲醇中激活,之后转移至转膜缓冲液中;冰浴条件下将蛋白从SDS-PAGE凝胶上转至PVDF膜上,恒压100V转移2h;用1×TBST洗涤标记目的蛋白的PVDF膜2-3次,之后将膜浸入5%脱脂奶粉(用1×TBST配制)封闭液中,室温封闭1-2h;TBST洗涤PVDF膜3次,每次5-10min;取出PVDF膜,浸入用1×TBST稀释过的一抗中,4℃标记过夜或室温标记4h;1×TBST洗涤PVDF膜3次,每次5-10min,室温标记二抗30min;1×TBST洗涤膜5次,每次5min;将PVDF膜用Micro Chemi化学发光仪进行显影。
比较糖尿病对照组与正常对照组小鼠Pdx1蛋白表达量的差异,以及当糖尿病小鼠经血竭素及其衍生物处理后,Pdx1蛋白表达是否得以恢复,以判断血竭素及其衍生物在体内是否同样能促进糖尿病小鼠胰岛中Pdx1蛋白的表达,如图7所示,糖尿病对照组小鼠Pdx1蛋白的表达量明显少于正常对照组,当糖尿病小鼠经10mg/kg的TI90处理后,Pdx1蛋白的表达得以恢复,如表40~43所示,血竭素及其衍生物对糖尿病小鼠胰岛Pdx1表达的影响,Western Blot结果用Image J软件进行量化分析,说明血竭素及其衍生物能够显著促进糖尿病小鼠胰岛Pdx1的表达。
表40 TI90对糖尿病小鼠胰岛Pdx1表达的影响
表41 TI91对糖尿病小鼠胰岛Pdx1表达的影响
表42 TI92对糖尿病小鼠胰岛Pdx1表达的影响
表43 TI93对糖尿病小鼠胰岛Pdx1表达的影响
尽管本发明的实施方案已公开如上,但其并不仅仅限于说明书和实施方式中所列运用,它完全可以被适用于各种适合本发明的领域,对于熟悉本领域的人员而言,可容易地实现另外的修改,因此在不背离权利要求及等同范围所限定的一般概念下,本发明并不限于特定的细节和这里示出与描述的图例。
SEQUENCE LISTING
<110> 东北师范大学
<120> 血竭素、血竭素衍生物或其可用盐在制备糖尿病药物中的应用
<160> 3
<170> PatentIn version 3.3
<210> 1
<211> 1972
<212> DNA
<213> 人(Homo sapiens)HEK293T细胞
<400> 1
cgtcgccaag tcaaccctcg gcgactcggc agattatctc caagggtcaa cacgccgcgg 60
ccaggcaacc ccctccagcc tgccctcctg atcgatgtgg tcactcgcgg ccagggtgat 120
agggtagagt tctccgcggc cgcagacaat ggactcattg acgcgggcgc acagagatta 180
ggtgcccggg ccccacggcc tttcactctc tgcccccacc aaaactgcag gtggcacttt 240
tccctgaaga aatcaccgaa actctccccg cccgccgccg tgcttccctt ggcctgtctt 300
cggtgacagc aagggcatct acaagccagg gagccacaca tcagagccac acacatgagg 360
ccacaggcca ggaagccaca cacatgagtt ctcacacatc gaagcaaatg ctgagactat 420
accggcctcc cgcaagagaa ggaatctgca gagaagtcca cattcccgac tggctttttt 480
gtcttttaat aaaaataaag agtcctcaga atagagcact caatccgcac ttaaaacaca 540
aatatttcca gtaggaagaa agaaatacat taagattgac tctcaaaggt ctggatgttg 600
gtgcgttgtt taggaaaggc ggagcagtga tttttctctg gcttggttct ttgtggttca 660
agctctctct tgctgagacg tttctgcaaa gctgtctagt ttttctaaaa cccacggtgg 720
cgtttcgaga aacgtcctca tttcgggagt atccagtcag aggctggtca ggccgccagg 780
cctagcggat catgcccagg cagggggttg gacgtcaccg ccacccggag gtcatccatc 840
cgcgtcagtg ggtgcagaaa aagtggccct gtttaagtca ggaccccaga atgcccagaa 900
gttactgaat ggtttgaagc caagcacaga tgttatcatg gaaaatgcag cgtttttatt 960
tctttttcta aatatgtaac tcttcctcca cttccccctc tcctgcttgc cttatttcaa 1020
ttgcaagcag aagagagtga gtgttctctg ccggcaaact ccgccagggt cccggcccgt 1080
agagagtcgt caagggtctg gaacccccgt gccaacacct gcccctgctt cgcagcccca 1140
agaggaaggc cgcgtctttc cccctcgctg tattgggaag ctacgttccg ggctggccaa 1200
atgggcccca attttccaaa acccaaattt gtaataccct tcaatttttt aaaaaaaaga 1260
atttaaaaaa gtctctgtga atgcttcaga agttaccgtt tacaccccag aagtacttgc 1320
agcacatcca caagtaaaaa cacacaacga atgccagagt ttcgtgtgtt ttttaaccga 1380
catctttgtg gctgtgaaca aacttcataa ataaaataga atcaaatgct tctgacctag 1440
agagctgggt ctgcaaactt tttttttatc gtattccgca acagttaaat aaaaaattaa 1500
aaactcaaca tgtctccttg taaactacat caattaacaa acacactatg tccattatca 1560
aatataatag aaaaaatata ggaaaataga aaatagaaaa atataggaaa atagaaactt 1620
ttaagccacg gtgaaaatgt ttctataaat gagtggttct aatgttttcg tgagcgccca 1680
ttttggggag caccgccagc tgcccgttca ggagtgtgca gcaaactcag ctgagagaga 1740
aaattggaac aaaagcaggt gctcgcgggt acctgggcct agcctcttag tgcggccagc 1800
caggccaatc acggcccccg gctgaaccac gtggggcccc gcggagccta tggtgcggcg 1860
gccggcccgc cggtccgcgc tggctgtggg ttccctctga gatcagtgcg gagctgtcaa 1920
agcgagcagg ggtggcgccg ggagtgggaa cgccacacag tgccaaatcc cc 1972
<210> 2
<211> 31
<212> DNA
<213> 人工序列
<220>
<223> 人工合成,以用作得到人Pdx1启动子的编码序列的上游引物
<400> 2
attactcgag cgtcgccaag tcaaccctcg g 31
<210> 3
<211> 33
<212> DNA
<213> 人工序列
<220>
<223> 人工合成,以用作得到人Pdx1启动子的编码序列的下游引物
<400> 3
ttaagcttgg ggatttggca ctgtgtggcg ttc 33
- 还没有人留言评论。精彩留言会获得点赞!