全人源抗CD19单克隆抗体及其生产方法与流程
本发明属于生物免疫领域,具体地,本发明涉及一种全人源cd19单克隆抗体。
背景技术:
cd19是重要的b细胞恶性肿瘤的靶点。cd19几乎表达在b细胞发育的所有时期,以及各种b细胞肿瘤中,但是,重要的是cd19并不表达在多能性造血干细胞上。这些特点使得cd19成为了很好的b细胞肿瘤的靶点。虽然靶向cd19会摧毁正常b细胞,但是,这一缺陷能够被患者很好的耐受。当前靶向cd19的单抗,嵌合抗原受体或者是双特异性抗体均采用的是鼠源或者人源化的序列。但是鼠源或者人源化的序列中含有的鼠源成分可能会引起引起人抗鼠抗体(hama,humanantimouseantibody)反应,导致抗体效力的降低,甚至带来严重的副反应。因此开发新型的全人源cd19抗体或者是scfv有迫切需要。
单链抗体(single—chainantibodyfragment,scfv)是单克隆抗体的一种形式,通过将抗体的可变区通过铰链区相连接,形成了单链可变区,也称为单链抗体。scfv保留了抗体的抗原结合能力的最小单位。由于其结构更小,更利于基因工程操作,所以被广泛用于人源抗体的构建、筛选和应用。例如car-t技术就采用scfv结构的抗体做为嵌合受体识别抗原的区域;也可以通过两个scfv串联形成双特异性抗体。另外由于scfv包含了抗体结合抗原的所有序列,可以轻易的通过基因工程手段将其改造为传统结构的抗体,例如通过加入cl,ch1,ch2,ch3等区域改造为不同类型的igg抗体。
技术实现要素:
本发明的目的在于提供一种全人源抗cd19单克隆抗体,包括人来源的轻链可变区和重链可变区,其特征在于:所述轻链可变区包含序列表seqidno:2所示的cdrl1,seqidno:4所示的cdrl2及seqidno:6所示的cdrl3;所述重链可变区序列包含seqidno:10所示的cdrh1,seqidno:12所示的cdrh2及seqidno:14所示的cdrh3。
优选地,所述的全人源抗cd19单克隆抗体包含如序列表seqidno:8所示的vh序列及seqidno:16所示的vl序列。
优选地,所述全人源抗cd19单克隆抗体为单链抗体,其序列由一段linker序列将vh,vl连接,连接方式为vh-linker-vl,或vl-linker-vh。
优选地,所述linker序列为ggggsggggsggggs。
优选地,所述linker序列为为(ggggs)n,其中n为自然数。
优选地,所述的全人源抗cd19单克隆抗体的cd19单链抗体(scfv)2a3序列如序列表seqidno:20所示。2a3序列通过全人源scfv噬菌体展示文库筛选获得。通过imgtv-quest分析其人源胚系序列的来源见表1。
表1:cd19scfv2a3胚系基因来源
一种编码上述cd19全人源抗体的核苷酸序列,其特征在于,编码该抗体轻链可变区的核苷酸序列包含seqidno:1所示的cdrl1,seqidno:3所示的cdrl2,seqidno:5所示的cdrl3,编码该抗体的重链可变区核苷酸包含seqidno:9所示的cdrh1,seqidno:11所示的cdrh2及seqidno:13所示的cdrh3。
一种全人源抗cd19单克隆抗体的制备方法:包括如下步骤:
重组质粒pef-2a3转染hek293t细胞
转染前一天向t175瓶中接种hek293t细胞,第二天在细胞密度大约为80%时进行转染。首先取无血清培养1.5ml中加入质粒60ug;其次再取无血清培养基1.5ml加入120ullipofectamine2000脂质体转染试剂;将质粒和脂质体溶液混合均匀,室温静置15分钟后加入细胞培养基中;6小时后培养基换为新鲜的dmem+10%fbs培养基;72小时后收取培养上清。上清中即含单链抗体。
优选地,所述的全人源抗cd19单克隆抗体的制备方法进一步包括单链抗体纯化:首先向重力柱中加入500ul镍填料悬浊液,待液体流干后向其中加入10mlpbs平衡体系;将培养基上清加入到重力柱中,使其自然流出;随后使用10mm,20mm,50mm咪唑的pbs进行洗涤,以洗去杂蛋白;最后用500ul含200mm咪唑的pbs洗脱单链抗体;之后将所得单链抗体加入脱盐柱中,离心以除去咪唑,最终得到纯化的全人源cd19单链抗体。
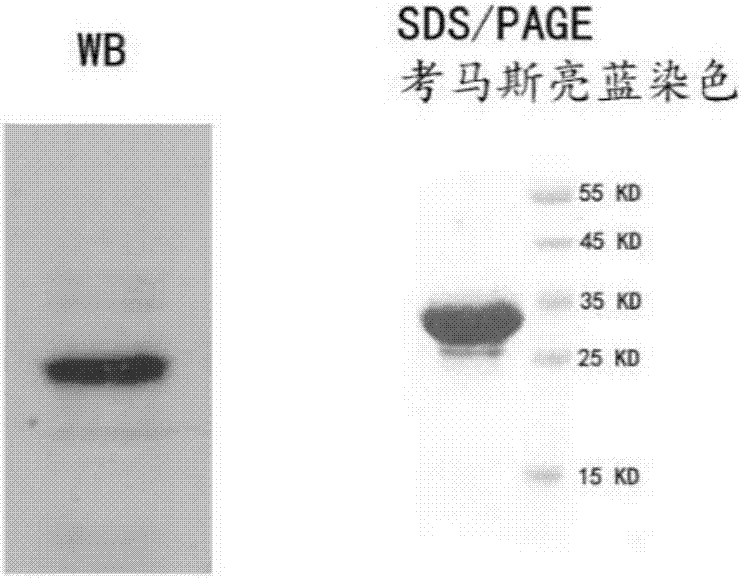
优选地,所述的全人源抗cd19单克隆抗体的制备方法进一步包括全人源cd19单链抗体的检测:使用考马斯亮蓝染色以及免疫印迹分别检测目的蛋白的表达。样品:pef空载体转染细胞上清,pef-2a3转染细胞上清,纯化后的单链抗体上样并进行sds-page电泳,电泳之后进行考马斯亮蓝染色或者进行免疫印迹,使用ha抗体检测单链抗体的表达。
有益效果:本发明的cd19单克隆抗体为全人源序列,其序列完全来自人源基因,因此相对于传统的鼠源单抗,嵌合单抗,人源化单抗具有免疫原性低,不引起hama反应等优点,具有更好的稳定性和安全性。
本发明的这些目的,特点将会在下面的具体实施方式,附图,和权利要求中详细的揭露。
附图说明
图1为根据本发明实施例一的pef-2a3结构示意图。
图2为根据本发明实施例二单链抗体检测中sds-page电泳及考马斯亮蓝染色结果。
图3为根据本发明实施例三的抗原结合能力检测结果。
图4为根据本发明实施例四的抗原结合特异性检测结果。
具体实施方式
请参见图1和图2,本发明为一种全人源抗cd19单克隆抗体,包括人来源的轻链可变区和重链可变区,所述轻链可变区包含序列表seqidno:2所示的cdrl1,seqidno:4所示的cdrl2及seqidno:6所示的cdrl3;所述重链可变区序列包含seqidno:10所示的cdrh1,seqidno:12所示的cdrh2及seqidno:14所示的cdrh3。
其具体实施方式如下。
实施例一:cd19单链抗体2a3的序列以及载体构建
本发明中cd19单链抗体2a3序列由vl和vh,通过一段linker序列连接而成,结构为vl-linker-vh。其linker氨基酸序列为ggggsggggsggggs。
vl的序列特征在于含有表一所示的三个轻链互补决定区cdrl1,cdrl2,cdrl3。vl完整序列见序列表。该序列来源于人胚系基因
vh的序列特征在于含有表一所示的三个重链互补决定区vhcdr1,cdr2,cdr3。vh完整序列如序列表所示。该序列来源于人胚系基因
完整的2a3序列由vl,linker,vh顺序排列组成,如序列表所示。需特别提出的是,虽然本实施例中仅提供了vl-linker-vh一种结构的scfv序列的实验结果,但是通过常规的分子生物学方法,可以快速的构建出结构为vh-linker-vl的scfv序列。linker序列可以替换为(ggggs)n。以上所指出的替换不会影响单链抗体对于cd19的识别,故这些结构的单链抗体也应该在本专利的保护范围之内。
为了方便单链抗体的检测以及纯化,我们在2a3之后加入了ha和6*his标签,结构为2a3-ha-his,由于ha和his标签很小,一般认为其不会影响scfv结合抗原的能力。为了便于单链抗体在哺乳动物细胞中的分泌性表达,我们在2a3的c端加入了信号肽序列,该信号肽会在蛋白质合成过程中被剪切掉,从而并不会影响scfv的正常功能,但是可以促进单链抗体的分泌表达。故完整的2a3-ha-hi序列为:
蛋白序列
myrmqllscialslalvtnsqsvltqppsasgtpgqrvtiscsgrksnigsktvnwyqqlpgtapklliynnyerpsgvpdrfsgsksgtsaslaisglqsedeadyycaawddslhgpvfgggtkltvlgggggsggggsggggsqvqlqesggglvqpggslrlscaasgftfssyamswvrqapgkglewvsaisgsggstyyadsvkgrftisrdnskntlylqmnslraedtavyycakdlrrwggsqtdafdiwgqgtmvtvspgsasaptlsgypydvpdyahhhhhh
dna序列
atgtaccggatgcagctgctgagctgtatcgccctgagcctggctctggttaccaactctcagagcgtgctgacccagcctccttctgcttctggaacccctggacagcgtgtgacaatcagctgcagcggaagaaaatccaacatcggatccaagactgtgaactggtaccagcagctgcccggaactgcacctaaactcctcatctacaataactacgagaggccctctggcgtgcccgacaggttcagcggaagcaagtcaggaaccagcgcctctctggctatcagcggactgcaatctgaagacgaggccgactactactgcgccgcttgggacgactctctccatggacctgtgtttggcggagggacaaagctgacagtgctgggaggtggaggaggatcaggaggaggaggatctggaggaggaggttctcaggtgcagctgcaagagagcggaggaggactggttcagcctggaggaagtctgagactgagctgtgccgcaagtggattcacattcagcagctacgcaatgtcatgggtgaggcaggcacccggaaagggactggagtgggtgagcgctataagcggaagcggaggaagcacatactacgccgattctgtgaagggccggttcacaatttccagagacaatagcaagaacaccctgtacctgcagatgaacagcctgagagccgaggacacagctgtgtactactgcgcaaaggacctgagacggtggggaggatcacagacagacgctttcgacatctggggacaaggcaccatggtgaccgtgtcaccaggaagtgccagcgctcctacactgtccggatacccttacgacgtgcccgattacgcccatcaccaccatcaccac
完整编码框由奥吉生物公司合成,并且通过nhei和noti酶切位点克隆到载体pef-ires-puro上。重组质粒pef-2a3-ha-his-ires-puro(简写为pef-2a3)使用qiagen中提试剂盒抽提,并经过酶切和测序验证序列正确。在该克隆中,scfv编码框位于ef-1a启动子的下游,scfv的下游分别为核糖体内部进入位点ires,嘌呤霉素抗性基因,sv40polya转录终止元件。嘌呤霉素抗性基因可以用于构建稳定表达单链抗体的细胞系,在大量制备单链抗体时使用。质粒结构图谱如图1所示。
实施例二:cd19单链抗体的制备
重组质粒pef-2a3转染hek293t细胞:转染前一天向t175瓶中接种hek293t细胞,第二天在细胞密度大约为80%时进行转染。首先取无血清培养1.5ml中加入质粒60ug;其次再取无血清培养基1.5ml加入120ullipofectamine2000脂质体转染试剂;将质粒和脂质体溶液混合均匀,室温静置15分钟后加入细胞培养基中;6小时后培养基换为新鲜的dmem+10%fbs培养基;72小时后收取培养上清。上清中即含单链抗体。
单链抗体2a3的纯化:首先向重力柱中加入500ul镍填料悬浊液,待液体流干后向其中加入10mlpbs平衡体系;将培养基上清加入重力柱中,使其自然流出;随后使用10mm,20mm,50mm咪唑的pbs进行洗涤,以洗去杂蛋白;最后用500ul含200mm咪唑的pbs洗脱单链抗体;之后将所得单链抗体加入脱盐柱中,离心以除去咪唑,最终得到目的蛋白。
单链抗体的检测:使用考马斯亮蓝染色以及免疫印迹分别检测目的蛋白的表达。样品:pef空载体转染细胞上清,pef-2a3转染细胞上清,纯化后的单链抗体2a3上样并进行sds-page电泳,电泳之后进行考马斯亮蓝染色或者进行免疫印迹,使用ha抗体检测单链抗体2a3的表达。结果参见图2。
实施例三:cd19抗原结合能力检测
使用elisa法检测cd19单链抗体2a3于cd19抗原的结合能力。首先使用cd19抗原包被酶标板,抗原浓度为2ug/ml,包被液为碳酸钠缓冲液,4℃包被过夜。用2%mpbs封闭酶标板和单链抗体2a3,室温2小时。将100ul封闭后的2a3加入封闭后的酶标板中,对照孔中加入bsa做为对照,室温孵育1小时。使用pbst洗板5次,pbs洗板2次;加入anti-ha-hrp抗体孵育1小时;使用pbst洗板5次,pbs洗板2次;加入tmb显色液,100微升/孔;室温显色5-30分钟,直至孔中显示出适当程度的蓝色,加入50ul浓硫酸以终止反应,立即在酶标仪读取450nm处的吸光度值。检测结果参见图3。结果表明2a3单抗能够有效结合cd19抗原。
实施例四:cd19结合特异性分析
使用elisa法检测抗体2a3对于cd19,cd20,cd30,cd33,cd138,pd-1,pd-l1等多个抗原的结合能力以分析2a3结合cd19的能力是否具有特异性。首先使用上述7个抗原分别包被酶标板,抗原浓度均为2ug/ml,4℃包被过夜。第二天用2%mpbs封闭酶标板和单链抗体2a3,室温2小时。将100ul封闭后的2a3加入封闭后的酶标板中,室温孵育2小时。使用pbst洗板5次,pbs洗板2次;加入anti-ha-hrp抗体孵育1小时;使用pbst洗板5次,pbs洗板2次;加入tmb显色液,100微升/孔;室温显色5-30分钟,直至孔中显示出适当程度的蓝色,加入50ul终止液以终止反应,立即在酶标仪读取450nm处的吸光度值。检测结果参见图4。结果说明单抗2a3能够有效结合cd19,但是不能结合其它6种抗原,证明了单抗2a3对于cd19结合的特异性。
通过上述实施例,本发明的目的已经被完全有效的达到了。熟悉该项技艺的人士应该明白本发明包括但不限于附图和上面具体实施方式中描述的内容。任何不偏离本发明的功能和结构原理的修改都将包括在权利要求书的范围中。
- 还没有人留言评论。精彩留言会获得点赞!