金属硫蛋白‑1在制备抑制类风湿性关节炎药物中的应用的制作方法
本发明涉及药物领域,特别是金属硫蛋白-1重组蛋白,金属硫蛋白-1重组蛋白-免疫就蛋白g-fc融合蛋白、及透明质酸包裹的金属硫蛋白-1重组蛋白和金属硫蛋白-1重组蛋白-免疫就蛋白g-fc融合蛋白的纳米颗粒的制备,及其在治疗类风湿性关节炎和其它自身免疫疾病疾病药物中的应用。
背景技术:
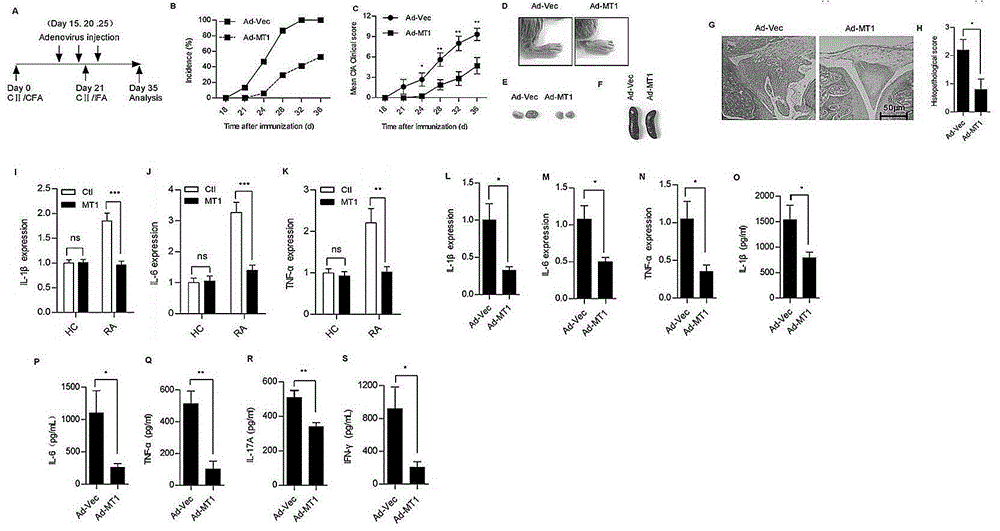
:机体免疫内环境的稳定依赖于促炎性th细胞(cth)和抑炎性treg细胞之间的平衡,cth/treg细胞间的免疫平衡紊乱,如cth细胞的的过度活化则导致自身免疫疾病的发生。类风湿性关节炎(rheumatoidarthritis,ra)是一种以滑膜慢性炎症为主要特征的多关节全身系统性自身免疫病,最终导致关节破坏和生理残疾。尽管其具体的发病机制尚不清楚,越来越多的证据表明th17在ra发病中发挥关键的致病作用。th17细胞分泌的细胞因子il-17不仅可以诱导促炎因子的表达,而且促进软骨和骨的破坏。目前调节th17分化的分子机制尚未完全阐明,已知多种细胞因子如tgf-β和il-6在小鼠中可以诱导初始cd4+t细胞分化为th17,stat3和转录因子rorγt在th17分化中也至关重要。此外,已有报道显示ifnγ、il-4、il-21和il-27通过调节stat3、rorγt和rorα,也能参与调控th17的分化。相反,tgf-β激活初始cd4+t则分化为调节性t细胞(regulatoryt,treg),表达转录因子foxp3,并且在ra进程中发挥免疫抑制作用。th17和treg直接通过相互调节可以实现彼此转换,如foxp3可以拮抗rorγt结合dna的能力以及rorγt可以抑制foxp3的表达。因此,研究th17/treg平衡的调节机制对于免疫内环境的维持和ra的治疗非常重要。金属硫蛋白(mts)是一类低分子量、富含半胱氨酸的小蛋白,参与调节重金属的内环境稳定和保护机体免受重金属中毒和氧化应激反应的伤害。受到外界刺激后,mts可以释放到细胞外,但是具体分泌机制尚不清楚。类风湿性关节炎的发病机制与治疗手段ra是一种全身性的免疫紊乱导致的急性、自身免疫性疾病,素有“不死的癌症”之说,可以造成关节的畸形和残疾。它是一种病因未明、病程较长及治疗难度较高的自身免疫疾病,目前,临床上尚缺乏根治和预防本病的措施。我国的ra患者群体大且致残和致死率较高,但诊治现状很不乐观,大部分ra患者没有得到系统、有效的治疗,给患者家庭和社会带来了沉重的心理和经济负担。该疾病伴随的症状包括疼痛、肿胀、僵硬及组织破坏,是炎性因子的级联放大反应造成的,ra病人的血清和滑膜液中均发现促炎因子的高表达,如il-6、il-8、tnfα、il-17及il-33。其发病率约为1%,经确诊且3年内未接受治疗的ra病人,其永久性致残率高达30%。因此,提高ra诊治水平,最大限度降低患者致残率是国家亟待解决的重大健康问题之一。1939年,waaler首先发现并确定类风湿因子(rheumatoidfactor,rf)是一种能够识别免疫球蛋白fc段的抗体,这一发现导致人们认为ra是自身抗体引发的自身免疫疾病。但是,许多正常人和其他感染性疾病的患者体内亦有rf的存在,表明仅自身抗体的存在尚不足以已发ra的发生。ra是一种抗原驱动、t细胞介导及遗传相关的自身免疫病,感染和自身免疫反应是此病发生和病情迁延的中心环节。ra的病因及发病机制至今尚不完全清楚。一般认为,ra的发病机制可能是外来抗原通过分子模拟或模糊识别机制诱导患者体内针对自身抗原的免疫细胞活化,产生致炎性细胞因子及特异性抗体,并活化单核细胞、中性粒细胞等效应细胞,产生白细胞介素(il)-1、肿瘤坏死因子(tnf)α及其他炎性介质,从而导致ra的滑膜炎症、软骨及骨质的破坏。在ra发病过程中,免疫细胞和细胞因子占有重要地位。t细胞、b细胞,巨噬细胞、中性粒细胞和滑膜成纤维细胞在ra炎症的形成和病情恶化中起到至关重要的作用。免疫细胞在滑膜组织的大量聚集,表达具有功能活性的炎性细胞因子,引起滑膜的增生、关节软骨的降解和关节的破坏。炎症介质进一步趋化和激活炎症细胞释放更多的炎症介质,炎症因子之间也相互调节,炎症反应持续存在并通过信号转导、级联放大,造成关节损伤。其中促炎因子tnf-α、白介素-1(interleukin-1)、il-6和il-17等炎性细胞因子在滑膜组织中的高表达与类风湿关节炎的严重程度密切相关,抑制这些炎性因子的表达及活性可以控制免疫反应的发生,并且可以延缓和减弱ra的发生和发展。细胞因子是引起关节炎症及损伤的重要介质,其变化与病情密切相关。在病理状态下,ra滑膜中的各种细胞在局部可产生多种细胞因子和趋化因子,如il-1、il-2、ifn-γ、il-6、il-10、gm-csf、tnf-α、tgf-β、il-13、il-16、il-17等。在ra患者的关节滑液中,巨噬细胞、成纤维样滑膜细胞持续产生tnf-α、il-1等促炎性细胞因子,刺激pge和胶原酶产生,抑制蛋白多糖合成,促进软骨吸收。同时,il-10、tgf-β等抗炎性细胞因子及可溶性细胞因子受体等细胞因子抑制剂的表达水平明显增高。但是,这些抗炎性细胞因子的表达不足以消除促炎性细胞因子的作用,两者之间平衡失调是ra发病的关键。tnf-α是由单核/巨噬细胞产生的一种具有双重生物学作用的多肽细胞因子,参与机体的免疫防护和病理损伤。tnf-α过表达可致小鼠发生ra,阻断tnf-α活性或使用tnf-α受体拮抗剂可保护小鼠免受ra损害、减轻关节病变及延缓ra临床进程。抗tnf-α药物已被证实在ra临床症状和体征方面以及放射学方面都有一定的疗效。美国风湿病协会2012年推荐治疗ra的生物制剂是塞妥珠单抗(聚乙二醇化人tnf-α单克隆抗体fab片段)、戈利木单抗(完全人源化抗tnf-α单克隆抗体)。除了阻断tnf-α活性外,抑制患者il-6、il-8、il-18、mmp及il-17等的表达,也可有效保护ra患者的骨关节免受破坏,因此一些新的细胞因子作为靶标有望成为治疗ra的新方法。目前认为,类风湿关节炎的发病是受抗原驱动所激发的链锁免疫反应过程,目前,生物制剂是ra治疗最好的选择之一,该类药物的整体安全性优于传统的改变病情抗风湿治疗,目前国内最流行的还是抗tnfα和抗il-6抗体,已被证实在ra临床症状和体征方面以及放射学方面都有一定的疗效。由于经济条件偏差,我国只有5%左右的ra患者使用该类药物。因此,目前国内ra的治疗仍是一个令人担忧的现状,ra发病机制的深入研究和新药物的开发具有非常重大的意义。除了tnfα,研究最多的细胞因子为il-1β,其与ra的发生和发展密切相关,ra患者的血清和关节液中检到高水平的il-1β,并且其水平与组织活动性和形态学特征密切相关,如滑膜增生、白细胞浸润、软骨损伤等。研究表明,tnfα可作为衡量ra疾病炎症活动度的指标之一,il-1β仅在一定程度上反映炎症活动程度,从一定程度解释了目前针对tnfα治疗ra的生物制剂疗效要优于针对il-1β的原因。此外,抑制患者il-6、il-8、il-18、mmp及il-17等的表达,可以有效保护ra患者的骨关节免受破坏,因此一些新的细胞因子作为靶标有望成为治疗ra的新方法。目前,医学上仍然缺乏针对ra关节破坏的有效治疗手段,大部分治疗风湿病的药物疗效有限、副作用大和预后效果差,严重的滑膜炎症及关节病变导致ra患者的致残率不断加重,因此,攻克ra顽症仍是全世界医学界的跨世纪难题,仍有待于致力于ra研究的人们继续深入下去。技术实现要素:为了克服现有技术的上述缺点,本发明的目的是提供一种金属硫蛋白-1在制备治疗类风湿性关节炎药物中的应用。本发明解决其技术问题所采用的技术方案是:制备具生物活性金属硫蛋白-1重组蛋白;为了增加重组金属硫蛋白-1蛋白在体内的半衰期时间,我们利用人igg1fc与金属硫蛋白-1基因构建融合重组蛋白;并利用透明质酸制备mt-1重组蛋白和mt-1-fc重组融合蛋白的纳米颗粒,它们不但能在体内具有较长半衰期并具金属硫蛋白-1蛋白的生物活性。金属硫蛋白-1在防治类风湿性关节炎药物中的应用。作为本发明的进一步改进:所述药物中的人金属硫蛋白-1为重组蛋白,所述重组蛋白的核苷酸序列如seq图5a所示,所述的重组蛋白的氨基酸序列如seq图5b所示。作为本发明的进一步改进:所述药物以人金属硫蛋白-1或其衍生物为人金属硫蛋白-1与igg1fc(mt-1-fc)构建成融合蛋白。作为本发明的进一步改进:重组的人mt-1-fc融合蛋白是重组蛋白,其氨末端为mt-1活性部分,羧末端为人igg1fc包括铰链ch2和ch3部分,所述重组蛋白的核苷酸序列如seq图5c所示,氨基酸序列如seq图5d所示。mt-1重组蛋白的制备方法,其中:包括如下步骤:(1)设计得到如权利要求4所述的核苷酸序列;(2)构建如权利要求2和4任一项所述的核苷酸序列表达系统,包括构建表达载体并将表达载体转入宿主细胞,形成可表达如权利2和4任一项所述的mt-1重组蛋白;(3)权利要求2和4任一项所述的核苷酸序列表达系统的重组细胞,使其表达目的蛋白;(4)分离纯化权利要求2和4任一项所述的mt-1的重组蛋白。作为本发明的进一步改进:所述表达的系统为原核表达系统或为真核表达系统,所述原核表达系统选自大肠杆菌表达系统;所述真核表达系统为酵母表达系统。作为本发明的进一步改进:所述的mt-1和mt-1-fc蛋白制备方法所获的重组蛋白被透明质酸所包裹。作为本发明的进一步改进:所述的mt-1重组蛋白制备药物,应用于类风湿关节炎和其它自身免疫疾病疾病如:多发性硬化、结肠性肠炎、动脉粥样硬化、银屑病、支气管哮喘、强直性脊柱炎和病态肥胖炎症的治疗。作为本发明的进一步改进:本发明中证明小分子蛋白mt1在ra进程中发挥非常重要的调节作用。所述的金属硫蛋白-1通过抑制th细胞向th17细胞的分化,促进treg细胞的分化,调控cia状态下的th17/treg平衡;并抑制与ra相关炎性因子il-1β、il-6、il-17、tnf-α、ifn-γ的表达,促进抑炎因子il-10、tgf-β的表达;从而参与抑制类风湿性关节炎的发生或发展。本实施例的研究结果第一次发现mt1蛋白以负反馈机制参与调节ra进程,即mt1在ra中通对th17/treg平衡的调控,抑制ra等由th17所介导的自身自身免疫疾病的发生发展。作为本发明的进一步改进:所述的相关的自身免疫疾病为类风湿关节炎等其它有th17说调节的自身免疫疾病。与现有技术相比,本发明的有益效果是:mt1在ra炎症反应中发挥至关重要的抑制作用。并且本发明发现腺病毒介导的mt1小鼠在关节局部的过表达,显著减少cia发病率、降低临床评分和减轻骨破坏。mt-1-fc重组融合蛋白和透明质酸制备mt-1重组蛋白和mt-1-fc重组融合蛋白的纳米颗粒,它们不但能在体内具有较长半衰期,并具金属硫蛋白-1蛋白的生物活性。故此我们的结果指出,mt1有望发展成抑制ra的药物,拓展了其社会价值和经济价值。本发明第一次揭示了mt1调控th17/treg平衡的机制,以及在ra进程中对自身免疫炎症反应的抑制作用,因此,小蛋白mt1有可能成为ra或其他自身免疫病治疗的一个潜在药物靶点。附图说明图1.mt-1在ra和cia中表达显著增加:图1a:分离ra和hc血液标本中的pbmc,体外培养过夜,提取rna,实时定量pcr检测ra和hcpbmc中mt1mrna的表达;图1b:收集ra和hc的血清,elisa检测ra和hc血清中mt1蛋白的表达;图1c-e:分离cia和对照小鼠的脾脏、淋巴结和滑膜组织,液氮研磨,提取rna,实时定量pcr检测各组织中mt1mrna的表达;图1f:收集cia和对照小鼠的滑膜液,elisa检测滑膜液mt1蛋白的表达;图2.mt1抑制cia疾病的进程,并抑制ra和cia炎症因子的表达:图2a:cia诱导和腺病毒注射方法;图2b-c:cia诱导后,不同时间于关节腔注射腺病毒,记录小鼠的发病率和临床评分;图2d:35天后,比较注射ad-vec和ad-mt1的cia小鼠脚掌的水肿情况;图2e-f:35天后,比较注射ad-vec和ad-mt1的cia小鼠淋巴结和脾脏的大小;图2g-h:35天后,分别取注射ad-vec和ad-mt1的cia小鼠的滑膜组织,h-e染色,比较两者滑膜增生与软骨破坏程度的差异。图2i-k:分离ra和hc血液标本的pbmc,体外培养,加入20μmmt1重组蛋白处理过夜,加入1μg/mllps刺激4h,收集细胞,qpcr比较mt1对hc和ra病人促炎因子il-1β、il-6、tnf-α的表达的差异。图2l-n:分别取注射ad-vec和ad-mt1的cia小鼠的滑膜组织,液氮研磨,提取rna,qpcr检测mt1对il-1β、il-6、tnf-α的表达的抑制作用;图2o-s:分别收集注射ad-vec和ad-mt1的cia小鼠的滑膜液,elisa检测mt1对ifn-γ、tnf-α、il-1β、il-17a和il-6的表达的抑制作用。图3.mt1调控类风湿关节炎th17/treg的平衡图3a-d:th17分化的条件下,facs检测mt1对cd4+il-17+th17、cd4+foxp3+treg细胞数目的影响,并统计il-17+、foxp3+细胞占cd4+t细胞的百分比。图3e-h:th17分化条件下培养条件,qpcr检测mt-1对th17细胞相关因子il-17a、il-17f及treg细胞相关因子il-10、foxp3表达的影响。图3i-j:th17分化条件下培养三天,facs检测mt-1对cd4+t细胞的增殖和凋亡影响。图3k-n:cia诱导35天后,分别取ad-vec和ad-mt1注射小鼠的脾脏,制备单细胞悬液,facs检测mt1对cd4+il-17+th17、cd4+foxp3+treg细胞数目的影响,并统计il-17+、foxp3+细胞占cd4+t细胞的百分比。图3o-r:cia诱导35天后,分别分离ad-vec和ad-mt1注射小鼠的滑膜组织,qpcr检测mt1对th17细胞相关因子il-17a、il-17f及treg细胞相关因子il-10、foxp3表达的影响。图4类风湿关节炎炎症状态下mt-1调控th17/treg平衡的机制图4a-b:磁珠分选cd4+t细胞,体外加入tgfβ和il-6促进th17细胞的分化,加入20μmmt1重组蛋白,培养三天后,收样,wb检测mt1对stat3及其磷酸化水平表达的影响;图4c:体外th17细胞分化的条件下,加入20μmmt1重组蛋白,培养三天后,收样,qpcr检测mt1对转录因子rorγt表达的影响。图4d-e:诱导了cia动物模型,分别于关节腔注射ad-vec和ad-mt1。35天后,分离cia小鼠的滑膜组织,匀浆,wb检测mt1对stat3及其磷酸化水平表达的影响;图4f:35天后,分离cia小鼠的滑膜组织,qpcr检测mt1对转录因子rorγt表达的影响。图5mt-1/mt-1-fc重组蛋白的自白,透明质酸-mt-1/mt-1-fc重组蛋白纳米微球的制备、它们生物活性和在体内半衰期的研究。图5a-b:图5a下方的mt-1核苷酸序列是优化后的mt-1核苷酸序列图5a,其重组蛋白的氨基酸序列如序列如图5b所示。图5c-d:图5c为人金属硫蛋白-1与igg1fc(mt-1-fc)构建成融合蛋白的核苷酸序列,其重组蛋白的氨基酸序列如序列如图5d所示。图5e:利用透明质酸与mt-1或mt-1-fc蛋白制备的载药纳米微球颗粒。扫描电镜观察载药微球的形状和大小,标尺显示显微照片的放大倍率。图5f-g:mt-1和mt-1-fc重组蛋白及ha-mt-1和ha-mt-1-fc纳米微球分别尾静脉注射,血液样本被收集的时间如图所示,hplc检测mt-1的难度。纵坐标:mt-1或mt-1-fc小鼠血清的含量(ng/ml),横坐标:检测血清中mt-1或mt-1-fc重组蛋白在不同时间的含量。图5h-i:mt-1和mt-1-fc重组蛋白及ha-mt-1和ha-mt-1-fc纳米微球分别加入ra患者pbmc细胞培养皿,它们对pbmc中tnfα表达的调节。具体实施方式现结合附图说明与实施例对本发明进一步说明:实施例一:ra中mt1的表达上调的试验小分子蛋白mt1可以广泛参与重金属解毒和自由基清除作用,并且研究表明mt1蛋白在胞外具有潜在的免疫调节功能。为了研究mt1在ra中的作用,首先分析了其在ra样品中的表达,本实施例将通过细胞生物学和分子生物学手段展开深入研究。一、实验材料、试剂1.实验材料dba小鼠饲养于深圳大学spf级动物中心;pbmc细胞用rpmi1640(10%fbs)培养基培养;rt-pcr引物在上海生工生物工程有限公司合成;荧光定量pcr仪购于7500fast,appliedbiosystem,usa;其他仪器耗材:枪头、试管、离心管、容量瓶、量杯、烧杯、一次性口罩、手套、台秤等均为国产。.实验试剂lps(货号:l2880)购于sigma公司;完全佐剂和不完全佐剂购于difco公司;rna提取、反转和qpcrsybrgreen相关试剂分别购于takara、thermofisher和北京全式金生物技术有限公司;透明质酸购于sigma公司,正庚烷和tween也均购于sigma公司,人外周血淋巴细胞分离液(lts1077)购于天津市灏洋生物制品科技有限责任公司;人和小鼠mt1elisa试剂盒(seb119hu,seb119mu)购于武汉优尔生物公司;streptomyin-penicilin青霉素-链霉素购于gbico公司;trizol购于invitrogen公司;磷酸氢二钠,氯化钠,氯化钾,氯仿,异丙醇,无水乙醇,无水碳酸钠等都是国产分析纯,研究用水为milipore纯水仪所制超纯水。缓冲液的配制:500ml1lnacl4.0g8.0gkcl0.1g0.2gna2hpo41.4g2.7gkh2po40.12g0.24gmilliqh2o400ml800ml调节ph值至7.4,定容至500ml(或1l),高压灭菌后备用。缓冲液的配制:1ltris-base2.42gnacl29.24gpbs200mlmilliqh2o600ml,调ph至7.5,定容至1000ml。溶液的配制:取tbs加入0.05%的tween-20为ttbs溶液二、实验方法1.研究对象ra样本为北京大学深圳医院2014年9月和10月收治的门诊病例及住院病例,其中男性9例,女性44例,平均年龄50.53,所有的ra患者由北京大学深圳医院诊断依据1984年修订的as纽约标准。另外,随机选取40例性别年龄相仿的健康对照血样平均年龄48.2。as组与健康对照组性别年龄无统计学差异。以上样本的采集均获得患者同意及北京大学深圳医院伦理委员会同意。.外周血单核细胞(pbmc)的提取(1)收集血液标本,4℃,400g离心10min,收集上清用于elisa检测;(2)加入2mlpbs重悬血液细胞;(3)15ml离心管加入3ml淋巴细胞分离液,上层缓慢加入细胞。4℃,700g离心20min,需要设置慢升慢降;(4)缓慢吸出中的单核细胞层,加入新的15ml离心管,再加入10mlpbs,混匀。4℃,500g离心10min;(5)去上清,加入新鲜的rpmi1640培养基,24孔板培养。.cia动物模型的建立与评分(1)cia动物模型的建立0.05m乙酸溶液溶解牛cⅱ至2mg/ml(4℃,过夜),等体积完全弗氏佐剂乳化cⅱ,100μl/小鼠于尾部皮下注射dbawt小鼠,21天后,注射100μl/小鼠不完全弗氏佐剂乳化的cⅱ加强免疫,诱导cia发生。(2)cia样品的收集和检测①35天后,取出滑膜组织,qrt-pcr检测滑膜组织中mt1的表达;②200μlpbs冲洗关节腔,收集滑膜液,elisa检测滑膜液中mt1的表达(操作方法参照elisa试剂盒说明书)。.细胞总rna的提取(1)细胞拿出,吸干培养基,加入trizol,用枪头反复吹吸,直至形成均一溶液,室温静置5分钟;(2)向离心管中加200μl氯仿(trizol:氯仿=5:13),)剧烈震荡15秒后静置5分钟,4℃12000g离心15分钟;(3)将上层水相小心转入新管,每管加入500μl异丙醇,充分混匀,室温静置10分钟,4℃12000g离心15分钟;(4)小心弃去异丙醇,每管加入1ml75%乙醇,轻柔颠倒,4℃8000g离心10分钟,洗涤沉淀一次;(5)小心弃去乙醇,自然风干rna沉淀。加入适量体积的depc水,用枪头轻柔吹打,放于55ºc-60ºc的水浴锅中5分钟,是rna充分溶解;(6)分装后,rna贮于,测od值和浓度,-80℃备用。.组织总rna的提取(1)35天后,取出滑膜组织,用液氮研磨至粉末状;(2)加入trizol,用枪头反复吹吸,直至形成均一溶液,室温静置5分钟。后续步骤同上。.实时定量rt-pcr(1)cdna的反转注意在超净台上操作并带上口罩,严防rna降解。所有操作均在冰上进行。用reveraidfirststrandcdnasynthesiskit,反转录体系如下:第一步:randomprimer1μltotalrna500ngrnasefreeh2oupto12μltotal12μl在pcr仪上进行变性、退火反应,65℃,5min。第二步:5×reactionbuffer4μl10mmdntpmix2μlribolockrnaseinhibitor1μlrevertaidm-mulvreversetranscriptase1μl第一步mix12μltotal20μl反应体系置于pcr仪上反应42℃温育60min,70℃温育5min.反应结束后,放于4℃备用。(2)实时定量rt-pcr反应体系目的基因及内参基因的mrna序列从pubmed的genbank里查找,然后利用引物设计软件primer5.0设计引物,由生工生物工程(上海)股份有限公司合成hmt1引物序列:gggatctccaacctcacc;acacttggcacagctcathβ-actin引物序列:cctgactgactacctcatgaag;gacgtagcacagcttctccttammt1引物序列:gctgtcctctaagcgtcacc;aggagcagcagctcttcttgmβ-actin引物序列:gtgacgttgacatccgtaaaga;gccggactcatcgtactcctransstarttipgreenqpcrsupermix实时定量pcr试剂盒,体系如下:2xsybrgreen10μl2μmol/l上游引物2μl2μmol/l下游引物2μl模板cdna2μlh2o4μltotal20μl(3)实时定量rt-pcr反应程序如下:反应结束后,用excel处理实验数据,实验结果以图表的形式表示出来。.elisa人鼠金属硫蛋白mt1elisa检测试剂盒,严格按照说明书进行:(1)标准品稀释与加样:将试剂盒中的配制好的标准品作为第一个浓度梯度,依次对半梯度释至7个浓度梯度,每个浓度做1个复孔,16孔为标准品孔;(2)加样品:每个人血清20ul加入80ul样品稀释液为100ul的血清检测样品,取每个滑膜液样品10ul加入90ul样品稀释液为100ul的细胞上清检测样品。(根据预实验确定样本稀释倍数);得到回归方程,根据方程式计算得出样品浓度,乘上稀释倍数,即为样品的实际浓度。(3)温育:用封板膜封住酶标板,置于室温中孵育2小时;(4)洗涤:揭掉封板膜,甩去液体,用洗板机洗板3次,最后在吸水纸上拍干;(5)孵育二抗:用1x稀释液按说明书稀释检测抗体,每个检测孔加入100ul溶液室温孵育1小时;(6)洗涤:孵育结束后弃掉稀释液,用洗板机洗板3次,每次洗液大于250ul每孔,最后在吸水纸上拍干;(7)加酶标试剂:除空白孔外,各孔均加入100ul的1xavidin-hrp液室温孵育30min;(8)洗涤:孵育结束后弃掉稀释液,用洗板机洗板5次,每次洗液大于250ul每孔,最后在吸水纸上拍干;(9)显色:每个检测孔加入100ultmb显色液,置于室温,避光显色15min;(10)终止:取出酶标板,每孔加50ul已配置好的终止液,终止显色反应;(11)测定:将酶标板置于酶标仪上,在450nm处依序测定每孔的吸光度od值(注意:要在终止15min内测定);(12)分析:以标品浓度为横坐标(x),标品od值为纵坐标(y),绘制标准曲8.构建透明质酸-mt-1/mt-1-fc重组蛋白纳米微球(ha-mt-1/mt-1-fc纳米微球):三、实验结果1.ra病人中mt1的表达上调为了研究mt1在ra中的潜在作用,首先比较了其在ra病人正常人hc的pbmc和血清中的表达。从北京大学深圳医院检验科收集了53例ra患者的血液标本,40例正常人(hc)的体检血液标本,具体信息如表1。characteristicsrapatientshealthycontrolsno.ofcases5340female,n(%)44(83.02%)33(82.5%)male,n(%)9(16.98%)7(17.5%)age,years(range)50.53(25-82)48.2(20-76)esr(mm/h)(mean±sd)25.15±17.25-rfconcentration(iu/ml)(mean±sd)66.39±49.75-crp(mg/l)(mean±sd)8.1±6.57-anti-ccp(u/ml)(mean±sd)93.36±48.11-表1ra病人和hc的具体信息esr,红细胞沉降率;rf,类风湿因子;crp,c-反应蛋白;anti-ccp,抗环瓜氨酸肽抗体分离pbmc,体外rpmi1640培养基培养过夜,trizol裂解细胞、提取mrna、实时定量rt-pcr检测mt1的表达。此外,分别取ra和hc血清用于elisa检测mt1的表达。结果显示,ra样品中mt1的mrna和蛋白水平都较hc高,如图1a-b所示。.cia小鼠中mt1的表达上调牛cⅱ胶原诱导cia动物模型,35天后,取出脾脏、淋巴结和滑膜组织,并且收集滑膜液,qrt-pcr和elisa检测滑膜组织中mt1表达。结果显示,cia小鼠中mt1的表达较对照为免疫诱导cia小鼠高。如图1c-f所示。四、结论:ra是一种病因不明的慢性、消耗性、反复发作、以关节症状为主的全身性自身免疫疾病,是国内最常见的风湿病之一。滑膜组织免疫细胞表达大量炎性细胞因子,其与ra的炎性反应、滑膜的增生、关节软骨的降解及骨破坏密切相关。促炎因子tnf-α、il-1、il-6、il-17、il-33促进ra的发生和发展,抗炎因子il-10、il-4延缓ra的发生、减轻ra的症状、阻延ra的病理发展,这些细胞因子与多种免疫细胞相互作用,形成错综复杂的网路,一旦网络失衡,则会加速ra的发生和发展。实验表明,mt1在ra中高表达,提示其与ra发病的相关性,mt1可能是参与ra进程的一个重要的免疫调节蛋白,为临床上ra的诊断提供一个潜在的靶点和可靠的理论依据。实施例二:mt1抑制cia的发生发展的试验cia动物模型是目前公认的用于研究ra的典型模型,其表型与ra临床症状非常相似。本实施例为了深入研究mt1对ra进程的调节作用,我本试验通过局部注射表达mt1的腺病毒于cia小鼠,观察mt1对cia进程、临床评分、滑膜炎症等表型的调节作用。一、实验材料、试剂1.实验材料同实施例一。.实验试剂mt1重组蛋白为深圳市意达凯公司赠予;il-1β、tnfα、ifnγ、il-17a和il-6elisa试剂盒购于ebioscience公司。其余同实施例一。二、实验方法1.腺病毒载体的构建使用invitrogen的adenoviralpad/cmv/v5gatewayvectors和block-it™腺病毒表达系统,构建过表达mt1的腺病毒载体,lipofectamine2000转染293a细胞进行病毒包装。液氮和37℃反复冻融细胞3次收集病毒,经多轮感染后获得高滴度的ad-mt1腺病毒(1012pfu/ml)。分别于cia建模的15天、20天和25天进行关节腔注射。.cia动物模型的临床评价(1)每天统计小鼠的发病率,使用游标卡尺测量和统计小鼠后足的厚度;(2)肉眼观察评估cia疾病严重程度,判断标准为:0分=无水肿或红肿;1分=轻度水肿,仅在后足或踝关节出现红疹;2分=轻度水肿,踝关节至跗骨出现红疹;3分=水肿,踝关节至整条腿部出现红疹;(3)35天后,取出小鼠脾脏与腘淋巴结,游标卡尺增量其长度和直径,并称重;(4)35天后,取适中长度的小鼠膝关节,4%多聚甲醛于4℃固定过夜,7%硝酸脱钙液脱钙1-2天至针刺组织无抵抗为止,用于后续石蜡切片,h-e染色,观察滑膜增生、血管翳生成、软骨及骨的破坏程度,组织学评分标准为:0分=无炎症,1分=轻度滑膜增生或滑膜衬层少量细胞浸润,2分=滑膜增生,滑膜衬层炎症细胞浸润及局部软骨轻度破坏,3分=滑膜间隙细胞浸润,血管翳形成,软骨破坏,骨侵蚀;(5)35天后,取出滑膜组织,qrt-pcr检测滑膜组织中tnf-α、il-1β、il-17a和il-6的表达;(6)200μlpbs冲洗关节腔,收集滑膜液,elisa检测滑膜液中ifn-γ、tnf-α、il-1β、il-17a和il-6的表达(操作方法参照ebioscienceelisa试剂盒说明书)。.关节组织切片制备与h-e染色(1)关节组织切片制备①取材和固定:剪取适中长度的小鼠膝关节和踝关节,迅速浸于甲醛溶液中固定20小时,用7%硝酸脱钙液脱钙1-2天至针刺组织无抵抗为止,用于后续石蜡切片。在脱钙过程中禁盖瓶盖,以使脱钙过程中产生的co2气体溢出。②脱钙:用7%硝酸脱钙液脱钙1-2天至针刺组织无抵抗为止;③脱水:固定后的组织依次由低浓度乙醇到高浓度乙醇浸泡脱水。④流水冲洗2h;50%乙醇2h(中间换液);70%乙醇(过夜);80%乙醇2h(中间换液);95%乙醇1h(中间换液一次);无水乙醇30mln(中间换液一次);无水乙醇:二甲苯(1:1)10min;⑤透明:选用二甲苯浸泡,使组织透明,二甲苯透明10min;二甲苯:石蜡(1:1)10min;二甲苯i:1h;二甲苯ii:1h;二甲苯iii:1h;⑥浸蜡和包埋:二甲苯:石蜡(1:1):15min;石蜡i:1h;石蜡ii:1h;石蜡iii:30min;将组织放入自制纸盒里,向纸盒中倒入石蜡液体,立即将纸盒放入冰水混合物里,以使石蜡尽快凝固,把组织包埋成块。⑦修蜡和切片:撕去纸盒,取出蜡块,用刀片修去多余的石蜡,各边和底部要平整;将修好的组织块固定于蜡台,然后把蜡台装在切片机上,切成厚度5um薄片。⑧捞片:把切好的石蜡片放入45℃漂烘仪中,以使蜡片展平,再用载玻片捞出,45℃烘干。(2)h-e染色,光学显微镜观察:染好的切片放在olympusbx51显微镜下观察,比较不同组之间小鼠膝关节病理变化,并利用自动成像系统拍照。(2)h-e染色①脱蜡复水:将切片放入60℃烤箱中烘2h或37℃过夜,然后依次将切片放入如下梯度溶液,使脱蜡复水。②二甲苯i10min;二甲苯ii5min;二甲苯:无水乙醇(1:1)3min;无水乙醇i2min;无水乙醇ii2min;95%乙醇2min;80%乙醇2min;70%乙醇2min;50%乙醇2min;蒸馏水3min;③染色:苏木素,45mim;自来水冲洗,2s;1%盐酸酒精,30s;自来水返蓝,20min;50%乙醇,1min;80%乙醇,1min;伊红(新鲜配置的染4s否则染2min);④脱水和透明:95%乙醇,2min;无水乙醇i,2min;无水乙醇ii,2min;二甲苯i,2min;二甲苯ii,2min;⑤中性树胶封固:用吸水纸吸掉多余二甲苯,用吸管吸取中性树胶滴到切片上,缓慢盖上盖玻片,室温放置,晾干;⑥光学显微镜观察:染好的切片放在olympusbx51显微镜下观察,比较不同组之间小鼠膝关节病理变化,并利用自动成像系统拍照。.实时定量rt-pcr方法同实施例一。mtnf-α引物序列:gaccctcacactcagatcat;ttgaagagaacctgggagtamil-1β引物序列:ccttccaggatgaggacatga;tgagtcacagaggatgggctcmil-6引物序列:agccactcacctcttcagaac;acatgtctcctttctcagggchil-1β引物序列:ccacagaccttccaggagaat;gtgcacataagcctcgttatcchil-6引物序列:agccactcacctcttcagaac;acatgtctcctttctcagggchtnfα引物序列:acctctctctaatcagccctct;gggtttgctacaacatgggcta5.elisa(1)按说明书配置实验所需溶液(包被液、标准品、洗液);(2)根据待测样品数量和标准品数量决定所需检测孔数,每孔加入100μl抗体包被液4℃包被过夜,同时设定2孔作空白对照;(3)洗涤:包被结束后弃掉包被液,用洗板机洗板3次,每次洗液大于250μl每孔,最后在吸水纸上拍干;后续步骤同实施例一。.mt1蛋白刺激试验分离ra患者及hc的pbmc,体外培养2h后加入mt1重组蛋白(20μm)培养24小时,加lps(1μg/ml)刺激4小时,1600rpm离心5min后收集细胞,trizol裂解细胞,提取细胞的总rna,反转后rt-pcr检测分析相关细胞因子mrna的表达。三、实验结果1.mt1推迟cia发病、降低发病率和临床评分为了研究mt1对ra进程的调节作用,本实施例诱导wt小鼠cia的发生,分别于第15天、20天、25天关节腔注射ad-vector和ad-mt1,如图2a所示,每天观察并记录小鼠的cia临床表型和严重程度。结果发现,注射ad-mt1可以明显抑制其发病率和临床评分,如图2b-c所示。.mt1抑制cia进程ra是以慢性滑膜炎症反应为主要特征,可以导致软骨和骨的破坏。接下来,本实施例比较了mt1腺病毒注射后对cia小鼠表型的变化,以及mt1对滑膜组织炎症反应的调节作用。结果表明,关节腔注射ad-mt1后,cia小鼠的淋巴结和脾脏组织较ad-vec小,并且脚掌水肿表现减轻。如图2c-e所示。此外,35天后,取滑膜组织切片,h-e染色,显示mt1明显抑制cia小鼠滑膜增生和软骨破坏。如图2f-g所示。.mt1蛋白抑制ra病人促炎因子的表达类风湿性关节炎是一种病因不明的自身免疫性疾病,遗传和环境因素都发挥着不容忽视的作用。研究表明,促炎和抑炎因子、效应性和调节性免疫细胞的失衡是导致关节炎及ra的关键因素。上述结果表明mt1可以抑制cia的发生发展,促炎因子在ra进程中发挥这关重要的作用,mt1可通过调节促炎因子的表达发挥抑制ra的作用。纯化mt1重组蛋白,处理体外培养的ra和hc的pbmc,pcr检测mt1对其促炎因子表达的作用。结果表明,mt1可以明显抑制ra病人促炎因子il-1β、il-6、tnf-α的表达,但对hcpbmc中促炎因子的表达没有影响,提示mt1特异性的调节ra炎症反应,如图2i-k所示。.mt1蛋白抑制cia小鼠促炎因子的表达为了炎症mt1抑制ra炎症因子的表达,本实施例更进一步检测了cia小鼠中促炎因子的表达是否会受到mt1的抑制。cia诱导35天后,分别取ad-vec和ad-mt1的小时的滑膜组织并收集其滑膜液,qpcr和elisa检测相关促炎因子的变化。结果如图2l-s所示。四、结论:炎性细胞因子在特异性和非特异性病理免疫炎症反应进程。ra中滑膜组织表达大量具有炎症活性的细胞因子,已有研究表明这些炎症因子与ra的炎性反应、滑膜的增生、关节软骨的降解及关节旁骨的破坏密切相关。本实施例研究发现,关节腔局部过表达mt1可以明显抑制cia的发生发展,进一步研究发现mt1蛋白可以特异性抑制ra病人中促炎因子的表达。因此,小分子蛋白mt1是ra进程中一个很重要的免疫抑制调节蛋白,为临床上ra的治疗提供一个潜在的药物靶点,并且其对ra的抑制作用可能来源于与对促炎因子表达的抑制。实施例三:mt1调控th17/treg平衡的试验免疫内环境的稳定依赖于th/treg细胞之间的平衡,这些细胞的含量或功能异常会导致自身免疫病的发生。th17细胞的发现源于对自身免疫性疾病机制的研究,th17细胞主要分泌il-17a、il-17f、il-22等细胞因子,调节炎症反应和促进自身免疫病。相反,treg细胞通过调节效应th细胞的功能,维持免疫系统稳定,抑制自身免疫病的发生。ra发生的免疫学机制尚未明确,但是研究表明,th17细胞分化和treg细胞功能紊乱都与ra的发生密切相关。因此,本实施例检验mt-1通过调节th17/treg细胞平衡来抑制ra的发生发展。一、实验材料、试剂1.实验材料流式细胞仪购于bd公司;其余同实施例一。2.实验试剂anti-cd3/cd28包被抗体、cd4、il-17和foxp3流式抗体购于ebioscience公司;tgfβ、il-6和il-23细胞因子购于peprotec公司;pma、ionmycin和moesin试剂购于sigma公司;细胞质抗原固定破膜试剂盒cytofix/cytopermtmplus和foxp3检测试剂盒foxp3stainingkit分别购于bd和ebioscience公司;磁珠分选相关仪器和cd4+tcellisolationkit购于miltenyibiotec公司;凋亡检测试剂盒fitcannexinvapoptosisdetectionkitⅰ购于bdbiosciences公司;cfse燃料购于ebioscience公司;其余同实施例一。二、实验方法1.小鼠脾脏cd4+t细胞的磁珠分离(1)制备脾脏单细胞悬液;(2)离心,弃上清,macs缓冲液重悬细胞团200ul/108;(3)按照5µlofthebiotin-antibodycocktailper107,加入biotin-antibodycocktail,充分混匀;(4)置于冰上,反应5min;(5)按照30µlofbufferper107totalcells的比率加入macs缓冲液;(6)按照10µlofanti-biotinmicrobeadsper107totalcells的比率加入anti-biotinmicrobeads;(7)充分混匀后,置于4oc反应10min;(8)按照200µlofbufferper108totalcells的比率加入macs缓冲液,并充分混匀;(9)将ms柱子固定在磁性铁板上,加入1mlpbs润洗;(10)将细胞悬液加入到ms柱子里,然后用15ml的离心管收集洗脱的细胞;(11)用200ulmacs悬液润洗ls柱子,收集洗脱的悬液;(12)离心收集细胞,用适量的培养基混匀细胞,并进行细胞计数;2.th17细胞的体外分化(1)anti-cd3/28(1ug/ml)抗体包被24-孔板,4度过夜,使用前,pbs洗两遍;(2)磁珠分选cd4+t细胞,在th17细胞分化的条件下培养3天,th17分化的条件:il-23(50ng/ml)、il-6(20ng/ml)、tgfβ(5ng/ml)。(3)加入20μmmt1重组蛋白处理细胞;(4)收样前5h加入pma(50ng/ml)、离子霉素(1μg/ml)及brefeldina(10μg/ml,golgiplug)。3.facs检测胞内抗原il-17和foxp3的表达按照试剂盒说明书操作,冰上进行:(1)①样品准备:磁珠分选wt小鼠脾脏组织中的cd4+t细胞,在th17细胞分化的条件下培养3天,加入pma(1μg/ml)、离子霉素(0.5μg/ml)及golgiplug刺激5小时后,pbs重悬细胞,先进性细胞表面抗原cd4染色,再进行细胞内抗原il-17及foxp3的染色。②35天后,分别取ad-vec和ad-mt1cia小鼠的脾脏组织,制备单细胞悬液,磁珠分选cd4+t细胞,在th17细胞分化的条件下培养3天,加入pma(1μg/ml)、离子霉素(0.5μg/ml)及golgiplug刺激5小时后,pbs重悬细胞,先进性细胞表面抗原cd4染色,再进行细胞内抗原il-17及foxp3的染色。(2)pbs收集细胞,离心后,50μlpbs重悬,加入1μlcd4-pe抗体,冰上避光孵育20min;(3)加入1mlpbs洗一遍;(4)固定破膜:加100μlfixationandpermeabilizationbuffer,冰上避光孵育20min;(5)加入1ml1×permeabilizationwashbuffer洗一遍;(6)染色:50μl1×permeabilizationwashbuffer重悬细胞,加入1μl胞内抗原相应抗体il-17/foxp3-apc,冰上避光孵育20min;(7)加入1mlpbs洗一遍;(8)分析:上机检测。4.facs检测cd4+t细胞的增殖与凋亡(1)增殖磁珠分选cd4+t细胞,无血清rpmi1640培养基重悬细胞,加入2μmcfse染料,37℃培养箱标记10min。然后加入血清至30%,37℃培养箱中和染色30min。离心后,新鲜培养基重悬细胞,在th17分化条件下培养三天,加入20μmmt1重组蛋白处理,流式分析cd4+t增殖的变化。(2)凋亡磁珠分选cd4+t细胞,离心后,新鲜培养基重悬细胞,在th17分化条件下培养三天,加入20μmmt1重组蛋白处理,流式分析cd4+t凋亡的变化。凋亡染色的步骤如下:①用预冷的pbs洗涤细胞2次,每次均需300g,4℃离心5min。收集1~5×105细胞。②加入100μl1×bindingbuffer重悬细胞。③加入5μlannexinv-fitc和5μlpistainingsolution,轻轻混匀。④避光、室温反应10min。⑤加入400μl1×bindingbuffer,混匀,样品在1小时内用流式细胞仪或荧光显微镜检测。5.实时定量pcr方法同实施例一。mil-17a引物序列:cagcagcgatcatccctcaaag;caggaccaggatctcttgctgmil-17f引物序列:gaggataacactgtgagagttgac;gagttcatggtgctgtcttccmil-10引物序列:tgctatgctgcctgctctta;gctccactgccttgctcttamfoxp3引物序列:cacccaggaaagacagcaacc;gcaagagctcttgtccattga三、实验结果1.体外mt1抑制th17但促进treg细胞分化ra的发生很关键得一个因素就是th17、treg介导的细胞反应之间的失衡。为了检测mt1对th17、treg细胞分化的影响,本实施例分离了wt小鼠脾脏中的cd4+t细胞,在th17分化的条件下,加入20μmmt1重组蛋白,培养三天后,检测mt1对th17和treg细胞分化的影响。结果显示,加入mt1后可以明显抑制cd4+il-17+th17细胞数目,但是增加cd4+foxp3+treg细胞数目。如图4a-d所示。2.体外mt1调节th17、treg细胞相关因子的表达为了进步一研究mt1对th17、treg细胞分化的调节作用,本实施例分析了其相关细胞因子的表达情况。cd4+t细胞在th17分化的条件下,加入20μmmt1重组蛋白,培养三天后,qpcr检测mt-1对th17细胞相关因子il-17a、il-17f及treg细胞相关因子il-10、foxp3表达的影响。结果显示,mt1重组蛋白可以明显抑制th17细胞相关因子il-17a、il-17f、促进treg细胞相关因子il-10、foxp3的表达。如图3e-h所示。3.mt1蛋白对cd4+t细胞的增殖和凋亡的影响由上述结果可以,mt1参与调节th17、treg细胞分化,为了排除中作用是由cd4+t细胞的增殖或凋亡介导的,本实施例分析了mt-1对其影响。cd4+t细胞用cfse标记后,在th17分化条件下,三天后facs检测cfse表达分布的情况。此外,还用facs分析了mt-1对th17分化条件下cd4+t细胞凋亡的影响。结果显示,mt1对cd4+t细胞的增殖和凋亡均没有作用。如图3i-j所示。4.体内mt1调节th17/treg平衡上述结果显示,mt1可以调节th17、treg细胞的分化,提示ra中mt1可能参与调控th17/treg平衡,进而参与抑制ra炎症进程。为了直接验证这一结论,本实施例诱导了cia动物模型,分别于关节腔注射ad-vec和ad-mt1。35天后,facs分析脾脏组织中th17、treg细胞的含量。结果显示,注射ad-mt1后可以明显抑制cia小鼠脾脏中cd4+il-17+th17细胞数目,但是增加cd4+foxp3+treg细胞数目。如图4k-n所示。5.体内mt1调节th17、treg细胞相关因子的表达为了进一步验证mt1在cia状态下对th17、treg细胞分化的调节,本实施例检测了cia状态下,mt1对th17、treg细胞相关因子的表达。胶原诱导cia35天后,分别分离ad-vec和ad-mt1关节腔注射小鼠的滑膜组织,液氮研磨,提取rna,qpcr检测mt1对il-17a、il-17f及il-10、foxp3表达的影响。结果显示,mt1抑制th17细胞相关因子的表达,促进treg细胞相关因子的表达。提示cia状态下,mt1可以调控th17/treg平衡,进而参与抑制cia的发生发展。四、结论:机体免疫内环境的稳定依赖于th细胞免疫激活和treg细胞免疫抑制作用之间的平衡,ra的发生是b、t、巨噬细胞和滑膜成纤维细胞等共同作用的结果,早期观点认为,ra疾病是由th1细胞介导的,然而,近期研究结果表明,th17在ra炎症反应、软骨破坏及骨吸收过程中发挥着至关重要的作用。th17、treg细胞的分化过程是密切相关的,th17和treg细胞在特定的细胞因子微环境下可以相互转化,其平衡对于维持正常免疫应答,防止自身免疫病的发生至关重要。本实施例研究结果显示,小分子蛋白mt1可以抑制th17细胞的分化、促进treg细胞的分化,进而参与调控th17/treg平衡,并且mt1可以抑制th17细胞相关因子的表达,促进treg细胞相关因子的表达。表明mt1可能通过对这些相关因子的表达进而调控其分化,最终在cia状态下调控th17/treg平衡,参与抑制ra的发生发展。实施例四:mt1抑制stat3激活和rorγt表达的试验上述实施例的研究结果显示mt1可以通过抑制炎性因子的表达和调控th17/treg平衡,参与抑制ra的发生发展。但是其具体的分子调节机制如何;已知小鼠中tgfβ和il-6可以诱导th17细胞的分化,tgfβ和il-6与受体结合后激活stat3信号通路,进而促进转录因子rorγt的表达。研究表明,stat3缺陷的t细胞中th17细胞的分化明显被抑制。此外,stat3也可以通过调节il-17、il-21、il-23r来调控th17细胞的分化。因此,本实施例检验mt1对th17/treg平衡的调控是否来源于对stat3信号通路的抑制及转录因子rorγt表达的抑制,最终参与抑制ra的发生发展。一、实验材料与试剂1.实验材料电泳仪、电泳槽和转膜槽购于bio-rad公司;凝胶成像系统购于carestream公司;其余同实施例一。2.实验试剂抗stat3、pi-stat3和β-actin抗体购于cellsignalingtechnology公司;ripalyisisbuffer及相关蛋白抑制剂购于solarbio公司;ecl化学发光液购于thermo公司;电泳和转膜液配制相关试剂trisbase、甘氨酸和sds、bsa和脱脂奶粉购于上海生工公司;其余同实施例一。分离缓冲液(resolvingbuffer):调节ph值至8.8。浓缩缓冲液(stackingbuffer):调节ph值至6.8。分离胶(resolvinggel):浓缩胶(stackinggel,3.9%):10×电泳缓冲液(10xrunningbuffer):10×转膜缓冲液(10×blottingbuffer):1×转膜缓冲液(1×blottingbuffer):二、实验方法1.免疫印迹(wb)(1)制胶10%分离胶配制:ddh2o1.4ml,30%丙烯酰胺溶液0.33ml,1.0mol/ltris(ph8.8)0.25ml,10%过硫酸氨20ul,10%sds20ul,temed2ul;充分混匀后,将分离胶缓慢注入准备好的两玻璃板夹缝中,过绿板底线后用水压平液面,在室温聚合;分离胶聚合后倒出凝胶顶部的水,并小心用滤纸吸干多余水分。5%浓缩胶配制:ddh2o1.9ml,30%丙烯酰胺溶液1.7ml,1.5mol/ltris(ph6.8)1.3ml,10%过硫酸氨50ul,10%sds50ul,temed2ul;将浓缩胶缓慢注入分离胶上层,在两玻璃板夹缝中水平插入梳子,注意避免产生气泡。(2)上样将配胶的玻璃板放入电泳槽中注意小玻璃板面向内,大玻璃板面向外。取蛋白质样品水浴100度加热5min变性,取20ul样品加入5ul5xloadingbuffer上样,并加上蛋白maker以指示目的蛋白,其余孔用1xloadingbuffer补齐,注意避免气泡及上样顺序。(3)电泳恒压80v跑积沉胶约20min至样品压成一条线,换成恒压120v,跑约1小时,待溴酚蓝抵达胶底边停止。取出凝胶用于转印。(4)转膜①将玻璃板取出,将玻璃板轻撬开,取出胶块,将浓缩胶和分离胶上不用的部分切去。②用量筒配置1l1x电转液:80ml10x电转液、720mlddh2o、200ml无水乙醇。③根据剩下的胶块大小划滤纸(六层,上三层下三层),和nc膜,在电转液中浸泡。④电转膜夹子放入,黑面在下面,根据海绵、三层滤纸、凝胶、nc膜、三层滤纸、海绵的顺序添加,最后合紧。⑤将电转膜夹子放入电泳槽内,根据红黑对应,往槽内加入剩余的1x电转液,盖上盖子。⑥电压100v、时间1hours,开始转膜。(5)封闭①配置5%脱脂奶粉(30ml1xtbst+1.5g脱脂奶粉)②取出电转膜夹子,将nc膜取出,nc膜的正面对着凝胶,标记nc膜的正面,nc膜正面朝上放置在培养皿。③加入5%脱脂奶粉,将培养皿放置水平摇床上,20-30转/min,室温摇1-2h。(6)免疫检测①去除封闭液,用1xtbst清洗两次,每次摇床5min;②加入bsa稀释的一抗覆盖膜界面4℃孵育过夜;③加入1xtbst清洗3次,每次5-10min;④加入bsa稀释的二抗,覆盖膜界面4℃孵育1小时温和晃动;⑤加入1xtbst清洗3次,每次5-10min;⑥加入tbst清洗1次;⑦加ecl发光试剂反应,经多功能成像系统成像;⑧应用imagej分析软件进行条带光密度的测定,其中对照组的光密度值设置为1,其余实验组与对照组的比值为该条带的相对光密度值;相对比值为倍数改变。2.实时定量pcr方法同实施例一。mrorγt引物序列:ccgctgagagggcttcac;tgcaggagtaggccacattaca三、实验结果1.体外mt1抑制stat3活化和rorγt的表达鉴于stat3信号通路与rorγt在th17分化过程中的重要作用,本实施例首先在通过磁珠分选的方法纯化了wt小鼠脾脏中的cd4+t细胞,体外th17分化培养的条件下,加入20μm的mt1重组蛋白处理。三天后,收集细胞,离心后,加入蛋白裂解液和相关蛋白酶抑制剂,冰上裂解30min后。14000rpm,离心15min,取上清检测浓度。加入相应体积的蛋白上样缓冲液,煮样器上100℃,煮5min。12000rpm。离心5min,上样wb检测stat3信号通路的活性。结果显示,mt1明显抑制tgfβ和il-6对stat3的激活,即mt1抑制了stat3磷酸化水平的表达。(图4a-b)。此外,本实施例也检测了mt1对rorγt表达的调节作用,与预想结果一致,体外在th17分化条件下,mt1明显抑制转录因子rorγt的表达(图4c)。本结果指出mt-1通过对stat3磷酸化的下调,进而抑制il-17转录子rorγt的表达,而达到对th17细胞分化的抑制。2.体内mt1可以抑制stat3活化和rorγt的表达为了进一步验证mt1对stat3及rorγt表达的抑制作用,本实施例诱导了cia动物模型,分别于关节腔注射ad-vec和ad-mt1。35天后,分离cia小鼠的滑膜组织,加入适量蛋白裂解液和相关蛋白酶抑制剂,匀浆器研磨至匀浆状,置于冰上裂解30min。14000rpm,离心15min,取上清检测浓度。加入相应体积的蛋白上样缓冲液,煮样器上100℃,煮5min。12000rpm。离心5min,上样wb检测stat3信号通路的活性。结果显示,mt1在cia炎症状态下,可以明显抑制stat3磷酸化水平的表达(图4d-e)。此外,本实施例还检测了cia炎症状态下,mt1对rorγt表达的调节作用,与体外结果一致,cia状态下,35天后,分离cia小鼠的滑膜组织,qpcr结果表明mt1明显抑制转录因子rorγt的表达(图4f)。四、结论本实施例研究结果表明,mt1可以抑制stat3信号通路的活性,并且抑制转录因子rorγt的表达。因此,本文研究结果显示,mt1通过抑制stat3信号通路依赖的th17细胞的分化,调控cia状态下的th17/treg平衡,参与抑制ra的发生发展。并且ra状态下,mt1的表达明显升高。因此,mt1以负反馈调节的机制参与ra进程,为ra等相关自身免疫疾病的诊断和治疗提供可靠的临床依据和潜在的药物靶点。实施例五:mt-1/mt-1-fc编码基因的克隆和重组蛋白表达载体的构建,重组蛋白的纯化,和透明质酸-mt-1/mt-1-fc重组蛋白纳米微球的制备、生物活性和在体内半衰期的研究。上述实施例的研究结果显示mt1可以通过抑制炎性因子的表达和调控th17/treg平衡,参与抑制ra的发生发展。但由于mt1是一小分子蛋白,在体内的半衰期非常短,仅仅只有半小时,故必须构建融合蛋白,并制备纳米颗粒,以延长其在体内的半衰期,才有可能作为药物对类风湿关节炎炎及th17细胞介导的自身免疫疾病进行治疗。因此本实验通过构建mt-1-fc融合蛋白,及透明质酸包裹mt-1或mt-1-fc融合蛋白的纳米颗粒,以解决mt-1在体内半衰期过短的问题。一、实验材料、试剂1.实验材料同实施例一。.实验试剂质粒和菌种:原核表达载体为质粒pet-28a、ppic9k购于invitrogen公司;所使用菌种大肠杆菌e.colitranst1克隆菌、e.colitransetta(de3)均购于北京全式金生物技术有限公司,毕赤酵母gs115购于invitrogen公司。主要试剂和工具酶:质粒dna小量提取试剂盒和dna胶纯化试剂盒购于生工生物工程(上海)股份有限公司;taq酶、dnamarker购于北京全式金生物技术有限公司;蛋白marker购于fermentas公司;限制性内切酶和t4连接酶均购于takara公司。二、实验方法mt-1及mt-1-fc表达载体的构建:根据生物遗传信息学对il-37编码基因进行优化改造,详见实验结果图5a(比较的基因序列中,上为原始的mt-1核苷酸序列,下为优化改造后的mt-1核苷酸序列)将建改造后的mt-1基因片段的核苷酸序列(图5b)进行合成,在5’和3’端加限制性内切酶位点。将mt-1基因片段放在在氨端和并将igg1fc段放在在羧端(图5c),合成得mt-1-fc核苷酸序列,在5’和3’端加限制性内切酶位点;表达载体的构建和扩增:将合成mt-1和mt-1-fc的基因用dna连接酶在16℃进行连接反应,连接到t载体,用氯化钙法将所要克隆的基因产物转化e.colitranst1克隆菌,在含氨苄青霉素的lb平板进行筛选,挑取阳性菌落(含重组质粒载体,进行扩增,提取质粒,分别用限制性内切酶进行酶切。所得产物琼脂糖凝胶电泳鉴定并分离纯化,并测序验证核苷酸序列。重组蛋白mt-1的表达:pet28a-mt-1重组蛋白的表达:将连接后的pet28a-mt-1质粒分别转化e.colitransetta(de3),挑取单菌落培养过夜,按1%比例接种于lb培养基,加异丙基-β-d-硫代吡喃半乳糖苷(iptg)诱导mt-1的表达,ppic9k-mt-1-fc的重组蛋白的表达:sacⅰ限制性内切酶将ppic9k-mt-1-fc重组质粒线性化,将其电转化到毕赤酵母gs115感受态细胞,将已被转染的毕赤酵母gs115感受态细胞涂布在md培养基平板,除了组氨酸营养筛选外,还用不同浓度g418进行筛选,挑选在g418高浓度的单克隆菌落,进行pcr鉴定,获得多拷贝重组菌。重组gs115-ppic9k-mt-1-fc用甲醇诱导mt-1-fc表达。和mt-1-fc蛋白的表达和纯化:诱导表达后收集菌体,离心破碎,盐析、透析、分子筛、离子交换层析等多个步骤,得mt-1和mt-1-fc目的蛋白重组mt-1重组蛋白与il-37-il-37-fc重组蛋白透明质酸纳米颗粒的制备:mt-1或mt-1-fc重组蛋白溶于氯化钠(naoh),以ha-naoh为水相(在naoh中含mt-1或mt-1-fc),以正庚烷为油相,tween为乳化剂,水相/油相超声乳化制备载药微球。扫描电镜观察载药微球的形状和大小。新鲜制备的载药微球迅速冻结在液态丙烷和立即调到1%锇丙酮(-196oc)。样品被冻结超过4天。电子扫描显微镜样品进行临界点干燥,安装溅射涂层然后照片拍摄(图5e)。载药微球干燥后,进行载药量、包封率及体外释放药累计释放率的测定。重组mt-1重组蛋白与il-37-il-37-fc重组蛋白在体内血循环半衰期的比较:用纯化mt-1和mt-1-fc融合重组蛋白在sd大鼠中做单个剂量(mt-110ug/kg;mt-1-fc52.28ug/kg)尾静脉注射。血液样本被收集在0,0.5,1,2,6,24,48,72,96小时;mt-1elisa试剂盒测量血清mt-1和mt-1-fc融合蛋白的水平。mt-1和mt-1-fc融合重组蛋白的体内药代动力学研究结果如图5f所示,与mt-1重组蛋白相比,mt-1-fc在血清中具有较长的半衰期(mt-1:mt-1-fc为0.5小时:24小时.mt-1重组蛋白与mt-1-fc重组蛋白透明质酸纳米颗粒在体内血循环半衰期的比较:用透明质酸纳米分别对纯化mt-1和mt-1-fc融合重组蛋白制备纳米颗粒。在sd大鼠中,用相当于mt-110ug/kg;mt-1-fc52.28ug/kg的透明质酸纳米颗粒尾静脉注射。血液样本被收集在0,0.5,1,2,6,24,48,72,96,120,144,168小时;mt-1elisa试剂盒测量血清mt-1和mt-1-fc融合蛋白的水平。重组蛋白和mt-1-fc重组蛋白及mt-1重组蛋白与mt-1-fc重组蛋白透明质酸纳米颗粒生物活性的检测:从类风湿关节炎手术患者获取滑膜,从滑膜组织中分离滑膜细胞,用rpmi1640(hyclone,thermo,美国)全培养基,加10%胎牛血清(hyclone,美国)及100iu/ml青霉素100μg/ml链霉素培养滑膜细胞。细胞培养3个小时后,分别加或不加入mt-1重组蛋白、mt-1-fc重组蛋白、mt-1重组蛋白透明质酸纳米颗粒或mt-1-fc重组蛋白透明质酸纳米颗粒(它们mt-1的蛋白含量是5nmol/ml)进行培养12小时,细胞收集前lps4小时加1μg/ml刺激,收集细胞用于总rna提取以检测tnfα的转录水平。三、实验结果1.mt-1/mt-1-fc编码基因的克隆和重组蛋白表达载体的构建,重组蛋白的纯化,和透明质酸-mt-1/mt-1-fc重组蛋白纳米微球的制备:图5a:下方为优化改造后的mt-1核苷酸序列,图5b为mt-1氨基酸序列。图5c:为mt-1-fc核苷酸序列,图5d为mt-1-fc氨基酸序列。图5e:为扫描电镜观察载药微球的形状和大小,结果显示我们成功的制备了透明质酸载药纳米颗粒。图5f:mt-1和mt-1-fc融合重组蛋白的体内药代动力学研究结果显示,与mt-1重组蛋白相比,mt-1-fc在血清中具有较长的半衰期(mt-1:mt-1-fc为0.5小时:24小时.图5g:mt-1和mt-1-fc融合重组蛋白透明质酸钠纳米颗粒体内药代动力学研究结果显示,与mt-1重组蛋白透明质酸纳米颗粒相比,mt-1-fc透明质酸纳米颗粒在血清中具有较长的半衰期(mt-1:mt-1-fc为24小时:72小时。结果并显示mt-1和mt-1-fc融合重组蛋白透明质酸钠纳米颗粒与mt-1和mt-1-fc融合重组蛋白相比,分别具有较长的半衰期。图5h:mt-1和mt-1-fc融合重组蛋白生物活性的检测:结果显示,与对照组相比,mt-1和mt-1-fc重组蛋白显著抑制类风湿关节炎患者滑膜细胞炎性细胞因子tnfα的表达,指出mt-1和mt-1-fc重组蛋白在类风湿关节炎的滑膜细胞中具有抑炎的生物活性。图5i:mt-1和mt-1-fc融合重组蛋白透明质酸纳米颗粒生物活性的检测:实验显示,与对照组相比,mt-1和mt-1-fc重组蛋白透明质酸的纳米颗粒显著抑制类风湿关节炎患者滑膜细胞炎性细胞因子tnfα的表达,其指出mt-1和mt-1-fc重组蛋白透明质酸纳米颗粒在类风湿关节炎的滑膜细胞中具有抑炎的生物活性。综上所述,本领域的普通技术人员阅读本发明文件后,根据本发明的技术方案和技术构思无需创造性脑力劳动而作出其他各种相应的变换方案,均属于本发明所保护的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1