发光材料、有机发光元件及化合物的制作方法
本发明是涉及作为发光材料较有用的化合物及使用其的有机发光元件。
背景技术:
一直以来对提高有机电致发光元件(有机EL元件)等有机发光元件的发光效率积极地进行研究。尤其是对通过新开发构成有机电致发光元件的电子传输材料、电洞传输材料、发光材料等而提高发光效率进行各种研究。其中,亦可见关于利用如下化合物的有机电致发光元件的研究,该化合物具有在含有吡啶环的环状结构键结三级胺基的结构。
在专利文献1提出下述通式所表示的导入三级胺基NY、NY′的啡啉衍生物。此处,记载了对导入啡恶嗪基或啡噻嗪基等具有三环结构的三级胺基的啡啉衍生物确认发光特性的情况。
[化1]
而且,在非专利文献1中亦记载了对导入啡恶嗪基或啡噻嗪基等三级胺基的啡啉衍生物在可见区域的发光特性或电化学特性进行研究后的结果。
[先前技术文献]
[专利文献]
[专利文献1]日本专利特开2004-331586号公报
[非专利文献]
[非专利文献1]Inorganica Chimica Acta 357(2004)4335-4340
技术实现要素:
[发明要解决的问题]
如上所述,在专利文献1及非专利文献1中记载了导入啡恶嗪基等三级胺基的啡啉衍生物在可见区域发光的情况。然而,本发明者等人对导入三级胺基的啡啉衍生物的发光特性实际进行评价时发现其发光特性未能充分满足,故而必须提供具有更优异的发光特性的发光材料。
因此,本发明者等人开始对具有吡啶环与三级胺基的化合物群进行各种研究,首次发现在很多类似骨架中对联吡啶骨架导入三级胺基而成的化合物群有作为发光材料的有用性,并进行更进一步的研究。如上所述,对于具有啡啉骨架的化合物,在专利文献1及非专利文献1中确认了在可见区域的发光特性。然而,在该等文献中,未记载对联吡啶骨架导入三级胺基而成的化合物。因此,完全未预测对联吡啶骨架导入三级胺基而成的化合物作为发光材料的有用性。
于此种状况下,本发明者等人对在联吡啶骨架导入三级胺基而成的化合物作为发光材料的有用性进行更进一步的研究,为了发现发光特性优异的化合物而反复研究。并且,以导出作为发光材料有用的化合物的通式,使发光效率较高的有机发光元件的构成普及化为目的进行努力研究。
[解决问题的技术手段]
本发明者等人进行努力研究,结果发现具有特定结构的联吡啶衍生物作为发光材料具有优异的性质。而且,在此种化合物群中,发现作为延迟荧光材料较为有用,确认可廉价地提供发光效率较高的有机发光元件。本发明者等人基于该等见解从而提供以下本发明作为解决所述问题的方法。
[1]一种发光材料,其含有下述通式(1)所表示的化合物。
[化2]
通式(1)
[在通式(1)中,Y1及Y2分别独立表示N或C(R7),R1~R7分别独立表示氢原子或取代基;其中,R1及R2中的至少一个与R5及R6中的至少一个分别独立表示下述通式(2)所表示的基]。
[化3]
通式(2)
[在通式(2)中,Z表示连结链长为1原子的2价连结基;L1表示单键、或者经取代或未经取代的伸芳基,*表示通式(1)中的与杂环的键结部位;R11~R18分别独立表示氢原子或取代基;R11与R12、R12与R13、R13与R14、R15与R16、R16与R17、R17与R18亦可分别相互键结而形成环状结构]。
[2]根据[1]所述的发光材料,其特征在于:通式(2)所表示的基是下述通式(3)~(7)中任一个所表示的基。
[化4-1]
通式(3)
通式(4)
通式(5)
[化4-2]
通式(6)
通式(7)
[在通式(3)~(7)中,L14~L18表示单键、或者经取代或未经取代的伸芳基,*表示通式(1)中的与杂环的键结部位。R31~R38、R3a、R3b、R41~R48、R4a、R51~R58、R61~R68、R71~R78分别独立表示氢原子或取代基。R31与R32、R32与R33、R33与R34、R35与R36、R36与R37、R37与R38、R3a与R3b、R41与R42、R42与R43、R43与R44、R45与R46、R46与R47、R47与R48、R51与R52、R52与R53、R53与R54、R55与R56、R56与R57、R57与R58、R61与R62、R62与R63、R63与R64、R65与R66、R66与R67、R67与R68、R71与R72、R72与R73、R73与R74、R75与R76、R76与R77、R77与R78亦可分别键结而形成环状结构]。
[3]根据[1]或[2]所述的发光材料,其特征在于:通式(1)的R2及R5分别独立为通式(2)所表示的基。
[4]根据[1]至[3]中任一项所述的发光材料,其特征在于:通式(1)的Y1及Y2均为N、或均为C(R7)。
[5]根据[1]至[4]中任一项所述的发光材料,其特征在于:通式(2)的L1为单键。
[6]根据[1]至[5]中任一项所述的发光材料,其特征在于:存在于分子中的通式(2)所表示的基全部相同。
[7]根据[1]至[6]中任一项所述的发光材料,其特征在于:分子具有旋转对称结构。
[8]根据[1]至[6]中任一项所述的发光材料,其特征在于:分子具有线对称结构。
[9]一种延迟荧光体,其含有所述通式(1)所表示的化合物。
[10]一种有机发光元件,其特征在于:其含有根据[1]至[8]中任一项所述的发光材料。
[11]根据[10]所述的有机发光元件,其特征在于:其放射延迟荧光。
[12]根据[10]或[11]所述的有机发光元件,其特征在于:其是有机电致发光元件。
[13]一种化合物,其是由下述通式(1')所表示。
[化5]
通式(1')
[在通式(1')中,Y1'及Y2'分别独立表示N或C(R7'),R1'~R7'分别独立表示氢原子或取代基。其中,R1'及R2'中的至少一个与R5'及R6'中的至少一个分别独立表示下述通式(2')所表示的基]。
[化6]
通式(2')
[在通式(2')中,Z'表示连结链长为1原子的2价连结基。L1'表示单键、或者经取代或未经取代的伸芳基,*表示通式(1)中的与杂环的键结部位。R11'~R18'分别独立表示氢原子或取代基。R11'与R12'、R12'与R13'、R13'与R14'、R15'与R16'、R16'与R17'、R17'与R18'亦可分别键结而形成环状结构]。
[发明效果]
本发明的化合物作为发光材料较为有用。而且,在本发明的化合物中含有放射延迟荧光的化合物。将本发明的化合物用作发光材料的有机发光元件可实现较高的发光效率。
附图说明
图1是表示有机电致发光元件的层构成例的概略剖视图。
图2是实施例1的化合物1的甲苯溶液的发光光谱。
图3是实施例1的化合物1的甲苯溶液的暂态衰减曲线。
图4是实施例2的化合物4的薄膜型有机光致发光元件的发光光谱。
图5是实施例2的化合物4的薄膜型有机光致发光元件的暂态衰减曲线。
图6是比较例1的比较化合物1的薄膜型有机光致发光元件的发光光谱。
图7是比较例1的比较化合物1的薄膜型有机光致发光元件的暂态衰减曲线。
图8是实施例3的化合物1的有机电致发光元件的发光光谱。
图9是表示实施例3的化合物1的有机电致发光元件的电压-电流密度特性的曲线图。
图10是表示实施例3的化合物1的有机电致发光元件的电流密度-外部量子效率特性的曲线图。
具体实施方式
以下,对本发明的内容进行详细说明。以下记载的构成要件的说明是基于本发明的代表性的实施态样或具体例而完成,但本发明并不限定于此种实施态样或具体例。另外,在本说明书中使用「~」表示的数值范围意指包含以及在于「~」的前后的数值为下限值及上限值的范围。而且,本发明所使用的化合物的在分子内存在的氢原子的同位素种类并无特别限定,例如可为分子内的氢原子全部为1H,亦可为一部分或全部为2H(Deuterium D,氘)。
[通式(1)所表示的化合物]
本发明的发光材料的特征在于含有下述通式(1)所表示的化合物。
[化7]
通式(1)
在通式(1)中,Y1及Y2分别独立表示N或C(R7)。此处,Y1及Y2可其中任一个为N,另一个为C(R7),亦可为Y1及Y2均为N、或均为C(R7),优选为Y1及Y2均为N、或均为C(R7),更优选为Y1及Y2均为C(R7)。
R1~R7分别独立表示氢原子或取代基。其中,R1及R2中的至少一个与R5及R6中的至少一个分别独立表示下述通式(2)所表示的基。R1及R2中,下述通式(2)所表示的基可为R1及R2中的任一个,亦可为R1及R2两者,优选为R1及R2中的任一者。R5及R6中,下述通式(2)所表示的基可为R5及R6中的任一个,亦可为R5及R6两者,优选为R5及R6中的任一个。R1及R2中,通式(2)所表示的基的数量,与R5及R6中,通式(2)所表示的基的数量可相同亦可不同,优选为相同。优选的化合物为通式(1)的R1与R6为通式(2)所表示的基的化合物、通式(1)的R2与R5为通式(2)所表示的基的化合物,更优选的化合物为通式(1)的R2与R5为通式(2)所表示的基的化合物。在通式(1)中存在的复数个通式(2)表示的基可相同亦可不同,优选为相同。而且,亦优选为通式(1)所表示的化合物采取旋转对称结构。即,优选为Y1与Y2均为N,R1与R4、R2与R5、R3与R6分别相同。而且,亦优选为通式(1)所表示的化合物采取线对称结构。即,优选为Y1与Y2、R1与R6、R2与R5、R3与R4分别相同。
[化8]
通式(2)
在通式(2)中,Z表示连结链长为1原子的2价连结基。连结基只要为连结链长为1原子的2价连结基则无特别限制。优选的连结基为苯环的C所连结的原子为C、N、O、S的连结基,更优选的连结基为C(R3a)(R3b)、C=O、N(R4a)、O、S。此处,R3a、R3b、R4a与下述通式(3)中的R3a、R3b、下述通式(4)中的R4a分别同义。
L1表示单键、或者经取代或未经取代的伸芳基,优选为单键。*表示通式(1)中的与杂环的键结部位。L1为伸芳基时,作为伸芳基,优选为碳数6~18的伸芳基。作为碳数6~18的伸芳基,可列举伸苯基、联伸苯基、伸茀基、联三伸苯基等,更优选为连结基为伸苯基,进一步优选为连结基为1,4-伸苯基。关于伸芳基具有取代基时的取代基的说明与优选的范围,可参照下述R1~R7等可采取的取代基的说明与优选的范围。
在通式(2)中,R11~R18分别独立表示氢原子或取代基。取代基的数量并无特别限制,R11~R18亦可全部为未经取代(即氢原子)。在R11~R18中的2个以上为取代基的情形时,复数个取代基可相同亦可相互不同。
作为R11~R18可采取的取代基、与R1~R7可采取的取代基,例如可列举:羟基、卤素原子、氰基、碳数1~20的烷基、碳数1~20的烷氧基、碳数1~20的烷硫基、碳数1~20的烷基取代胺基、碳数2~20的酰基、碳数6~40的芳基、碳数3~40的杂芳基、碳数2~10的烯基、碳数2~10的炔基、碳数2~10的烷氧羰基、碳数1~10的烷基磺酰基、碳数1~10的卤烷基、酰胺基、碳数2~10的烷基酰胺基、碳数3~20的三烷基矽烷基、碳数4~20的三烷基矽烷基烷基、碳数5~20的三烷基矽烷基烯基、碳数5~20的三烷基矽烷基炔基及硝基等。该等具体例中,进一步亦可经可由取代基取代的基而取代。更优选的取代基为卤素原子、氰基、碳数1~20的经取代或未经取代的烷基、碳数1~20的烷氧基、碳数6~40的经取代或未经取代的芳基、碳数3~40的经取代或未经取代的杂芳基、碳数1~20的二烷基取代胺基。进一步优选的取代基为氟原子、氯原子、氰基、碳数1~10的经取代或未经取代的烷基、碳数1~10的经取代或未经取代的烷氧基、碳数6~15的经取代或未经取代的芳基、碳数3~12的经取代或未经取代的杂芳基。
R11与R12、R12与R13、R13与R14、R15与R16、R16与R17、R17与R18亦可相互键结而形成环状结构。环状结构可为芳香环,亦可为脂肪环,而且,可为含有杂原子的结构,进一步亦可为环状结构为2环以上的缩合环。作为此处所提及的杂原子,优选为选自由氮原子、氧原子及硫原子所组成的群中的杂原子。作为所形成的环状结构的例,可列举:苯环、萘环、吡啶环、哒嗪环、嘧啶环、吡嗪环、吡咯环、咪唑环、吡唑环、三唑环、咪唑啉环、恶唑啉环、异恶唑啉环、噻唑环、异噻唑环、环己二烯环、环己烯环、环戊烯环、环庚三烯环、环庚二烯环、环庚烯环等。
通式(2)所表示的基优选为下述通式(3)~(7)中任一个所表示的基。
[化9-1]
通式(3)
通式(4)
通式(5)
[化9-2]
通式(6)
通式(7)
在通式(3)~(7)中,L14~L18表示单键、或者经取代或未经取代的伸芳基,*表示通式(1)中的与杂环的键结部位。关于L14~L18为伸芳基时的伸芳基的说明优选的范围,可参照L1为伸芳基时的伸芳基的说明优选的范围。
R31~R38、R3a、R3b、R41~R48、R4a、R51~R58、R61~R68、R71~R78分别独立表示氢原子或取代基。关于此处所提及的取代基的说明与优选的范围,可参照所述R1~R7等可采取的取代基的说明与优选的范围。而且,R31~R38、R3a、R3b、R41~R48、R4a、R51~R58、R61~R68、R71~R78亦优选为分别独立为所述通式(3)~(7)中任一个所表示的基。通式(3)~(7)中的取代基的数量并无特别限制。亦优选为全部未经取代(即氢原子)的情形。而且,R3a及R3b优选为经取代或未经取代的烷基、经取代或未经取代的芳基,更优选为碳数1~6的经取代或未经取代的烷基、碳数6~18的经取代或芳基。而且,在通式(3)~(7)各个中取代基为2个以上的情形时,该等取代基可相同亦可不同。在通式(3)~(7)中存在取代基的情形时,该取代基若为通式(3),则优选为R32~R37、R3a、R3b中的任一个,更优选为R3a及R3b中的至少一个,若为通式(4),则优选为R42~R47、R4a中的任一个,若为通式(5),则优选为R52~R57中的任一个,若为通式(6),则优选为R62~R67中的任一个,若为通式(7),则优选为R72~R77中的任一个。
在通式(3)~(7)中,R31与R32、R32与R33、R33与R34、R35与R36、R36与R37、R37与R38、R3a与R3b、R41与R42、R42与R43、R43与R44、R45与R46、R46与R47、R47与R48、R51与R52、R52与R53、R53与R54、R55与R56、R56与R57、R57与R58、R61与R62、R62与R63、R63与R64、R65与R66、R66与R67、R67与R68、R71与R72、R72与R73、R73与R74、R75与R76、R76与R77、R77与R78亦可相互键结而形成环状结构。关于环状结构的说明与优选的例,可参照在所述通式(2)中,R11与R12等相互键结而形成的环状结构的说明与优选的例。
在通式(1)中存在的通式(2)所表示的基优选为全部为通式(3)~(7)中任一个所表示的基。例如,可优选地例示全部为通式(5)所表示的基的情形。
以下,例示通式(1)所表示的化合物的具体例。其中,可用于本发明的通式(1)所表示的化合物不应由该等具体例而限定性地解释。另外,在下述式中,Me表示甲基。
[化10]
通式(1)所表示的化合物的分子量例如在意欲将含有通式(1)所表示的化合物的有机层利用蒸镀法制膜而利用之情形时,优选为1500以下,更优选为1200以下,进一步优选为1000以下,进一步更优选为800以下。分子量的下限值是通式(1)所表示的最小化合物的分子量。
通式(1)所表示的化合物不论分子量多少均可利用涂布法而成膜。只要使用涂布法,即便为分子量相对较大的化合物亦可成膜。
亦可考虑应用本发明,而将在分子内含有复数个通式(1)所表示的结构的化合物用作发光材料。
例如,考虑预先使聚合性基存在于通式(1)所表示的结构中,而将通过使该聚合性基聚合而获得的聚合物用作发光材料。具体而言,考虑准备在通式(1)的R1~R7中的任一个含有聚合性官能基的单体,使其单独聚合,或与其他单体一併共聚合,由此获得具有重复单元的聚合物,而将该聚合物用作发光材料。或者,亦考虑使具有通式(1)所表示的结构的化合物彼此反应,由此获得二聚物或三聚物,而将该等用作发光材料。
作为具有含有通式(1)所表示的结构的重复单元的聚合物的例,可列举含有下述通式(8)或(9)所表示的结构的聚合物。
[化11]
在通式(8)或(9)中,Q表示含有通式(1)所表示的结构的基,L1及L2表示连结基。连结基的碳数优选为0~20,更优选为1~15,进一步优选为2~10。连结基优选为具有-X11-L11-所表示的结构的连结基。此处,X11表示氧原子或硫原子,优选为氧原子。L11表示连结基,优选为经取代或未经取代的伸烷基、或者经取代或未经取代的伸芳基,更优选为碳数1~10的经取代或未经取代的伸烷基、或者经取代或未经取代的伸苯基。
在通式(8)或(9)中,R101、R102、R103及R104分别独立表示取代基。优选为碳数1~6的经取代或未经取代的烷基、碳数1~6的经取代或未经取代的烷氧基、卤素原子,更优选为碳数1~3的未经取代的烷基、碳数1~3的未经取代的烷氧基、氟原子、氯原子,进一步优选为碳数1~3的未经取代的烷基、碳数1~3的未经取代的烷氧基。
L1及L2所表示的连结基可与如下键结:构成Q的通式(1)的结构的R1~R7中的任一个,通式(2)的结构的R11~R18中的任一个,通式(3)的结构的R31~R38、R3a、R3b中的任一个,通式(4)的结构的R41~R48、R4a中的任一个,通式(5)的结构的R51~R58中的任一个,通式(6)的结构的R61~R68中的任一个,通式(7)的结构的R71~R78中的任一个。亦可为对一个Q连结2个以上的连结基而形成交联结构或网状结构。
作为重复单元的具体的结构例,可列举下述式(10)~(13)所表示的结构。
[化12]
具有含有该等式(10)~(13)的重复单元的聚合物可利用如下方式合成:预先对通式(1)的结构的R1~R7中的任一个导入羟基,将其作为连结子使下述化合物反应并导入聚合性基,使该聚合性基聚合。
[化13]
在分子内包含通式(1)所表示结构的聚合物可为仅包含具有通式(1)所表示的结构的重复单元的聚合物,亦可为包含具有除此以外的结构的重复单元的聚合物。而且,聚合物中所含有的具有通式(1)所表示的结构的重复单元可为单一种,亦可为2种以上。作为不具有通式(1)所表示的结构的重复单元,可列举通常的由共聚合所使用的单体衍生的重复单元。例如可列举由具有乙烯、苯乙烯等乙烯性不饱和键的单体衍生的重复单元。
[通式(1')所表示的化合物]
通式(1')所表示的化合物为新颖化合物。
[化14]
通式(1')
在通式(1')中,Y1'及Y2'分别独立表示N或C(R7'),R1'~R7'分别独立表示氢原子或取代基。其中,R1'及R2'中的至少一个与R5'及R6'中的至少一个分别独立表示下述通式(2')所表示的基。
[化15]
通式(2')
在通式(2')中,Z'表示连结链长为1原子的2价连结基。L1'表示单键、或者经取代或未经取代的伸芳基,*表示通式(1)中的与杂环的键结部位。R11'~R18'分别独立表示氢原子或取代基。R11'与R12'、R12'与R13'、R13'与R14'、R15'与R16'、R16'与R17'、R17'与R18'亦可分别键结而形成环状结构。
关于通式(1')中的Y1'、Y2'R1'~R7'与Z'、L1'、与R11'~R18'的说明与优选的范围,可参照通式(1)所表示的化合物的说明。
[通式(1')所表示的化合物的合成方法]
通式(1')所表示的化合物可通过组合已知的反应而合成。例如,通式(1')的R2'与R5'为通式(2')所表示的基的化合物可通过使以下2种化合物反应而合成。
[化16]
关于所述反应式中的R1'、R3'、R4'、R6'、R11'~R18'的说明,可参照通式(1')中的相应的记载。X表示卤素原子,可列举氟原子、氯原子、溴原子、碘原子,优选为氯原子、溴原子、碘原子。
所述反应是应用乌尔曼(Ul lmann)反应或布赫瓦尔德-哈特维希(Buchwald-Hartwig)反应等公知的反应,可适当选择公知的反应条件。关于所述反应的详情,可参考下述合成例。而且,通式(1')所表示的化合物亦可通过组合其他公知的合成反应而合成。
而且,中间物的联吡啶的二溴物及胺衍生物可作为市售品而获取,亦可使用合成品。联吡啶的二溴物例如可利用Tetrahedron Letters,36(36),6471-4;1995记载的方法而合成,胺衍生物可利用Journal of Organic Chemistry,76(9),2976-2993;2011记载的方法而合成。
[有机发光元件]
本发明的通式(1)所表示的化合物作为有机发光元件的发光材料较为有用。因此,本发明的通式(1)所表示的化合物可在有机发光元件的发光层有效地用作发光材料。在通式(1)所表示的化合物中含有放射延迟荧光的延迟荧光材料(延迟荧光体)。即,本发明亦提供如下发明:具有通式(1)所表示的结构的延迟荧光体的发明、将通式(1)所表示的化合物用作延迟荧光体的发明、及使用通式(1)所表示的化合物使延迟荧光发光的方法的发明。将此种化合物用作发光材料的有机发光元件具有放射延迟荧光、发光效率较高的特征。以有机电致发光元件为例对其原理进行如下说明。
在有机电致发光元件中,由正负两电极对发光材料注入载子,产生激发状态的发光材料,并使其发光。通常,在为载子注入型有机电致发光元件的情形时,所生成的激发子中,激发单重态所激发为25%,剩余的75%是受激发三重态激发。因此,利用作为来自激发三重态的发光的磷光的能量的利用效率较高。然而,由于激发三重态寿命较长,故而会引起因与激发状态的饱和或激发三重态的激发子的相互作用而导致的能量失去活性,通常磷光的量子产率不高的情况较多。另一方面,延迟荧光材料是利用系间跨越等而跃迁成激发三重态能量后,利用三重态-三重态烟灭或热量的吸收,而向激发单重态逆系间跨越并放射荧光。认为在有机电致发光元件中,利用热量的吸收的热活性化型的延迟荧光材料尤其有用。在将延迟荧光材料有机电致发光元件的情形时,激发单重态的激发子通常放射荧光。另一方面,激发三重态的激发子是吸收装置发出的热而向激发单重态系间跨越并放射荧光。此时,由于是来自激发单重态的发光,故而是与荧光相同波长的发光,但是利用自激发三重态向激发单重态的逆系间跨越,而使产生的光的寿命(发光寿命)变得较通常的荧光或磷光更长,因此以较该等延迟的荧光的形式而观察到。可将其定义为延迟荧光。只要使用此种热活性化型激发子移动机构,则通过在载子注入后经由热量的吸收,而可使通常仅产生25%的激发单重态的化合物的比率提升至25%以上。只要使用即便为未达100℃的较低温度亦可发出较强的荧光及延迟荧光的化合物,则利用装置的热而充分地产生自激发三重态向激发单重态的系间跨越从而放射延迟荧光,故而可使发光效率飞跃性地提升。
通过将本发明的通式(1)所表示的化合物用作发光层的发光材料,而可提供有机光致发光元件(有机PL元件)或有机电致发光元件(有机EL元件)等优异的有机发光元件。此时,本发明的通式(1)所表示的化合物作为所谓的参杂剂,亦可为具有复数发光层所含有的其他发光材料的发光的功能的化合物。即,发光层所含有的本发明的通式(1)所表示的化合物亦可为具有发光层所含有的主体材料的最低激发单重态能阶与发光层所含有的其他发光材料的最低激发单重态能阶之间的最低激发单重态能阶的化合物。
有机光致发光元件具有在基板上形成至少发光层的结构。而且,有机电致发光元件具有至少阳极、阴极、及阳极与阴极之间形成有机层的结构。有机层是至少含有发光层的有机层,可仅包含发光层,亦可除发光层以外具有1层以上的有机层。作为此种其他有机层,可列举电洞传输层、电洞注入层、电子阻止层、电洞阻止层、电子注入层、电子传输层、激发子阻止层等。电洞传输层亦可为具有电洞注入功能的电洞注入传输层,电子传输层亦可为具有电子注入功能的电子注入传输层。将具体的有机电致发光元件的结构例示于图1。在图1中,1表示基板、2表示阳极、3表示电洞注入层、4表示电洞传输层、5表示发光层、6表示电子传输层、7表示阴极。
以下,对有机电致发光元件的各构件及各层进行说明。另外,基板与发光层的说明亦符合有机光致发光元件的基板与发光层。
(基板)
本发明的有机电致发光元件优选为受基板支持。关于该基板并无特别限制,只要为自先前以来有机电致发光元件的惯用基板即可,例如可使用包含玻璃、透明塑料、石英、硅等的基板。
(阳极)
作为有机电致发光元件的阳极,可优选地使用将功函数较大的(4eV以上)金属、合金、导电性化合物及该等的混合物作为电极材料的阳极。作为此种电极材料的具体例,可列举Au等金属、CuI、氧化铟锡(ITO)、SnO2、ZnO等导电性透明材料。而且,亦可使用可利用IDIXO(In2O3-ZnO)等非晶质制作透明导电膜的材料。阳极是可将该等电极材料利用蒸镀或溅镀等方法而形成薄膜,利用光微影法而形成所需的形状的图案,或者亦可为在不太需要图案精度的情形时(100μm以上左右),在所述电极材料的蒸镀或溅镀时经由所需的形状的遮罩而形成图案。或者,在使用如有机导电性化合物般可涂布的材料的情形时,亦可使用印刷方式、涂布方式等湿式成膜法。在由该阳极提取发光的情形时,较理想为将透过率设为大于10%,又,作为阳极的薄片电阻优选为数百Ω/□以下。进一步膜厚亦根据材料来选定,通常在10~1000nm、优选为在10~200nm的范围选择。
(阴极)
另一方面,作为阴极,可使用将功函数较小的(4eV以下)金属(称为电子注入性金属)、合金、导电性化合物及该等的混合物作为电极材料。作为此种电极材料的具体例,可列举钠、钠-钾合金、镁、锂、镁/铜混合物、镁/银混合物、镁/铝混合物、镁/铟混合物、铝/氧化铝(Al2O3)混合物、铟、锂/铝混合物、稀土类金属等。该等之中,就电子注入性及对氧化等的耐久性的方面而言,较佳为电子注入性金属与功函数的值大于其的稳定的金属即第二金属的混合物,例如镁/银混合物、镁/铝混合物、镁/铟混合物、铝/氧化铝(Al2O3)混合物、锂/铝混合物、铝等。阴极可通过将该等电极材料利用蒸镀或溅镀等方法而形成薄膜而制作。而且,作为阴极的薄片电阻优选为数百Ω/□以下,膜厚通常在10nm~5μm、优选为在50~200nm的范围内选择。另外,为了使发出的光透过,有机电致发光元件的阳极或阴极中任一个只要为透明或半透明,则会使发光亮度提升而合适。
而且,通过将阳极的说明所列举的导电性透明材料用于阴极,而可制作透明或半透明的阴极,通过应用其而可制作阳极与阴极两者具有透过性的元件。
(发光层)
发光层是通过使自阳极及阴极各个注入的电洞及电子再次键结而产生激发子后发光的层,可将发光材料单独用于发光层,优选为含有发光材料与主体材料。作为发光材料,可使用选自通式(1)所表示的本发明的化合物群中的1种或2种以上。为了使本发明的有机电致发光元件及有机光致发光元件体现较高的发光效率,将由发光材料产生的单重态激发子及三重态激发子封入发光材料中较为重要。因此,优选为在发光层中除发光材料以外亦使用主体材料。作为主体材料,可使用激发单重态能量、激发三重态能量中的至少任一个具有较本发明的发光材料更高值的有机化合物。其结果,可将由本发明的发光材料产生的单重态激发子及三重态激发子封入本发明的发光材料的分子中,可充分地提升其发光效率。但是,由于亦有即便无法充分地封入单重态激发子及三重态激发子,亦可获得较高的发光效率的情形,故而只要为可实现较高的发光效率的主体材料则无特别限制而可用于本发明。在本发明的有机发光元件或有机电致发光元件中,发光是由发光层所含有的本发明的发光材料产生。该发光包含荧光发光及延迟荧光发光两者。但是,亦可为发光的一部分或部分性地来自主体材料的发光。
在使用主体材料的情形时,作为发光材料的本发明的化合物的发光层中所含有的量优选为0.1重量%以上,更优选为1重量%以上,而且,优选为50重量%以下,更优选为20重量%以下,进一步优选为10重量%以下。
作为发光层中的主体材料,优选为具有电洞传输能、电子传输能,且可防止发光的长波长化,而且具有较高的玻璃转移温度的有机化合物。
(注入层)
所谓注入层,是为了降低驱动电压或提升发光亮度而设置在电极与有机层间的层,且有电洞注入层与电子注入层,亦可存在于阳极与发光层或电洞传输层之间、及阴极与发光层或电子传输层之间。注入层可视需要而设置。
(阻止层)
阻止层是可阻止存在于发光层中的电荷(电子或电洞)及/或激发子向发光层外扩散的层。电子阻止层可配置于发光层及电洞传输层之间,而阻止电子朝向电洞传输层的方向通过发光层。同样地,电洞阻止层可配置于发光层及电子传输层之间,而阻止电洞朝向电子传输层的方向通过发光层。而且,阻止层亦可用于阻止激发子扩散至发光层的外侧。即,电子阻止层、电洞阻止层分别亦可兼具作为激发子阻止层的功能。本说明书中所提及的电子阻止层或激发子阻止层是以包含以一层具有电子阻止层及激发子阻止层的功能的层的意思而使用。
(电洞阻止层)
所谓电洞阻止层,在广义上具有电子传输层的功能。电洞阻止层具有传输电子,并且阻止电洞到达电子传输层的作用,由此,可提升发光层中的电子与电洞的再键结机率。作为电洞阻止层的材料,视需要可使用下述电子传输层的材料。
(电子阻止层)
所谓电子阻止层,在广义上具有传输电洞的功能。电子阻止层具有传输电洞,并且阻止电子到达电洞传输层的作用,由此,可提升发光层中的电子与电洞再键结的机率。
(激发子阻止层)
所谓激发子阻止层,是用于阻止发光层内通过使电洞与电子再键结而产生的激发子扩散至电荷传输层的层,可通过插入本层而将激发子有效地封入发光层内,可提升元件的发光效率。激发子阻止层是邻接于发光层并可插入阳极侧、阴极侧中的任一个,亦可同时插入至两者。即,在阳极侧具有激发子阻止层的情形时,可在电洞传输层与发光层之间邻接于发光层而插入该层,在插入阴极侧的情形时,可在发光层与阴极之间邻接于发光层而插入该层。而且,可在阳极与邻接于发光层的阳极侧的激发子阻止层之间具有电洞注入层或电子阻止层等,可在阴极与邻接于发光层的阴极侧的激发子阻止层之间具有电子注入层、电子传输层、电洞阻止层等。在配置阻止层的情形时,优选为用作阻止层的材料的激发单重态能量及激发三重态能量中的至少一个较发光材料的激发单重态能量及激发三重态能量更高。
(电洞传输层)
所谓电洞传输层,是含有具有传输电洞的功能的电洞传输材料,电洞传输层可设置单层或复数层。
作为电洞传输材料,是具有电洞的注入或传输、电子的障壁性中的任一个,亦可为有机物、无机物中的任一个。作为可使用的公知的电洞传输材料,例如可列举:三唑衍生物、恶二唑衍生物、咪唑衍生物、咔唑衍生物、吲哚咔唑衍生物、聚芳基烷烃衍生物、吡唑啉衍生物及吡唑啉酮衍生物、苯二胺衍生物、芳基胺衍生物、胺基取代查尔酮衍生物、恶唑啉衍生物、苯乙烯蒽衍生物、茀酮衍生物、腙衍生物、茋衍生物、硅氮烷衍生物、苯胺系共聚物、而且导电性高分子低聚物、尤其是噻吩低聚物等,优选为使用卟啉化合物、芳香族三级胺化合物及苯乙烯胺化合物,更优选为使用芳香族三级胺化合物。
(电子传输层)
所谓电子传输层,是含有具有电子的功能的材料,电子传输层可设置单层或复数层。
作为电子传输材料(有时亦兼作电洞阻止材料),只要具有将由阴极注入的电子传输至发光层的功能即可。作为可使用的电子传输层,例如可列举:硝基取代茀衍生物、二苯基苯醌衍生物、噻喃二氧化物衍生物、碳二醯亞胺、亞茀基甲烷衍生物、蒽醌二甲烷及蒽酮衍生物、恶二唑衍生物等。进一步,在所述恶二唑衍生物中,将恶二唑环的氧原子取代为硫原子而成的噻二唑衍生物、作为拉电子基而所知的具有喹恶啉环的喹恶啉衍生物亦可用作电子传输材料。进一步,亦可使用使用将该等材料导入至高分子链、或将该等材料作为高分子的主链的高分子材料。
在制作有机电致发光元件时,将通式(1)所表示的化合物不仅用于发光层,亦可用于发光层以外的层。此时,用于发光层的通式(1)所表示的化合物、与用于发光层以外的层的通式(1)所表示的化合物可相同亦可不同。例如,亦可在所述注入层、阻止层、电洞阻止层、电子阻止层、激发子阻止层、电洞传输层、电子传输层等使用通式(1)所表示的化合物。该等层的制膜方法并无特别限定,利用干式制程、湿式制程中的任一个均可制作。
以下,具体例示可用于有机电致发光元件的优选的材料。其中,可用于本发明的材料并不由以下的例示化合物而限定性地解释。而且,即便作为具有特定功能的材料而例示的化合物亦可转用作具有其他功能的材料。另外,以下的例示化合物的结构式中的R、R1~R10分别独立表示氢原子或取代基。N表示3~5的整数。
首先,列举亦可用作发光层的主体材料的优选的化合物。
[化17]
[化18]
[化19]
[化20]
[化21]
其次,可列举可用作电洞注入材料的优选的化合物例。
[化22]
其次,可列举可用作电洞传输材料的优选的化合物例。
[化23]
[化24]
[化25]
[化26]
[化27]
[化28]
其次,可列举可用作电子阻止材料的化合物例。
[化29]
其次,可列举可用作电洞阻止材料的化合物例。
[化30]
其次,可列举可用作电子传输材料的化合物例。
[化31]
[化32]
[化33]
其次,可列举可用作电子注入材料的优选的化合物例。
[化34]
进一步,可列举作为可添加的材料的优选的化合物例。例如,考虑作为稳定化材料而添加的化合物等。
[化35]
根据上述方法制作而成的有机电致发光元件是通过在所获得的元件的阳极与阴极之间施加电场而发光。此时,只要为利用激发单重态能量的发光,则与其能阶相应的波长的光被确认为荧光发光及延迟荧光发光。而且,只要为利用激发三重态能量的发光,则与其能阶相应的波长被确认为磷光。通常的荧光由于较延迟荧光发光而言荧光寿命较短,故而发光寿命可按荧光与延迟荧光来区分。
另一方面,关于磷光,如本发明的化合物的通常的有机化合物由于激发三重态能量不稳定而转换为热等,寿命较短而立即失去活性,故而在室温下几乎无法观测。为了测定通常的有机化合物的激发三重态能量,而可通过观测极低温的条件下的发光而测定。
本发明的有机电致发光元件亦可应用于单一的元件、包含呈阵列状地配置的结构的元件、阳极与阴极呈X-Y矩阵状地配置的结构中的任一个。根据本发明,通过在发光层含有通式(1)所表示的化合物,而可获得发光效率得到大幅改善的有机发光元件。本发明的有机电致发光元件等有机发光元件进一步可应用于各种用途。例如,可使用本发明的有机电致发光元件来制造有机电致发光显示装置,关于详细情况,可参照时任静士、安达千波矢、村田英幸共著「有机EL显示器」(Ohmsha公司)。而且,尤其是本发明的有机电致发光元件亦可应用于需要较大的有机电致发光照明或背光装置。
[实施例]
以下,列举合成例及实施例对本发明的特征进行更具体的说明。以下所示的材料、处理内容、处理顺序等只要不脱离本发明的主旨则可适当变更。因此,本发明的范围并不由以下所示的具体例而限定性地解释。
(合成例1)化合物1的合成
[化36]
化合物1
将4,4'-二溴联吡啶(3.14g,10mmol)、啡恶嗪(4.40g,24mmol)、双(二亚苄基丙酮)钯(Pd(dba)2:0.46g,0.8mmol)、第三丁醇钠(NaOt-Bu:2.88g,30mmol)、及三(第三丁基)鏻四氟硼酸盐(tBu3P·HBF4:0.116g,0.4mmol)加入至脱水甲苯50ml,一面将内温保持为100℃一面加热24小时。在放置冷却后的反应液中加入水200ml,进行分液。过程中浓缩有机层,将浓缩物利用SiO2管柱层析法,并将氯仿:己烷=1:1的混合溶剂用于展开溶剂而精制。由此,以产量3.10g、产率60%获得化合物1。进一步,将该化合物1的精制物在320℃、1Pa以下的条件下进行升华精制。
1H NMR(600MHz,CDCl3)d 8.9-8.5(2H),7.8-7.5(2H)、7.4-6.8(18H);MS(70eV,EI)m/z=518(M+)
(合成例2)化合物2的合成
[化37]
化合物2
使用二甲基吖啶(5.02g,24mmol)代替啡恶嗪(4.40g,24mmol),除此以外,进行与合成例1相同的合成步骤及利用管柱层析法的精制,以产量2.28g、产率40%获得化合物2。其后,将化合物2的精制物在320℃、1Pa以下的条件下进行升华精制。
1H NMR(600MHz,CDCl3)d 8.9-8.6(2H),7.9-7.5(2H)、7.4-6.5(18H)、1.5-1.9(12H);MS(70eV,EI)m/z=570(M+)、555(M+-15)
(合成例3)化合物3的合成
[化38]
化合物3
使用4,4'-二溴联吡啶(1.57g,5mmol)与二苯基吖啶(4.00g,12mmol)代替4,4'-二溴联吡啶(3.14g,10mmol)与啡恶嗪(4.40g,24mmol),除此以外,进行与合成例1相同的合成步骤及利用管柱层析法的精制,以产量2.25g,产率55%获得化合物3。其后,将化合物3的精制物在320℃、1Pa以下的条件进行升华精制。
1H NMR(600MHz,CDCl3)d 8.9-8.6(2H),7.9-7.5(2H)、7.4-6.5(38H);MS(70eV,EI)m/z=819(M+)
(合成例4)化合物4的合成
[化39]
化合物4
使用5,5'-二溴联吡啶(3.14g,10mmol)代替4,4'-二溴联吡啶(3.14g,10mmol),除此以外,进行与合成例1相同的合成步骤及利用管柱层析法的精制,以产量2.33g、产率45%获得化合物4。其后,将化合物4的精制物在320℃、1Pa以下的条件进行升华精制。
1H NMR(600MHz,CDCl3)d 8.6-8.1(2H),8.0-7.6(2H)、7.4-6.5(18H);MS(70eV,EI)m/z=518(M+)
(合成例5)化合物5的合成
[化40]
化合物5
使用5,5'-二溴联吡啶(3.14g,10mmol)与二甲基吖啶(5.02g,24mmol)代替4,4'-二溴联吡啶(3.14g,10mmol)与啡恶嗪(4.40g,24mmol),除此以外,进行与合成例1相同的合成步骤及利用管柱层析法的精制,以产量1.71g、产率30%获得化合物5。其后,将化合物5的精制物在320℃、1Pa以下的条件进行升华精制。
1H NMR(600MHz,CDCl3)d 8.6-8.1(2H),8.0-7.6(2H)、7.4-6.5(18H)、1.5-1.9(12H);MS(70eV,EI)m/z=570(M+)、555(M+-15)
(合成例6)化合物6的合成
[化41]
化合物6
使用5,5'-二溴联吡啶(1.57g,5mmol)与二苯基吖啶(4.00g,12mmol)代替4,4'-二溴联吡啶(3.14g,10mmol)与啡恶嗪(4.40g,24mmol),除此以外,进行与合成例1相同的合成步骤及利用管柱层析法的精制,以产量1.97g、产率48%获得化合物6。其后,将化合物6的精制物在320℃、1Pa以下的条件进行升华精制。
1H NMR(600MHz,CDCl3)d 8.6-8.1(2H),8.0-7.5(2H)、7.4-6.5(38H);MS(70eV,EI)m/z=819(M+)
(比较合成例1)比较化合物1的合成
[化42]
比较化合物1
使用5,5'-二溴联吡啶(3.14g,10mmol)与二苯基胺(4.06g,24mmol)代替4,4'-二溴联吡啶(3.14g,10mmol)与啡恶嗪(4.40g,24mmol),除此以外,进行与合成例1相同的合成步骤及利用管柱层析法的精制,以产量4.91g、产率80%获得比较化合物1。其后,将比较化合物1的精制物在320℃、1Pa以下的条件下进行升华精制。
1H NMR(600MHz,CDCl3)d 8.5-8.1(2H),8.0-7.6(2H)、7.4-6.5(22H);MS(70eV,EI)m/z=490(M+)
(实施例1)化合物1的甲苯溶液的制备与评价
在Ar气体氛围的手套箱中制备化合物1的甲苯溶液(浓度10-5mol/L)。
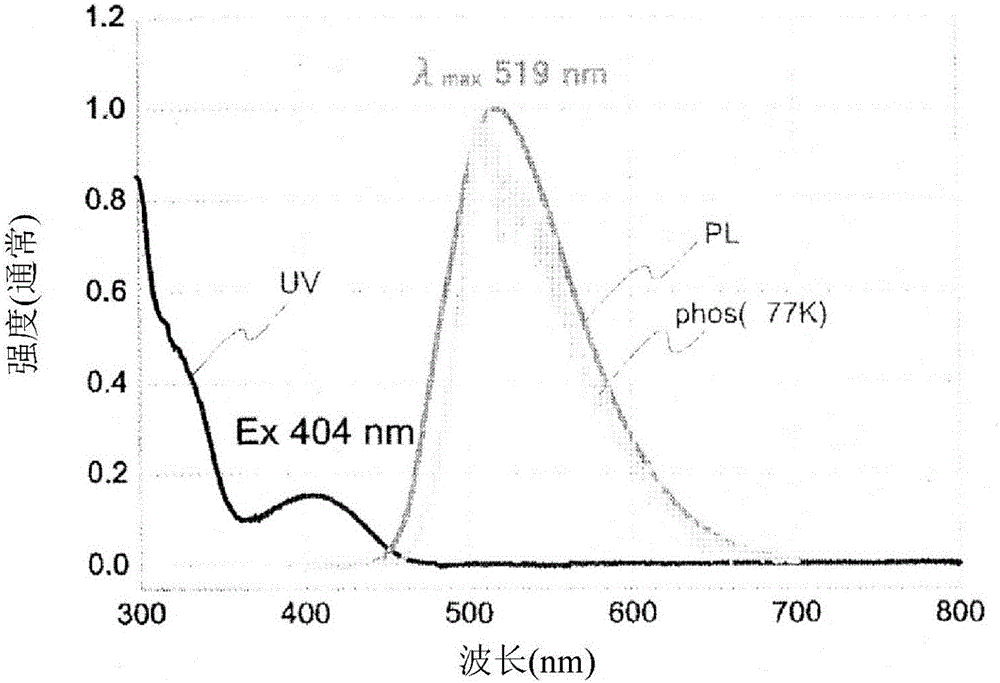
对化合物1的甲苯溶液测定利用337nm激发光的发光光谱,进一步,在空气中及利用通入氮气而进行氮气置换后测定光致发光量子效率。测定出的发光光谱是荧光光谱(PL)与磷光光谱(phos)。将该等光谱一并示于图2。光致发光量子效率在空气中为18%、在氮气取代后为88%。
而且,对化合物1的甲苯溶液在空气中及氮取代后测定暂态衰减曲线。将测定的暂态衰减曲线示于图3。该暂态衰减曲线是表示对化合物照射激发光而使发光强度失去活性的过程进行测定而得的发光寿命测定结果。通常的一成分的发光(荧光或磷光)是发光强度依单一指数函数而衰减。其是指在曲线图的纵轴为半对数的情形时,为直线性地衰减。图3所示的化合物1的暂态衰减曲线是在观测初期观测到此种直线性成分(荧光),但在数μ秒之后出现自直线性脱离的成分。此是延迟成分的发光,且与初期成分相加的信号成为在长时间侧端部延伸的缓和的曲线。通过如此般测定发光寿命,而确认化合物1是除荧光成分以外亦包含延迟成分的发光体。即时荧光的发光寿命τ1在空气中为0.00636ns、在氮气置换后为0.0192μs。延迟荧光的发光寿命τ2在氮气取代后为2.54μs。
(实施例2)化合物4的薄膜型有机光致发光元件的制备与评价
在石英基板上利用真空蒸镀法,在真空度10-4Pa以下的条件下将化合物4与mCP自不同的蒸镀源蒸镀,将化合物4的浓度为6.0重量%的薄膜形成为100nm的厚度而作为薄膜型有机光致发光元件。
对化合物4的有机光致发光元件,测定利用337nm激发光的荧光光谱及暂态衰减曲线。将测定出的荧光光谱示于图4,将暂态衰减曲线示于图5。光致发光量子效率在空气中为47%、在氮气取代后为50%。而且,化合物4的薄膜型有机光致发光元件的发光寿命是即时荧光τ1为59.6ns、延迟荧光τ2为2.88μs。
(比较例1)比较化合物1的薄膜型有机光致发光元件的制备与评价
使用比较化合物1代替化合物4,除此以外,与实施例2同样地制作薄膜型有机光致发光元件。
对比较化合物1的有机光致发光元件测定利用337nm激发光的荧光光谱及暂态衰减曲线。将测定出的荧光光谱示于图6,将暂态衰减曲线示于图7。在荧光光谱中除422nm以外,在550nm亦确认到波峰。光致发光量子效率在空气中为18%、在氮气取代后为19%。比较化合物1的薄膜型有机光致发光元件的发光寿命是即时荧光τ1为3.06ns,未观测到延迟荧光。
(实施例3)化合物1的有机电致发光元件的制备与评价
在膜厚100nm的形成铟·锡氧化物(ITO)的阳极的玻璃基板上,利用真空蒸镀法在真空度10-3Pa以下积层各薄膜。首先,在ITO上将HAT-CN形成为10nm的厚度,将Tris-PCz形成为30nm的厚度。其次,化合物1与mCBP自不同的蒸镀源中共蒸镀,形成30nm的厚度的层作为发光层。此时,将化合物1的浓度设为6.0重量%。其次,将T2T形成为10nm的厚度,将Bpy-TP2形成为40nm的厚度,进一步,真空蒸镀氟化锂(LiF)0.8nm,其次,通过将铝(Al)蒸镀为100的nm的厚度而形成阴极而作为有机电致发光元件。
将制造出的有机电致发光元件的发光光谱示于图8,将电压-电流密度特性示于图9,将电流密度-外部量子效率特性示于图10。将化合物1用作发光材料的有机电致发光元件达成12.7%的较高的外部量子效率。假设,使用发光量子效率为100%的荧光材料试制取得平衡的理想的有机电致发光元件,只要光提取效率为20~30%,则荧光发光的外部量子效率成为5~7.5%。该值通常被作为使用荧光材料的有机电致发光元件的外部量子效率的理论极限值。使用化合物1的本发明的有机电致发光元件在实现理论极限值的较高的外部量子效率的方面极为优异。
所述实施例中使用的化合物均为放射延迟荧光的延迟荧光体。通式(1)所表示的化合物均发光量子效率较高,作为发光材料显示优异的特性。相对于此,比较化合物1与实施例的化合物相比较发光量子效率较低,亦未观测到延迟荧光。推测该情况是由于以作为供体部的胺基在苯环彼此之间无桥接结构,未形成环所致。
[化43]
[产业上的可利用性]
本发明的化合物作为发光材料较为有用。因此,本发明的化合物可有效地用作有机电致发光元件等有机发光元件用的发光材料。在本发明的化合物之中,由于亦含有放射延迟荧光的化合物,故而亦可提供发光效率较高的有机发光元件。因此,本发明的产业上的可利用性较高。
【符号说明】
1 基板
2 阳极
3 电洞注入层
4 电洞传输层
5 发光层
5 电子传输层
7 阴极
- 还没有人留言评论。精彩留言会获得点赞!