肿瘤坏死因子受体相关泛支架和信号蛋白及其抑制剂在治疗心肌肥厚中的应用的制作方法
本发明属于基因的功能与应用领域,涉及肿瘤坏死因子受体相关泛支架和信号蛋白(TNF-R-AssociatedUbiquitousScaffoldingAndSignalingProtein,TRUSS)作为药物靶标在筛选治疗心肌肥厚的药物中的应用,以及TRUSS的的抑制剂在制备治疗心肌肥厚的药物中应用。
背景技术:
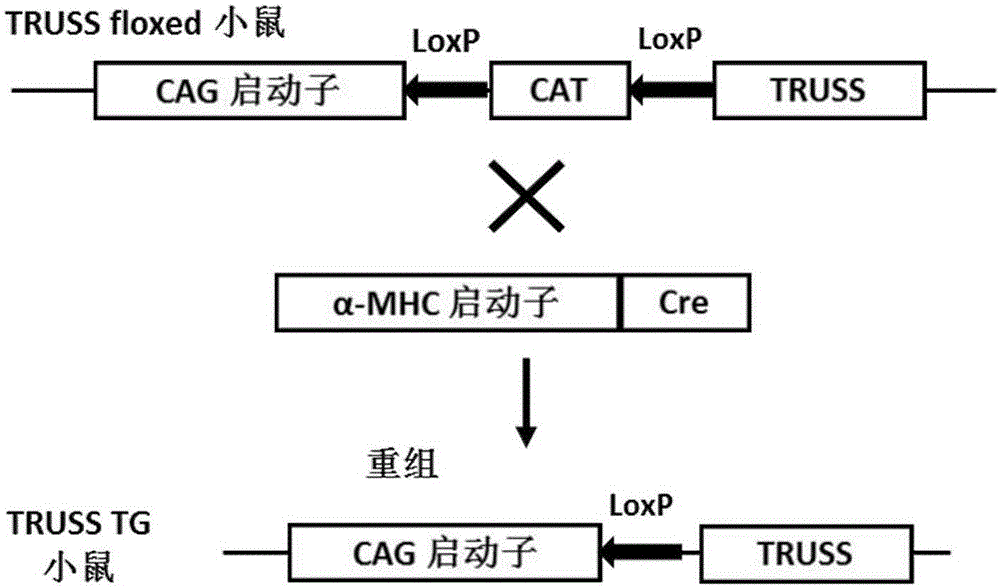
:心肌肥厚是指心脏在压力负荷或容量负荷刺激下而发生的心脏体积及质量增加,其主要特征为心肌细胞体积增大,重量增加和细胞外基质增多[1]。心肌肥厚中心肌细胞由于蛋白合成增加,引起体积增大、直径或长度增加,肌节数量增多。同时,心肌细胞表型也由成熟型向胚胎型转化,并伴随心肌间质细胞增殖和心脏细胞外基质改建,引起心肌重构[2]。心肌肥厚作为一种代偿机制,初期有利于维持正常心脏功能,而长期持续刺激可引起失代偿,从而引起扩张型心肌病、心力衰竭、甚至猝死[3]。临床上许多心脏疾病可以引起心肌肥厚,常见病因包括原发性或继发性高血压病、心脏瓣膜病、冠心病,以及先天性心脏病等,研究表明随着心脏左室肥厚的发生发展,心肌缺血、室性心律失常、心力衰竭、猝死等心血管事件的发生率增加了6~10倍[4]。在细胞和分子水平上,心肌细胞肥大过程主要涵盖3个环节:胞外肥大信号刺激、胞内信号通路转导及核内基因转录活化[5]。但现阶段心肌肥厚的发生机制尚未完全明确,现有的研究及发现在临床实践中仍具有一定的局限性,尚不能形成真正有效的针对心肌肥厚的防治措施。因此,发现阻断心肌肥厚的特异性分子,对于进一步阐明心肌肥厚的发生发展机制,寻找防治心肌肥厚的药物靶点具有非常重要的理论和临床意义。TRUSS(TNF-R-AssociatedUbiquitousScaffoldingAndSignalingProtein),也称为TRPC4AP(TransientReceptorPotentialCationChannel,SubfamilyC,Member4-associatedProtein),分子量90.7KDa,含有797个氨基酸,其C端(包括440~797位氨基酸残基)富含亮氨酸[6]。TRUSS参与了信号通路中TNF-R1与GPCR协同的信号传导,TRUSS与TRPC4钙离子通道直接结合,调节钙内流及内质网内钙离子浓度[7]。TRUSS在多种疾病中均发挥重要作用,PodusloSE[8,9]等人证实,TRUSS基因与迟发型阿尔茨海默病相关。亦有实验证实,TRUSS作为E3泛素化连接酶可以负向调节肿瘤中原癌基因c-Myc的表达[10,11]。因此,TRUSS基因可作为一个重要的疾病治疗、干预靶点。参考文献:[1].Drazner,M.H.,Theprogressionofhypertensiveheartdisease.Circulation,2011.123(3):p.327-34.[2].GuptaS,DasB,SenS.Cardiachypertrophy:mechanismsandtherapeuticopportunities.AntioxidRedoxSignal,2007.9(6):p.623-52.[3].Bui,A.L.,T.B.HorwichandG.C.Fonarow,Epidemiologyandriskprofileofheartfailure.NatRevCardiol,2011.8(1):p.30-41.[4].Zile,M.R.,etal.,Prevalenceandsignificanceofalterationsincardiacstructureandfunctioninpatientswithheartfailureandapreservedejectionfraction.Circulation,2011.124(23):p.2491-501.[5].BalakumarP,JagadeeshG.Multifariousmolecularsignalingcascadesofcardiachypertrophy:canthemuddywatersbeclearedPharmacolRes,2010.62(5):p.365-83.[6].Soond,S.M.,etal.,TRUSS,anoveltumornecrosisfactorreceptor1scaffoldingproteinthatmediatesactivationofthetranscriptionfactorNF-kappaB.MolCellBiol,2003.23(22):p.8334-44.[7].Mace,K.E.,etal.,TRUSS,TNF-R1,andTRPCionchannelssynergisticallyreverseendoplasmicreticulumCa2+storagereductioninresponsetom1muscarinicacetylcholinereceptorsignaling.JCellPhysiol,2010.225(2):p.444-53.[8].Poduslo,S.E.,etal.,Genomescreenoflate-onsetAlzheimer'sextendedpedigreesidentifiesTRPC4APbyhaplotypeanalysis.AmJMedGenetBNeuropsychiatrGenet,2009.150B(1):p.50-5.[9].Poduslo,S.E.,R.HuangandJ.Huang,ThefrequencyoftheTRPC4APhaplotypeinAlzheimer'spatients.NeurosciLett,2009.450(3):p.344-6.[10].Jamal,A.,etal.,TheG1phaseE3ubiquitinligaseTRUSSthatgetsderegulatedinhumancancersisanovelsubstrateoftheS-phaseE3ubiquitinligaseSkp2.CellCycle,2015.14(16):p.2688-700.[11].Choi,S.H.,etal.,MycproteinisstabilizedbysuppressionofanovelE3ligasecomplexincancercells.GenesDev,2010.24(12):p.1236-41.技术实现要素:为解决临床防治心肌肥厚疾病现有技术的缺陷和不足,本发明的目的在于确定TRUSS基因的表达与心肌肥厚疾病之间的相互关系。提供一个用于治疗心肌肥厚疾病的靶基因TRUSS的新用途,进而把TRUSS基因应用于心肌肥厚疾病的治疗。本发明的目的通过下述技术方案实现:1、TRUSS基因敲除显著抑制了心肌肥厚、纤维化,改善心功能本发明选用心脏特异性α-MHC-MCM小鼠、心脏特异性TRUSS基因敲除小鼠(TRUSS-CKO)、用于构建TRUSS-CKO的条件性敲除小鼠(TRUSS-flox,TRUSS正常表达)进行试验,并将每种小鼠分成假手术组和手术组,每组10只小鼠。手术组给予主动脉弓缩窄手术,假手术组不予主动脉弓缩窄,然后通过对假手术组和手术组的各组小鼠进行心心脏心肌肥厚、纤维化及心功能的测定,研究TRUSS基因敲除对主动脉弓缩窄诱导的心肌肥厚的影响。结果表明敲除TRUSS基因显著抑制心肌肥厚、纤维化,改善心功能。2、TRUSS基因过表达显著促进了心肌肥厚及其纤维化,恶化心功能本发明选用心脏特异性TRUSS转基因小鼠和非转基因小鼠进行试验,并将每种小鼠分成假手术组和手术组,每组10只小鼠。手术组给予主动脉弓缩窄手术,假手术组不予主动脉弓缩窄,然后通过对假手术组和手术组的各组小鼠进行心心脏心肌肥厚、纤维化及心功能的测定,研究TRUSS基因过表达对主动脉弓缩窄诱导的心肌肥厚的影响。结果表明过表达TRUSS基因显著促进心肌肥厚及纤维化,恶化心功能。3、TRUSS干扰(AdshTRUSS)及过表达(AdTRUSS)腺病毒对经AngII诱导的心肌细胞肥大模型的影响本发明通过构建重组腺病毒AdshTRUSS及AdTRUSS感染SD乳鼠原代心肌细胞,予以AngII刺激构建心肌细胞肥大模型,对照组则予以PBS,经免疫荧光监测及心肌细胞表面积统计表明,在AngII刺激下TRUSS干扰病毒明显抑制心肌细胞肥大,心肌细胞表面积减小;TRUSS过表达病毒显著促进心肌细胞肥大,心肌细胞表面积增大。由上述结果可知TRUSS基因缺陷抑制了心肌肥厚、纤维化,改善心功能,促进TRUSS表达则促进心肌肥厚、纤维化,恶化心功能。本发明的研究证明了:在主动脉缩窄术造成心肌肥厚模型中,TRUSS具有促进心肌肥厚及其纤维化,恶化心功能的作用。因此,TRUSS基因可作为药物靶点,构建TRUSS基因过表达的体外细胞模型或动物模型,用于筛选预防、缓解和/或治疗心肌肥厚疾病的药物;TRUSS基因也可作为基因治疗中的靶基因,设计并制备预防、缓解和/或治疗心肌肥厚疾病的药物和/或生物学试剂,通过基因工程技术达到预防、缓解和/或治疗心肌肥厚疾病的目的。例如以TRUSS为靶基因,设计可干扰TRUSS表达的双链siRNA,通过化学方法合成以后,注射入人体通过RNA干扰的方法使TRUSS基因沉默来治疗心肌肥厚疾病;还可以设计并构建TRUSS的突变体,注射后进入细胞,竞争TRUSS原形的作用底物,从而抑制TRUSS的功能,起到治疗目的;此外,还可以以TRUSS为靶点设计小分子化合物抑制剂,利用TRUSS基因过表达的体外细胞模型或动物模型,通过筛选,发现其中能够特异性抑制TRUSS的分子,从而为心肌肥厚疾病的治疗提供新的治疗性分子。针对TRUSS的上述功能,提供TRUSS作为药物靶标在筛选保护心脏功能、预防、缓解和/或治疗心肌肥厚及抗心肌纤维化的药物中的应用。所述的应用是非诊断和非治疗的目的;所述的筛选是指筛选TRUSS的抑制剂。针对TRUSS的上述功能,提供TRUSS的抑制剂在制备保护心脏功能、预防、缓解和/或治疗心肌肥厚及抗心肌纤维化的药物中的应用。一种保护心脏功能的药物,包含TRUSS的抑制剂。一种预防、缓解和/或治疗心肌肥厚疾病的药物,包含TRUSS的抑制剂。一种抗心肌纤维化的药物,包含TRUSS的抑制剂。所述的TRUSS的抑制剂具有本领域公知的含义,其可以是能够特异抑制TRUSS对靶基因的调控作用的任何物质,可以是在细胞中特异抑制TRUSS达的物质,也可以是与TRUSS具有特异性相互作用并能减弱TRUSS作用的物质。优选为TRUSS基因的siRNA、TRUSS基因的RNA干扰载体,TRUSS的抗体及其他能够抑制TRUSS表达的抑制剂中的一种。一种筛选用于保护心脏功能和预防、缓解和/或治疗心肌肥厚疾病的药物的方法,为筛选TRUSS的抑制剂的方法,包括根据TRUSS的序列设计其反义RNA,或者将TRUSS候选物质接触,检测TRUSS的表达或作用,并选择特异抑制TRUSS表达或减弱TRUSS作用的候选物质。本发明相对于现有技术具有如下的优点及效果:(1)本发明发现TRUSS的新功能,即TRUSS具有促进心肌肥厚及其纤维化,恶化心功能的作用。(2)基于TRUSS的功能,其为研制保护心脏功能、预防、缓解和/或治疗心肌肥厚疾病的药物提供靶标。(3)TRUSS的抑制剂可用于制备保护心脏功能、预防、缓解和/或治疗心肌肥厚疾病的药物。附图说明图1是构建心脏特异性TRUSS基因敲除小鼠的打靶策略图。图2是构建心脏特异性TRUSS转基因小鼠的打靶策略图。图3是α-MHC-MCM、TRUSS-flox和TRUSS-CKO小鼠AB模型4周后HW/BW、LW/BW及HW/TL的统计柱状图,结果显示TRUSS敲除显著抑制HW/BW、LW/BW及HW/TL(*:p<0.05vsα-MHC-MCM/TRUSS-flox/TRUSS-CKOSham组,#:p<0.05vsTRUSS-floxAB组)。图4是α-MHC-MCM、TRUSS-flox和TRUSS-CKO小鼠AB模型4周(4W)后心脏表型、心脏组织HE染色及心肌细胞横截面积统计柱状图,结果显示TRUSS敲除显著抑制心肌细胞肥大(*:p<0.05vsα-MHC-MCM/TRUSS-flox/TRUSS-CKOSham组,#:p<0.05vsTRUSS-floxAB组)。图5是α-MHC-MCM、TRUSS-flox和TRUSS-CKO小鼠AB模型4周后心脏组织天狼星红染色图,结果显示TRUSS敲除显著抑制心脏的纤维化(*:p<0.05vsα-MHC-MCM/TRUSS-flox/TRUSS-CKOSham组,#:p<0.05vsTRUSS-floxAB组)。图6是NTG和TG小鼠AB模型4周后HW/BW、LW/BW及HW/TL的统计柱状图,结果显示TRUSS过表达会促进HW/BW、LW/BW及HW/TL(*:p<0.05vsNTG/TGSham组,#:p<0.05vsNTGAB组)。图7是NTG和TG小鼠AB模型4周后心脏表型、心脏组织HE染色及心肌细胞横截面积统计柱状图,结果显示TRUSS过表达会促进心肌细胞肥大(*:p<0.05vsNTG/TGSham组,#:p<0.05vsNTGAB组)。图8是NTG和TG小鼠AB模型4周后心脏组织天狼星红染色图,结果显示TRUSS过表达会促进心脏的纤维化(*:p<0.05vsNTG/TGSham组,#:p<0.05vsNTGAB组)。图9是α-MHC-MCM、TRUSS-flox和TRUSS-CKO小鼠AB模型4周后超声检测心功能结果统计柱状图,结果显示TRUSS敲除显著保护心功能;其中,LVEDd为左室舒张末期内径、LVEDs为左室收缩末期内径、FS为短轴缩短率(*:p<0.05vsα-MHC-MCM/TRUSS-flox/TRUSS-CKOSham组,#:p<0.05vsTRUSS-floxAB组)。图10是NTG和TG小鼠AB模型4周后超声检测心功能结果统计柱状图,结果显示TRUSS过表达显著恶化心功能;其中,LVEDd为左室舒张末期内径、LVEDs为左室收缩末期内径、FS为短轴缩短率(*:p<0.05vsNTG/TGSham组,#:p<0.05vsNTGAB组)。图11是SD乳鼠原代心肌细胞用腺病毒AdshRNA、AdshTRUSS、AdGFP、AdTRUSS感染,经AngII刺激后的免疫荧光及细胞表面积统计柱状图,TRUSS的干扰病毒抑制心肌细胞肥大,TRUSS的过表达病毒促进心肌细胞肥大(*:p<0.05vsAdshRNA组,#:p<0.05vsAdGFP组)。具体实施方式下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。实验用动物及饲养实验动物:选用8-10周龄、体重在23.5-27.5g、雄性的心脏特异性Cre小鼠(α-MHC-Cre(α-MHC-MCM),背景为C57BL/6,购自JacksonLaboratory,货号005650)、TRUSS-flox条件性敲除小鼠(TRUSS-flox)、心脏特异性TRUSS基因敲除小鼠(TRUSS-KO,由武汉大学心李红良教授实验室构建)、心脏特异性TRUSS转基因小鼠(TRUSS-TG,由武汉大学李红良教授实验室构建)及非转基因小鼠(NTG,同龄同窝对照非转基因小鼠)为实验对象。饲养环境:所有实验小鼠均饲养在武汉大学SPF级实验动物中心。SRF级小鼠饲料购自北京华阜康生物科技股份有限公司。饲养条件:室温在22-24℃之间,湿度在40-70%之间,明暗交替照明时间为12h,自由饮水摄食。实施例1心脏特异性TRUSS基因敲除小鼠以及TRUSS转基因小鼠的构建(1)心脏特异性TRUSS基因敲除小鼠的构建(构建策略见图1)利用CRISPR-Cas9技术构建心脏特异性TRUSS基因敲除小鼠。首先,通过在线CRISPR设计工具(http://crispr.mit.edu)分别在小鼠TRUSS基因内含子3和4中各设计一个CRISPR的打靶位点,靶序列分别为:TRUSSsgRNA1:ggCTGAGTGTCTCTACGCAACTAAGG,TRUSSsgRNA2:ggCTTGACCCCGCCTCCGTTTTCTTGG。此外还设计了一个用于同源修复的供体载体(DonorVector),它包括两侧同源臂它包括两侧同源臂、中间的外显子3以及两个同向的loxp序列。(1)打靶载体的构建:分别将sgRNA1和sgRNA2对应的两条引物融合成双链DNA,然后用T4DNA连接酶连入经过限制性内切酶BsaI处理过的pUC57-sgRNA载体中。该载体上游有一个T7启动子,可以用于后续的体外转录实验。(2)条件性敲除骨架载体pBluescriptSK(+)-2loxp的构建:分别合成4条寡聚单链核苷酸序列:loxp1-F:AGCTTGACGTCATAACTTCGTATAGCATACATTATAGCAATTTATACCGGTGAT,loxp1-R:ATCACCGGTATAAATTGCTATAATGTATGCTATACGAAGTTATGACGTCA;loxp2-F:GATCCCTTAAGATAACTTCGTATAGCATACATTATAGCAATTTATACGCGTA,loxp2-R:CTAGTACGCGTATAAATTGCTATAATGTATGCTATACGAAGTTATCTTAAGG;上述寡核苷酸序列退火后形成loxp1和loxp2两条双链。将pBluescriptIISK(+)载体用HindIII(NEB,R0104L)和EcoRV(NEB,R0195L)双酶切后连接入loxp1退火双链,再将测序正确的载体用BamHI(NEB,R0136L)和SpeI(NEB,R0133L)双酶切,连接入loxp2退火双链,得到条件性敲除骨架载体,命名为pBluescriptSK(+)-2loxp。(3)供体载体的构建:根据引物设计原则,设计如下引物(表1)用于扩增供体载体的左右同源臂(LA和RA)以及中间的外显子部分(M)。扩增得到的产物经表1中所示限制性内切酶酶切后得到3个片段,将其分别连入条件性敲除骨架载体pBluescriptSK(+)-2loxp中,得到供体载体。表1构建供体载体所需引物序列及对应酶切位点引物名称引物序列酶切位点TRUSSLA-FCCGCTCGAGGCTCAGACTCCAGTTGAACATTTAXhoITRUSSLA-RATGGACGTCCTAAGGAGCATCTCTGAAGAATCTAatIITRUSSM-FTCTACCGGTTTGCGTAGAGACACTCAGGGATAgeITRUSSM-RCGGGATCCAAACGGAGGCGGGGTCAABamHITRUSSRA-FCGACGCGTTCTTGGGAGGTTTTTATGCTGMluITRUSSRA-RATAAGAATGCGGCCGCGCCTGTCTGAGGAATGTGGTNotI(4)打靶载体的转录:对CRIPR/Cas9系统包含的两个部分(负责切割作用的Cas9蛋白和引导Cas9蛋白定位到靶位点的gRNA)分别进行转录。对于Cas9蛋白,将其表达载体pST1374-Cas9(Addgene44758)用PmeI进行酶切,以纯化后回收线性化质粒为转录模板,用T7mMESSAGEmMACHINE试剂盒(AM1345,Ambion)进行体外转录,获得加帽的mRNA产物。并用Poly(A)Tailing试剂盒(Ambion)对上述产物加尾,获得成熟的mRNA产物;对于sgRNA,使用MEGAshortscriptTMKit(AM1354,Ambion公司)进行体外转录。将转录得到的Cas9和sgRNA的mRNA使用miRNeasyMicroKit(Qiagen,217084)进行纯化。(5)TRUSS-flox条件性敲除小鼠的制作将上述成熟的mRNA产物与供体质粒一同注入小鼠受精卵中,移植到代孕母鼠体内进行培育。得到的小鼠进行鉴定。取出生一周后的小鼠脚趾或尾部组织,提取基因组,并通过PCR方法筛选阳性首建鼠。从确定发生同源重组的小鼠中随机挑选一只作为F0代进行后续的繁殖,最终获得TRUSS-flox纯合小鼠。与野生型小鼠相比,TRUSS-flox小鼠中TRUSS蛋白表达含量不变。(6)心脏特异性TRUSS基因敲除小鼠的制作将上述TRUSS-flox小鼠与心脏特异性α-MHC-Cre(购自JacksonLaboratory,货号005650)转基因小鼠交配,筛选得到TRUSSflox/flox/α-MHC-Cre小鼠,待该小鼠长至6周龄左右后,腹腔注射Tamoxifen,诱导Cre酶的表达,Cre酶特异性的识别两个同向的loxp,并切除两者之间的序列及其中的一个loxp,最后得到心脏细胞特异性TRUSS基因敲除小鼠。(2)心脏特异性TRUSS转基因小鼠的构建(构建策略见图2)以C57BL/6_小鼠TRUSS基因的cDNA为模板,用如下引物PCR扩增小鼠TRUSS基因(NCBI,GeneID:56407,NM_001163452.1):上游引物:5’-AGCTTTGTTTAAACGCCACCATGGCGGCAGCGCCCG-3’,下游引物:5’-CTAGCTAGCTCACTCCTCAGTGAAGTCTCTGTCTATG-3’。把扩增得到的产物和pCAG-CAT-LacZ载体(北京协和医学院基础学院杨青林老师实验室提供,制备过程参见参考文献:KimT,ZhelyabovskaO,LiuJ,etal.GenerationofanInducible,Cardiomyocyte-SpecificTransgenicMouseModelwithPPARb/dOverexpression[J].PeroxisomeProliferator-ActivatedReceptors(PPARs),57.)用限制性内切酶PmeI(NEB,R0560L)和NheI(NEB,R0131L)酶切后连接,得到转基因载体pCAG-CAT-TRUSS-polyA,TRUSS的表达由CAG启动子驱动得到。将构建的pCAG-CAT-TRUSS-polyA载体通过显微注射构造成受精胚胎(C57BL/6J背景),得到TRUSS-floxed转基因小鼠。心脏特异性TRUSS转基因小鼠由TRUSS-floxed转基因小鼠和α-MHC-Cre(购自JacksonLaboratory,货号005650)小鼠杂交繁殖得到,方法同上述基因敲除小鼠的构建。实施例2心肌肥厚模型的获得1.实验动物分组:通过主动脉缩窄(AB)术建立心肌肥厚模型。随机分为10组,分组如下:对照组小鼠假手术组(α-MHC-MCMSham、TRUSS-floxSham)及AB术组(α-MHC-MCMAB、TRUSS-floxAB)、心脏特异性TRUSS基因敲除小鼠假手术组(TRUSS-KOSham)及AB术组(TRUSS-KOAB)、非转基因小鼠假手术组(NTGSham)及AB术组(NTGAB)、心脏特异性TRUSS转基因小鼠假手术组(TGSham)及AB术组(TGAB)。2.心肌肥厚模型采用主动脉弓缩窄(AB)手术,模型操作流程:2.1术前准备(1)麻醉:先给小鼠称重,按照90mg/kg体重计算所需麻药(3%戊巴比妥钠)量,通过腹腔注射,并记录注射时间点。夹尾、夹趾无明显反应且小鼠状态良好为麻醉成功标准(一般注射后约10min无明显反应,以麻醉后约50min小鼠夹趾有反应,麻醉后30min左右为最佳手术时间)。(2)术区准备:将小鼠左胸部、左侧胸部及左前肢腋下的皮肤去毛。剃毛后用湿纱布擦拭术区去除鼠毛,以不影响手术视野为宜。(3)气管插管:用橡皮筋将小鼠上门齿固定于V形板斜面上,并迅速将气管插管经声门准确插入气管内,随后右侧卧位置于加热垫上(加热垫需提前预热),然后将气管插管与呼吸机连接,固定小鼠。若小鼠的胸廓起伏与呼吸机频率一致,说明气管插管成功。2.2主动脉弓降支结扎术取右侧卧位,小鼠左前肢置于右前肢上方,并用医用胶带将两前肢固定。右胸部下方垫入棉签,抬高胸廓,依次用碘酒及体积分数为75%的酒精对手术区域皮肤消毒。左手持眼科镊将左胸部皮肤捏起,右手持眼科剪剪开皮肤约1cm,依次分离肌肉及软组织,于第2-3肋水平打开胸腔,用棉签稍拨开左肺,游离主动脉弓降支,将7-0手术缝线穿过血管,并在血管上方平行放置一段26G(25.0-27.5g小鼠)或者27G(23.5-25.0g)注射器针头,将血管及针头一起结扎好,再抽出针头即可达到相应程度的血管缩窄。结扎完毕后依次缝合,关闭胸腔,用注射器从缝口处插入胸腔并抽出1cc气体以恢复胸腔内负压,拔出注射器后迅速缝合皮肤切口。假手术组(Sham)在游离出主动脉降支后只穿线不结扎,其余步骤同心肌肥厚模型组。2.3术后护理主动脉弓降支结扎术后,待小鼠出现自主呼吸、夹趾出现强烈反应,拔出气管插管,并将小鼠放入装有高压灭菌过的垫料、饲料和饮用水的饲养笼内,于饲养室继续饲养观察。TRUSS基因敲除小鼠及对照组小鼠术后4周、非转基因小鼠及心脏特异性TRUSS转基因小鼠术后4周分别进行各项指标的检测。实施例3心肌肥厚模型小鼠心肌肥厚及纤维化检测1.取材(1)前期工作:预先准备装有20mL的体积分数10%甲醛的尿杯,并贴好标签(小鼠编号、组别、手术类型及取材日期)。将倒满质量分数10%KCl溶液的培养皿置于取材处。打开分析天平,调零备用。再称重处死小鼠。(2)取材:眼科弯镊夹住心耳下方的血管蒂,剪下心脏,迅速置于质量分数10%KCl溶液中。待心脏停跳在舒张期后,置于灭菌纱布上,轻轻挤压心腔内液体,蘸干表面液体后,称重并记录,将心脏放入相应的尿杯中,固定48h后用于病理学检测。(3)相关测量及计算:取出小鼠肺脏,修剪后滤纸吸干,称重并记录。剪开小鼠后肢胫骨处皮肤,测量并记录胫骨长度。计算心重与体重的比值(HW/BW),肺重与体重的比值(LW/BW)以及心重与胫骨长度的比值(HW/TL)。2.病理学检测2.1制备石蜡标本切片主要操作程序包括修剪心脏→包埋框处理→流水冲洗→脱水→透明→浸蜡→包埋→切片→摊片→晾干或烘烤后备用。2.2苏木精-伊红(HE)染色主要步骤为:55℃烘烤30min→二甲苯5min,3次→100%酒精1min→95%酒精1min→70%酒精1min→双蒸水1min→苏木素溶液(珠海贝索,BA-4021)5min→水洗1min→1%盐酸酒精(取3mL浓盐酸与297mL70%酒精充分混合均匀)1-3s→水洗1min→Scott液(碳酸氢钠0.35g,七水硫酸镁2g,两者溶于100mL蒸馏水)1min→水洗1min→伊红溶液(珠海贝索,BA-4024)3-5min→蒸馏水洗去浮色→70%酒精1s→95%酒精1s→100%酒精30s,3次→二甲苯2min,3次→趁二甲苯未干立即封片→通风橱内吹干,显微镜拍照。HE染色图片统计:每张图片选择3个以上边界清楚,核大致位于中央的细胞,用Image-ProPlus6.0软件圈细胞面积。2.3天狼星红(PSR)染色主要步骤为:55℃烘烤30min→二甲苯2min,3次→100%酒精1min→95%酒精1min→70%酒精1min→流水冲洗10min→双蒸水1min→质量分数0.2%磷钼酸2min→0.1%天狼猩红苦味酸溶液滴于组织上,湿盒中染色90min→去除残液→0.01N盐酸4s→70%酒精1次→90%酒精1次→100%酒精30s,3次→二甲苯2min,3次→趁二甲苯未干立即盖玻片封片,显微镜拍照。心肌组织由心肌细胞和间质组织组成,心脏是一终末分化器官,心肌细胞失去增殖能力,各种生理或病理性刺激引起的心肌细胞反应,只能是单个细胞的体积增大而不能在数量上增殖。因此,在心肌肥厚的病理生理过程中,主要表现为心肌细胞体积增大,肌节数量增多,细胞排列紊乱,心脏间质改变包括心肌成纤维细胞的增殖与转化,胶原纤维密度增加,胶原分泌增加,胶原比例平衡失调等。α-MHC-MCM、TRUSS-flox和TRUSS-KO小鼠AB术后的表型结果见图3、图4、图5。Sham(假手术)组中α-MHC-MCM、TRUSS-flox小鼠和TRUSS-KO小鼠的HW/BW、LW/BW及HW/TL之间的差异均无统计学意义;对照组小鼠AB术后4周的HW/BW、LW/BW、HW/TL高于其Sham组;AB术后4周,TRUSS-KO小鼠的HW/BW、LW/BW及HW/TL均较α-MHC-MCM、TRUSS-flox小鼠降低(图3)。心脏表型,Sham组心脏无明显差异,AB组较Sham组的心脏均增大,AB组TRUSS-KO小鼠的心脏明显小于α-MHC-MCM、TRUSS-flox组小鼠。HE染色切片可观察到:Sham组心肌肌原纤维细胞排列整齐、致密,形态完整,胞核及核仁结构清晰;AB组肌丝排列紊乱、松散,心肌细胞体积明显增大,形态不规整,胞核深染、增大、畸形,核仁模糊,AB组TRUSS-KO则无对照组细胞肥大明显,差异有统计学意义(图4)。PSR染色后,发现AB组心室心肌间质胶原含量较Sham组增加,动脉血管周围胶原增加更为明显,胶原增粗,排列紊乱成网络状;AB术后TRUSS-KO小鼠胶原含量及血管周围胶原含量小于α-MHC-MCM、TRUSS-flox组小鼠(图5)。以上结果说明经AB术后,小鼠发生明显的心肌肥厚,TRUSS-KO小鼠的心肌肥厚程度小于α-MHC-MCM、TRUSS-flox小鼠。图6、图7、图8是NTG和TRUSS-TG小鼠AB术后的表型结果。同样NTG小鼠AB术后4周的HW/BW、LW/BW及HW/TL高于其Sham组;AB术后4周TG小鼠的HW/BW、LW/BW及HW/TL增大的程度明显大于NTG小鼠(图6)。心脏表型,AB组较Sham组的心脏均增大,且AB术后TG小鼠心脏增大的程度远大于NTG小鼠。HE染色切片可观察到:TG小鼠AB术后心肌细胞横截面积大于Sham组,显著大于NTG小鼠AB组(图7)。PSR染色可见,TG小鼠AB术后心肌间质胶原含量及血管周围胶原含量均大于NTG小鼠AB组(图8)。以上结果说明经AB术后,小鼠发生明显的心肌肥厚,TRUSS-TG小鼠的心肌肥厚程度大于NTG小鼠。实施例4心肌肥厚模型小鼠超声检测心功能1.前期准备(1)麻醉机准备:先连接氧气瓶和麻醉机上的进气接口,再拧开麻醉机上加药口密封盖,迅速加入异氟烷至安全刻度后拧紧密封盖。拧开氧气瓶上总阀门,调整流量控制阀的旋钮,出气压力维持在0.2-0.3mPa。(2)待测小鼠准备:待检测小鼠用异氟烷迅速麻醉后,左胸前区剃毛,将处理好的小鼠头部伸入麻醉剂导管套头内,以1.5-2.0%异氟烷维持小鼠稳定的麻醉状态。2.心功能检测小鼠取左侧卧位或仰卧位,并在剃毛区均匀涂抹超声耦合剂(天津成信公司)。采用高频超声诊断仪,频率为15MHz,选取标准左心室乳头肌短轴切面,测量左室舒张末期内径(LVEDD)、左室收缩末期内径(LVESD)及短轴缩短率(FS)。本实施例运用M型超声心动图检测评价心肌肥厚和心功能。图9是对照组和TRUSS-KO小鼠AB术后心功能检测结果。与对照组Sham组相比,对照组小鼠AB术后4周表现出心功能减弱和心肌肥厚,主要表现为心肌肥厚的指标LVEDd、LVEDs均不同程度的增加,而反映心功能的指标FS则下降。AB术后4周,TRUSS-KO小鼠心肌肥厚的指标增大的程度及反映心功能的指标下降的程度小于对照组小鼠。说明TRUSS-KO小鼠的心功能恶化、心肌肥厚程度较轻,这些结果均与TRUSS-KO小鼠心肌肥厚减轻结果一致。图10是NTG和TRUSS-TG小鼠AB术后的超声检测结果。与NTGSham组相比,NTG小鼠AB术后4周表现出心功能减弱和心肌肥厚,主要表现为心肌肥厚的指标LVEDd、LVEDs增大,而反映心功能的指标FS则下降。AB术后4周,与NTG小鼠相比,TG小鼠心肌肥厚的指标增大的程度及反映心功能的指标下降的程度则大于NTG组。这些结果与TG小鼠促进心肌肥厚的结果一致。实施例5TRUSS干扰(AdshTRUSS)及过表达(AdTRUSS)腺病毒对AngII刺激的原代心肌细胞肥大的影响1.原代新生SD大鼠心肌细胞培养(1)新生1天Sprague-Dawley乳鼠8只,颈部以下75%酒精消毒,用眼科剪和显微镊取下心脏,放入盛有10mLDMEM/F12培养基的玻璃平皿中。再取另一只,重复以上过程。(2)用DMEM/F12培养基清洗心脏,并将心脏剪成1-2mm3的碎片。转入到放有转子的血清瓶中,吸去DMEM/F12,加入胰酶消化液。转速为120r/min,消化15min,静止数秒钟,弃去上清液。(3)加入胰酶消化液,转速为120r/min,消化15min。静止数秒钟,吸取上清液,用含20%小牛血清的DMEM/F12培养基终止消化,并置于4℃冰箱保存。重复该步骤,循环若干次。取上清时应尽量取尽,当组织块变白并明显变小时,终止消化。(4)将收集好的心肌细胞悬液以1500rpm转速离心8min,弃去上清液。在离心管中加入适量培养基,轻柔吹打重悬细胞,集中至1个50mL离心管中,细胞悬液用细胞40μm过滤网过滤。(5)将细胞接种在100mm的培养皿中,差时贴壁90min,吸取未贴壁的细胞悬液过滤。根据细胞悬液的总量加入Brdu(终浓度0.1mM),混匀之后,加入到用0.1%明胶包被的器皿中。(6)轻摇分散细胞,勿漩涡摇晃。37℃、5%CO2孵育48小时用PBS清洗1次,更换培养基。2.TRUSS干扰(AdshTRUSS)及过表达(AdTRUSS)腺病毒对经AngII诱导的心肌细胞肥大模型的影响AdshRNA(含shRNA(沉默RNA)的腺病毒,用作对照)、AdshTRUSS(含shRNA-TRUSS(沉默RNA-TRUSS融合蛋白)的腺病毒,沉默TRUSS表达)、AdGFP(含GFP(绿色荧光蛋白)的腺病毒,用作对照)及AdTRUSS(含GFP-TRUSS(绿色荧光蛋白-TRUSS融合蛋白,TRUSS过表达)的腺病毒)(1)重组腺病毒构建从美国InvivoGen公司购得TRUSS的表达载体,应用腺病毒表达系统AdenoVec构建重组AdGFP、AdTRUSS;从美国SuperArray公司购得shRNA,shTRUSS载体,然后应用腺病毒表达系统AdenoVec构建重组AdshRNA、AdshTRUSS。(2)重组腺病毒的鉴定取病毒粗提液加入裂解液,经混匀、离心后取上清液作为模板进行PCR扩增,产物通过凝胶电泳鉴定。(3)重组腺病毒的扩增转染前接种HEK293细胞,待细胞达到50-70%汇合时换液,加入含有重组腺病毒载体的新鲜培养液,培养90分钟后再填加新鲜培养液,培养至大约有50%的细胞从培养板上脱落时,收集细胞悬液。反复冻融以制备病毒粗提液,通过CsCl密度梯度超速离心法纯化病毒液。(4)重组腺病毒滴度测定在96孔板中接种HEK293细胞,24小时后加入倍比稀释的病毒液,1-10列加入稀释的病毒液,每个浓度8个重复孔,11-12列加入无病毒完全培养液,培养10天后在显微镜下观察细胞病变效应(CPE),计算每个浓度的阳性率。病毒滴度采用Spearman-KarberMethod计算:滴度(pfu/mL)=10(x+0.8),x=各浓度阳性率总和。前提条件:阴性对照无CPE和生长抑制现象;最小稀释浓度组均有CPE;最大稀释浓度组均无CPE。(5)重组腺病毒作用的鉴定用2×108pfu/virus浓度的AdTRUSS和AdGFP及AdshTRUSS和AdshRNA感染6孔培养板中培养的心肌细胞(约80%汇合度),24小时后收集细胞,加入蛋白裂解液裂解50分钟后收集上清,取50μg样品经10%SDS-PAGE电泳分离后,用TRUSS特异性抗体做WesternBlot分析。根据TRUSS蛋白的表达,确定腺病毒AdTRUSS和AdGFP及AdshTRUSS和AdshRNA是否能发挥预期作用。由AdGFP和AdshRNA感染的细胞TRUSS蛋白表达含量不变。由AdshTRUSS感染的细胞TRUSS蛋白表达含量显著减少;相反的,由AdTRUSS感染的细胞TRUSS蛋白表达含量显著增加。腺病毒10MOIs分别感染培养3天的原代心肌细胞,12小时后用1μM血管紧张素II(AngII)(购自Sigma,A9525)刺激48小时,然后进行免疫荧光试验。结果表明,经AdshTRUSS腺病毒感染后的心肌细胞表面积较AdshRNA对照组显著减小,而经AdTRUSS腺病毒感染的心肌细胞表面积则与对照组相比AdGFP明显增大(图11)。即TRUSS的干扰腺病毒抑制心肌细胞肥大,TRUSS过表达的腺病毒则促进心肌细胞肥大。由以上结果可知,在主动脉弓缩窄引起的心肌肥厚疾病模型中,TRUSS基因缺陷显著抑制了心肌肥厚、纤维化,保护心功能,TRUSS基因过表达显著促进了心肌肥厚、纤维化,恶化心功能。因此TRUSS基因具有恶化心功能和促进心肌肥厚及纤维化的作用,特别是TRUSS基因能够促进主动脉弓缩窄引起的心肌肥厚相关疾病发生的作用。上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。SEQUENCELISTING<110>武汉大学<120>肿瘤坏死因子受体相关泛支架和信号蛋白及其抑制剂在治疗心肌肥厚中的应用<130>1<160>14<170>PatentInversion3.3<210>1<211>26<212>DNA<213>Musmusculus<400>1ggctgagtgtctctacgcaactaagg26<210>2<211>27<212>DNA<213>Musmusculus<400>2ggcttgaccccgcctccgttttcttgg27<210>3<211>54<212>DNA<213>Artificial<220><223>loxp1-F<400>3agcttgacgtcataacttcgtatagcatacattatagcaatttataccggtgat54<210>4<211>50<212>DNA<213>Artificial<220><223>loxp1-R<400>4atcaccggtataaattgctataatgtatgctatacgaagttatgacgtca50<210>5<211>52<212>DNA<213>Artificial<220><223>loxp2-F<400>5gatcccttaagataacttcgtatagcatacattatagcaatttatacgcgta52<210>6<211>52<212>DNA<213>Artificial<220><223>loxp2-R<400>6ctagtacgcgtataaattgctataatgtatgctatacgaagttatcttaagg52<210>7<211>33<212>DNA<213>Artificial<220><223>TRUSSLA-F<400>7ccgctcgaggctcagactccagttgaacattta33<210>8<211>33<212>DNA<213>Artificial<220><223>TRUSSLA-R<400>8atggacgtcctaaggagcatctctgaagaatct33<210>9<211>31<212>DNA<213>Artificial<220><223>TRUSSM-F<400>9tctaccggtttgcgtagagacactcagggat31<210>10<211>26<212>DNA<213>Artificial<220><223>TRUSSM-R<400>10cgggatccaaacggaggcggggtcaa26<210>11<211>29<212>DNA<213>Artificial<220><223>TRUSSRA-F<400>11cgacgcgttcttgggaggtttttatgctg29<210>12<211>36<212>DNA<213>Artificial<220><223>TRUSSRA-R<400>12ataagaatgcggccgcgcctgtctgaggaatgtggt36<210>13<211>36<212>DNA<213>Artificial<220><223>上游引物<400>13agctttgtttaaacgccaccatggcggcagcgcccg36<210>14<211>37<212>DNA<213>Artificial<220><223>下游引物<400>14ctagctagctcactcctcagtgaagtctctgtctatg37当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 作为AXL抑制剂的杂环化合物的制作方法与工艺
- HPTP‑β抑制剂的制作方法与工艺
- 作为LSD1抑制剂的环丙胺的制作方法与工艺
- KRAS G12C的抑制剂的制作方法与工艺
- 调节雌激素受体突变体的方法和组合物与流程
- 作为PI3K抑制剂的吡啶并[1,2‑A]嘧啶酮类似物的制作方法与工艺
- 作为PI3K抑制剂的吡啶并[1,2‑A]嘧啶酮类似物的制作方法与工艺
- 包含Ⅲ类受体酪氨酸激酶抑制剂和烷基化组蛋白‑脱乙酰酶抑制剂融合分子EDO‑S101的药物组合及其在治疗癌症中的用途的制作方法与工艺
- 包含Ⅲ类受体酪氨酸激酶抑制剂和烷基化组蛋白‑脱乙酰酶抑制剂融合分子EDO‑S101的药物组合及其在治疗癌症中的用途的制作方法与工艺
- 新型雌激素相关受体α抑制剂及其医学用途的制作方法与工艺
- 作为原肌球蛋白受体激酶(Trk)抑制剂的取代的吡唑并[1,5‑a]吡啶的制作方法与工艺
- 一种核孤儿受体TR3抑制剂多肽及其应用的制作方法与工艺
- 程序性死亡受体1基因抑制剂及其制备方法与应用与流程
- 作为H3受体抑制剂的包含哌啶和哌嗪环的氨基甲酸酯/脲衍生物的制作方法与工艺
- 一种雄性激素受体抑制剂的结晶形式及其制备方法与流程
- 一种雄性激素受体抑制剂的结晶形式及其制备方法与流程
- 丙型肝炎病毒辅助受体CD36的特异性抑制剂在制备防治丙型肝炎病毒感染药物中的应用的制造方法与工艺
- IRE‑1α抑制剂的制造方法与工艺
- 白细胞介素‑23受体的口服肽抑制剂以及其治疗炎症性肠病的用途的制造方法与工艺
- 一类孪药型HMG‑CoA还原酶抑制剂及其合成方法与制造工艺
- Flt3蛋白在制备肝癌对索拉菲尼疗效评估试剂盒中的应用
- 用于治疗癌症的雄激素受体抑制剂与akt抑制剂的组合的制作方法
- 一种药物中间体2-芳酰基吲哚衍生物的合成方法
- 一种作用于EGFR敏感突变激酶EGFR<sup>L858R</sup>,EGFR<sup>(d746-750)</sup>的6-取代氨基嘌呤类化合物及 ...的制作方法
- 一种6-溴喹啉的制备方法
- 一种基于巢式复合cold-pcr的t790m突变检测方法
- 具抗肿瘤活性的表皮生长因子受体酪氨酸激酶抑制剂irsf和irsh及其制备方法和应用
- 具抗肿瘤活性的表皮生长因子受体酪氨酸激酶抑制剂irsf和irsh及其制备方法和应用
- 一种多维替尼的制备方法
- 具有抗肿瘤活性的表皮生长因子受体酪氨酸激酶抑制剂nxgf和nxgh及其制备方法和应用