预防或治疗犬瘟热的寡聚核酸组合及其应用的制作方法
本发明涉及生物医药领域,具体涉及预防或治疗犬瘟热的寡聚核酸组合及其应用。
背景技术:
犬瘟热是由犬瘟热病毒(caninedistempervirus,cdv)引起的急性、高度接触传染性疾病,呈世界性分布,自然感染宿主种类广泛,且可在不相关的动物种类间交叉感染,现已扩展到了食肉目的所有8个科、偶蹄目猪科和灵长目的猕猴属和鳍足目海豹科等多种动物,且有不断扩大的趋势,在人的变形性骨炎患者体内也检测到了cdv的核酸分子。cdv是负链单股不分节段的rna病毒,与麻疹病毒、牛瘟病毒、海豹病毒等在分类学上同属于副粘病毒科麻疹病毒属,其基因组长约16kb。研究表明,cdv的融合蛋白(由f基因编码)和血凝素蛋白(由h基因编码)是宿主免疫系统的主要目的抗原,是产生中和抗体的重要抗原之一;核衣壳蛋白(由n基因编码)是保守性较强的免疫原性蛋白。融合蛋白、血凝素蛋白和核衣壳蛋白在犬瘟热的免疫预防方面起重要作用。
目前主要通过接种犬瘟热弱毒疫苗,来防御犬瘟热的爆发。但由于cdv的基因变异,普通疫苗很难具有广适性。而且目前cdv疫苗的管理不严谨,市场上疫苗质量良莠不齐,各厂家使用的疫苗毒株也不尽相同,这种情况下cdv发生变异和重组的频率可能会加快,易出现新的基因型,出现上述情况后,又会进一步导致疫苗抗体效价下降快,抗原特异性降低。对cdv各结构蛋白结构和功能的研究进展显示,选择合适的高度保守或特异性的序列作为抗原表位,开发基因工程药物是预防和治疗犬瘟热的发展趋势之一。
技术实现要素:
本发明所要解决的技术问题是如何预防或治疗犬瘟热。
为解决上述技术问题,本发明首先提供了一种寡聚核酸组合。
本发明所提供的寡聚核酸组合,可为寡聚核酸ngene-119、寡聚核酸ngene-1321、寡聚核酸ngene-476、寡聚核酸ngene-749、寡聚核酸ngene-316、寡聚核酸ngene-541、寡聚核酸ngene-1091、寡聚核酸ngene-435、寡聚核酸ngene-927、寡聚核酸fgene-866、寡聚核酸fgene-1825、寡聚核酸fgene-792、寡聚核酸fgene-685、寡聚核酸fgene-1279、寡聚核酸fgene-485、寡聚核酸hgene-416、寡聚核酸hgene-1447、寡聚核酸hgene-1664、寡聚核酸hgene-492、寡聚核酸hgene-947、寡聚核酸hgene-1488、寡聚核酸hgene-1373、寡聚核酸hgene-1332和寡聚核酸hgene-794中的24种、任23种、任22种、任21种、任20种、任19种、任18种、任17种、任16种、任15种、任14种、任13种、任12种、任11种、任10种、任9种、任8种、任7种、任6种、任5种、任4种、任3种、任2种或任1种。
所述寡聚核酸ngene-119、所述寡聚核酸ngene-1321、所述寡聚核酸ngene-476、所述寡聚核酸ngene-749、所述寡聚核酸ngene-316、所述寡聚核酸ngene-541、所述寡聚核酸ngene-1091、所述寡聚核酸ngene-435、所述寡聚核酸ngene-927、所述寡聚核酸fgene-866、所述寡聚核酸fgene-1825、所述寡聚核酸fgene-792、所述寡聚核酸fgene-685、所述寡聚核酸fgene-1279、所述寡聚核酸fgene-485、所述寡聚核酸hgene-416、所述寡聚核酸hgene-1447、所述寡聚核酸hgene-1664、所述寡聚核酸hgene-492、所述寡聚核酸hgene-947、所述寡聚核酸hgene-1488、所述寡聚核酸hgene-1373、所述寡聚核酸hgene-1332和所述寡聚核酸hgene-794均为具有粘末端的双链dna分子。
所述寡聚核酸ngene-119由序列表中的序列1所示单链dna分子和序列表的序列2所示的单链dna分子组成。
所述寡聚核酸ngene-1321由序列表中的序列3所示单链dna分子和序列表的序列4所示单链dna分子组成。
所述寡聚核酸ngene-476由序列表中的序列5所示单链dna分子和序列表的序列6所示单链dna分子组成。
所述寡聚核酸ngene-749由序列表中的序列7所示单链dna分子和序列表的序列8所示单链dna分子组成。
所述寡聚核酸ngene-316由序列表中的序列9所示单链dna分子和序列表的序列10所示单链dna分子组成。
所述寡聚核酸ngene-541由序列表中的序列11所示单链dna分子和序列表的序列12所示单链dna分子组成。
所述寡聚核酸ngene-1091由序列表中的序列13所示单链dna分子和序列表的序列14所示单链dna分子组成。
所述寡聚核酸ngene-435由序列表中的序列15所示单链dna分子和序列表的序列16所示单链dna分子组成。
所述寡聚核酸ngene-927由序列表中的序列17所示单链dna分子和序列表的序列18所示单链dna分子组成。
所述寡聚核酸fgene-866由序列表中的序列19所示单链dna分子和序列表的序列20所示单链dna分子组成。
所述寡聚核酸fgene-1825由序列表中的序列21所示单链dna分子和序列表的序列22所示单链dna分子组成。
所述寡聚核酸fgene-792由序列表中的序列23所示单链dna分子和序列表的序列24所示单链dna分子组成。
所述寡聚核酸fgene-685由序列表中的序列25所示单链dna分子和序列表的序列26所示单链dna分子组成。
所述寡聚核酸fgene-1279由序列表中的序列27所示单链dna分子和序列表的序列28所示单链dna分子组成。
所述寡聚核酸fgene-485由序列表中的序列29所示单链dna分子和序列表的序列30所示单链dna分子组成。
所述寡聚核酸hgene-416由序列表中的序列31所示单链dna分子和序列表的序列32所示单链dna分子组成。
所述寡聚核酸hgene-1447由序列表中的序列33所示单链dna分子和序列表的序列34所示单链dna分子组成。
所述寡聚核酸hgene-1664由序列表中的序列35所示单链dna分子和序列表的序列36所示单链dna分子组成。
所述寡聚核酸hgene-492由序列表中的序列37所示单链dna分子和序列表的序列38所示单链dna分子组成。
所述寡聚核酸hgene-947由序列表中的序列39所示单链dna分子和序列表的序列40所示单链dna分子组成。
所述寡聚核酸hgene-1488由序列表中的序列41所示单链dna分子和序列表的序列42所示单链dna分子组成。
所述寡聚核酸hgene-1373由序列表中的序列43所示单链dna分子和序列表的序列44所示单链dna分子组成。
所述寡聚核酸hgene-1332由序列表中的序列45所示单链dna分子和序列表的序列46所示单链dna分子组成。
所述寡聚核酸hgene-794由序列表中的序列47所示单链dna分子和序列表的序列48所示单链dna分子组成。
上述寡聚核酸组合中,所述寡聚核酸ngene-119、所述寡聚核酸ngene-1321、所述寡聚核酸ngene-476、所述寡聚核酸ngene-749、所述寡聚核酸ngene-316、所述寡聚核酸ngene-541、所述寡聚核酸ngene-1091、所述寡聚核酸ngene-435、所述寡聚核酸ngene-927、所述寡聚核酸fgene-866、所述寡聚核酸fgene-1825、所述寡聚核酸fgene-792、所述寡聚核酸fgene-685、所述寡聚核酸fgene-1279、所述寡聚核酸fgene-485、所述寡聚核酸hgene-416、所述寡聚核酸hgene-1447、所述寡聚核酸hgene-1664、所述寡聚核酸hgene-492、所述寡聚核酸hgene-947、所述寡聚核酸hgene-1488、所述寡聚核酸hgene-1373、所述寡聚核酸hgene-1332或所述寡聚核酸hgene-794的核苷酸序列均可进行如下(a1)-(a4)中至少一种修饰:
(a1)3′末端和/或5′末端的修饰;
(a2)连接核苷酸的磷酸二酯键的修饰;
(a3)核糖的2′-oh的修饰;
(a4)碱基的修饰。
上述寡聚核酸组合中,所述(a1)中,所述3′末端和/或5′末端的修饰”具体可为5′末端p修饰、5′巯基、5′末端nh2修饰、5′末端chol修饰、5′末端me-dc修饰、5′末端tet修饰、5′末端biotin修饰、3′末端nh2修饰、3′末端chol修饰、3′末端bhq-1修饰、3′末端dabcyl修饰、5′末端c6s-s修饰或3′末端c6s-s修饰。
上述寡聚核酸组合中,所述(a2)中,所述“连接核苷酸的磷酸二酯键的修饰”具体可为磷酸二酯键中的氧被硫取代。
上述寡聚核酸组合中,所述(a3)中,所述“核糖的2′-oh的修饰”具体可为甲氧基取代修饰、氟取代修饰或者脱氧修饰。
上述寡聚核酸组合中,所述(a1)中,所述“3′末端和/或5′末端的修饰”为3′末端进行胆固醇修饰和5′末端进行磷酸化修饰。
上述任一所述寡聚核酸组合具体可为组合一;所述组合一为所述寡聚核酸ngene-119、所述寡聚核酸ngene-476、所述寡聚核酸ngene-749、所述寡聚核酸ngene-435和所述寡聚核酸ngene-927。所述组合一中,所述寡聚核酸ngene-119、所述寡聚核酸ngene-476、所述寡聚核酸ngene-749、所述寡聚核酸ngene-435和所述寡聚核酸ngene-927的摩尔比可为1:1:1:1:1。
上述任一所述寡聚核酸组合具体可为组合二;所述组合二为所述寡聚核酸fgene-485、所述寡聚核酸fgene-685、所述寡聚核酸fgene-792和所述寡聚核酸fgene-1279。所述组合二中,所述寡聚核酸fgene-485、所述寡聚核酸fgene-685、所述寡聚核酸fgene-792和所述寡聚核酸fgene-1279的摩尔比可为1:1:1:1。
上述任一所述寡聚核酸组合具体可为组合三;所述组合三为所述寡聚核酸hgene-416、所述寡聚核酸hgene-947、所述寡聚核酸hgene-1373、所述寡聚核酸hgene-1447和所述寡聚核酸hgene-1664。所述组合三中,所述寡聚核酸hgene-416、所述寡聚核酸hgene-947、所述寡聚核酸hgene-1373、所述寡聚核酸hgene-1447和所述寡聚核酸hgene-1664的摩尔比可为1:1:1:1:1。
上述任一所述寡聚核酸组合具体可为组合四;所述组合四为所述寡聚核酸hgene-119、所述寡聚核酸fgene-485和所述寡聚核酸hgene-416。所述组合四中,所述寡聚核酸hgene-119、所述寡聚核酸fgene-485和所述寡聚核酸hgene-416的摩尔比可为1:1:1。
上述任一所述寡聚核酸组合具体可为所述寡聚核酸ngene-119、所述寡聚核酸ngene-1321、所述寡聚核酸ngene-476、所述寡聚核酸ngene-749、所述寡聚核酸ngene-316、所述寡聚核酸ngene-541、所述寡聚核酸ngene-1091、所述寡聚核酸ngene-435、所述寡聚核酸ngene-927、所述寡聚核酸fgene-866、所述寡聚核酸fgene-1825、所述寡聚核酸fgene-792、所述寡聚核酸fgene-685、所述寡聚核酸fgene-1279、所述寡聚核酸fgene-485、所述寡聚核酸hgene-416、所述寡聚核酸hgene-1447、所述寡聚核酸hgene-1664、所述寡聚核酸hgene-492、所述寡聚核酸hgene-947、所述寡聚核酸hgene-1488、所述寡聚核酸hgene-1373、所述寡聚核酸hgene-1332或所述寡聚核酸hgene-794。
编码上述任一所述寡聚核酸组合的dna分子也属于本发明的保护范围。
含有编码上述任一所述寡聚核酸组合的dna分子的表达盒、重组载体或重组菌也属于本发明的保护范围。
上述任一所述寡聚核酸组合、编码上述任一所述寡聚核酸组合的dna分子、或、含有编码上述任一所述寡聚核酸组合的dna分子的表达盒、重组载体或重组菌在如下(b1)-(b5)任一种的应用也属于本发明的保护范围:
(b1)抑制犬瘟热病毒复制;
(b2)制备用于治疗犬瘟热的药物;
(b3)抑制犬瘟热病毒生长;
(b4)制备用于预防犬瘟热发生或传播的药物;
(b5)促进犬瘟热病毒死亡或灭活。
上述应用中,所述(b1)中,抑制犬瘟热病毒复制的药物可为抑制犬瘟热病毒核酸复制的药物。
上述应用中,所述犬瘟热可为犬瘟热病毒引起的疾病。
上述应用中,所述犬瘟热病毒可具体为犬瘟热弱毒cdv3-cl株。犬瘟热弱毒cdv3-cl株具体可为吉林特研生物技术有限责任公司的产品,产品名称为水貂犬瘟热活疫苗。
为解决上述技术问题,本发明还提供了一种药物。
本发明所提供的药物,具有如下(b1)-(b5)功能中至少一种,其活性成分为上述任一所述寡聚核酸组合、编码上述任一所述寡聚核酸组合的dna分子、或、含有编码上述任一所述寡聚核酸组合的dna分子的表达盒、重组载体或重组菌;
(b1)抑制犬瘟热病毒复制;
(b2)制备用于治疗犬瘟热的药物;
(b3)抑制犬瘟热病毒生长;
(b4)制备用于预防犬瘟热发生或传播的药物;
(b5)促进犬瘟热病毒死亡或灭活。
上述药物中,所述(b1)中,抑制犬瘟热病毒复制的药物可为抑制犬瘟热病毒核酸复制的药物。
上述药物中,所述犬瘟热可为犬瘟热病毒引起的疾病。
上述药物中,所述犬瘟热病毒可具体为犬瘟热弱毒cdv3-cl株。犬瘟热弱毒cdv3-cl株具体可为吉林特研生物技术有限责任公司的产品,产品名称为水貂犬瘟热活疫苗。
上述药物中,所述药物还可包括药学上可接受的载体。所述药学上可接受的载体可为lipofectamine2000;所述药物中,所述寡聚核酸组合和所述lipofectamine2000的配比为(20-60)pmol:1μl。所述lipofectamine2000可为thermofisher-invitrogen公司的产品,货号为11668-027。
为解决上述技术问题,本发明还提供了一种抑制犬瘟热病毒复制的方法。
本发明所提供的抑制犬瘟热病毒复制的方法,包括如下步骤:在受体中表达上述任一所述寡聚核酸组合。
上述方法中,抑制犬瘟热病毒复制可为抑制犬瘟热病毒核酸复制。
上述方法中,所述受体可为感染犬瘟热病毒的受体细胞。
上述方法中,所述犬瘟热病毒可具体为犬瘟热弱毒cdv3-cl株。犬瘟热弱毒cdv3-cl株具体可为吉林特研生物技术有限责任公司的产品,产品名称为水貂犬瘟热活疫苗。
上述方法中,所述受体细胞可为vero细胞。所述vero细胞可为中国科学院典型培养物保藏委员会细胞库的产品,产品目录号为gno10。
上述方法中,所述“在受体中表达上述任一所述寡聚核酸组合”具体可为重组质粒pcdna3.1-n和上述任一所述寡聚核酸组合共转染受体、重组质粒pcdna3.1-f和上述任一所述寡聚核酸组合共转染受体或重组质粒pcdna3.1-h和上述任一所述寡聚核酸组合共转染受体。所述受体可为293t细胞。所述293t细胞可为中国科学院典型培养物保藏委员会细胞库的产品,货号为gnhu17。
所述重组质粒pcdna3.1-n为将载体pcdna3.1+的限制性内切酶hindⅲ和ecorⅰ识别序列间的片段替换为序列表中序列49自5’末端起第12至1583位所示的dna分子,得到的重组质粒。
所述重组质粒pcdna3.1-h为将载体pcdna3.1+的限制性内切酶hindⅲ和ecorⅰ识别序列间的片段替换为序列表中序列50自5’末端起第12至1835位所示的dna分子,得到的重组质粒。
所述重组质粒pcdna3.1-f为将载体pcdna3.1+的限制性内切酶hindⅲ和ecorⅰ识别序列间的片段替换为序列表中序列51自5’末端起第12至2000位所示的dna分子,得到的重组质粒。
实验证明,上述组合一、组合二、组合三和组合四均可抑制感染犬瘟热弱毒cdv3-cl株的复制;组合一可抑制感染犬瘟热弱毒cdv3-cl株的vero细胞中n基因的相对表达量;组合二可抑制感染犬瘟热弱毒cdv3-cl株的vero细胞中f基因的相对表达量,组合三可抑制感染犬瘟热弱毒cdv3-cl株的vero细胞中h基因的相对表达量,组合四可抑制感染犬瘟热弱毒cdv3-cl株的vero细胞中n基因、f基因和h基因的相对表达量。因此,利用本发明提供的寡聚核酸组合,可抑制犬瘟热病毒复制,对预防或治疗犬瘟热具有重要的应用价值。
附图说明
图1为n基因的相对表达量。
图2为f基因的相对表达量。
图3为h基因的相对表达量。
图4为实施例3中光学显微镜的观察结果。
图5为实施例3中n基因、f基因或h基因的相对表达量的检测结果。
具体实施方式
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。
下述实施例中的实验方法,如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
10×pfubuffer(含mg2+)和pfudnapolymerase均为takara公司的产品,产品目录号分别为9151a和rr001b。dna凝胶回收试剂盒为生工生物工程(上海)股份有限公司的产品,产品目录号为sk8131。载体pcdna3.1+为thermofisher公司的产品,产品目录号为v79020。dmem培养基和fbs均为gibco公司的产品。opti-mem培养基为gibco公司的产品,产品目录号为#31985-070。lipofectamine2000为thermofisher-invitrogen公司产品,货号为11668-027。293t细胞为中国科学院典型培养物保藏委员会细胞库的产品,货号为gnhu17。犬瘟热弱毒cdv3-cl株为吉林特研生物技术有限责任公司的产品,产品名称为水貂犬瘟热活疫苗。vero细胞为中国科学院典型培养物保藏委员会细胞库的产品,产品目录号为gno10。
实施例1、修饰的寡聚核酸的制备
由上海吉玛制药技术有限公司合成表1所示的正义链和反义链。
用去离子水将正义链稀释,得到正义链稀释液。用去离子水将反义链稀释,得到反义链稀释液。取正义链稀释液和相应的反义链稀释液,进行退火反应,形成寡聚核酸。将各个寡聚核酸的3′末端进行胆固醇修饰,5′末端进行磷酸化修饰,得到修饰的寡聚核酸。
本实施例共制备表1所示的28个寡聚核酸。各个寡聚核酸中的a、g、c和u依次表示腺嘌呤核糖核苷酸、鸟嘌呤核糖核苷酸、胞嘧啶核糖核苷酸和尿嘧啶核糖核苷酸,t表示胸腺嘧啶脱氧核苷酸。
阴性对照寡聚核酸1和阴性对照寡聚核酸2的核苷酸序列均为随机序列。
表1
实施例2、实施例1制备的修饰的寡聚核酸对cdv的n基因、f基因和h基因的相对表达量的影响
一、重组质粒的构建
1、重组质粒pcdna3.1-n的构建
(1)根据cdv的n基因的核苷酸序列(sequenceid:gb|eu409838.1|或genebank:eu409838.1),设计并由上海吉玛制药技术有限公司合成序列表中序列49所示的dna片段。序列49自5’末端起第1至11位为保护性碱基和限制性内切酶hindⅲ的识别序列,第12至1583位为n基因的核苷酸序列,第1584至1594位为保护性碱基和限制性内切酶ecorⅰ的识别序列。
(2)用限制性内切酶hindⅲ和ecorⅰ双酶切步骤(1)合成的dna片段,用dna凝胶回收试剂盒回收酶切产物。
(3)用限制性内切酶hindⅲ和ecorⅰ双酶切载体pcdna3.1+,用dna凝胶回收试剂盒回收约5400bp的载体骨架。
(4)将酶切产物和载体骨架进行连接,获得重组质粒pcdna3.1-n。
根据测序结果,对重组质粒pcdna3.1-n进行结构描述如下:将载体pcdna3.1+的限制性内切酶hindⅲ和ecorⅰ识别序列间的片段替换为序列表中序列49自5’末端起第12至1583位所示的dna分子。重组质粒pcdna3.1-n含有cdv的n基因的核苷酸序列,表达核衣壳蛋白(genebank:abz79285.1)。
2、重组质粒pcdna3.1-h的构建
(1)根据cdv的h基因的核苷酸序列(genebank:hq128601.1),设计并由上海吉玛制药技术有限公司合成序列表中序列50所示的dna片段。序列50自5’末端起第1至11位为保护性碱基和限制性内切酶hindⅲ的识别序列,第12至1835位为n基因的核苷酸序列,第1836至1846位为保护性碱基和限制性内切酶ecorⅰ的识别序列。
(2)用限制性内切酶hindⅲ和ecorⅰ双酶切步骤(1)合成的dna片段,用dna凝胶回收试剂盒回收酶切产物。
(3)用限制性内切酶hindⅲ和ecorⅰ双酶切载体pcdna3.1+,用dna凝胶回收试剂盒回收约5400bp的载体骨架。
(4)将酶切产物和载体骨架进行连接,获得重组质粒pcdna3.1-h。
根据测序结果,对重组质粒pcdna3.1-h进行结构描述如下:将载体pcdna3.1+的限制性内切酶hindⅲ和ecorⅰ识别序列间的片段替换为序列表中序列50自5’末端起第12至1835位所示的dna分子。重组质粒pcdna3.1-h含有cdv的h基因的核苷酸序列,表达血凝素蛋白(genebank:adv76478.1)。
3、重组质粒pcdna3.1-f的构建
(1)根据cdv的f基因的核苷酸序列(genebank:eu327874.1),设计并由上海吉玛制药技术有限公司合成序列表中序列51所示的dna片段。序列51自5’末端起第1至11位为保护性碱基和限制性内切酶hindⅲ的识别序列,第12至2000位为n基因的核苷酸序列,第2001至2011位为保护性碱基和限制性内切酶ecorⅰ的识别序列。
(2)用限制性内切酶hindⅲ和ecorⅰ双酶切步骤(1)合成的dna片段,用dna凝胶回收试剂盒回收酶切产物。
(3)用限制性内切酶hindⅲ和ecorⅰ双酶切载体pcdna3.1+,用dna凝胶回收试剂盒回收约5400bp的载体骨架。
(4)将酶切产物和载体骨架进行连接,获得重组质粒pcdna3.1-f。
根据测序结果,对重组质粒pcdna3.1-f进行结构描述如下:将载体pcdna3.1+的限制性内切酶hindⅲ和ecorⅰ识别序列间的片段替换为序列表中序列51自5’末端起第12至2000位所示的dna分子。重组质粒pcdna3.1-f含有cdv的f基因的核苷酸序列,表达融合蛋白(genebank:aby49137.1)。
二、实施例1制备的修饰的寡聚核酸对cdv的n基因、f基因和h基因的相对表达量的影响
1、实施例1制备的修饰的寡聚核酸对cdv的n基因的相对表达量的影响
(1)将实施例1制备的修饰的寡聚核酸(ngene-119、ngene-1321、ngene-476、ngene-316、ngene-541、ngene-1091、ngene-435、ngene-927、ngene-749、对照寡聚核酸1、对照寡聚核酸2、阴性对照寡聚核酸1或阴性对照寡聚核酸2),用depc水分别溶解至20μmmol/l,得到修饰的寡聚核酸溶液。
(2)取处于对数生长期的293t细胞,用胰酶消化,然后用含10%(体积百分比)fbs的dmem培养基中培养,获得浓度为5×106个/ml的细胞悬浮液。
(3)完成步骤(2)后,将所述细胞悬浮液接种于6孔板,每孔接种1ml(约5×106个293t细胞),然后置于37℃、5%co2培养箱中培养18h,使293t细胞贴壁。
(4)完成步骤(3)后,将所述6孔板中的培养基更换为500μlopti-mem培养基,然后加入5μg重组质粒pcdna3.1-n和10μl步骤(1)获得的修饰的寡聚核酸溶液,进行共转染(共转染过程中,转染试剂为lipofectamine2000,培养基为opti-mem培养基,共转染的步骤参考lipofectamin2000说明书),然后置于37℃、5%co2培养箱中孵育5h。
(5)完成步骤(4)后,将所述6孔板中的培养基更换为新的opti-mem培养基,置于37℃、5%co2培养箱中继续培养24h;然后用胰酶消化,加入1ml的100mm、ph7.0的pbs缓冲液洗涤一次,1000rpm离心3min,得到沉淀。沉淀即为重组质粒pcdna3.1-n和步骤(1)获得的修饰的寡聚核酸溶液共转染后的293t细胞组,简称n-1293t细胞组。
按照步骤(5)的方法,将24h替换为48h,其它步骤均不变,得到n-2293t细胞组。
按照步骤(5)的方法,将24h替换为72h,其它步骤均不变,得到n-3293t细胞组。
(6)提取n293t细胞组(n-1293t细胞组、n-2293t细胞组或n-3293t细胞组)的总rna,然后用逆转录酶进行反转录(反应程序为:26℃30min;42℃30min;85℃10min),得到cdna,向上述cdna加入ddh2o稀释,得到cdna浓度为1000ng/μl的模板溶液。
(7)以步骤(6)得到的模板溶液为模板,通过荧光定量pcr检测n293t细胞组中n基因的相对表达量(以b-actin基因为内参基因)。
鉴定n基因的引物为5’-aggtaatcccaagcatcaactctgt-3’和5’-ttcgacccttcgtctacaattttg-3’。鉴定b-actin基因的引物为actin-f:5’-ccctggcacccagcac-3’和actin-r:5’-gccgatccacacggagtac-3’。
n-1293t细胞组中,将重组质粒pcdna3.1-n和阴性对照寡聚核酸1共转染后的293t细胞组中n基因的相对表达量作为1,重组质粒pcdna3.1-n和其它寡聚核酸共转染后的293t细胞组中n基因的相对表达量的部分结果见图1中a。n-2293t细胞组中,将重组质粒pcdna3.1-n和阴性对照寡聚核酸1共转染后的293t细胞组中n基因的相对表达量作为1,重组质粒pcdna3.1-n和其它寡聚核酸共转染后的293t细胞组中n基因的相对表达量的部分结果见图1中b。n-3293t细胞组中,将重组质粒pcdna3.1-n和阴性对照寡聚核酸1共转染后的293t细胞组中n基因的相对表达量作为1,重组质粒pcdna3.1-n和其它寡聚核酸共转染后的293t细胞组中n基因的相对表达量的部分结果见图1中c。图1中,ngene为转染阴性对照寡聚核酸1,ngene-119为转染ngene-119,ngene-1321为转染ngene-1321,ngene-476为转染ngene-476,ngene-316为转染ngene-316,ngene-541为转染ngene-541,ngene-1091为转染ngene-1091,ngene-435为转染ngene-435,ngene-927为转染ngene-927。
结果表明,本发明所提供的ngene-119、ngene-1321、ngene-476、ngene-316、ngene-541、ngene-1091、ngene-435、ngene-927和ngene-749均可使n基因的相对表达量降低,即干扰效率高;且干扰时间越长,干扰效率越高。对照寡聚核酸1、对照寡聚核酸2、阴性对照寡聚核酸1或阴性对照寡聚核酸2不能使n基因的相对表达量降低,即不能对n基因形成干扰。
2、实施例1制备的修饰的寡聚核酸对cdv的f基因的相对表达量的影响
(1)将实施例1制备的修饰的寡聚核酸(fgene-866、fgene-1825、fgene-792、fgene-685、fgene-1279、fgene-485、对照寡聚核酸1、对照寡聚核酸2、阴性对照寡聚核酸1或阴性对照寡聚核酸2),用depc水分别溶解至20μmmol/l,得到修饰的寡聚核酸溶液。
(2)同步骤1中(2)。
(3)同步骤1中(3)。
(4)完成步骤(3)后,将所述6孔板中的培养基更换为500μlopti-mem培养基,然后加入5μg重组质粒pcdna3.1-f和10μl步骤(1)获得的修饰的寡聚核酸溶液,进行共转染(共转染过程中,转染试剂为lipofectamine2000,培养基为opti-mem培养基,共转染的步骤参考lipofectamin2000说明书),然后置于37℃、5%co2培养箱中孵育5h。
(5)完成步骤(4)后,将所述6孔板中的培养基更换为新的opti-mem培养基,置于37℃、5%co2培养箱中继续培养24h;然后用胰酶消化,加入1ml的100mm、ph7.0的pbs缓冲液洗涤一次,1000rpm离心3min,得到沉淀。沉淀即为重组质粒pcdna3.1-f和步骤(1)获得的修饰的寡聚核酸溶液共转染后的293t细胞组,简称f-1293t细胞组。
按照步骤(5)的方法,将24h替换为48h,其它步骤均不变,得到f-2293t细胞组。
按照步骤(5)的方法,将24h替换为72h,其它步骤均不变,得到f-3293t细胞组。
(6)提取f293t细胞组(f-1293t细胞组、f-2293t细胞组或f-3293t细胞组)的总rna,然后用逆转录酶进行反转录(反应程序为:26℃30min;42℃30min;85℃10min),得到cdna,向上述cdna加入ddh2o稀释,得到cdna浓度为1000ng/μl的模板溶液。
(7)以步骤(6)得到的模板溶液为模板,通过荧光定量pcr检测f293t细胞组中f基因的相对表达量(以b-actin基因为内参基因)。
鉴定f基因的引物为5’-gcaaactagccacagatcggataac-3’和5’-tcgctccttgggtgacactctc-3’。鉴定b-actin基因的引物为actin-f:5’-ccctggcacccagcac-3’和actin-r:5’-gccgatccacacggagtac-3’。
f-1293t细胞组中,将重组质粒pcdna3.1-f和阴性对照寡聚核酸1共转染后的293t细胞组中f基因的相对表达量作为1,重组质粒pcdna3.1-f和其它寡聚核酸共转染后的293t细胞组中f基因的相对表达量的部分结果见图2中a。f-2293t细胞组中,将重组质粒pcdna3.1-f和阴性对照寡聚核酸1共转染后的293t细胞组中f基因的相对表达量作为1,重组质粒pcdna3.1-f和其它寡聚核酸共转染后的293t细胞组中f基因的相对表达量的部分结果见图2中b。f-3293t细胞组中,将重组质粒pcdna3.1-f和阴性对照寡聚核酸1共转染后的293t细胞组中f基因的相对表达量作为1,重组质粒pcdna3.1-f和其它寡聚核酸共转染后的293t细胞组中f基因的相对表达量的部分结果见图2中c。
结果表明,本发明所提供的fgene-866、fgene-1825、fgene-792、fgene-685、fgene-1279和fgene-485均可使f基因的相对表达量降低,即干扰效率高;且干扰时间越长,干扰效率越高。对照寡聚核酸1、对照寡聚核酸2、阴性对照寡聚核酸1或阴性对照寡聚核酸2不能使f基因的相对表达量降低,即不能对f基因形成干扰。
3、实施例1制备的修饰的寡聚核酸对cdv的h基因的相对表达量的影响
(1)将实施例1制备的修饰的寡聚核酸(hgene-416、hgene-1447、hgene-1664、hgene-492、hgene-947、hgene-1488、hgene-1373、hgene-1332、hgene-794、对照寡聚核酸1、对照寡聚核酸2、阴性对照寡聚核酸1或阴性对照寡聚核酸2),用depc水分别溶解至20μmmol/l,得到修饰的寡聚核酸溶液。
(2)同步骤1中(2)。
(3)同步骤1中(3)。
(4)完成步骤(3)后,将所述6孔板中的培养基更换为500μlopti-mem培养基,然后加入5μg重组质粒pcdna3.1-h和10μl步骤(1)获得的修饰的寡聚核酸溶液,进行共转染(共转染过程中,转染试剂为lipofectamine2000,培养基为opti-mem培养基,共转染的步骤参考lipofectamin2000说明书),然后置于37℃、5%co2培养箱中孵育5h。
(5)完成步骤(4)后,将所述6孔板中的培养基更换为新的opti-mem培养基,置于37℃、5%co2培养箱中继续培养24h;然后用胰酶消化,加入1ml的100mm、ph7.0的pbs缓冲液洗涤一次,1000rpm离心3min,得到沉淀。沉淀即为重组质粒pcdna3.1-h和步骤(1)获得的修饰的寡聚核酸溶液共转染后的293t细胞组,简称h-1293t细胞组。
按照步骤(5)的方法,将24h替换为48h,其它步骤均不变,得到h-2293t细胞组。
按照步骤(5)的方法,将24h替换为72h,其它步骤均不变,得到h-3293t细胞组。
(6)提取h293t细胞组(h-1293t细胞组、h-2293t细胞组或h-3293t细胞组)的总rna,然后用逆转录酶进行反转录(反应程序为:26℃30min;42℃30min;85℃10min),得到cdna,向上述cdna加入ddh2o稀释,得到cdna浓度为1000ng/μl的模板溶液。
(7)以步骤(6)得到的模板溶液为模板,通过荧光定量pcr检测h293t细胞组中h基因的相对表达量(以b-actin基因为内参基因)。
鉴定h基因的引物为5’-gcagagtattccccctatccgtatc-3’和5’-actccgtctgagatagcggttagc-3’。鉴定b-actin基因的引物为actin-f:5’-ccctggcacccagcac-3’和actin-r:5’-gccgatccacacggagtac-3’。
h-1293t细胞组中,将重组质粒pcdna3.1-h和阴性对照寡聚核酸1共转染后的293t细胞组中h基因的相对表达量作为1,重组质粒pcdna3.1-h和其它寡聚核酸共转染后的293t细胞组中h基因的相对表达量的部分结果见图3中a。h-2293t细胞组中,将重组质粒pcdna3.1-h和阴性对照寡聚核酸1共转染后的293t细胞组中h基因的相对表达量作为1,重组质粒pcdna3.1-h和其它寡聚核酸共转染后的293t细胞组中h基因的相对表达量的部分结果见图3中b。h-3293t细胞组中,将重组质粒pcdna3.1-h和阴性对照寡聚核酸1共转染后的293t细胞组中h基因的相对表达量作为1,重组质粒pcdna3.1-h和其它寡聚核酸共转染后的293t细胞组中h基因的相对表达量的部分结果见图3中c。
结果表明,本发明所提供的hgene-416、hgene-1447、hgene-1664、hgene-492、hgene-947、hgene-1488、hgene-1373、hgene-1332和hgene-794均可使h基因的相对表达量降低,即干扰效率高;且干扰时间越长,干扰效率越高。对照寡聚核酸1、对照寡聚核酸2、阴性对照寡聚核酸1或阴性对照寡聚核酸2不能使h基因的相对表达量降低,即不能对h基因形成干扰。
实施例3、实施例1制备的修饰的寡聚核酸对感染犬瘟热弱毒cdv3-cl株的vero细胞病毒复制抑制作用
一、干扰组合物的制备
1、干扰组合物1
取实施例1制备的ngene-119、ngene-476、ngene-749、ngene-435和ngene-927,按照1:1:1:1:1的摩尔比进行混合,得到干扰组合物1。
2、干扰组合物2
取实施例1制备的fgene-485、fgene-685、fgene-792和fgene-1279,按照1:1:1:1的摩尔比进行混合,得到干扰组合物2。
3、干扰组合物3
取实施例1制备的hgene-416、hgene-947、hgene-1373、hgene-1447和hgene-1664,按照1:1:1:1:1的摩尔比进行混合,得到干扰组合物3。
4、干扰组合物4
取实施例1制备的hgene-119、fgene-485和hgene-416,按照1:1:1的摩尔比进行混合,得到干扰组合物4。
5、干扰组合物5
取实施例1制备的对照寡聚核酸1、对照寡聚核酸2、阴性对照寡聚核酸1和阴性对照寡聚核酸2,按照1:1:1:1的摩尔比进行混合,得到干扰组合物5。
二、干扰组合物对感染犬瘟热弱毒cdv3-cl株的vero细胞复制的抑制作用
1、用犬瘟热弱毒cdv3-cl株侵染vero细胞,得到感染犬瘟热弱毒cdv3-cl株的vero细胞。
2、取感染犬瘟热弱毒cdv3-cl株的vero细胞,置于dmem培养基中培养,获得浓度为5×106个/ml的细胞悬浮液。
3、完成步骤2后,将所述细胞悬浮液接种于6孔板,每孔接种1ml(约5×106个感染犬瘟热弱毒cdv3-cl株的vero细胞),然后置于37℃、5%co2培养箱中培养24h,使感染犬瘟热弱毒cdv3-cl株的vero细胞贴壁。
4、完成步骤3后,将所述6孔板中的培养基更换为500μlopti-mem培养基,然后加入5μg步骤一制备的干扰组合物1,进行转染(转染过程中,转染试剂为lipofectamine2000,培养基为opti-mem培养基,共转染的步骤参考lipofectamin2000说明书),然后置于37℃、5%co2培养箱中孵育5h,得到细胞培养物1。
按照上述步骤,将干扰组合物1分别替换为干扰组合物2、干扰组合物3、干扰组合物4和干扰组合物5,其它步骤均不变,得到细胞培养物2、细胞培养物3、细胞培养物4和细胞培养物5。
取vero细胞,置于dmem培养基中培养,获得浓度为5×106个/ml的细胞悬浮液;将所述细胞悬浮液接种于6孔板,每孔接种1ml(约5×106个vero细胞),然后置于37℃、5%co2培养箱中培养24h,使vero细胞贴壁;将所述6孔板中的培养基更换为500μlopti-mem培养基,然后加入干扰组合物5,进行转染(转染过程中,转染试剂为lipofectamine2000,培养基为opti-mem培养基,共转染的步骤参考lipofectamin2000说明书),然后置于37℃、5%co2培养箱中孵育5h,得到细胞培养物6,作为空白对照。
在光学显微镜下观察细胞培养物1、细胞培养物2、细胞培养物3、细胞培养物4、细胞培养物5或细胞培养物6中的细胞病变情况。
部分实验结果见图4(a为细胞培养物6,即干扰组合物5转染vero细胞;b为细胞培养物1,即干扰组合物1转染感染犬瘟热弱毒cdv3-cl株的vero细胞;c为细胞培养物2,即干扰组合物2转染感染犬瘟热弱毒cdv3-cl株的vero细胞;d为细胞培养物3,即干扰组合物3转染感染犬瘟热弱毒cdv3-cl株的vero细胞;e为细胞培养物5,即干扰组合物5转染感染犬瘟热弱毒cdv3-cl株的vero细胞)。结果表明,干扰组合物1、干扰组合物2、干扰组合物3和干扰组合物4均可抑制感染犬瘟热弱毒cdv3-cl株的vero细胞病毒复制。
提取细胞培养物(细胞培养物1、细胞培养物2、细胞培养物3、细胞培养物4或细胞培养物6)的总rna,然后用逆转录酶进行反转录,得到cdna,向上述cdna加入ddh2o稀释,得到cdna浓度为1000ng/μl的模板溶液。以该模板溶液为模板,通过荧光定量pcr检测细胞培养物中n基因、f基因或h基因的相对表达量(以hactb基因为内参基因)。鉴定n基因的引物为5’-aggtaatcccaagcatcaactctgt-3’和5’-ttcgacccttcgtctacaattttg-3’。鉴定h基因的引物为5’-gcagagtattccccctatccgtatc-3’和5’-actccgtctgagatagcggttagc-3’。鉴定f基因的引物为5’-gcaaactagccacagatcggataac-3’和5’-tcgctccttgggtgacactctc-3’。鉴定hactb基因的引物为5’-ccctggcacccagcac-3’和5’-gccgatccacacggagtac-3’。
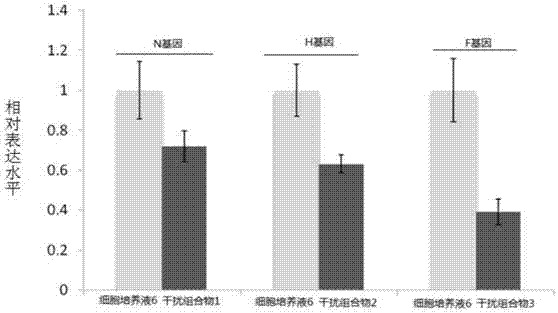
将细胞培养物6中n基因的相对表达量作为1,细胞培养物1中n基因的相对表达量见图5。将细胞培养物6中f基因的相对表达量作为1,细胞培养物1中f基因的相对表达量见图5。将细胞培养物6中h基因的相对表达量作为1,细胞培养物1中h基因的相对表达量见图5。
结果表明,干扰组合物1可抑制感染犬瘟热弱毒cdv3-cl株的vero细胞中n基因的相对表达量,干扰组合物2可抑制感染犬瘟热弱毒cdv3-cl株的vero细胞中f基因的相对表达量,干扰组合物3可抑制感染犬瘟热弱毒cdv3-cl株的vero细胞中h基因的相对表达量,干扰组合物4可抑制感染犬瘟热弱毒cdv3-cl株的vero细胞中n基因、f基因和h基因的相对表达量。
- 还没有人留言评论。精彩留言会获得点赞!
- 基于DNA酶嵌合引物的核酸筛查生物传感器的制造方法与工艺
- 一种高密度、高稳定性的核酸芯片及其制备方法与流程
- CYP2C9*3基因多态性快速检测的引物、分子信标、试剂盒及其检测方法与流程
- 黄牛ADNCR基因单核苷酸多态性的四引物扩增受阻突变体系PCR检测方法及其应用与制造工艺
- 一种原位杂交探针及其对大麦染色体组鉴定的方法与制造工艺
- 一种大麦亚端粒寡核苷酸探针及其应用的制造方法与工艺
- 一种核酸检测的复合物及其制备方法与核酸检测的方法与制造工艺
- 用于检测人类ROS1融合基因的核酸、试剂盒及方法与制造工艺
- 一种特异性结合GPC3的核酸适配体及其应用的制造方法与工艺
- 一种单链核酸分子、聚合酶活性测定方法及试剂盒与制造工艺