一种药物组合物及其应用的制作方法
本发明涉及肿瘤药物研究领域,尤其涉及一种药物组合物及其应用。
背景技术:
肿瘤是机体在各种致瘤因素作用下,局部组织的细胞在基因水平上失去对其生长的正常调控导致异常增生与分化而形成的新生物。新生物一旦形成,不因病因消除而停止生长,他的生长不受正常机体生理调节,而是破坏正常组织与器官,这一点在恶性肿瘤尤其明显。与良性肿瘤相比,恶性肿瘤生长速度快,呈浸润性生长,易发生出血、坏死、溃疡等,并常有远处转移,造成人体消瘦、无力、贫血、食欲不振、发热以及严重的脏器功能受损等,最终造成患者死亡。
肾癌是一种严重危害人类健康的恶性疾病遥大多数晚期肾癌对放化疗不敏感袁且预后较差,细胞免疫治疗对肿瘤的生物治疗取得了良好效果并逐渐成为肿瘤治疗的重要手段之一。近年细胞因子诱导的杀伤细胞(cytokine induced killer,CIK)的免疫功能得到广泛研究,CIK细胞作为一种新型的广谱抗肿瘤免疫细胞,不仅具有强大的广谱抗肿瘤效应,而且可以调节增强肿瘤患者的免疫功能。
程序性死亡受体1(Programmed Death-1;PD-1),是一种重要的免疫抑制分子,为CD28超家族成员,其最初是从凋亡的小鼠T细胞杂交瘤2B4.11克隆出来。PD-1主要是在激活的T细胞和B细胞中表达,具有抑制细胞激活的功能,这是免疫系统中一种正常的自稳机制,因为过度的T/B细胞激活会引起自身免疫疾病,所以PD-1相当于人体内的一道护栏。
CN 105326893 A公开了一种抗癌组合物及其制剂。该组合物包括DC-CIK细胞和康艾注射液。该发明将DC-CIK细胞与康艾注射液联合使用时,在药物用量减少的情况下效果更好,可有效治疗癌症。该抗癌组合物针对性不强,也没有有力的证据可以证明其对癌症有显著的治疗效果。
CN 105744955 A公开了包含抗CEACAM1抗体的组合物、包含能够抑制或阻断PD-1和其配体之间相互作用的抗体的组合物,以及在治疗癌症中所述组合物组合使用的方法。该发明将PD-1抗体单独施用或与别的抗体结合,其针对性不强,也没有有力的证据证明其对癌症有明显的治疗效果。
技术实现要素:
针对目前存在的问题,本发明提供一种药物组合物及其应用,所述药物组合物包括PD-1抗体和非特异性扩增激活T细胞,该药物组合物对肾癌有明显的治疗效果,按RESIST标准评价均达到PR(部分缓解)或接近CR(完全缓解),有效率达100%,而副作用都十分微小,无3或4级不良反应发生。
为达此目的,本发明采用以下技术方案:
一方面,本发明提供一种药物组合物,所述组合物包括PD-1抗体和非特异性扩增激活T细胞。
本发明中,非特异性扩增激活T细胞指的是CD8+T、CD4+T经过扩增激活后,获得的一类具有广谱杀伤功能的CD8CD4混合T淋巴细胞群,由患者外周血中的T淋巴细胞经多种细胞因子活化扩增而成,具有正向免疫调节作用,如它们能分泌多种细胞因子如IFN-γ、IL-2等,还能抑制免疫抑制细胞如MDSC等,非特异性扩增激活T细胞回输到患者体内后,它们能进入肿瘤组织中。在肿瘤组织的微环境中,它们发挥免疫调控的作用,通过分泌的IFN-γ等细胞因子诱导肿瘤细胞表达PD-1的配体PD-L1,并抑制肿瘤微环境中的免疫抑制细胞,发挥免疫调控作用。PD-1抗体主要通过阻断肿瘤组织中T淋巴细胞上的PD-1分子与PD-L1结合,重新活化T淋巴细胞对肿瘤细胞的杀伤。但由于肿瘤微环境中免疫抑制因素如MDSC及Treg等细胞的存在,减低了PD-1抗体对T淋巴细胞的再活化作用。非特异性扩增激活T细胞能抑制肿瘤微环境的免疫抑制细胞,因而能增强PD-1抗体的作用。
根据本发明,所述PD-1抗体为从商业途径可以购买得到的PD-1抗体都是可行的,不同购买途径的PD-1抗体不会对本申请的药物组合物的药效造成影响,本申请的PD-1抗体购买自Keytruda,PD-1抗体为美国FDA已批复的处方药,所述PD-1抗体的浓度为1-10mg/kg,例如可以是1mg/kg、1.5mg/kg、2mg/kg、2.5mg/kg、3mg/kg、3.5mg/kg、4mg/kg、4.5mg/kg、5mg/kg、5.5mg/kg、6mg/kg、6.5mg/kg、7mg/kg、7.5mg/kg、8mg/kg、8.5mg/kg、9mg/kg、9.5mg/kg或10mg/kg,优选为1-5mg/kg,进一步优选为2mg/kg,以及上述数值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
根据本发明,所述非特异性扩增激活T细胞的数量为(3-12)×109个,例如可以是3×109个、3.1×109个、3.2×109个、3.3×109个、3.5×109个、3.8×109个、4×109个、4.2×109个、4.5×109个、4.8×109个、5×109个、5.3×109个、5.5×109个、5.8×109个、5.83×109个、6×109个、6.5×109个、7×109个、7.5×109个、8×109个、8.5×109个、9×109个、9.5×109个、10×109个、10.5×109个、11×109个、11.5×109个或12×109个,优选为(6-10)×109个,进一步优选为5.83×109个,以及上述数值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
优选地,所述非特异性扩增激活T细胞的制备方法包括如下步骤:
(1)抽取患者外周血,离心;
(2)离心后的上层血浆放入4℃冰箱中保存,用生理盐水稀释下层血细胞,稀释后的血细胞加至淋巴细胞细胞分离液上层,离心;
(3)离心后提取单个核细胞,用生理盐水洗涤,进行细胞计数;
(4)细胞计数后接种在包被过重组人纤粘连蛋白(RetroNectin)、CD3单抗和PBS的培养瓶内,加入完全培养液50-60mL,放入5%CO2培养箱中,37℃进行非特异性扩增激活T细胞的培养;
(5)隔日显微镜下观察,根据细胞状态和数量补充完全培养基;
(6)10-20d,优选14d后非特异性扩增激活T细胞成熟,用生理盐水洗涤,重悬后低速离心,弃上清,用含有20%白蛋白的生理盐水重悬细胞。
本发明中,研究发现在淋巴细胞培养体系中加入RetroNectin,促使细胞由G1期进入S期,可以使细胞获得上万倍的细胞增值率。RetroNectin与CD3单抗联合包被,Retronectin参与细胞的附着、伸展、分化和增殖的同时,也增加了CD3单抗与非特异性扩增激活T细胞的接触、附着,即增加了CD3单抗的作用,进一步提高了非特异性扩增激活T细胞的扩增培养效率。
优选地,步骤(1)所述离心的条件为500-1000g,4℃离心10-20min,优选为800g、4℃离心15min。
所述离心的转速为500-1000g,例如可以是500g、550g、600g、650g、700g、750g、800g、850g、900g、950g或1000g,以及上述数值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
所述离心的时间为10-20min,例如可以是10min、11min、12min、13min、14min、15min、16min、17min、18min、19min或20min,以及上述数值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
优选地,步骤(2)所述的生理盐水和血细胞的体积比为(1-3):1,例如可以是1:1、2:1或3:1,优选为1:1,以及上述数值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
优选地,步骤(2)所述离心的条件为500-1000g,16-23℃离心10-20min,优选为800g、20℃离心17min,以及上述数值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
所述离心的转速为500-1000g,例如可以是500g、550g、600g、650g、700g、750g、800g、850g、900g、950g或1000g,以及上述数值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
所述离心的温度为16-23℃,例如可以是16℃、17℃、18℃、19℃、20℃、21℃、22℃或23℃,以及上述数值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
所述离心的时间为10-20min,例如可以是10min、11min、12min、13min、14min、15min、16min、17min、18min、19min或20min,以及上述数值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
优选地,步骤(3)所述洗涤的次数为1-5遍,例如可以是1遍、2遍、3遍、4遍或5遍,优选为2-3遍,以及上述数值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
优选地,步骤(4)所述细胞计数后将细胞进行CD4和CD8磁珠分选,并将获得的CD4+T细胞和CD8+T细胞进行混合。
优选地,所述CD4+T细胞和CD8+T细胞的细胞数量比为1:1。
本发明中,CD8+T即细胞毒性T细胞(Tc)可通过颗粒酶、细胞毒性细胞因子的释放及Fas途径实现对靶细胞的杀伤;CD4+T即辅助性T细胞(Th)可分泌大量细胞因子以维护Tc细胞的免疫应答。这两种效应细胞相互协调是有效维持获得性免疫所必需的,所以非特异性扩增激活T细胞相较于单纯CD8+T或者CIK在体内发生杀伤的效率更高,持续时间也更久。
优选地,步骤(4)所述的完全培养基为无血清培养基中加入800-1200IU/mL IL-2、800-1200IU/mL IFN-γ、100-200IU/mL庆大霉素、50-150IU/mL IL-1α和1-8%自体血浆,优选为1000IU/mL IL-2、1000IU/mL IFN-γ、160IU/mL庆大霉素、100IU/mL IL-1α和5%自体血浆。
所述IL-2的浓度为800IU/mL、850IU/mL、900IU/mL、950IU/mL、1000IU/mL、1050IU/mL、1100IU/mL、1150IU/mL或1200IU/mL,以及上述数值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
所述IFN-γ的浓度为800IU/mL、850IU/mL、900IU/mL、950IU/mL、1000IU/mL、1050IU/mL、1100IU/mL、1150IU/mL或1200IU/mL,以及上述数值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
所述庆大霉素的浓度为100IU/mL、120IU/mL、130IU/mL、140IU/mL、150IU/mL、160IU/mL、180IU/mL、190IU/mL或200IU/mL,以及上述数值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
所述IL-1α的浓度为50IU/mL、60IU/mL、70IU/mL、80IU/mL、90IU/mL、100IU/mL、110IU/mL、120IU/mL、130IU/mL、140IU/mL或150IU/mL,以及上述数值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
所述自体血浆的质量分数为1%、2%、3%、4%、5%、6%、7%或8%,以及上述数值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
优选地,步骤(6)所述的洗涤后进行离心,离心的条件为100-500g,4℃离心5-16min,优选为300g、4℃离心8min。
所述离心的转速为100-500g,例如可以是100g、150g、200g、250g、300g、350g、400g、450g、500g、550g或600g,以及上述数值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
所述离心的时间为5-16min,例如可以是5min、6min、7min、8min、9min、10min、11min、12min、13min、14min、15min或16min,以及上述数值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
优选地,所述非特异性扩增激活T细胞的制备方法包括如下步骤:
(1)抽取病人外周血50mL(肝素钠抗凝),分装在两个50mL的离心管内800g、4℃离心15min;
(2)离心后抽取上层血浆于50mL离心管中放于4℃冰箱中保存;
(3)将离心管中的血细胞与生理盐水1:1稀释,缓慢加至淋巴细胞细胞分离液上层,800G、20℃离心17min;
(4)离心后提取单个核细胞(即白膜层)置于50mL离心管内,加入生理盐水洗涤,300G、4℃离心8min,洗2遍;
(5)细胞计数后将细胞进行CD4和CD8磁珠分选,并将获得的CD4+T细胞和CD8+T细胞按细胞数量比1:1进行混合,细胞接种在包被过RetroNectin60μL/瓶、CD3单抗15μL/瓶、PBS 10mL/瓶的培养瓶内,加入完全培养液50-60mL,所述完全培养基为无血清培养液中加入IL-2为1000IU/mL,IFN-γ为1000IU/mL,庆大霉素为160IU/mL,IL-1α为50-150IU/mL,5%自体血浆,放入5%CO2培养箱中,37℃进行非特异性扩增激活T细胞的培养。
(6)隔日显微镜下观察,根据细胞状态和数量适量补充完全培养基;
(7)14d左右非特异性扩增激活T细胞成熟,提前进行质控检测,合格后结合医嘱回收细胞,用生理盐水洗3遍,重悬后低速离心、弃上清,用适量含有20%白蛋白的生理盐水重悬细胞
第二方面,本发明提供如第一方面所述的药物组合物在制备抗肿瘤药物中的应用。
优选地,所述肿瘤为肺癌、乳腺癌、肾癌或肝癌中的任意一种或至少两种的组合,优选为肾癌。
优选地,所述抗肿瘤药物还包括药学上接受的辅料。
优选地,所述辅料为赋形剂、稀释剂、载体、调味剂、粘合剂和填充剂中的任意一种或至少两种的组合。
第三方面,本发明提供一种检测如第一方面所述的药物组合物对肾癌细胞抑制作用的方法,包括如下步骤:
通过将如第一方面所述的药物组合物移植到患有肾癌的模型生物体内,检测模型生物体内肾癌肿瘤组织块来判断药物组合物对肾癌细胞的抑制作用。
本发明中,所述模型用于非治疗目的的检测药物组合物对肾癌细胞抑制作用,通过将药物组合物移植到患有肾癌的免疫缺陷小鼠体内,构建可有效模拟肾癌病人体内病理微环境的人源化小鼠模型,并在该模型中模拟临床治疗模型多次移植药物组合物,确保药物组合物的稳定供给,通过肿瘤监控评估药物组合物对肾癌的治疗作用。
优选地,所述药物组合物转移的频率为2-5周一次,例如可以是2周一次、3周一次、4周一次或5周一次,优选为3周一次,以及上述数值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
根据本发明,所述模型生物体为本领域常规的模型生物,本发明模型生物可以选自兔、鼠、猫、狗或猴中的任意一种模型生物,优选为免疫缺陷小鼠模型。
优选地,所述检测的方式为量取肾癌肿瘤组织块大小、称量肾癌肿瘤组织块重量、荧光素酶-活体成像技术或流式细胞仪和免疫组化技术中的任意一种或至少两种的组合。
根据本发明,所述量取肝癌肿瘤组织块大小、称量肝癌肿瘤组织块重量的方式、荧光素酶-活体成像技术或流式细胞仪和免疫组化技术为本领域常规的量取方法,本领域技术人员可以根据实际需要进行选择,在此不做特殊限定。
第四方面,本发明提供如第三方面所述的方法在评估药物组合物对肾癌细胞抑制效果中的应用。
与现有技术相比,本发明具有如下有益效果:
(1)本发明药物组合物包括PD-1抗体和非特异性扩增激活T细胞,两种组分协同作用,能够明显抑制肾癌细胞的生长,并对肾癌细胞具有杀伤作用;
(2)本发明药物组合物对肾癌有明显的治疗效果,按RESIST标准评价均达到PR(部分缓解)或接近CR(完全缓解),有效率达100%,而副作用都十分微小,无3或4级不良反应发生。
附图说明
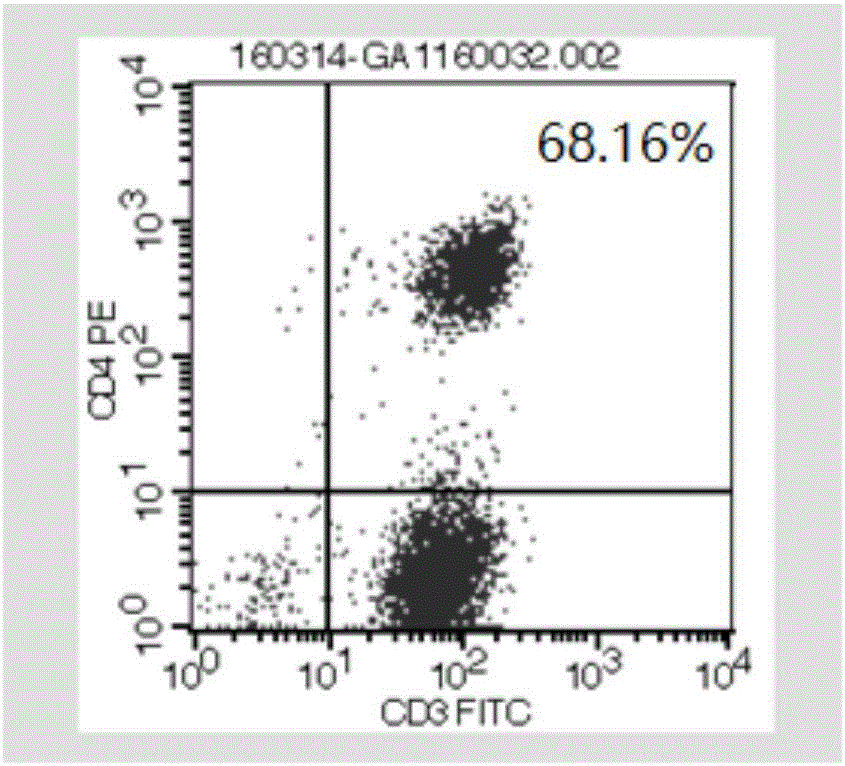
图1为成熟的非特异性扩增激活T细胞的流式细胞仪检测结果,其中,图1(A)为CD3+CD4+细胞的结果,图1(B)为CD3+CD8+细胞的结果,PE和FITC为流式细胞仪的通道;
图2为施用本发明药物组合物后临床实验结果,其中,图2(A)-(B)治疗前的脑胸部转移灶的肿瘤大小结果图,图2(C)-(D)治疗2月后脑胸部转移灶的肿瘤大小结果图,图2(E)-(F)治疗6月后脑胸部转移灶的肿瘤大小结果图;
图3为本发明施用本发明药物组合物后临床实验结果,其中,图3(A)-(E)治疗前的骨、肝、脑、胰腺及右肾多发转移灶肿瘤大小结果图,图3(F)-(J)治疗3月后各器官多发转移灶肿瘤大小结果图,图3(K)-(O)治疗5月后病灶肿瘤大小结果图,图3(P)-(T)治疗11月后病灶肿瘤大小结果图;
图4施用本发明药物组合物后临床实验结果,其中,图4(A)-(E)治疗前的胸腹部多发转移灶肿瘤大小结果图,图4(F)-(J)治疗45天后胸腹部多发转移灶肿瘤大小结果图,图4(K)-(O)治疗3月后病灶肿瘤大小结果图,图4(P)-(T)治疗5月后病灶肿瘤大小结果图;
图5施用本发明药物组合物后临床实验结果,其中,图5(A)、图5(C)和图5(E)为治疗前的肺部多发转移灶的肿瘤大小结果图,图5(B)、图5(D)和图5(F)为治疗2.5月后肺部多发转移灶的肿瘤大小结果图;
图6施用本发明药物组合物后临床实验结果,其中,图6(A)-(D)为治疗4周期后肺部转移灶的肿瘤大小结果图。
具体实施方式
为更进一步阐述本发明所采取的技术手段及其效果,以下结合附图并通过具体实施方式来进一步说明本发明的技术方案,但本发明并非局限在实施例范围内。
实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件,或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可通过正规渠道商购获得的常规产品。
实施例1:制备非特异性扩增激活T细胞
所述非特异性扩增激活T细胞的制备方法包括如下步骤:
(1)抽取病人外周血50mL(肝素钠抗凝),分装在两个50mL的离心管内800g、4℃离心15min;
(2)离心后抽取上层血浆于50mL离心管中放于4℃冰箱中保存;
(3)将离心管中的血细胞与生理盐水1:1稀释,缓慢加至淋巴细胞细胞分离液上层,800g、20℃离心17min;
(4)离心后提取单个核细胞(即白膜层)置于50mL离心管内,加入生理盐水洗涤,300g、4℃离心8min,洗2遍;
(5)细胞计数后将细胞进行CD4和CD8磁珠分选,并将获得的CD4+T细胞和CD8+T细胞按细胞数量比1:1进行混合,细胞接种在包被过(RetroNectin60μL/瓶、CD3单抗15μL/瓶、PBS 10mL/瓶)的培养瓶内,加入完全培养液50-60mL,所述完全培养基为无血清培养液中加入IL-2为1000IU/mL,IFN-γ为1000IU/mL,庆大霉素为160IU/mL,IL-1α为50-150IU/mL,5%自体血浆,放入5%CO2培养箱中,37℃进行非特异性扩增激活T细胞的培养;
(6)隔日显微镜下观察,根据细胞状态和数量适量补充完全培养基;
(7)14d后非特异性扩增激活T细胞成熟,提前进行质控检测,合格后结合医嘱回收细胞,用生理盐水洗3遍(重悬后低速离心、弃上清),用适量含有20%白蛋白的生理盐水重悬细胞。
将细胞进行流式细胞仪鉴定,结果如图1(A)-1(B)所示,CD3+CD4+含量为34.66%,CD3+CD8+含量为68.16%,符合细胞发放标准。
实施例2:药物组合物对小鼠模型肾癌细胞的抑制作用
(1)小鼠肾癌模型的建立采用皮下抑制模型,便于观察肿瘤生长情况。取正常6周龄裸鼠25只,每只老鼠体重约为20g,在每只裸鼠右侧鼠鼠鼷处皮下注射0.2mL肾癌细胞悬液,10d于接种出长出2~3mm瘤时,小鼠黑色素瘤模型制作成功。
(2)分组及处理
造模后小鼠随机分成5组,每组5只,分别包括PBS对照组(腹腔注射灭菌PBS 1mL),PD-1单抗处理组(腹腔注射2mg/kg),非特异性扩增激活T细胞处理组(双歧杆菌5.83×109个),药物组合物处理组,与接种瘤细胞后次日开始给药,每三周给药一次,连续给药4个周期。
(3)对小鼠肾癌细胞抑制作用的研究
停药次日并称重处死小鼠,解剖剥离肿瘤块,称瘤重,按平均瘤重计算抑瘤率。抑瘤率=[(对照组肿瘤体积-实验组肿瘤体积)/对照组肿瘤体积]×100%。
(4)实验结果
结果显示,处理组与PBS对照组相比,前者明显抑制了小鼠肾癌细胞的生长,PD-1单抗处理组、非特异性扩增激活T细胞处理组和药物组合物处理组的抑瘤率分别为27%、70%、100%。其中,药物组合物处理组和其他两组相比,有显著差异(P<0.05)。说明,药物组合物处理组使用抑制肾癌细胞效果要高于其他各组
实施例3:临床实验
男,50岁。2012.12诊为左肾透明细胞癌并肺骨转移,行左肾癌手术切除后,应用双磷酸盐维持治疗,2013.5因脑转移γ-刀放疗。2013.9-2014.10,因肺部肿瘤进展口服索坦治疗,期间及2013.11因脑部出现新病灶行γ-刀放疗及全脑放疗。2014.11-2015.5:因脑肺转移进展改用依维莫司治疗,期间2014.4行γ-刀立体定向放射外科治疗。
2015.6-2016.1:因脑胸部肿瘤再次进展,应用PD-1抗体(keytruda)2mg/kg,三周一次,共8次。非特异性扩增激活T细胞5.83×109/次,共11次。结果如图2所示,图2(A)-(B)显示治疗前肾癌肿瘤的最大直径之和为6.7cm,图2(C)-(D)显示治疗2月后脑胸部转移灶的肿瘤明显缩小,图2(E)-(F)显示治疗6月后脑胸部转移灶的肿瘤的最大直径之和为1.4cm,肿瘤缩小79.1%,明显治疗2月后脑胸部转移灶逐渐缩小,疗效持续6.5个月,疗效评价达PR(部分缓解)。
2016.2-2016.6.8:脑转移灶再次进展,对症支持治疗,2016年6月8日去世
不良反应:回输PD-1抗体后最高体温37.8℃,持续36小时(没有用退热药物)。轻度乏力(可能与治疗无关)。
实施例4:临床实验
男,66岁。2012.6诊断为左肾透明细胞癌并多发骨转移,行左肾癌切除术。
2012.7-2015.7:口服索拉菲尼治疗。2013.7行第三腰椎放疗(30Gy/10f),2015.4因左肱骨病理性骨折行左肱骨内钢板内固定术。
2015.7-2015.10:因骨转移进展口服舒尼替尼治疗。在此期间肿瘤进一步转移到肝、脑、胰腺及右侧肾上腺,口服舒尼替尼期间出现Ⅲ度血小板减少及贫血,Ⅱ度阴囊皮肤溃疡。
2015.7-2016.8:因肿瘤进展无法控制,应用PD-1抗体(keytruda)2mg/kg,三周一次,共10次,联合非特异性扩增激活T细胞5.83×109/次,共10次,结果如图3所示,图3(A)-(E)显示治疗前病灶肿瘤的最大直径之和为6.1cm,有胸水,图3(F)-(J)显示治疗3月后病灶肿瘤的最大直径之和明显缩小,图3(K)-(O)显示治疗5月后病灶肿瘤的最大直径之和几乎不可见,图3(P)-(T)显示治疗11月后病灶肿瘤消失,胸水消失,疗效持续大于10个月,疗效评价为CR(完全缓解)。
不良反应:前2次PD-1抗体回输后最高体温38.2℃,1度甲状腺功能减低。
实施例5:临床实验
男,79岁。2016.6诊断为左肾透明细胞癌,行左肾癌根治术。
2015.10-2016.3:因胸腹部多发转移,口服阿昔替尼治疗,效果差,肿瘤持续进展,出现皮疹及腹泻3级不良反应。
2015.6-至今:应用PD-1抗体2mg/kg,三周一次,共联合非特异性扩增激活T细胞5.83×109/次6次。为缓解第三腰椎疼痛在免疫治疗前进行了局部放疗,结果如图4所示,图4(A)-(E)显示治疗前病灶肿瘤的最大直径之和为6.3cm,图4(F)-(J)显示治疗45天后病灶肿瘤的最大直径之和为0.6cm,图4(K)-(O)显示治疗3月后病灶肿瘤的最大直径之和明显缩小,图4(P)-(T)显示治疗5月后病灶肿瘤的最大直径之和为0.6cm,肿瘤缩小91.5%,治疗持续大于7个月,疗效评价为PR(部分缓解)。
不良反应:每次PD-1抗体及回输后皮肤出现数片荨麻疹,不用药物自行消退。
实施例6:临床实验
男,65岁,右肾癌3期术后3月出现肺转移,应用索拉菲尼治疗2年半后耐药出现疾病进展,应用PD-1抗体2mg/kg,三周一次,共联合非特异性扩增激活T细胞5.83×109/次6次,结果如图5(A)-(F)所示,治疗前转移肺的肿瘤最大直径之和为2.3cm,治疗1月后转移肺的肿瘤的最大直径之和缩小为1.9cm,肿瘤缩小23.5%,治疗1月后复查肺部转移灶开始缩小,治疗2月半后复查肿瘤几乎消失,疗效评价为CR(完全缓解)。
不良反应:副作用为PD1回输后低热、乏力,3天后缓解,自述副作用远较索拉菲尼小。
实施例7:临床实验
男,58岁。2014年11月行右肾癌根治术,术后11月出现肺转移。
2015年11月至2016年7月:应用PD-1抗体2mg/kg,三周一次,共联合非特异性扩增激活T细胞5.83×109/次6次,结果如图6(A)-图6(D)所示,治疗前转移肺的肿瘤最大直径之和为1.2cm,治疗11月后转移肺的肿瘤细胞基本消失,疗效持续大于11个月,疗效评价为CR(完全缓解)。
不良反应:无明显不良反应。
综上所述,本发明药物组合物通过PD-1抗体和非特异性扩增激活T细胞协同作用,对肾癌有明显的治疗效果,按RESIST标准评价均达到PR(部分缓解)或接近CR(完全缓解),有效率达100%,而副作用都十分微小,无3或4级不良反应发生。
申请人声明,本发明通过上述实施例来说明本发明的详细方法,但本发明并不局限于上述详细方法,即不意味着本发明必须依赖上述详细方法才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
- 还没有人留言评论。精彩留言会获得点赞!