一种间充质干细胞无血清培养基的制作方法
本发明属于生物医药领域,具体涉及一种间充质干细胞无血清培养基。
背景技术:
间充质干细胞(mesenchymal stem cell,MSC)是中胚层来源的具有高度自我更新能力和多向分化潜能的多能干细胞,已从肌肉、脂肪、牙周质、脐血、脐带等多种组织中分离得到,在特定条件下能分化为成骨细胞、软骨细胞、脂肪细胞和神经元等。来源广泛且不存在伦理道德等问题,MSC已经在多方面被证明是自体和异体细胞移植、治疗的理想种子细胞。目前国内外已开展了多项MSC临床应用研究,涉及多种来源的MSC类型及多种疾病类型。
临床应用的干细胞制剂制备所用的培养基成分应有足够的纯度并符合无菌、无致病微生物及内毒素的质量标准,残留的培养基对受者应无不良影响;在满足干细胞正常生长的情况下,不影响干细胞的的“干性”及分化能力。血清中含有大量的氨基酸、核苷、蛋白质、激素、脂类等微量成分,这些成分的含量和具体作用仍没有完全确定。而且血清经常被病毒污染,还含有血小板生长因子等可能抑制细胞生长的物质。因此,成分确定且质量可控的无血清培养基是临床应用MSC培养的必然选择。
技术实现要素:
本发明的目的是提供一种间充质干细胞无血清培养基,该培养基不含血清,成分确定,符合无菌、无致病微生物及内毒素的质量标准,可以满足间充质干细胞正常生长,且不影响间充质干细胞的“干性”及分化能力;残留的培养基对受者应无不良影响。
本发明的间充质干细胞无血清培养基,包括基础培养基和添加成分,添加成分及其含量如下:
优选,所述的基础培养基为L-DMEM、DMEM-F12或α-MEM培养基。
本发明提供的间充质干细胞无血清培养基成分确定,质量可控,用其培养间充质干细胞生长正常;多次传代次后仍保持了间充质干细胞的“干性”及分化为成骨细胞、软骨细胞、脂肪细胞和神经元等类型细胞的能力。
附图说明
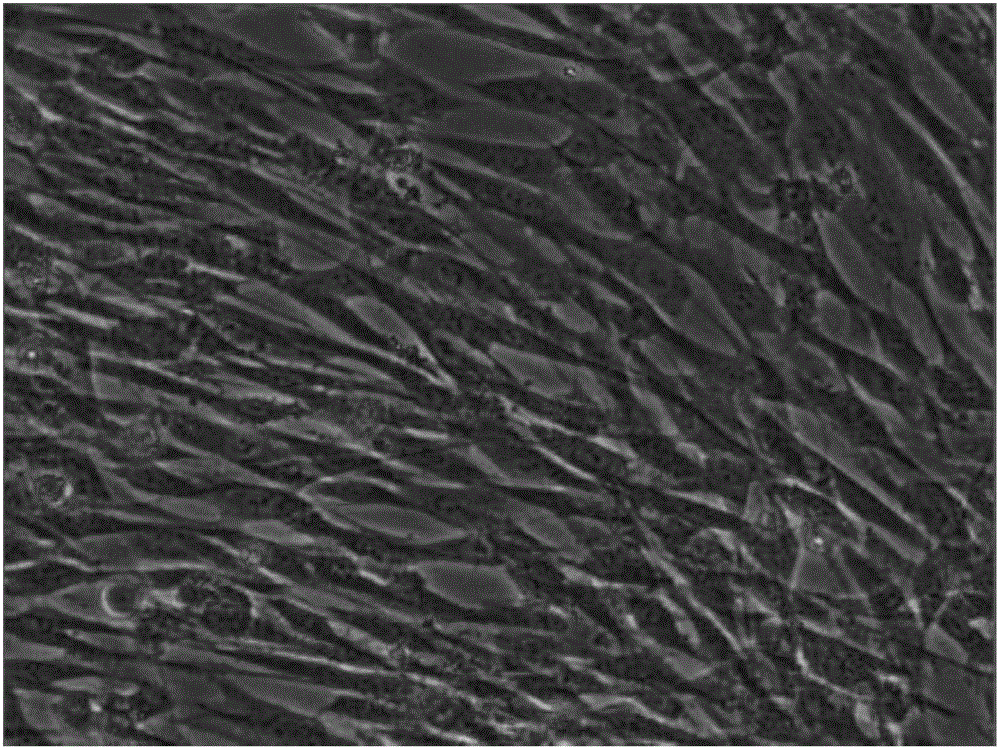
图1是脐带间充质干细胞传代培养至第3代第二天的生长状况。
图2是脐带间充质干细胞传代培养至第3代第三天的生长状况。
具体实施方式
以下实施例是对本发明的进一步说明,而不是对本发明的限制。
本发明中所用的粘连蛋白购自Gene Operation,层粘连蛋白购自R&D,转铁蛋白、胰蛋白酶、抑肽酶、生长激素、胰岛素、氢化可的松、地塞米松、胆碱、亚油酸、亚硒酸钠、磷酸乙醇胺、维生素C、维生素E、维生素B12和生物素购自Sigma,bFGF、EGF、B27、IGF-I、IGF-II和谷胱甘肽购自Gibco。所用的L-DMEM、DMEM-F12或α-MEM培养基购自Gibco。
实施例1:
本实施例的一种间充质干细胞无血清培养基,以L-DMEM培养基为基础培养基,还包括以下添加成分,添加成分及其含量(终浓度)如下:粘连蛋白25μg/mL、层粘连蛋白25μg/mL、转铁蛋白0.2ng/mL、胰蛋白酶10μg/mL、抑肽酶0.1mg/mL、生长激素20ng/mL、胰岛素1U/mL、氢化可的松0.5μg/mL、地塞米松0.2nM、bFGF 20ng/mL、EGF 30ng/mL、B27体积分数1%、IGF-I 10ng/mL、IGF-II 30ng/mL、胆碱30nM、亚油酸10nM、亚硒酸钠30nM、磷酸乙醇胺50nM、谷胱甘肽2.5μg/mL、维生素C 50μg/mL、维生素E 30μg/mL、维生素B12 10μM、生物素20μM。
其具体配制方法是在L-DMEM培养基中添加上述添加成份,并使其终浓度为上述浓度,由此得到间充质干细胞无血清培养基。
实施例2:
本实施例的一种间充质干细胞无血清培养基,以DMEM-F12培养基为基础培养基,还包括以下添加成分,添加成分及其含量(终浓度)如下:层粘连蛋白40μg/mL、转铁蛋白2ng/mL、胰蛋白酶20μg/mL、抑肽酶0.1mg/mL、生长激素30ng/mL、胰岛素10U/mL、氢化可的松1μg/mL、地塞米松0.3nM、bFGF 40ng/mL、EGF 20ng/mL、B27体积分数2%、IGF-I 10ng/mL、IGF-II 20ng/mL、胆碱30nM、亚油酸20nM、亚硒酸钠15nM、磷酸乙醇胺30nM、谷胱甘肽5μg/mL、维生素C 50μg/mL、维生素E 30μg/mL、维生素B12 20μM、生物素30μM。
其具体配制方法是在DMEM-F12培养基中添加上述添加成份,并使其终浓度为上述浓度,由此得到间充质干细胞无血清培养基。
实施例3:
本实施例的一种间充质干细胞无血清培养基,以α-MEM培养基为基础培养基,还包括以下添加成分,添加成分及其含量(终浓度)如下:层粘连蛋白50μg/mL、转铁蛋白0.2ng/mL、胰蛋白酶30μg/mL、抑肽酶0.1mg/mL、生长激素30ng/mL、胰岛素6U/mL、氢化可的松1μg/mL、地塞米松0.3nM、bFGF 30ng/mL、EGF 30ng/mL、B27体积分数3%、IGF-I 10ng/mL、IGF-II 10ng/mL、胆碱20nM、亚油酸20nM、亚硒酸钠20nM、磷酸乙醇胺20nM、谷胱甘肽2.5μg/mL、维生素C 50μg/mL、维生素E 30μg/mL、维生素B12 20μM、生物素30μM。
其具体配制方法是在α-MEM培养基中添加上述添加成份,并使其终浓度为上述浓度,由此得到间充质干细胞无血清培养基。
实施例4:实施例1制备的间充质干细胞无血清培养基培养MSC细胞
(1)MSC复苏方法
从液氮罐中取出脐带间充质干细胞(UMSC细胞)冻存管,直接浸入37℃水浴锅中,并不时摇动令其尽快融化。溶化后将UMSC细胞转移至离心管中,并往离心管中滴加UMSC细胞的10倍以上体积的实施例1制备的间充质干细胞无血清培养基,混匀。离心,去上清,加入实施例1制备的间充质干细胞无血清培养基,计数,调整细胞密度,接种至细胞培养皿或培养瓶中,37℃、CO2培养箱静置培养。
(2)MSC传代方法
MSC细胞达到90%汇合时,吸出培养基,用PBS清洗,加入适量0.25%胰蛋白酶消化2-5min,吸弃胰蛋白酶加入实施例1制备的间充质干细胞无血清培养基,将细胞吹散,离心,去上清,加入实施例1制备的间充质干细胞无血清培养基,计数,调整细胞密度,接种至细胞培养皿或培养瓶中,37℃、CO2培养箱静置培养。图1和图2是脐带间充质干细胞传代培养至第3代第二天和第三天的生长状况。
如此往复进行传代至得到第20代脐带间充质干细胞后,对第20代脐带间充质干细胞进行干细胞表面标志测定、向成骨细胞分化潜能的检测、向脂肪细胞分化潜能的检测、向神经元分化潜能的检测。具体的检测方法包括:干细胞表面标志测定、向成骨细胞分化潜能的检测和向脂肪细胞分化潜能的检测按照文献(王娟,陆琰,何冬梅.人脐带间充质干细胞体外分离、纯化及鉴定.暨南大学学报:医学版,2009,30:367-372)中的方法进行。结果表明,在进行20代传代的情况下,分离培养的间充质干细胞还具有干细胞的特异性表面标志、向成骨细胞分化潜能、向脂肪细胞分化潜能。由此可见,本发明能够很好地用于间充质干细胞的体外培养,且多次传代后细胞仍未丢失分化潜能。
实施例5:
本实施例与实施例4基本相同,只是所用的间充质干细胞无血清培养基是实施例2或实施例3制备的间充质干细胞无血清培养基,按照实施例4的方法进行试验后发现,实施例2或实施例3制备的间充质干细胞无血清培养基也能培养间充质干细胞生长正常;多次传代次后仍保持了间充质干细胞的“干性”及分化为成骨细胞、软骨细胞、脂肪细胞和神经元等类型细胞的能力。
- 还没有人留言评论。精彩留言会获得点赞!