纳米环丙沙星颗粒在抑制铜绿假单胞菌生物被膜形成中的应用的制作方法
本发明涉及一种抑制铜绿假单胞菌生物被膜形成的纳米环丙沙星颗粒制备方法,属于生物纳米领域。
背景技术:
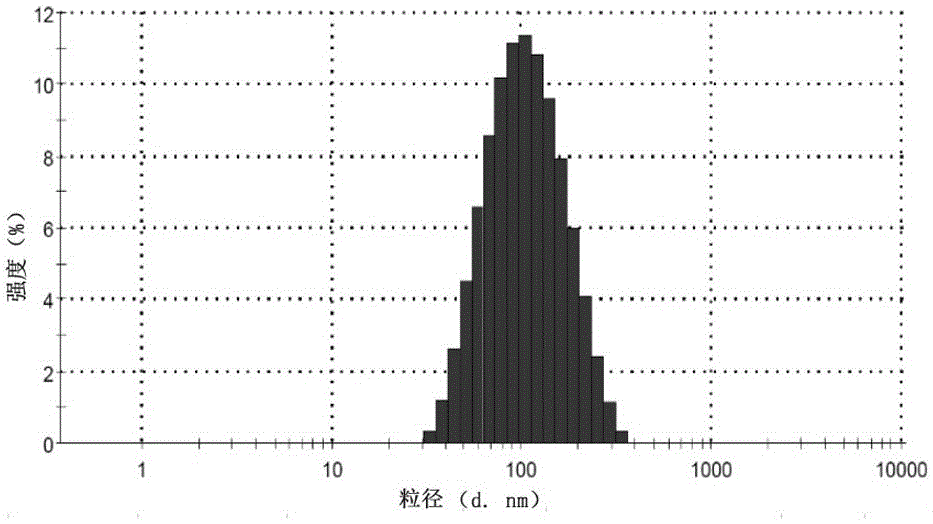
:新型抗生素研制的速度远赶不上临床耐药菌出现的速度,人类将面临着无药可治的严峻挑战。提高现有抗生素抑菌效力似乎也成为人类的救命稻草。目前解决这一难题的一条有效途径就是怎样改变抗生素输送方式和释放位置,从而起到靶向和富集的作用,实现抗生素高效抑制病原菌感染的功效。纳米抗生素(nano-antibiotics)是目前发展的一种新型抗生素体系,可以在纳米尺度输送药物,逃避细菌的耐药机制,被认为是一种有前途的控制细菌感染方法。铜绿假单胞菌(Pseudomonasaeruginosa)生物被膜是细菌粘附在固体表面,分泌一些胞外基质复合物将其包裹其中而形成的膜状结构。这些胞外基质主要包括一些大分子聚合物,它们构成结构坚实的生物被膜,帮助细菌逃避抗生素的作用。生物被膜条件下的铜绿假单胞菌,比在自由浮游状态下对抗生素的耐药性可提高1000倍左右。加上铜绿假单胞菌对多种抗生素固有的和获得性的耐药性,使得铜绿假单胞菌的感染性疾病在临床上治疗非常困难。技术实现要素:本发明的目的在于提供一种抑制铜绿假单胞菌生物被膜形成的纳米环丙沙星颗粒制备方法。本发明的实现过程如下:一种纳米环丙沙星颗粒的制备方法,包括以下步骤:(1)将壳聚糖盐酸盐配成水溶液,调节pH值为5.0,经微孔膜过滤除菌备用;(2)将β-环糊精硫酸盐配成水溶液,经微孔膜过滤除菌备用;(3)将盐酸环丙沙星配成水溶液,经微孔膜过滤除菌,加入到步骤(2)的溶液中,室温搅拌;(4)将步骤(3)得到的溶液加入步骤(1)的溶液中室温搅拌,经离心、洗涤、冷冻干燥后得到目标产物。上述壳聚糖盐酸盐、β-环糊精硫酸盐和盐酸环丙沙星的质量比为(1-3):(1-3):(1-3)。本发明制备方法得到的纳米环丙沙星颗粒可抑制铜绿假单胞菌生物被膜形成。本发明的优点及积极效果:本发明以壳聚糖盐酸盐(Chitosanhydrochloride,CS)和β-环糊精硫酸盐(β-cyclodextrinsulfatecy,S-β-CD)为载体,包裹盐酸环丙沙星(CiprofloxacinHydrochloride,Cip),制备纳米环丙沙星颗粒。CS和S-β-CD构成的包载体系稳定,载药率高,细胞毒性低。纳米环丙沙星颗粒可有效抑制铜绿假单胞菌生物被膜的形成,这将为临床上治疗铜绿假单胞菌感染性疾病提供新的有效途径。附图说明图1为纳米环丙沙星颗粒制备过程中的外观形态;图2为动态光散射检测纳米颗粒粒径分布;图3为纳米环丙沙星颗粒的能谱分析及形貌分析;A:能谱分析;B:扫描电子显微镜;图4为纳米环丙沙星颗粒体外模拟累积释放曲线;图5为纳米环丙沙星颗粒对生物被膜形成的抑制及生物被膜内部细菌的清除作用;图6为纳米环丙沙星颗粒在抑制PAO1生物被膜形成过程中对其厚度的影响;图7为快速银染法和扫描电镜检测纳米环丙沙星颗粒抑制PAO1生物被膜形成。具体实施方式以下实验方法如无特殊说明,均为常规方法,所使用的材料、试剂等如无特殊说明,均可从商业途径得到。实验涉及的仪器为磁力搅拌器,台式高速离心机、紫外分光光度计、动态光散射仪、原子力显微镜、扫描电子显微镜、荧光显微镜。实施例1纳米环丙沙星颗粒的制备(1)CS用无菌双蒸水配成浓度为1.0mg/ml的水溶液,NaOH调节pH值至5.0,无菌微孔膜过滤除菌备用;(2)S-β-CD用无菌双蒸水配成浓度为1.0mg/ml的水溶液,微孔膜过滤除菌备用;(3)Cip用无菌双蒸水配成浓度为1mg/ml的水溶液,微孔膜过滤除菌,加入到等体积的1mg/mlS-β-CD溶液,室温下磁力搅拌1h;(4)加入到等体积的1mg/ml的CS水溶液,室温下继续搅拌4h,即得到纳米抗生素载药颗粒乳光液。16000rpm离心30min,取上清,测包封率,无菌水漂洗沉淀颗粒三次,过夜冷冻干燥,得到纳米环丙沙星颗粒(Cip-NPs)。图1为纳米环丙沙星颗粒制备过程中的外观形态。最终制备的纳米环丙沙星颗粒,呈现均一的乳光液,无任何聚集现象。为了验证制备的纳米载药分散体系的稳定性,将制备好的乳光液室温放置,取不同天数测粒径,结果发现,在30天内,粒径大小并无显著性差异和变化。实施例2空载纳米颗粒的制备浓度分别为1.0mg/ml的CS与S-β-CD按照1:1体积混合,室温下置于磁力搅拌器上搅拌4h,即得到空载纳米颗粒乳光液。16000rpm离心30min,无菌水漂洗沉淀颗粒三次,过夜冷冻干燥,得到空载纳米颗粒(NPs)。实施例3盐酸环丙沙星浓度检测(1)配制10µg/ml的Cip标准溶液。(2)按照表1方法,将10µg/ml的Cip标准溶液稀释得到不同浓度,以蒸馏水作为空白对照液,用紫外可见分光光度计于Cip的最大吸收波长276nm处测定各浓度Cip的吸光值。以浓度为X轴,OD值为Y轴绘制标准曲线。回归方程为:y=0.109x-0.012(R²=0.997),Y为吸光值,X为药物浓度(µg/ml)。表1Cip标准曲线绘制溶液组分配制溶液编号123456789Cip标准液(ml)0.50.751.01.251.51.752.02.252.5蒸馏水(ml)2.52.252.01.751.51.251.00.750.5Cip终浓度(µg/ml)1.66 2.5 3.333 4.167 5.0 5.833 6.667 7.5 8.333 实施例4纳米环丙沙星颗粒包封率的测定Cip-NPs乳光液于16000rpm离心10min,收集上清液,并用无菌水漂洗沉淀颗粒。重复三次。沉淀颗粒于-80℃过夜冷冻干燥,即得到载药纳米颗粒。测上清液在276nm处的紫外吸收值,与Cip标准曲线作对比,计算相应的Cip浓度,并推算出上清液中Cip含量。包封率(EE)按照下列公式计算。所有的样品三个平行,结果用平均百分比(w/w)±SD表示。公式如下:EE(%)=Mo-Mc/Mo×100%其中,Mo指在形成纳米Cip颗粒之前所加的总Cip量,Mc表示上清液中的Cip的量。实施例5纳米环丙沙星颗粒的表征(1)Zeta电位仪测量粒径和Zeta电位将上述制备的新鲜空载NPs或Cip-NPs乳光液稀释后取3ml于马尔文动态光散射仪上测颗粒粒径和Zeta电位。图2为动态光散射(MelvinZeta电位仪)检测纳米颗粒粒径分布图。在CS、S-β-CD和Cip均为1mg/ml,搅拌时间为4h,pH值在5.5条件下制备的纳米环丙沙星颗粒的平均粒径在142.9±1.41nm,最大粒径在175.4nm,集中度为97.8%;Zeta电位为+62.47±0.28mV,包封率在51.21%,即得到了粒径相对较小,电位和包封率较高的纳米环丙沙星颗粒。其中,空载颗粒的粒径为132.5±1.2nm,Zeta电位为+33.63±0.97mV,在加入Cip后,载药体系的稳定性增强,颗粒粒径有增大趋势。(2)纳米环丙沙星颗粒表面形态观察a)扫描电镜观察将上述制备好的新鲜纳米乳光液滴于粘有导电胶的金属导电台上,室温下超净台中自然晾干,之后喷金扫描采集图像。b)原子力显微镜观察将金片放于丙酮、95%乙醇和纯净水中依次超声处理30min,保存于75%乙醇中备用。将新鲜制备的Cip-NPs适当稀释后滴在金片上,室温下于超净工作台中自然晾干后采集图像。c)红外光谱检测将100-200mg的干燥KBr粉末2mg与冻干的Cip-NPs、Cip、CS或S-β-CD粉末分别混匀研细,做成1mm左右厚度片子,红外光谱扫描仪采集数据,并绘制图表。图3为纳米环丙沙星颗粒的能谱分析及形貌分析A:能谱分析;B:电镜扫描。从电镜扫描结果来看,纳米环丙沙星颗粒形貌呈现较为标准的圆球形,有高有低地分散在导电胶上,每个圆球颗粒灰度一致,未发现局部发黑或者局部偏白的情况,整个颗粒很均匀。为了检测环丙沙星纳米颗粒的组成成分,随机选取纳米颗粒进行能谱分析,结果显示,纳米环丙沙星颗粒组分中CS的特征元素N,S-β-CD的特征元素S和Cip中的特征元素F均可以检测到,说明载药颗粒制备成功。FAM结果看到很多圆球状颗粒铺满整个视野。从3D图像来看,颗粒呈现不同大小的突起。实施例6纳米环丙沙星颗粒体外模拟释放将10ml同浓度的Cip水溶液和Cip-NPs乳光液分别置于透析袋中,封口并固定在装有200mlpH值为7.4的生理盐水的烧杯中,密封烧杯。37℃恒温搅拌(300rpm),不同时间点取样3ml,并补充等体积生理盐水。276nm处测不同时间点取样液的Cip紫外吸收值,并计算期浓度与含量。所有取样做三个平行,进而计算累积释放率。以取样时间点为横坐标,累积吸光值为纵坐标绘制释放曲线。图4纳米环丙沙星颗粒体外模拟累积释放曲线。药纳米颗粒的体外模拟释放选用生理盐水作为生理模拟释放介质,从累积释放曲线来看,载药颗粒有一定的缓释作用,Cip水溶液在8h的时候,近90%的药物已经释放出来,而纳米环丙沙星颗粒却只释放了不到50%,一直到48h的时候才释放到90%,这时候跟Cip的终释放量基本接近,说明纳米环丙沙星颗粒有较好的缓释作用。实施例7铜绿假单胞菌的培养本发明所用实验菌株为铜绿假单胞菌野生型菌株PAO1,所用培养基为LB培养基。液体培养时,摇床转速为200rpm,其余按照方法说明进行。实施例8最低抑菌浓度(minimuminhibitoryconcentration,MIC)测定在96孔板中分别用LB培养液对Cip和纳米环丙沙星颗粒进行1/2梯度稀释,终浓度依次为1.6µg/ml,0.8µg/ml,0.4µg/ml,0.2µg/ml,0.1µg/ml,0.05µg/ml和0.025µg/ml。每孔分别加入10µlOD600=0.1的PAO1菌体,37℃恒温静置培养24h。MIC定义为,培养24h后无菌生长的最低抗生素浓度。实施例9生物被膜模型构建及定量(1)生物被膜模型构建a)利用硼硅酸盐试管形成生物被膜铜绿假单胞菌过夜培养物1:100稀释后,吸取5ml菌液于15ml硼硅酸盐试管中于30℃培养24h,然后轻轻吸走培养基,PBS漂洗3次,洗掉浮游菌,加入6ml0.1%结晶紫染色液染色15min,自来水冲掉浮色,室温晾干,拍照记录。b)在盖玻片上形成生物被膜用钢化直尺将盖玻片裁剪成0.5cm×0.5cm大小,浓H2SO4浸泡24h,超声处理30min后用水冲洗干净,湿热高压灭菌后备用。铜绿假单胞菌过夜培养物按1:100比例稀释后继续培养活化3h,调OD600=0.1,分别吸取0.5ml菌液到24孔板中。将无菌盖玻片放入到24孔板中的各孔中,30℃恒温静止培养24h。(2)生物被膜定量a)结晶紫染色PAO1菌株过夜培养物,1:100比例活化3h后调OD600=0.1。96孔板每孔加10µl菌液,再加入用LB稀释成不同浓度的Cip或者Cip-NPs培养液,总体积为200µl。37℃恒温静止培养24h,小心吸走培养液,加99%甲醇200µl过夜固定,移去甲醇,加入0.1%的结晶紫染色液200µl染色20min,用自来水温和缓慢地冲掉浮色,室温下自然干燥,之后加入200µl95%乙醇洗脱两次,收集洗脱液,590nm处测定光吸收值。同时做阴性对照和空白对照。b)快速银染法无菌PBS溶液多次充分漂洗盖玻片上的生物被膜,2.5%戊二醛固定12h,饱和CaCl2溶液处理15min,5%AgNO3溶液15min,1%对苯二酚溶液显色2min,5%Na2S2O3溶液固定2min,以上各步骤中间均用无菌PBS清洗1min。普通光学显微镜观察。c)扫描电子显微镜法用PBS反复漂洗盖玻片上的生物被膜,用2.5%戊二醛溶液4℃条件下固定12h后,0.1mol/mlPBS漂洗3次,30%,50%,70%,85%,90%乙醇分别固定15min,之后100%乙醇脱水两次,每次30min,自然干燥、喷金,扫描电子显微镜观察生物被膜微观形态。d)激光共聚焦显微镜法将携带绿色荧光蛋白gfp的质粒转化至PAO1菌株中,菌体黏附在生物被膜表面,内部或者被包埋在生物被膜深层,通过检测绿色荧光蛋白的荧光强度即可以间接的反应生物被膜的多少和厚度。用盖玻片上形成生物被膜后,无菌PBS缓冲液漂洗3次,小心放在激光共聚焦显微镜载物台上,由低倍镜到高倍镜慢慢调节观察,按照1µm的步距扫描逐层扫描,每个样沿Z轴各扫描6个视野。60×物镜,激发波长488nm,Z轴系列的光学部分用OlympusFV10-ASM1.7软件进行三维结构重建,即得到不同组别生物被膜的3D图像,并估测其厚度,对数据进行统计分析,整理图片。实施例10纳米环丙沙星颗粒对生物被膜形成的抑制及生物被膜菌清除作用(1)Cip对生物被膜形成的抑制在构建测定生物被膜过程中,培养基加入Cip浓度为1/2MIC、1/4MIC、1/8MIC和1/16MIC的Cip或者纳米环丙沙星颗粒,比较二者对生物被膜形成的抑制作用。(2)纳米环丙沙星颗粒对生物被膜菌清除作用分别选取Cip浓度为4MIC、2MIC、MIC和1/2MIC的纳米环丙沙星颗粒或Cip,对已在载玻片上形成的生物被膜进行1h、2h和6h三个处理时间点的生物被膜菌清除作用。生物被膜内铜绿假单胞菌数量检测采用稀释涂布法,即将生物被膜样品用无菌PBS漂洗三次之后,转移至1.5ml离心管中,超声处理2min破坏生物被膜,使得菌游离出来,稀释适当的梯度后涂布计数。被膜内菌的清除率(Clearancerate,CR)计算公式如下:CR(CFU)=[(CFU空白对照-CFU清除后)/CFU空白对照]×100%。图5为快速银染法和扫描电镜检测纳米环丙沙星颗粒抑制PAO1生物被膜,A:银染鉴定;B:电镜扫描鉴定。从生物被膜的形成量来看,空白的纳米环丙沙星颗粒对PAO1生物被膜的形成无抑制作用,对于纳米环丙沙星颗粒和单纯的Cip来说,随着亚抑制浓度的倍比减小,生物被膜的量呈现增加的趋势,且Cip组的生物被膜量菌大于纳米环丙沙星颗粒组,说明纳米环丙沙星颗粒对PAO1菌株生物被膜的形成起到了一定的抑制作用。银染法鉴定,从显微照片来看,生物被膜经过银染后呈现出棉絮状膜样的黑色物。与对照组相比较,Cip组和纳米环丙沙星颗粒组的图像中生物被膜呈现不同程度散落的黑点或黑斑状,从1/2MIC至1/16MIC,生物被膜的密集程度增加,由开始的散落的黑点和黑斑状逐渐扩展粘连成棉絮状,说明随着Cip浓度的减小,生物被膜的形成量也在逐渐增加,密集程度也再增加。但是Cip-NPs组前三个大浓度则呈较舒散的黑斑状,说明纳米抗生素颗粒对PAO1生物被膜的作用效果存在差异。扫描电镜结果更加清晰和直观的展示了组内和组间的差异。相对Cip组,Cip-NPs组的看起来更疏松,表面粘稠状高低隆起状也很明显,散落的菌体数量较多,这说明纳米环丙沙星颗粒在PAO1菌株生物被膜形成的过程中起到了一定的抑制作用。图6为激光共聚焦显微镜检测纳米环丙沙星颗粒在抑制生物被膜形成过程中对其厚度的影响。采用绿色荧光蛋白(GFP)标记野生型的PAO1,之后用激光共聚焦显微镜逐层扫描生物被膜的厚度,叠加起来即为整个生物被膜的厚度。扫描之后对每个样品的图片堆进行三维重建,得到样品的3D图像,这样就可以很清晰直观的看到绿色荧光标记的生物被膜的立体高度以及生物被膜的疏密程度。如图显示,从Cip组和Cip-NPs组的扫描结果,随着亚MIC浓度的梯度降低,生物被膜的量逐渐增多,厚度也随着加厚,说明Cip对PAO1生物被膜的形成有抑制作用;在四个亚MIC浓度下,纳米环丙沙星颗粒组的生物被膜厚度均显著小于Cip组(p<0.05),说明制备的纳米环丙沙星颗粒对PAO1生物被膜的形成抑制作用强于单纯的未包裹的Cip水溶液,说明纳米环丙沙星颗粒对PAO1生物被膜的厚度增加有一定的抑制作用。图7为纳米环丙沙星颗粒对生物被膜形成的抑制及生物被膜内部细菌的清除作用。在生物被膜菌清除实验中,结果显示,随着Cip浓度的增大,生物被膜菌清除率整体明显呈现增大趋势,被膜菌清除率很明显增大,而且随着处理时间的延长,被膜菌清除率也呈现增大趋势。然而,Cip组和Cip-NPs在处理1Hr和2Hr的时候,只有1/2MIC和MIC两个浓度Cip组的清除率明显高于Cip-NPs(p<0.05),其他浓度均为Cip-NPs的清除率稍高,但无显著差异;在处理6Hr的时,在高于MIC值浓度下,在2h时,2MIC浓度下,Cip-NPs组的清除率高于Cip(p<0.05);在6Hr时,4MIC浓度下,Cip-NPs组的清除率显著高于Cip组(p<0.05),且清除率已超过80%。造成这种不同的原因可能是纳米环丙沙星颗粒的缓释作用,在刚开始处理的时候,Cip组是高浓度的暴露在生物被膜环境中的,而纳米环丙沙星颗粒还被载体分子保护在颗粒里面或者吸附在颗粒上而没有释放出来,以至于到处理时间延长的情况下才逐步释放出来,达到单纯Cip的效果。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 检测水中铜绿假单胞菌和toxA的引物、试剂盒和方法与流程
- 一株可裂解多重耐药铜绿假单胞菌的噬菌体及其治疗感染的应用的制作方法与工艺
- 芪类化合物在抑制铜绿假单胞菌群体感应系统中的应用的制作方法与工艺
- 利用群体感应调控铜绿假单胞菌好氧反硝化以除废水中硝酸盐的方法与流程
- 适用于广泛耐药铜绿假单胞菌的筛查培养基及制备方法与流程
- 一株用于细菌病害防治的假单胞菌及应用的制造方法与工艺
- 一种利用高产鼠李糖脂的铜绿假单胞菌降解石油的方法与流程
- D‑色氨酸在抑制铜绿假单胞菌产弹性蛋白酶中的应用的制造方法与工艺
- 用于RPA快速检测携带喹诺酮类耐药基因的铜绿假单胞菌的引物及其应用的制造方法与工艺
- 铜绿假单胞菌噬菌体裂解酶及应用的制造方法与工艺