一种三联核酸检测试剂盒的制作方法
本发明涉及荧光定量PCR的核酸检测技术领域,具体是一种三联核酸检测试剂盒。
背景技术:
目前深部真菌感染多由条件致病性真菌引起,多见于免疫力低下人群,病死率较高。其中,念珠菌引起的侵袭性真菌感染占所有病例的70%~90%,其中白色念珠菌又占念珠菌感染的70~80%;曲霉感染占真菌感染的10%~20%;而隐球菌中主要是新型隐球菌,是艾滋病患者合并感染的常见病原真菌,引起艾滋病患者的隐球菌性脑膜炎,治愈率极低。
目前,临床上常用的抗真菌药有5类,多烯类、唑类、棘白菌素类、氟胞嘧啶类和烯丙胺类。其中,最常用的药物主要包括氟康唑、伊曲康唑、5-氟胞嘧啶、两性霉素B、制霉菌素等。氟康唑、伊曲康唑是临床上治疗深部真菌感染的首选药物,氟康唑抗菌谱较窄,主要用于念珠菌、隐球菌感染的治疗,对曲霉等感染的疗效较差,且易产生耐药性。并且在临床上四种用药方式预防性用药、经验性治疗、抢先治疗和目标治疗中,对白色念珠菌、曲霉菌和新型隐球菌所用的药物都不尽相同。并且由于目前缺乏明确诊断依据,仍然抗生素滥用依然存在,然而抗生素滥用所导致的患者的耐药性,甚至导致患者无药可救,因此我们需要快速、准确的检测方法。
目前,真菌检测方法除了有培养法外,还有乳胶凝集实验、胶体金方法、和Elisa试验及G试验。培养法虽然是金标准,但是耗时长,阳性率低。乳胶凝集实验及胶体金方法灵敏度很高,但是其假阳性较高,且其乳胶滴度不能准确反映感染的情况,G试验只是检测真菌,不能区分不同的菌种,Elisa试验很容易出现假阳性结果,且操作复杂。荧光定量PCR的方法通过其定量可以直接反应患者的感染情况,并且能够进行定期检测达到指导预后的效果,对临床诊断具有标志性意义。
想要建立一种快速、灵敏、特异性的检测方法,以DNA为基础的PCR分子生物学的方法为最佳,其中荧光定量PCR的方法因其在灵敏度、特异性,操作上具有很大的优越性,因此在临床真菌检测中应用该方法,对真菌感染的早期治疗具有重大意义。将Q-PCR技术应用到真菌检测领域,填补国内空白,实现早期、快速和准确检测,为临床提供一种新的检测真菌的途径。在一次检测中同时完成对白色念珠菌、曲霉菌和新型隐球菌三种真菌的检测,更加全面的辅助临床诊断。该检测试剂盒配套便携式Q-PCR仪器进行检测,无需繁琐的设置运行程序,只需选择检测项目和标定样品名称,反应完毕后,后台软件针对性分析数据,直接给出检测报告,方便快捷。
目前公布CN201110214986.9和CN201410821483.1专利是有关于检测致病曲霉菌的通用引物、检测探针和试剂盒,其主要针对的是烟曲霉、黄曲霉、土曲霉、黑曲霉四种致病曲霉菌进行检测;CN201110417477.6和CN201410017428.7这两个专利均是关于检测白色念珠菌的PCR荧光检测试剂盒;CN201410017251.0该专利是关于检测一种新型隐球菌的核酸检测试剂盒。以上几篇专利均是介绍的单一菌种的检测方法,没有达到像本发明这样多种真菌均属的同时检测。
CN201410820825.8该专利是关于常见致病真菌的检测方法,其主要是三个引物构成两对引物,两条探针构成的一种通用检测,其阳性结果代表曲霉菌、隐球菌、念珠菌、及米根霉和卷枝毛霉5种菌单一或混合感染,该方法是针对大类上真菌的检测,不具备像本发明能够鉴别是具体哪一种菌的能力。
另外,CN201510920311.4该专利是关于肠道病毒通用、柯萨奇病毒A16型、肠道病毒71型核酸荧光定性检测试剂盒,该专利虽然是将三种病毒进行联合检测,但是其是定性检测,并且针对的是病毒类的检测,其引物设计位置序列差异较大,利于引物的设计,与本发明不在一个难度水平上,本发明针对三种致病真菌进行联合检测,并且是定量检测,其18S、ITS保守序列,不同菌种之间相似性较高,引物设计难度较大。因此目前还没有相关的产品。
在多种联检的产品中由于基因序列的相似性,极有可能出现如图1a中的相互干扰情况,导致实验结果的准确性降低,特异性降低,不能辅助临床。因此,必须攻克该技术难关,本实验团队针对探针的序列和荧光基团的多次摸索及验证实验,解决了该难题,如图2a,不存在相互干扰的情况。
通过对比,上述已公开的各项专利技术方案与本申请的将三种常见致病菌混在一个体系中同时检测,并且能够区分菌种类别的定量检测方案具有本质性差别。
技术实现要素:
本发明的目的在于克服现有技术的不足,而提供一种三联核酸检测试剂盒。
本发明实现目的的技术方案如下:
一种三联核酸检测试剂盒,该试剂盒包括菌体裂解液,阳性定量反应液,阴性对照反应液及菌体检测反应液,所述菌体检测反应液中包含曲霉菌、新型隐球菌及白色念珠菌的特异性引物、特异性探针及内参荧光染料,
其中,所述菌体检测反应液中三种特异性引物根据曲霉菌、新型隐球菌及白色念珠菌ITS序列的区域所设计,
其中,所述菌体检测反应液中三种特异性探针的标记报告基团分别选用的是FAM、VIC和CY-5,淬灭基团为MGB,FAM基团的激发波长为492nm,发射波长为517nm;VIC基团的激发波长为557nm,发射波长为574nm;CY-5基团的发射波长为646nm,发射波长为664nm;FAM、VIC和CY-5基团激发波长和发射波长之间没有交叉重叠区段,故均不存在相互干扰的现象,进而实现了三种菌同时进行特异性检测;
其中,菌体检测反应液的组成成分如下:
而且,所述菌体检测反应液中特异性引物和特异性探针序列分别为:
曲霉特异性引物正向:SQ1 5’-AAGCACGGCTTGTGTGTTGG-3’
曲霉特异性引物反向:SQ2 5’-AGCCCCATACGCTCGAGGA-3’
曲霉特异性探针:SQ3 5’-FAM-AAGGCAGCGGCGGCA-MGB-3’
新型隐球菌特异性引物正向:SQ4 5’-GTTTTATTACCTGTTGGACTTGGATTTG-3’
新型隐球菌特异性引物反向:SQ5 5’-GGTTGTTATCAGCAAGCCGAAG-3’
型隐球菌特异性探针:SQ6 5’-VIC-TGTGTTAGTGGGAAGGT-MGB-3’
白色念珠菌特异性引物正向:SQ7 5’-CGCTGGGTTTGGTGTTGAG-3’
白色念珠菌特异性引物反向:SQ8 5’-CGCCTTACCACTACCGTCTTTC-3’
白色念珠菌特异性探针:SQ9 5’-CY 5-AATACGACTTGGGTTTGCT-MGB-3’;
而且,所述内参荧光染料为RQX,均一化校正由于移液误差或蒸发所导致的批内体积差异,校正单次反应运行中由于泡沫或蒸发、冷凝而导致的信号改变。
本发明的优点和效果是:
1、本发明针对三种致病真菌进行联合检测,并且是定量检测,其18S、ITS保守序列,不同菌种之间相似性较高,引物设计难度较大。
2、本发明提供一种曲霉菌、新型隐球菌、白色念珠菌三联核酸定量检测试剂盒,采用聚合酶链式反应及荧光探针技术分别对曲霉菌、新型隐球菌、白色念珠菌高保守特异性的序列进行扩增检测,辅助诊断曲霉菌、新型隐球菌、白色念珠菌的感染。
附图说明
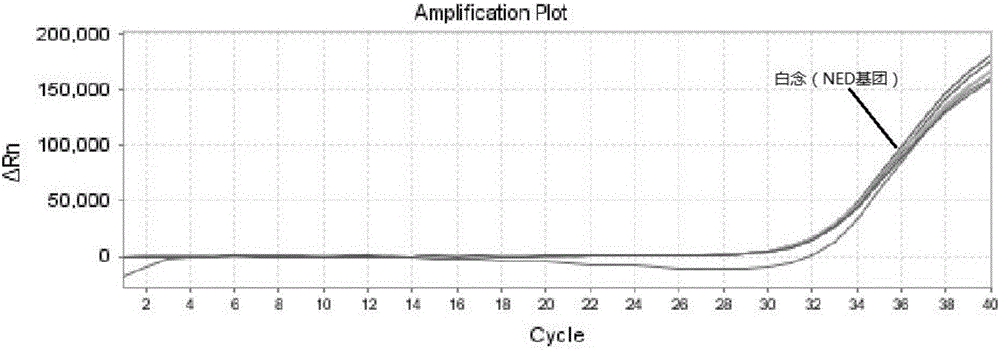
图1是对于探针波长之间有交叉情况下产生相互影响时的扩增曲线组图,其中,图1a是产生交叉的三种扩增曲线图;图1b是白念正常扩增曲线图;图1c是曲霉未交叉的扩增曲线图;图1d是产生交叉的隐球扩增曲线图;
图2是对于探针波长之间没有交叉情况下不产生相互影响时的扩增曲线组图,其中,图2a是未产生交叉的三种扩增曲线图;图2b是白念正常扩增曲线图;图2c是曲霉未交叉的扩增曲线图;图2d是隐球未交叉的扩增曲线图。
具体实施方式
下面结合具体实施方案对本发明进一步说明,其具体实施方案应该理解为仅为举例说明,不是限定性的,不能以下述举例说明来限定本发明的保护范围。
一种三联核酸检测试剂盒,该试剂盒包括菌体裂解液,阳性定量反应液,阴性对照反应液及菌体检测反应液,菌体检测反应液中包含曲霉菌、新型隐球菌及白色念珠菌的特异性引物、特异性探针及内参荧光染料,
其中,所述菌体检测反应液中三种特异性引物根据曲霉菌、新型隐球菌及白色念珠菌ITS序列的区域所设计。
其中,所述菌体检测反应液中三种特异性探针的标记报告基团分别选用的是FAM、VIC和CY-5,淬灭基团为MGB,FAM基团的激发波长为492nm,发射波长为517nm;VIC基团的激发波长为557nm,发射波长为574nm;CY-5基团的发射波长为646nm,发射波长为664nm;FAM、VIC和CY-5基团激发波长和发射波长之间没有交叉重叠区段,故均不存在相互干扰的现象,进而实现了三种菌同时进行特异性检测;
其中,菌体检测反应液的组成成分如下:
在本发明的具体实施中,所述菌体检测反应液中特异性引物和特异性探针序列分别为:
曲霉特异性引物正向:SQ1 5’-AAGCACGGCTTGTGTGTTGG-3’
曲霉特异性引物反向:SQ2 5’-AGCCCCATACGCTCGAGGA-3’
曲霉特异性探针:SQ3 5’-FAM-AAGGCAGCGGCGGCA-MGB-3’
新型隐球菌特异性引物正向:SQ4 5’-GTTTTATTACCTGTTGGACTTGGATTTG-3’
新型隐球菌特异性引物反向:SQ5 5’-GGTTGTTATCAGCAAGCCGAAG-3’
型隐球菌特异性探针:SQ6 5’-VIC-TGTGTTAGTGGGAAGGT-MGB-3’
白色念珠菌特异性引物正向:SQ7 5’-CGCTGGGTTTGGTGTTGAG-3’
白色念珠菌特异性引物反向:SQ8 5’-CGCCTTACCACTACCGTCTTTC-3’
白色念珠菌特异性探针:SQ9 5’-CY 5-AATACGACTTGGGTTTGCT-MGB-3’;
在本发明的具体实施中,所述内参荧光染料为RQX,均一化校正由于移液误差或蒸发所导致的批内体积差异,校正单次反应运行中由于泡沫或蒸发、冷凝而导致的信号改变。
实例:试剂盒的配制
(1)引物和探针设计与合成
特异性引物序列分别是针对曲霉菌、新型隐球菌、白色念珠菌的ITS的高保守且特异性强的序列,三种特异性探针的标记的报告基团也是分别选用的FAM、VIC和CY-5,淬灭基团为MGB,其数据均来源于GenBank中的核糖体ITS序列,引物和探针由life technologies公司合成。
(2)阳性定量参考品及阴性参考品的制备
分别以提取的曲霉菌基因组、新型隐球菌基因组、白色念珠菌基因组为模板,利用曲霉菌引物、dNTPs、dUTP、10*taq buffer、Taq酶为反应体系扩增获得曲霉菌阳性参考品,利用新型隐球菌引物、dNTPs、dUTP、10*taq buffer、Taq酶为反应体系扩增获得新型隐球菌阳性参考品、利用白色念珠菌引物、dNTPs、dUTP、10*taq buffer、Taq酶为反应体系扩增获得白色念珠菌阳性参考品。然后通过PCR纯化试剂盒纯化PCR产物,用分光光度计测得各个阳性参考品的OD值,利用拷贝数换算公式获得浓度。并依次稀释至5×107copies~5×102copies五个梯度,并分别加入阳性反应液中配制成阳性定量标准品,阴性对照用临床阴性样本经过裂解液处理后加入阴性反应液中制成阴性对照品。
(3)菌体检测反应液反应液组成
试剂盒的使用
样本处理
(1)肺泡灌洗液标本处理
①将管中的肺泡灌洗液用移液器混匀,取出1000μl于一个新的离心管中,12,000rpm(约13800g)离心5min,小心弃去上清(可将离心管倒置于干净的纸上,以去除管口的液体);
②向沉淀中加入100μl的菌体裂解液(加液前要将菌体裂解液充分混匀后立取液),充分混匀,100℃水浴10min,10,000rpm离心2min备用。
(2)酶处理:使用前需将DNA聚合酶和UNG酶以8,000rpm离心30s。如做阳性定量反应液则将32μl稀释液加入到一管DNA聚合酶中,充分混匀,待加入阳性定量反应液中。如做菌体检测反应和阴性反应液,则先将8μl UNG酶加入到一管DNA聚合酶中,再加入24μl稀释液,充分混匀,待加入菌体检测反应液和阴性反应液中。
(3)样本检测
将20μl处理好的标本上清加入到菌体检测反应管中,并且将之前备用的酶取2μl加入到菌体检测反应管中。做对照试验,分别加入2μl稀释后的DNA聚合酶(不加UNG酶)至阴性检测反应液、阳性定量检测反应液。
(4)反应程序
将探针的报告集团曲霉菌设为FAM、新型隐球菌设置为VIC、白色念珠菌设置为CY-5,淬灭基团均设为MGB。打开参数窗口设置循环:
37℃10分钟
95℃5分钟,
95℃15秒→62℃30秒→40个循环
(5)结果判断
根据分析后图像调节基线参数的起始值、停止值以及阈值(用户可根据实际情况自行调整,起始值可以在1~10、停止值可以在5~20范围选择),使标准曲线窗口下的标准曲线图达到最佳。在定量分析菜单下分析结果,根据标本点在标准曲线的位置确定标本浓度。
如果增长曲线不呈S型曲线或Ct值>=35,则判断样品的总含量小于检测极限。
如果增长曲线呈S型曲线且Ct值<35,则按以下方法判断:
若样品的Ct值小于103阳性定量参考品,则该样品的DNA总含量<1.0×103基因拷贝;
若样品的Ct值在103到107阳性定量参考品之间,则该样品的DNA总含量=C基因拷贝;
若样品的C大于107阳性定量参考品,则该样品的DNA总含量为>1.0×107基因拷贝。如果需要精确定量结果,可将提取后的样品稀释至线性范围内再检测。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种用于检测犬副流感病毒试剂盒的制造方法与工艺
- 腹泻相关病毒多重基因检测体系及其试剂盒和应用的制造方法与工艺
- 基于POCKIT Micro荧光PCR平台的禽流感病毒H7亚型检测试剂及应用的制造方法与工艺
- 一种流行性乙型脑炎的重组酶常温扩增核酸(RT‑RPA)试纸条检测试剂盒及应用的制造方法与工艺
- 一种腺苷高半胱氨酸酶基因启动子区甲基化程度检测试剂盒及测定方法与流程
- 一种检测心肌梗死的试剂及其应用的制造方法与工艺
- 用于检测CDKN2B基因变异的试剂盒及CDKN2B基因变异率的定量检测方法与流程
- 一种CYP2C19*3基因型检测试剂盒及其检测方法与流程
- 一种CYP2C19*2基因型检测试剂盒及其检测方法与流程
- 基于高通量测序法的人类多基因突变检测试剂盒的制造方法与工艺