一种通过延迟基因的表达时间来提高猪瘦肉产量的方法与流程
本发明涉及分子遗传
技术领域:
,具体地,涉及一种通过延迟基因的表达时间来提高猪瘦肉产量的方法。
背景技术:
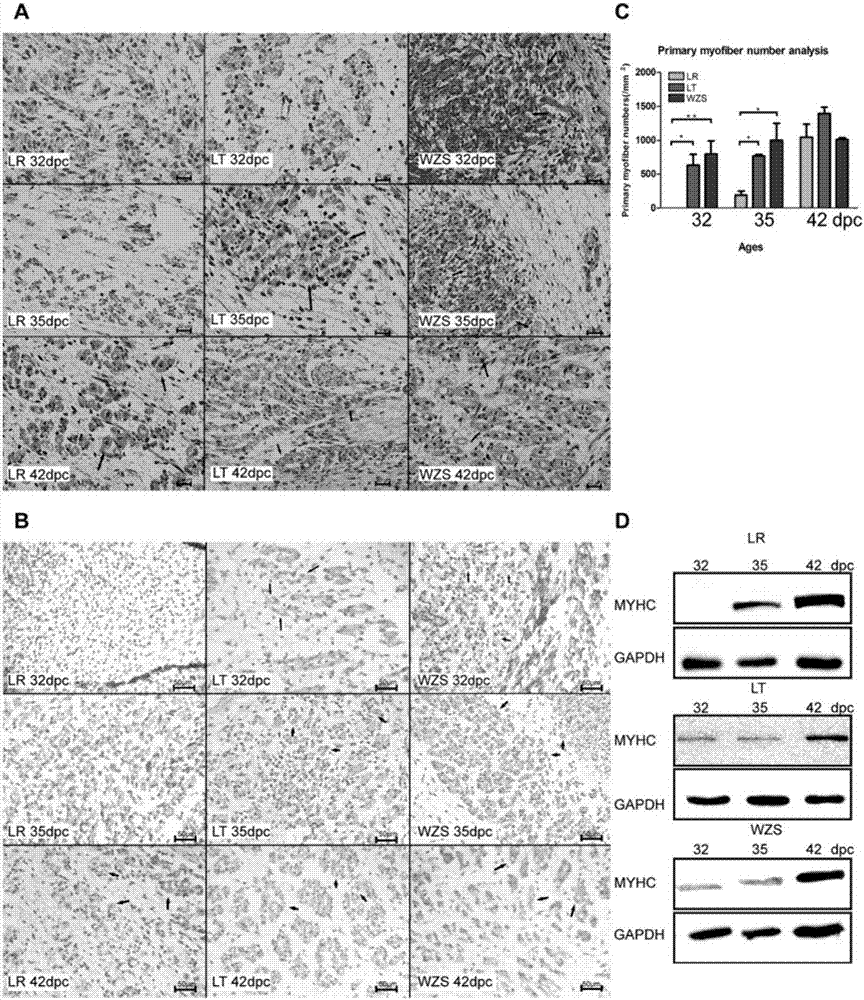
:猪的骨骼肌发育在胚胎期主要有两轮:1)初级肌纤维的形成阶段,妊娠后第14~22天是体节的发育,随后轴旁中胚层发育形成生肌节,初级肌纤维在妊娠后第35天左右开始出现,在妊娠第49天左右达到增殖高峰,并一直持续到妊娠第60天。2)次级肌纤维形成阶段,妊娠第45~90天左右次级肌纤维围绕初级肌纤维周围分化发育,并在妊娠75天左右达到高峰,妊娠第91天之后,肌纤维数目基本不再改变,肌纤维在出生后主要进行肌纤维的肥大以及类型变化的成熟过程。因此,猪胚胎期骨骼肌的肌纤维总数在出生前就已经确定。前人研究发现,肌纤维数目和大小是产肉量的主要决定因素,这其中,肌纤维数目更加重要,因为大小适中的肌纤维比例较高的动物会产生更多的瘦肉和较好的的肉,并且肌纤维数目越多,动物个体生长的速度就越快越高效。比较大白和长白猪杂交后子一代不同大小的胚胎,发现初级肌纤维出现的时间没有差异,但是体型小的猪胚胎次级肌纤维的数量要显著少于体型大的胚胎,并且在出生后有17%的肌纤维总数的差异。因此在同一品种内,次级肌纤维可能对总肌纤维数目的影响更大。不同品种猪之间的比较,体型较大的大白猪初级肌纤维的数目以及次级肌纤维与初级肌纤维的比例都显著高于小型猪。因此,在不同体型猪品种间,初级肌纤维可能对总肌纤维数目的影响更大。综上所述,初级肌纤维在产肉量不同的猪种中,对出生后的产肉量起到决定性的作用。成肌调控因子家族是成肌过程中起决定性作用的基因家族。该家族有四个成员:myod、myf5、myogenin和mrf4,其共同特征是拥有一个具有成肌调控潜力的高度保守的碱性螺旋环螺旋结构作用域。四个成员当中,myf5在胚胎中最先表达,并与myod相互补充来作为成肌的起始决定基因。有研究发现缺失上述两个基因的转基因小鼠不会形成任何肌肉,但单独缺失上述两者中的任意一个基因,对成肌均不会有太大的影响,说明myf5和myod有一定的功能重叠和互补。在对敲除myod小鼠中分离的成肌细胞进行研究发现,敲除myod的成肌细胞会增殖更长的时间,导致分化的延迟。最近的研究结果显示,myod与myf5结合下游基因的位点几乎一致,但与myod相比,myf5缺少一个较强的激活作用域,因此没有myod那么强的引起下游基因表达的能力。赵晓等在2011年,利用广东地方猪种蓝塘猪和国外瘦肉型长白猪胚胎35天到出生后180天的背最长肌组织进行了形态观察和转录组测序。结果发现,蓝塘猪在胚胎35天就已经出现了初级肌纤维,而长白猪到了胚胎49天才出现初级肌纤维,但是在之后的肌肉发育过程中,蓝塘猪肌肉发育要慢于长白猪,并且出生后产肉量也低于后者。通过转录组测序,他们发现成肌决定因子在蓝塘猪胚胎早期要比长白猪更早更多的表达,这其中就包括myod基因。2015年,yuqiangzhao等人比较研究了另外一种华中地区的地方猪种通城猪与西方瘦肉猪种约克夏猪(大白猪)胚胎30天直到出生后5周的背最长肌组织。与蓝塘猪情况类似,组织形态学发现,产肉量较少的通城猪同样在胚胎期30天比约克夏猪拥有较多数量和较高密度的成肌细胞,但是在之后的第二轮肌肉发育中,约克夏猪的次级肌纤维的发育速度要快于通城猪。猪胚胎期初级肌纤维的数量决定了肌纤维总数,而肌纤维总数又会影响出生后的产肉量,同时肌纤维总数在胚胎期已经确定,因此猪胚胎期初级肌纤维的发育对出生后产肉量具有决定性影响。技术实现要素:本发明的目的是为了克服现有技术的上述不足,提供一种通过延迟基因的表达时间来提高猪瘦肉产量的方法。为了实现上述目的,本发明是通过以下技术方案予以实现的:延迟猪胚胎期成肌分化因子myod的表达时间在提高猪产肉量中的应用。一种通过延迟基因的表达时间来提高猪瘦肉产量的方法,延迟猪胚胎期成肌分化因子myod的表达时间,从而提高猪产肉量。优选地,推迟myod基因在猪中表达1周以达到增加产肉量的效果。本发明在小鼠来源的c2c12成肌细胞系中模拟了中国地方猪种中myod基因早表达的情况,分别提前myod基因表达48h和24h,均使分化产生的肌管数量减少,并且越早表达产生的肌管数量越少。在实际应用中,我们根据瘦肉型长白猪比小型猪五指山猪myod晚表达一周的实际结果,推迟myod基因在猪中表达1周以达到增加产肉量的效果。本发明使用产肉量依次递减的长白、蓝塘和五指山猪胚胎早期18、21、28、32、35和42天的背最长肌肉样组织进行组织形态学观察及肌管标志蛋白检测,我们发现三个品种猪初级肌纤维出现的时间存在差异:五指山猪在胚胎32天首先出现初级肌纤维,蓝塘和长白猪在胚胎35天出现初级肌纤维,而此时蓝塘猪的初级肌纤维数量显著高于长白猪。通过对上述样品进行转录组测序、定量pcr和westernblot分析,我们发现myod在产肉量最少的五指山猪中表达最早、最高(胚胎21天开始表达),而在产肉量最多的长白猪中表达最晚、最低(胚胎28天开始表达)。为了验证myod表达时间对成肌的影响,我们在c2c12和nih3t3细胞系中通过过表达myod质粒来验证myod的表达以及表达时间是否会影响最终分化的肌纤维数量,而结果完全符合预期,即在两种细胞系中过表达myod均会抑制细胞的增殖,分化后产生的肌管减少。基于这一重要发现,我们可以通过生物技术手段来影响甚至是改变动物体内myod的表达时间,从而获得产肉量多的畜禽新品种。实现推迟表达myod的方法有在地方猪种中利用dox诱导的cre-loxp敲入myod基因的技术。通过cre-loxp猪与crispr-cas9技术构建的myod敲入猪杂交得到的myod-lacz-stop-cas9-ki猪,在不同的胚胎时期对母猪饲喂dox,诱导myod基因表达的时序,使地方猪种myod基因表达时间推迟。此外还有利用慢病毒介导的rna干扰技术,即构建myod基因的慢病毒干扰载体,在不同胚胎时期对地方猪种的母猪注射慢病毒干扰载体从而推迟myod的表达时间。这些方法的结果就是使成肌细胞有更多的时间增殖,进而分化出更多肌纤维,提高地方猪种的瘦肉产量。与现有技术相比,本发明具有如下有益效果:本发明首次发现:产肉量较多的猪myod表达较晚,而且出现初级肌纤维时间也较晚,因此成肌细胞有更多的时间增殖,分化后产生的肌纤维数量比产肉量少的猪种多,最终在出生后产肉量也就更多。基于这一重要发现,本发明可以通过生物技术手段来影响甚至是改变动物体内myod的表达时间,从而获得产肉量多的畜禽新品种。附图说明图1是三品种猪胚胎早期初级肌纤维出现时间存在差异的实验验证图;a.he染色,400×;b.免疫组化,400×;c.初级肌纤维的数量统计;d.三品种猪胚胎背最长肌组织免疫蛋白印迹结果;免疫组化,wb实验抗体为myhc,内参为gapdh,箭头所指为初级肌纤维;标尺=50μm;*,p<0.05;**,p<0.01。图2是三品种猪胚胎五个时期影响成肌的主要基因/mirna的转录组测序结果。(a-b)mrfs与mefs家族基因;(c)成肌分化时期的标志基因;(d)抑制成肌的基因;(e)促进成肌的成肌特异mirna。图3为三品种猪胚胎早期初级肌纤维出现时间存在差异的实验验证图。图4是过表达myod基因效率验证图。a.过表达myod基因,利用edu染色检测c2c12细胞增殖。b.正在增殖细胞占总细胞的比例。c.过表达myod基因对细胞周期的影响。d.过表达myod基因后,利用实时无标记细胞检测系统检测c2c12细胞增殖。e.过表达myod基因后,q-pcr定量检测细胞周期相关因子基因的表达。图5是不同时间点过表达myod基因对成肌分化的影响。a.分化前2天(-2d)和分化前1天(-1d)过表达myod基因,pcmv空载质粒为阴性对照。同时诱导分化,western-blot检测myhc蛋白的表达水平。b.不同时间点过表达myod基因,肌管免疫荧光结果图。c.为图a的western-blot检测myhc蛋白的灰度扫描定量结果。图6是过表达myod使nih3t3细胞融合形成肌管的图。(a)过表达myod后,检测myod的mrna表达水平。(b)转染48h后,检测myod蛋白水平。(c)诱导分化7d后,成肌分化关键因子的mrna水平检测。(d)诱导分化7d后,白光下观察到肌管形成。(e)过表达myod后,诱导分化7d,免疫荧光检测到myhc的表达。(f)过表达myod后,诱导分化7d,蛋白水平检测到myhc的表达。。*p<0.05,**p<0.01,***p<0.001,n=3。标尺大小:100μm。图7是过表达myod,抑制nih3t3细胞的增殖的图。(a)实时无标记细胞检测系统检测过表达myod后,与对照组相比nih3t3细胞的增殖情况。(b)统计gm不同时期对照组和过表达组的细胞数目。(c)过表达myod后,pi染色,流式细胞术分析细胞周期,过表达myod后与对照组相比,nih3t3细胞发生g1期阻滞,s期细胞减少。(d)免疫荧光检测edu阳性细胞并统计。(e)细胞周期关键因子的mrna水平检测。*p<0.05,**p<0.01,***p<0.001,n=3。标尺大小:100μm。具体实施方式下面结合说明书附图和具体实施例对本发明作出进一步地详细阐述,所述实施例只用于解释本发明,并非用于限定本发明的范围。下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。实施例1长白、蓝塘和五指山猪初级肌纤维出现时间的确定1、样品采集:长白、蓝塘和五指山猪均根据各自系谱,挑选全同胞或半同胞的12头母猪,各使用同一头相应品种公猪的精液进行人工授精(五指山猪采用自然授精方式),在相同的饲养条件下喂食相同的饲料。所有动物的处理办法都严格按照广东省动物保护与使用委员会批准的流程进行,批准文号为:scxk(guangdong)2011–0029和syxk(guangdong)2011–0112。在胚胎期18、21、28、32、35和42天分别屠宰各品种2头母猪,剖腹剪开子宫取出胚胎。18和21天由于胚胎较小故取整个胚胎,其余时期分离胚胎背部肉样组织,剪成约黄豆大小的组织块。所有的样品均用pbs洗干净,一部分装入2.0ml冻存管中,并迅速放入液氮保存;另一部分放入4%多聚甲醛溶液备用。为了便于标记,三品种猪分别简写为:长白猪(lr)、蓝塘猪(lt)和五指山猪(wzs);6个胚胎时期分别简写为:18天(lr1/lt1/wzs1)、21天(lr2/lt2/wzs2)、28天(lr3/lt3/wzs3)、32天(lr4/lt4/wzs4)、35天(lr5/lt5/wzs)和42天(lr6/lt6/wzs6)。2、石蜡切片和he染色:(1)固定:4%多聚甲醛放置24~48小时;(2)脱水:将样品放入包埋盒中,做好标记,然后放入全自动脱水机中,脱水步骤为:70%乙醇:2h;80%乙醇:2h;95%乙醇:30min;无水乙醇:2.5h;50%无水乙醇+50%透明剂:30min;透明剂:2.5h;50%透明剂+50%石蜡:30min;石蜡:5h;(3)包埋:将脱水后的组织放入钢包埋盒中,用包埋机加入融化的石蜡,并在制冷平台上凝固成蜡块,放入4℃冰箱保存或进行切片;(4)切片:将蜡块固定在石蜡切片机上,先调整为20μm的厚度将蜡块修平整,露出组织块,随后用4μm的厚度切片;(5)贴片:切下来的切片会漂浮在37℃的水面上,用洁净的载玻片将切片捞到玻片正中的位置,随后放在50℃烘片机上烘干,并做好标记。烘干后的切片放入4℃冰箱保存或进行染色;(6)脱蜡:将有石蜡切片的载玻片放入透明剂中10min,可重复一次;(7)复水:将载玻片在100%、95%、85%、70%、50%的乙醇,pbs以及纯水中各浸泡2min,并不时震荡;(8)he染色:将载玻片放入苏木素中1-5min,纯水冲洗1min,加入活化剂30s,纯水冲洗1min,伊红染色30s-2min,自来水冲洗1min;(9)封片:玻片自然风干后,滴20μl中性树脂于载玻片标本中心,用镊子小心盖上载玻片,并标注好样本名称信息以便观察。3、免疫组化染色:步骤(1)~(7)同以上步骤2的(1)~(7)(后面步骤所用试剂均来自免疫组化试剂盒);(8)切片标本风干后在组织上滴加2滴peroxidaseblockingreagent,5min;冲洗玻片至没有残余液体,并用pbs冲洗5min;(9)在组织块上滴加三滴serumblockingreagentg(封闭血清)处理15min,然后甩掉玻片上残余的血清并擦干,此步无需pbs冲洗;(10)组织块上滴加3滴aridinblockingreagent,处理15min,用pbs冲洗3次,甩掉残余液体并擦干;(11)用biotinblockingreagent(生物素)处理15min,随后用pbs冲洗三遍,甩掉残余液体并擦干;(12)加入80μl左右的一抗覆盖孵育组织块,为了防止玻片干燥,可放入里面装有浸润水的棉花球的湿盒中,4℃冷库过夜,本实验使用的是myhc的一抗;(13)甩掉残余液体并擦干后,向组织块表面滴加3滴biotinylatedsecondaryantibody(生物素标记的二抗),并在室温下放置1h,随后用pbs冲洗3遍,每遍15min;(14)甩掉残余液体并擦干后,组织块加上3滴hss-hrp孵育30min,并用pbs冲洗3遍,每遍2min;(15)甩掉pbs残余液体擦干后,用aec溶液显色3-20min;(16)用ddh2o浸泡显色过的玻片,处理5min;(17)风干后的玻片组织块用苏木素染色1~5min,纯水冲洗1min,自然风干后封片,4℃保存或显微镜观察。4、图像采集及数据处理:(1)图像采集:正置荧光显微镜,采用10×40倍的放大倍数观察拍摄,并标注标尺;(2)数据处理:每个实验至少重复3次,结果用平均值±标准差(mean±sd)表示,用student’stest计算两组差异,用anova检验多组差异。作图软件为graphpadprism6,数据分析使用spss(version20),统计分析采用双侧检验,差异表达方式:*,p<0.05;**,p<0.01;***,p<0.001。以上检测的结果见图1,结果显示,胚胎期18~28天三品种猪均没有肌纤维形态产生,到了胚胎32天,五指山猪首先出现了中心圆环状的初级肌纤维;胚胎35天时,蓝塘和长白猪均出现了初级肌纤维,但前者数量明显多于后者,而五指山猪的初级肌纤维继续增多;到了胚胎42天,三品种猪初级肌纤维数目接近。实施例2三品种猪胚胎五个时期影响成肌的主要基因/mirna的转录组测序1、样品采集:同实施例1样品采集部分。2、胚胎rna提取:(1)胚胎肉样组织加入1mltrizol,置于组织破碎仪中充分震荡;(2)加0.2倍体积氯仿于离心管中并涡旋震荡15s,室温静置3min;(3)随后将离心管4℃,12000g,离心15min;(4)取出后自上而下分为水相(无色透明),中间层(白色),有机相(粉红色),用移液器将水相层的液体转移到新的1.5ml离心管中;(5)向离心管中介入等体积提前预冷的异丙醇,颠倒混匀,置于-20℃、30~60min;(6)随后将离心管在4℃,12000g,离心15min;(7)取出离心管,此时底部会出现白色沉淀,弃去上清液,使用1ml预冷的75%乙醇清洗沉淀,随后在4℃,7500g,离心5min;(8)重复步骤(7)一次;(9)弃上清,空气中干燥沉淀5~10min;(10)加入10μlrnase-free水溶解,测浓度后-80℃冰箱保存。3、转录组测序实验步骤:提取样品总rna并使用dnasei消化dna后,用带有oligo(dt)的磁珠富集真核生物mrna;加入打断试剂在thermomixer中适温将mrna打断成短片段,以打断后的mrna为模板合成一链cdna,然后配制二链合成反应体系合成二链cdna,并使用试剂盒纯化回收、粘性末端修复、cdna的3’末端加上碱基“a”并连接接头,然后进行片段大小选择,最后进行pcr扩增;构建好的文库用agilent2100bioanalyzer和abisteponeplusreal-timepcrsystem质检合格后,使用illuminahiseqtm2000或其他测序仪进行测序。4、信息分析流程:由illuminahiseqtm2000测序所得的数据称为rawreads或rawdata,随后要对rawreads进行质控(qc),以确定测序数据是否适用于后续分析。质控后,经过滤得到cleanreads,用soapaligner/soap2将cleanreads比对到参考序列。在比对后,以reads在参考序列上的分布情况及覆盖度,来作为判断比对结果是否通过第二次质控的指标。如果通过第二次质控,则进行基因表达等后续分析。5、转录组数据分析:基因表达量的计算使用rpkm法(readsperkilobasetranscriptomepermillionmappedreads),其计算公式为:公式中假设rpkm(x)为基因x的表达量,那么c是唯一比对到基因x的reads数,n是唯一比对到参考基因的reads总数,l为基因x编码区的碱基数。rpkm法作为一个标准化处理,能消除测序量差异和基因长度对计算基因表达的影响,所计算得到的基因表达量可以用于直接比较不同样品间的基因差异表达。以上的检测结果见图2,结果表明三个品种间的基因表达出现了明显的与产肉量相符的梯度差异性规律。促进成肌的基因或者mirna的起始表达一般在五指山最早最多,而长白猪表达时间较晚,如myod、myog、mir-133b等。而抑制成肌的基因则在胚胎发育早期在长白猪中表达最多,其次是蓝塘猪、五指山猪,如id2、mdfi和mstn(28dpc)。肌管分化的标志基因在五指山猪的表达也最早、最多,长白猪则出现最晚、最少,如myh3、myh13、des等,这一现象也与之前组织形态学观察的结果吻合。实施例3五指山与长白猪myod表达情况的定量qpcr与westernblot检测。1、样品采集:同实例一样品采集部分。2、胚胎rna提取:同实例2胚胎rna提取步骤。3、rna逆转录得到cdna(具体方法参考本领域常规技术操作或各种商业化试剂盒的说明书),cdna置于-20℃,使用时稀释5倍。4、实时荧光定量pcr:反应体系如表1:先将水加入cdna中混合,再加到384孔板中,随后将引物与2×sybr®greenqpcrmix混匀,加入对应的孔中,gapdh作为内参基因,数据分析使用高级相对定量2-∆∆ct,定量引物见表2。将表1反应体系混匀后加入384孔板中,3000转离心2min;在lightcycler480ⅱ上进行荧光定量pcr,反应程序为:预变性95℃,10min;变性95℃,5s;退火60℃,1min;延伸72℃,30s;40个循环。分析溶解曲线:95℃,5s;65℃,15s;95℃,0s。表1为qpcr的反应体系表2为qpcr引物序列基因上游引物(5'to3')下游引物(5'to3')gapdhgcctccaaggagtaagaaacgaaattgtgagggagatgctmyodaccgctccgcgacgtagattgcgagtgttcctcgggcttt5、westernblot检测,具体步骤如下:(1)组织蛋白的提取:将少量组织块置于加入磁珠的组织破碎管中,加入前用剪刀剪碎,加入400μl含有pmsf的蛋白裂解液于组织破碎管中,在组织破碎仪上进行匀浆,然后置于冰上,重复几次使组织尽量碾碎,裂解30min;将裂解液移至1.5ml离心管中,并于12,000rpm4℃下离心5min,随后用0.5ml离心管分装上清液并置于-20℃保存;(2)蛋白定量:使用考马斯亮蓝法对蛋白样品浓度进行均一。首先稀释5×考马斯亮蓝至1×,酶标板每孔加入180μl的考马斯亮蓝液,每个样品重复3次。在室温下震荡30s混匀,静置5min后用595nm的波长测吸光值,绘制标准曲线计算蛋白浓度;(3)蛋白样品电泳:在放蛋白样品的离心管中加入5×蛋白上样缓冲液,干式恒温仪100℃加热10min变性蛋白质。每个孔加入10~30μg蛋白样品(根据蛋白浓度和表达情况确定),电泳条件:80v,45min;120v,80min;(4)转膜:半干转,首先在转膜缓冲液中浸润剪好的滤纸,随后将pvdf膜放入甲醇活化1min,阳极板从上到下依次放入滤纸、sds-page胶、pvdf膜、滤纸(每层均不要有气泡),盖上阴极板,转膜条件:20v,60min;(5)封闭:转膜后将pvdf膜放入封闭液(tbst配制的5%脱脂牛奶)室温震荡封闭1小时或4℃冷库过夜;(6)一抗孵育:将膜放入稀释好的一抗中,4℃冷库过夜,之后在摇床上用tbst洗3次,每次10min;(7)二抗孵育:将膜放入稀释好的二抗(1:5000)中,室温孵育1h,之后再摇床上用tbst洗3次(每次10min);(8)用滤纸吸干膜上的水,然后覆盖ecl显色液避光1min后用ecl显色仪拍照。以上的检测结果见图3,结果显示,胚胎期18~28天三品种猪均没有肌纤维形态产生,到了胚胎32天,五指山猪首先出现了中心圆环状的初级肌纤维;胚胎35天时,蓝塘和长白猪均出现了初级肌纤维,但前者数量明显多于后者,而五指山猪的初级肌纤维继续增多和直径加大;到了胚胎42天,三品种猪初级肌纤维继续分化。实施例4c2c12细胞中过表达myod抑制增殖1、转染:(1)转染前一天将c2c12细胞接种于6孔板,密度约为30%~50%,培养于完全培养基;(2)转染试剂配制:用250ulopti-mem稀释5ul的mirmimic或是10ulinhibitor及相应的对照mirnc;另250ulopti-mem稀释5ullipofectamine2000tm,于室温下放置5分钟;(3)将(2)中的二者轻轻混匀于室温孵育15分钟,形成转染复合物;(4)将(3)中的转染复合物加到细胞中,再加入培养基,轻轻混匀,6小时后更换新鲜培养基。2、实时无标记细胞检测:利用实时无标记细胞分析仪(real-timecellanalyzer)分析细胞的增殖。仪器调试校准:预热仪器,然后增殖检测板(e-plate16)每孔中加50μl含10%fbs的dmem,装回仪器,调整基线。细胞增殖检测:将处理过的细胞消化计数加入增殖检测板中,每孔加入8000个细胞,最终用10%fbs的dmem将每孔的培养基补齐180ul,每组实验3个重复。设置5min测试一次,测试时长72h后绘制细胞增殖曲线。3、edu增殖检测:(1)edu用10%的dmem培养基按1:1000的比例稀释,12孔板每孔加入300ul,细胞培养箱中孵育2h;(2)每孔用500ul的pbs洗2次,5min/次;(3)每孔用500ul4%的多聚甲醛室温固定10min;(4)pbs洗2次,5min/次;(5)每孔用500ml0.5%的tritonx-100室温孵育10min;(6)重复步骤(4);(7)300ul/孔apollo染色反应液(根据说明配制),室温避光孵育30min;(8)pbs洗1次,5min;(9)室温下,每孔300uldapi染色5min;(10)pbs清洗3次,5min/次;(11)倒置荧光显微镜下拍照。4、pi细胞周期检测:(1)前一天,把细胞消化下来装于1.5mlep管中,用pbs清洗,去除培养基和胰酶;(2)向每管中加入1ml70%预冷的乙醇,4℃固定过夜;(3)1500r/s离心5分钟收集细胞去除乙醇,用pbs洗3次,每次5分钟;(4)每孔加入1mlpi工作液,室温避光孵育30min。(5)过滤上机检测。5、实时荧光定量pcr:(1)细胞总rna提取:参考本领域常用的trizol提取法或者使用商业化的提取试剂盒;(2)rna反转为cdna:参考实施例3;(3)sybrgreenιreal-timepcr:参考实施例3。5、载体构建:(1)质粒dna提取:参照genstar质粒提取试剂盒说明书。(2)目的基因及线性化载体的获得:a:pcr:反应体系见表3,模板为c2c12细胞dna。反应程序为:预变性95℃,30s;变性95℃,10s;退火、延伸68℃,2min(根据基因大小和酶的扩增速率);延伸72℃,5min;39个循环。b:合成片段退火:化学合成的单链dna需要退火成为双链,反应体系见表4。退火程序为95℃,10min;85℃,1min;75℃,1min;65℃,1min;55℃,1min;45℃,1min;30℃,1min。c:载体双酶切和连接:利用限制性核算内切酶将载体双酶切使其线性化,酶切反应体系参照表5,37℃水浴酶切4小时后琼脂糖凝胶回收,将获取的线性化载体和基因片段按表6体系配制后16℃水浴连接过夜。d:转化和鉴定:(1)从-80℃冰箱取出dh5α感受态细胞,冰上融化后在超净台内加入连接产物,轻轻震荡使其混匀,冰浴30min;(2)42℃热激45s后立即冰浴2min;(3)每管加入600μl无抗lb液体培养基,37℃、220rpm震荡培养30min;(4)3000×g、1min离心弃上清浓缩菌体,将菌体均匀涂布于有相应抗生素的lb固体培养基平板上,37℃倒置培养12-16小时;(5)挑取单克隆菌落接种于600μl含抗生素的lb液体培养基中,37℃、220rpm震荡培养5小时,菌液pcr并经测序鉴定阳性克隆。e:westernblot实验:(1)样品处理:用pbs清洗2遍细胞,吸干残留液体后加入150~300μl含pmsf的蛋白裂解液,在冰上充分搅拌至细胞完全裂解,转移至1.5ml离心管中并用1ml注射器反复吹打至样品不再粘稠。(2)其余westernblot操作步骤参考见实施例3相关内容。f:数据处理及统计分析:除特别说明,每个生物学实验至少重复3次,实验结果用品均值±标准误差(mean±sem)表示;实验作图使用prism6软件,数据统计分析使用spss(version21),两组数据间的统计分析均采用双侧检验,三组以上数据间的统计分析采用anova,并表示为:显著性差异*:p<0.05;极显著差异**:p<0.01;***:p<0.001。表3为pcr反应体系组分体积(μl)5×pcrbuffer(mg2+)10dntp4templatedna1000ngprimestarhsdnapolymerase0.5forwardprimer1reverseprimer1h2oaddto50μl表4为单链退火反应体系组分体积(μl)forwardfragment2reversefragment210×t4ligasebuffer2t4pnk1h2oaddto20ul表5为双酶切体系组分体积(μl)plasmiddna2ug10×fermentasbuffer5enzyme11enzyme21h2oaddto50表6为连接反应体系组分体积(μl)10×t4ligasebuffer1vectorfragment20ngdnafragment80ngt4ligase0.3h2oaddto10以上检测结果见图4,结果显示过表达myod会抑制c2c12细胞的增殖。实例例5c2c12细胞增殖期越早过表达myod则分化后产生的肌管越少1、诱导分化:待细胞完全长满,弃培养基,换成含2%马血清的dmem培养基培养,每两天更换一次培养基。2、免疫荧光:(1)细胞用4%对聚甲醛室温固定10min;(2)0.5%的tritonx-100室温孵育10min;(3)用3%bsa封闭30min;(4)用3%bsa稀释的一抗在4℃过夜孵育;(5)吸去一抗,用pbs洗涤3个5min;(6)用相应的荧光二抗室温避光孵育1h;(7)吸去二抗,用pbs洗涤3个5min;(8)dapi染色5min;(9)pbs洗3个5min;(10)荧光显微镜下拍照。3、westernblot和实时荧光定量pcr:参考实施例4。以上检测结果见图5,结果显示在c2c12细胞增殖阶段过表达myod会抑制成肌分化过程,越早过表达myod,产生的肌管越少。实施例6nih3t3细胞中过表达myod会抑制增殖1、诱导分化:参考实施例5相关部分。2、免疫荧光:参考实施例5相关部分。3、westernblot和实时荧光定量pcr:参考实施例4相关部分。4、实时无标记细胞检测、edu染色和载体构建:参考实施例4相关部分。以上检测结果见图6和图7。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- CRISPR-Cas9特异性敲除猪SALL1基因的方法及用于特异性靶向SALL1基因的sgRNA的制作方法
- CRISPR-Cas9特异性敲除猪CMAH基因的方法及用于特异性靶向CMAH基因的sgRNA的制作方法
- CRISPR-Cas9特异性敲除猪SLA-2基因的方法及用于特异性靶向SLA-2基因的sgRNA的制作方法
- 一种安宁铗蠓的特异基因及其分子鉴定方法
- 一种蓝腹库蠓的特异基因及其分子鉴定方法
- 一种特异性抑制twist1基因表达的小干扰rna及其应用
- 一种特异性抑制magea1基因表达的小干扰rna及其应用
- 一种特异性抑制magea1基因表达的小干扰rna及其应用
- 一种特异性抑制twist1基因表达的小干扰rna及其应用
- 一种特异性抑制ctgf基因表达的小干扰rna及其应用
- 大豆低温诱导人工合成启动子SP5及应用的制造方法与工艺
- 一种棒状杆菌组成型表达载体启动子、含有该启动子及gnd基因的表达载体的制造方法与工艺
- 一种棒状杆菌组成型表达载体启动子、含有该启动子及lrp基因的表达载体的制造方法与工艺
- 一种二值卷积神经网络处理器及其使用方法与流程
- 检测NUP214‑ABL1基因相对表达量的试剂盒和方法与流程
- 环介导的级联放大策略用于高灵敏检测DNA甲基转移酶活性的制造方法与工艺
- 一种基于高压静电场来促进作物优质高效安全生产的嫁接方法与流程
- 一种酶性DNA机器用于miRNA检测的方法与流程
- 转基因玉米MON87403品系特异性实时荧光PCR检测引物、探针、方法和试剂盒与流程
- 葡萄早熟基因VvWRKY13在调控植物中乙烯生物合成中的应用的制造方法与工艺