金钱鱼黄体生成素LH基因、金钱鱼LH重组蛋白及应用的制作方法
本发明属于基因工程
技术领域:
,具体涉及一种金钱鱼黄体生成素LH基因的cDNA序列,还有由其通过重组质粒的构建、原核表达系统诱导表达得到的金钱鱼LH重组蛋白的纯化及应用。
背景技术:
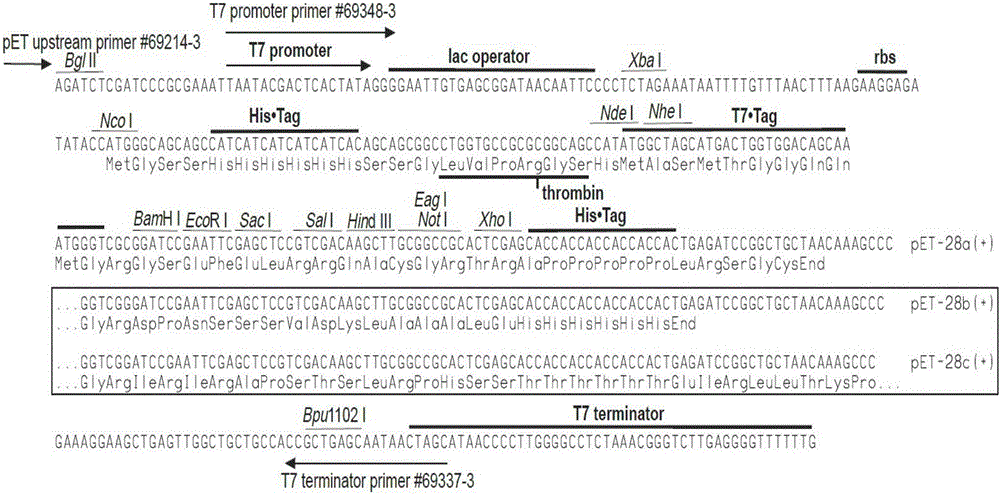
:金钱鱼(Scatophagusargus)又名金鼓鱼,隶属鲈形目(Perciformes),金钱鱼科(Scatophagidae),分布于我国东海和南海海域,为一种兼具观赏性的优质经济鱼类。金钱鱼为广盐性鱼类,在盐度极高的海区中有分布,在纯淡水中也能很好的生长与存活,可以直接从35‰的海水转移到淡水生活,无需进行淡化驯养,其罕有的对盐度超强的适应性使其非常适合作为研究硬骨鱼类生殖与生长的材料。研究金钱鱼的金钱鱼精子发生机制对于海水经济鱼类的淡化养殖非常有意义。了解海水鱼类繁育过程中的机体变化与环境适应,对于提高海水鱼类繁殖和生长性能,对于水产养殖发展具有重要意义。黄体生成素又称促黄体素(luteinizinghormone,LH)。垂体前叶嗜碱性细胞所分泌的激素。为糖蛋白。分子量约30000。化学结构:为糖蛋白,由α和β两个亚基肽链以共价键结合而成。在有卵泡刺激素存在下,与其协同作用,刺激卵巢雌激素分泌,使卵泡成熟与排卵,使破裂卵泡形成黄体并分泌雌激素和孕激素。刺激睾丸间质细胞发育并促进其分泌睾酮。故又称间质细胞促进素。LH、FSH和人绒毛膜促性腺激素(HCG)都属于糖蛋白家族,LH的结构和功能与HCG相似,两种激素通过相同的受体发挥作用,但其半衰期很短,约30分钟,在血液中波动范围较大;而HCG有较长的半衰期,并且与受体结合更加稳固,容易被放免法所测定,所以经常用于临床和实验室研究。虽然促黄体生成素(LH)对人类的不孕不育治疗有了广泛的应用,但是对鱼类的研究与应用还比较少。黄体生成素的功能:(1)促进雌激素和孕酮的合成。(2)触发排卵:在切除腺垂体的病人,当用各种方法使卵泡发育到一定阶段后,人工给予LH即可导致排卵。LH引起排卵的机制可能是由于溶蛋白酶,淀粉酶,透明质酸酶的活性增加,导致卵泡壁的结缔组织分解而造成的。动物实验表明:在LH作用下产生的孕酮可以触发排卵酶的形成及释放。在LH作用下,成熟的卵泡分泌前列腺素。(3)促进黄体的产生:成熟的卵泡中的粘膜细胞在没有LH存在时,也会自然地黄体化,但未成熟的粒膜细胞,只有加入LH,才能黄体化。(4)LH对卵巢的其他作用:增加卵巢的血流量,增加鸟氨酸脱羚酶的活性,降低卵巢组织内胆固醇浓度。LH能促进Leydig细胞增殖和分化促进攀酮的生成,同时,精囊和前列腺也增生。LH在促使家畜性成熟提前、诱导泌乳乏情期的母畜发情、提高公畜精液品质、治疗母畜卵巢疾病和胚胎移植中的供体超数排卵等领域的应用中已经得到了深入的分析和总结,近年来又对胚胎移植与超数排卵(MOET)、卵母细胞的体外成熟(IVM)和体外受精(IVF)进行了深入研究和探索。使我们进一步了解了LH在动物繁殖育种中的应用:(1)促使家畜性成熟提前:某些家畜的繁殖具有季节性,如果出生较晚,性成熟时有可能错过繁殖季节,接近性成熟的家畜孕酮处理,配合使用LH,可使它们提早发情配种;(2)诱导泌乳乏情期的母畜发情:LH处理,可诱导泌乳乏情期的母畜发情和配种,缩短胎间距,提高母畜的繁殖效率;(3)提高公畜精液品质:公畜精子密度不足或精子活力差可致母畜不孕,应用LH和FSH治疗,可提高精子密度,改善精液品质;(4)治疗母畜卵巢疾病:LH对卵巢机能不全,发育停滞或交替发育均有较好疗效;(5)超排处理:在胚胎移植工作中,为了获得大量的卵子和胚胎,常用LH对供体动物进行处理,使其卵泡大量发育成熟和排卵;(6)卵母细胞的体外成熟和体外受精。家畜卵母细胞体外成熟和促性腺激素有着密切的联系。总之,黄体生成素因其广泛而奇特的生物学功能,在水产养殖产业和畜牧业甚至人类疾病治疗等领域有着广泛和诱人的前景。现有技术存在的问题:随着水产养殖规模不断地扩大,为了稳定的保证数量的生产模式,确保繁殖、生长的效率,很多药物投入到生产行业中,这无疑会对环境以及人体造成一定伤害。近年来随着生物学技术的快速进展,使得对鱼类精子发生相关基因的认识取得了长足的进步。RT-PCR技术、原位杂交技术、减除杂交技术、差异显示技术、EST微阵列技术的应用获得了许多与精子发生及成熟相关的基因,促进了对精子发生分子机理的认识。但是,精子发生有大量基因表达,并且这些基因表达是呈阶段特异性的,具有严格的时、空调控关系,用睾丸和精子mRNA探测一块克隆EST微阵列已经说明了精子发生的复杂性,在精子发生相关基因的研究中尚存在许多未知领域。基因的发现及其功能与关系的阐明是将来研究精子发生分子机理的核心任务,目前鱼类对于调控精子发生的特异基因研究尚处于起步和探索阶段。进一步筛选、鉴定和克隆精子发生过程特异表达基因,对于了解精子发生、减数分裂和分化变态的分子及其调控机制十分重要。由于生精细胞的发育需要严格的特殊环境,缺少体外培养模型,长期制约着精子发生分子机理的研究。但近年来随着生物学技术的快速进展,使得对精子发生相关基因的认识取得了长足的进步。减除杂交、差异显示技术的应用获得了许多与精子发生及成熟相关的基因。鉴定调节精子发生的关键基因以及阐明其功能是将来研究精子发生分子机理的核心任务,完善对金钱鱼精子发生机制的研究,为研究鱼类精子发生的分子机制等提供基础数据,从而更好的指导生产实践。技术实现要素:本发明的目的在于提供一种金钱鱼黄体生成素LH基因、金钱鱼LH重组蛋白及应用;具体而言,是由金钱鱼黄体生成素LH基因通过原核表达系统诱导表达得到的金钱鱼LH重组蛋白及其应用,不仅获得了金钱鱼黄体生成素LH基因的cDNA序列全长,还通过原核表达获得了金钱鱼LH重组蛋白,通过亲和柱纯化,获得纯的LH重组蛋白,以应用于鱼类体外注射来促进鱼类性腺发育,进而使鱼类性腺发育表现同步性。本发明的目的是通过以下技术方案来实现的:第一方面,本发明涉及一种金钱鱼黄体生成素LH基因,其cDNA序列包括如SEQIDNO:1所示的碱基序列。第二方面,本发明涉及一种金钱鱼LH重组蛋白,所述重组蛋白包括如SEQIDNO:2所示的氨基酸序列。编码该重组蛋白的基因序列如SEQIDNO:1所示。第三方面,本发明还涉及一种前述的金钱鱼LH重组蛋白的制备方法,获取前述的金钱鱼黄体生成素LH基因的cDNA序列全长,通过原核表达获得金钱鱼LH重组蛋白。优选的,所述获取包括如下步骤:S1、利用Trizol提取法,利用金钱鱼性腺进行RNA提取,再通过反转试剂盒进行cDNA的合成;S2、根据步骤S1合成得到的cDNA保守区设计引物,利用RT-PCR和RACE技术,克隆获得金钱鱼LH基因序列全长。优选的,所述克隆引物对为3′LH1、3′LH2和5′LH1、5′LH2。其碱基序列分别依次如SEQIDNO:3-6所示。优选的,所述原核表达包括如下步骤:A1、金钱鱼黄体生成素LH基因的cDNA序列与pGEM-TEasy载体连接后,转化至DH5α感受态细胞,扩增培养;离心收集,抽提含有目的基因(LH基因)和pGEM-TEasy载体的质粒;A2、根据pET-28a+载体选择酶切位点XhoI(158),NdeI(238),分别对步骤A1抽提得到的质粒DNA进行双酶切;回收有效片段;A3、纯化;将目的基因和质粒的回收产物连接,连接产物导入BL-21表达感受态细胞;离心分离;挑菌,菌落PCR验证后选取有效菌液;A4、将所述有效菌液以体积比1∶10转接到含卡那霉素的LB液体培养基中,37℃,振荡培养,进行重组蛋白诱导表达,获取重组粗提蛋白。优选的,步骤A2中,酶切引物对为pET(LH)-F、pET(LH)-R;其对应的序列分别如SEQIDNO:7、8所示。优选的,原核表达后还包括通过亲和柱纯化,获得纯的金钱鱼LH重组蛋白的步骤。优选的,所述亲和柱纯化包括如下步骤:B1、取1ml镍琼脂糖凝胶FF或镍NTA琼脂糖凝胶FF预装柱,用10ml平衡缓冲液平衡,然后10ml重组粗提蛋白样品以0.5ml/min上样,然后2ml/管分管收集;B2、用15ml平衡缓冲液洗去未吸附的重组粗提蛋白样品,流速1-2ml/min,2ml/管收集;B3、用5ml洗脱缓冲液洗去未吸附的重组粗提蛋白样品,流速1-2ml/min,2ml/管收集。第四方面,本发明还涉及一种前述的金钱鱼LH重组蛋白在用作促进鱼类性腺发育药剂中的用途。优选的,所述促进鱼类性腺发育药剂为体外注射液。第五方面,本发明还涉及一种前述的制备方法制得的金钱鱼LH重组蛋白在用作促进鱼类性腺发育药剂中的用途。优选的,所述促进鱼类性腺发育药剂为体外注射液。第六方面,本发明还涉及一种鱼用重组蛋白体外注射液,所述体外注射液包括获取前述的金钱鱼黄体生成素LH基因的cDNA序列全长,通过原核表达获得的金钱鱼LH重组蛋白。第七方面,本发明还涉及一种鱼用重组蛋白体外注射液的制备方法,所述方法包括如下步骤:C1、利用Trizol提取法,利用金钱鱼性腺进行RNA提取,再通过反转试剂盒进行cDNA的合成;C2、根据步骤S1合成得到的cDNA保守区设计引物,利用RT-PCR和RACE技术,克隆获得金钱鱼LH基因序列全长;C3、金钱鱼黄体生成素LH基因的cDNA序列与pGEM-TEasy载体连接后,转化至DH5α感受态细胞,扩增培养;离心收集,抽提含有目的基因(LH基因)和pGEM-TEasy载体的质粒;C4、根据pET-28a+载体选择酶切位点XhoI(158),NdeI(238),分别对步骤A1抽提得到的质粒DNA进行双酶切;回收有效片段;C5、纯化;将目的基因和质粒的回收产物连接,连接产物导入BL-21表达感受态细胞;离心分离;挑菌,菌落PCR验证后选取有效菌液;C6、将所述有效菌液以体积比1∶10转接到含卡那霉素的LB液体培养基中,37℃,振荡培养,进行重组蛋白诱导表达,获取重组粗提蛋白;C7、重组粗提蛋白通过亲和柱纯化,获得纯的金钱鱼LH重组蛋白,即所述鱼用重组蛋白体外注射液。优选的,所述亲和柱纯化包括如下步骤:B1、取1ml镍琼脂糖凝胶FF或镍NTA琼脂糖凝胶FF预装柱,用10ml平衡缓冲液平衡,然后10ml重组粗提蛋白样品以0.5ml/min上样,然后2ml/管分管收集;B2、用15ml平衡缓冲液洗去未吸附的重组粗提蛋白样品,流速1-2ml/min,2ml/管收集;B3、用5ml洗脱缓冲液洗去未吸附的重组粗提蛋白样品,流速1-2ml/min,2ml/管收集。与现有技术相比,本发明具有如下有益效果:1)本发明是利用RT-PCR和RACE等分子生物操作技术,克隆得到黄体生成素的cDNA序列全长,通过酶切等技术构建重组质粒,将重组质粒转化到大肠杆菌内,然后在IPTG作用下诱导重组蛋白的表达,然后进行提取、纯化。本发明着力于获得一种较为安全、健康、有效的体外注射夜,其过程中所提及的重组质粒的构建、分离和纯化,是之前水产养殖中体外注射所没有涉及到的。2)本发明填补了国内外利用金钱鱼黄体生成素(LH)重组质粒的构建制备蛋白体外注射液,解决了金钱鱼性腺发育不同步的问题。3)由于饲料中添加投喂重组蛋白存在因饲料投喂而产生的重组蛋白浪费、蛋白利用率不高等问题;且鱼类促性腺激素是糖蛋白类物质,容易被有胃鱼体内的蛋白酶所降解,从而降低其生理功能。因此,本发明采用注射诱导方式可更为直接地使体外重组LH作用于鱼体,利用直观地研究LH对鱼类配子的生成的调控作用。4)本发明利用注射诱导方法,认识了金钱鱼黄体生成素LH重组蛋白对成熟期金钱鱼配子发育参数的影响。可从基因表达水平、血清相关激素水平和扫描隧道显微镜角度分析,推测其可能的机制,为深入认识金钱鱼生殖轴(BPG-axis)的调控机制和建立实用的金钱鱼养殖技术提供基础。附图说明通过阅读参照以下附图对非限制性实施例所作的详细描述,本发明的其它特征、目的和优点将会变得更明显:图1为pET-28a(+)载体质粒图谱;图2为pET-28a载体多克隆位点示意图;图3为酶联免疫法(ELISA)测定激素水平示意图,其中,A为11-KT(睾酮)雌性♀水平示意图,B为Estrogen(雌二醇)雌性♀水平示意图,C为11-KT(睾酮)雄性♂水平示意图,D为Estrogen(雌二醇)雄性♂水平示意图;图4为扫描电镜观察、拍摄性腺结构示意图;其中,A、B、E、F为对照组;C、D、G、H为试验组;图5为LH克隆PCR示意图;图6为LH胶回电泳、PCR送测阳性克隆产物电泳验证示意图;其中,a为LH胶回电泳示意图,b为阳性克隆产物电泳示意图;图7为双酶切pET-LH电泳图;其中,a为pET-LH,b中,左上pET-28a,左下LH,右pET-LH;图8为pET-LH重组蛋白Western检测图谱;其中a为显色拍摄图,且1-5道是考马斯亮蓝染色拍摄图,6、7道是Westernblot转膜ECL显色拍摄图,b为重组蛋白纯化结果示意图;具体实施方式本发明首先利用RT-PCR和RACE等分子生物操作技术,获得金钱鱼黄体生成素LH基因的cDNA序列全长,通过原核表达系统诱导表达得到金钱鱼粗提LH重组蛋白,通过亲和柱纯化,获得纯的LH重组蛋白,应用于鱼类体外注射,促进鱼类性腺发育,使鱼类性腺发育表现同步性。具体步骤如下:1)利用Trizol提取法,利用金钱鱼性腺进行RNA提取,再通过反转试剂盒(罗氏)进行cDNA的合成,合成的cDNA保存于-20℃,待用。LH基因的cDNA全长608bp(图5为LH克隆PCR示意图;由图5可知,LH片断大小608bp(所用Marker为2000bp,Takara)),其序列如SEQIDNO:1所示,其中开放阅读框为438bp(第106-543个碱基),编码145个氨基酸,第1-22个氨基酸为信号肽,存在着一个硬骨鱼类特异性的Cys-Ser-Gly-His(CSGH)区域。此外,在LH氨基酸序列中发现了一个N-糖基化位点(NHT),在3’端非编码区内含有一个加尾信号AAATAA。NCBI,ORFfinderLHcDNA序列检测结果如下:ORF编码氨基酸:第1-22个氨基酸为信号肽,具体序列如SEQIDNO:2所示:MMAAQVSRATFPLILFLEFTAAFQLPPCQLVNHTVSLEKEGCPKCHPVETTICSGHCLTKDPVIKIPFSNVYQHVCTYRDLYYKTFELPDCPPGVDPTVTYPVALSCHCGRCAMDTSDCTFESLHPDFCMNDIPFYYPSEGMSLY。2)通过生物软件BioEdit,Primer5.0等生物软件,根据保守区设计引物,利用RT-PCR和RACE技术,克隆获得金钱鱼LH(黄体生成素)基因序列全长。克隆引物:3′LH1GTCTCTGGAGAAGGAGGGCTGT(SEQIDNO:3)3′LH2TACAAGACATTTGAGCTTCCCGA(SEQIDNO:4)5′LH1CAGGCTCTCGAAGGTGCAGTC(SEQIDNO:5)5′LH2TCGGGAAGCTCAAATGTCTTGTA(SEQIDNO:6)再通过与pGEM-TEasy载体(普洛麦格(北京)生物技术有限公司)16℃连接过夜,然后再转化至DH5α感受态细胞(天根生化科技(北京)有限公司)中,然后摇菌3-6h后,进行菌落PCR验证,将有效菌液接种到新鲜的LB液体培养基中,使用足够的LB液体培养基让大肠杆菌大量扩增培养。3)提取质粒:2)中所摇菌包括转入目的基因和表达载体的感受态细胞,扩增培养之后,先将扩增培养的大肠杆菌离心收集,然后利用Takara质粒抽提试剂盒(上海皓嘉科技发展有限公司)大量提取目的基因和载体的质粒。4)双酶切:根据pET-28a+载体(北京全式金生物技术有限公司)选择酶切位点XhoI(158),NdeI(238)(载体pET-28a(+)图谱如图1所示,载体大小5369bp;载体pET-28a(+)上选择的酶切位点如图2所示),分别对提取的质粒DNA进行双酶切,将目的片段和表达质粒用限制性内切酶进行双酶切,酶切产物经琼脂糖电泳检测后,2%琼脂糖胶跑胶,用Promega胶回试剂盒(普洛麦格(北京)生物技术有限公司)回收有效片段。酶切引物:pET(LH)-FCATATGTTCCAGCTGCCGCCATGC(SEQIDNO:7)pET(LH)-RCTCGAGTTAGTACAGAGACATCCCTTCAGACGG(SEQIDNO:8)图7为双酶切pET-LH电泳图;由图7-a可知,pET-LH大小约为6000bp,酶切正确,回收产物为目的片段(所用Marker为5000bp);由图7-b可知,因为购买pET-28a载体片段大小为5369bp,图中pET-LH大小约为6000bp,符合酶切意图(所用Marker为5000bp,Takara)。5)纯化:通过琼脂糖进行胶回,目的基因回收的是较小的片段,质粒则是较大的片段。图6为LH胶回电泳示意图;由图6-a,b可知,LH片断大小608bp(所用Marker为2000bp,Takara)。6)连接:将目的基因和质粒的回收产物连接,以10∶1的比例,16℃连接过夜。琼脂糖电泳鉴定正确后,将连接产物导入BL-21表达感受态细胞(BL21(DE3)感受态细胞天根生化科技(北京)有限公司)中,加入装有新鲜1mlLB液体培养基的1.5ml的EP管中,摇菌。7)酶切检测:对连接产物分别进行双酶切和单酶切(都是2个)检测。将携带有目的基因和载体的质粒的菌液,接种于50mlLB液体培养基(Amp+工作液浓度50ug/ml),37℃,200rpm,摇菌6-8h,双酶切组与单酶切组互相做对照。8)将所摇得的菌液进行离心收集,然后涂于Kana+的LB平板,每组10样进行挑菌,置于装有1mlKana+的LB液体培养基的1.5mlEP管中摇菌3-6h,进行菌落PCR验证,选取上述步骤中的有效菌液进行接下来的接种工作。9)保存菌种:将50%⑧有效菌液与50%甘油混合,摇匀,-80℃保存(甘油浓度在30-70%即可。)10)将上述8)菌液以1∶100转接到新的LB中,37℃,200rpm,进行大量培养2-3h;当细菌长到OD=0.4-0.6后,加入IPTG工作液至其终浓度为1mM,37℃诱导培养6-8h,收集菌液(做对照组,无IPTG)。11)蛋白检测:4℃,12,000g离心5min,收集细菌沉淀,1×PBS漂洗(注意不要溶解),然后溶解沉淀,加2×LoadingBuffer,100℃煮沸5min,冷却至室温,然后10,000g离心10min,取5ul上清进行SDS-PAGE电泳。考染或WesternBlot分析,出现目的条带,蛋白丰度较高,进行诱导蛋白扩增培养。图8为pET-LH重组蛋白Western检测图谱;由图8-a,b可知,蛋白表达丰度较高,且大小约为16kDa。12)重组蛋白诱导表达:取上述9)中-80℃保存的pET-LH/BL和pET-28a/BL冻存菌液100ul接于1ml含卡那霉素(Kana+)的新鲜LB液体培养基中,37℃,振荡培养1h。随后吸取适量菌液涂于含卡那霉素(Kana+)的LB固体平板培养基上,37℃培养10-14h。13)挑取单克隆接于lml含卡那霉素(Kana+)LB液体培养基的1.5mlEP管中,37℃,振荡培养8-10h以让大肠杆菌大量扩增(生长至大肠杆菌对数生长期)。菌液PCR验证后,将含有目的基因插入片段的菌液以1∶100(v/v)的比例接种于400ml新鲜(Kana+终浓度50ug/ml)LB液体培养基中,37℃扩增培养。14)重组粗提蛋白获取:将收集的菌液于4000-5500rpm离心10min,去除培养基,用pH=7.4的PBS缓冲液重悬菌体。冰浴超声破碎菌体。参数设置为电压200V,2s破碎,2s间隔,如此反复至菌液清亮。4000-5500rpm离心10min,沉淀为细胞碎片,上清液为菌体粗蛋白。吸取上清液,-20℃保存备用。15)溶液试剂:(纯化所用试剂购于生工生物工程上海股份有限公司)平衡缓冲液,pH=7.4的50mM磷酸缓冲液含0.5MNaCl,含20mM咪唑。洗脱缓冲液,pH=7.4的50mM磷酸缓冲液含0.5MNaCl,含500mM咪唑。16)重组蛋白分离纯化:取1ml镍琼脂糖凝胶FF或镍NTA琼脂糖凝胶FF预装柱,用10ml平衡缓冲液平衡,然后取破碎上清10ml样品以0.5ml/min上样,然后2ml/管分管收集。用15ml平衡缓冲液洗去未吸附的样品,流速1-2ml/min,2ml/管收集。用5ml洗脱缓冲液洗去未吸附的样品,流速1-2ml/min,2ml/管收集。再用5ml平衡缓冲液平衡柱子,灌满20%乙醇,封闭,以备下次使用。收集的部分用考玛斯亮蓝法、SDS-Page电泳、Western-Blot检测。下面结合实施例对本发明进行详细说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干调整和改进。这些都属于本发明的保护范围。实施例1、重组蛋白诱导表达:取上述-80℃保存的pET-LH/BL和pET-28a/BL冻存菌液100ul接于1ml含卡那霉素(Kana+)的新鲜LB液体培养基中,37℃,振荡培养1-3h。随后吸取适量菌液涂于含卡那霉素(Kana+)的LB固体平板培养基上,37℃培养10-14h。挑取单克隆接于1ml含卡那霉素(Kana+)LB液体培养基的1.5mlEP管中,37℃,振荡培养8-10h以让大肠杆菌大量扩增(生长至大肠杆菌对数生长期)。2、菌液PCR验证后,将含有目的基因插入片段的菌液以1∶100(v/v)的比例接种于400ml新鲜(Kana+终浓度50ug/m1)LB液体培养基中,37℃扩增培养。3、重组粗提蛋白获取:将收集的菌液于4000-5500rpm离心10min,去除培养基,用pH=7.4的PBS缓冲液重悬菌体。冰浴超声破碎菌体。参数设置为电压200V,2s破碎,2s间隔,如此反复至菌液清亮。4000-5500rpm离心10min,沉淀为细胞碎片,上清液为菌体粗蛋白。吸取上清液,-20℃保存备用;4、溶液试剂:(纯化所用试剂购于生工生物工程上海股份有限公司)平衡缓冲液:pH=7.4的50mM磷酸缓冲液含0.5MNaCl,含20mM咪唑。洗脱缓冲液:pH=7.4的50mM磷酸缓冲液含0.5MNaCl,含500mM咪唑。5、重组蛋白分离纯化:首先取1ml镍琼脂糖凝胶FF或镍NTA琼脂糖凝胶FF预装柱,用10ml平衡缓冲液平衡,然后取破碎上清10ml样品以0.5ml/min上样,然后2ml/管分管收集。用15ml平衡缓冲液洗去未吸附的样品,流速1-2ml/min,2ml/管收集。用5ml洗脱缓冲液洗去未吸附的样品,流速1-2ml/min,2ml/管收集。再用5ml平衡缓冲液平衡柱子,灌满20%乙醇,封闭,以备下次使用。收集的部分用考玛斯亮蓝法、SDS-Page电泳、Western-Blot检测。6、体外注射:使用生理盐水进行稀释,配置浓度为5-10ng/ml的重组蛋白注射液,分别对三组(空白组:不注射任何药物及药品,对照组:注射与实验组相同剂量的生理盐水,实验组:注射浓度为5-10ng/ml的重组蛋白,注射量为1.5-2ml/100g)金钱鱼进行肌肉注射(背鳍),设采样时间点设为0d,7d,14d,采取性腺、血清。7、结果检测:对所采得的样品进行分子水平的检测,经由酶联免疫法(ELISA试剂盒德国Cayman公司)对血清中的睾酮,雌二醇进行浓度检测。另将所采得的性腺经过处理,扫描电镜下进行观察并拍摄。酶联免疫法(ELISA)测定激素水平如图3所示,可见在0d,7d,14d,金钱鱼空白组,对照组,实验组血清中的睾酮,雌二醇浓度差异。实验组的雌性金钱鱼血清中雌二醇在0天时含量391pg/ml,7天时含量为578pg/ml,有显著上升,14天时含量降为305pg/ml,又有所降低。而血清中睾酮含量从0天至14天含量在11-17pg/ml之间,处理前后无明显变化(*p<0.05)。实验组的雄性金钱鱼血清中睾酮在0天和7天时含量50pg/ml左右,14天时含量为132pg/ml,有显著上升。而血清中雌二醇含量从0天至14天含量在6.5-7.5pg/ml之间,处理前后无明显变化(*p<0.05)。扫描电镜观察、拍摄性腺结构示意图如图4所示,扫描隧道显微镜观察发现,处理前后卵巢组织实验组和对照组无明显变化。对照组精巢出现精子发育不同步,实验组精子发育较一致。说明体外注射LH重组蛋白可促进金钱鱼配子生成及发育。以上对本发明的具体实施例进行了描述。需要理解的是,本发明并不局限于上述特定实施方式,本领域技术人员可以在权利要求的范围内做出各种变形或修改,这并不影响本发明的实质内容。SEQUENCELISTING<110>上海海洋大学<120>金钱鱼黄体生成素LH基因、金钱鱼LH重组蛋白及应用<130>2016<160>8<170>PatentInversion3.5<210>1<211>608<212>DNA<213>Scatophagusargus<400>1ggaaactgcctgcaggctgcagacgggactgttcaaaacacgcccactagctggcacacc60tgacaatcaacagaacaactaagtaaattattgactgacttcaggatgatggctgcacag120gtcagcagagcgacgttccccttgatactgtttctggaattcacagcggccttccagctg180ccgccatgccagctcgtcaaccacacggtgtctctggagaaggagggctgtcccaagtgt240cacccggtggaaacaaccatctgcagtgggcactgcctcaccaaggatcctgtcattaag300ataccgttcagcaacgtttaccagcacgtctgcacgtaccgggacttgtactacaagaca360tttgagcttcccgactgtccacccggcgtggacccgacggtcacctaccccgtggctctg420agctgccactgcggccgctgcgccatggacacatccgactgcaccttcgagagcctgcac480ccagacttctgcatgaacgacatacctttctactacccgtctgaagggatgtctctgtac540taaagcacacgacacgtacaaaaactgtgctgacttcaaatattgtaaataaagattgtt600gcatttac608<210>2<211>145<212>PRT<213>Scatophagusargus<400>2MetMetAlaAlaGlnValSerArgAlaThrPheProLeuIleLeuPhe151015LeuGluPheThrAlaAlaPheGlnLeuProProCysGlnLeuValAsn202530HisThrValSerLeuGluLysGluGlyCysProLysCysHisProVal354045GluThrThrIleCysSerGlyHisCysLeuThrLysAspProValIle505560LysIleProPheSerAsnValTyrGlnHisValCysThrTyrArgAsp65707580LeuTyrTyrLysThrPheGluLeuProAspCysProProGlyValAsp859095ProThrValThrTyrProValAlaLeuSerCysHisCysGlyArgCys100105110AlaMetAspThrSerAspCysThrPheGluSerLeuHisProAspPhe115120125CysMetAsnAspIleProPheTyrTyrProSerGluGlyMetSerLeu130135140Tyr145<210>3<211>22<212>DNA<213>ArtificialSequence<220><223>ArtificialSequence<400>3gtctctggagaaggagggctgt22<210>4<211>23<212>DNA<213>ArtificialSequence<220><223>ArtificialSequence<400>4tacaagacatttgagcttcccga23<210>5<211>21<212>DNA<213>ArtificialSequence<220><223>ArtificialSequence<400>5caggctctcgaaggtgcagtc21<210>6<211>23<212>DNA<213>ArtificialSequence<220><223>ArtificialSequence<400>6tcgggaagctcaaatgtcttgta23<210>7<211>24<212>DNA<213>ArtificialSequence<220><223>ArtificialSequence<400>7catatgttccagctgccgccatgc24<210>8<211>33<212>DNA<213>ArtificialSequence<220><223>ArtificialSequence<400>8ctcgagttagtacagagacatcccttcagacgg33当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1