一种抑制RbAp48基因的siRNA及其制备抗肿瘤化疗药物增敏剂中的应用的制作方法
本发明涉及抑制rbap48的sirna在制备抗肿瘤化疗药物增敏剂中的应用。
背景技术:
据世界卫生组织发表的《全球癌症报告2014》,癌症是影响全球发病率和死亡率的主要原因,2012年全世界大约有1400万新发癌症病例,癌症相关死亡为820万例,并且预计未来20年内新发病例数约增加70%。报告统计引起癌症死亡常见的癌症类型为肺癌、肝癌、胃癌、大肠癌、乳腺癌、食管癌等。近几年,肿瘤化疗取得一定进展,肿瘤患者的生存时间明显延长,但仍没有令人满意的疗效,尤其在实体瘤治疗方面。
化疗作为全身性的治疗手段,在恶性肿瘤治疗过程占有手术和放疗不能代替的地位。铂类和抗代谢药为临床上常用的治疗肿瘤的化疗药物。顺铂是铂类代表之一,临床上多作为首选治疗食道癌、子宫颈癌、肺癌等。5-fu是抗代谢类药之一,临床上对多种实体瘤有效,特别是消化道肿瘤方面。但临床上抗肿瘤药物的治疗效率仍然低,原因是随着铂类和抗代谢类药物的广泛使用,不可避免地会引起肿瘤细胞对其的敏感性下降,甚至是产生严重的耐药反应。因此,寻找提高肿瘤对化疗药物敏感性的药物成为抗肿瘤的一个研究热点。
rbap48(retinoblastoma-associatedprotein48)属wd-40蛋白家族,最初被鉴定为rb蛋白的结合蛋白,其分子量为48kda。rbap48参与多种复合物的作用,比如atp-依赖重组复合物,组蛋白脱乙酰酶复合物sin3,染色体组装因子与dna序列配对复合物caf-1,核染色质重构和脱乙酰酶nurd。近期研究发现rbap48是pcg(polycombgroupprotein,pcg)的主要成员之一,pcg能特异性催化组蛋白h3第27位赖氨酸甲基化,从而实现靶基因的沉默。研究发现rbap48在肺癌、宫颈癌、甲状腺癌、急性髓细胞白血病、原发性肝癌等恶性肿瘤中均呈现异常高表达,这表明rbap48与肿瘤的发生、发展有密切关系。
rna干扰(rnainterference,rnai)是指内源性或外源性短链rna诱导同源mrna降解,导致基因表达下调或沉默的生物学现象。rnai介导特定基因沉默的相关机制发生在转录后水平,故也称为转录后基因沉默(ptgs)。在起始阶段,外源性短双链rna(dsrna)进入细胞被一种称为dicer的酶识别,该酶可将dsrna切成长度为21~23nt(核苷酸)的小片段rna,即小干扰rna(sirna)。可以通过设计出相应的sirna来沉默或下调rbap48基因的表达,从而达到观察下调该基因与增加化疗药物敏感性的关系。目前还没有联合应用抑制rbap48基因表达的sirna能有效地提高肿瘤对化疗药物敏感性的报道。本发明一个方面提供了一种抑制rbap48基因的sirna,其如seqidno.1和seqidno.2、seqidno.3和seqidno.4,或seqidno.5和seqidno.6所示。
本发明另一个方面提供了一种rbap48基因抑制剂作为抗肿瘤药物增敏剂的用途。
本发明另一个方面提供了一种rbap48基因抑制剂在制备提高肿瘤细胞抗肿瘤药物敏感性的药物中的应用。
本发明另一个方面提供了一种药物组合物,其中包含至少一种抗肿瘤药物,以及至少一种rbap48基因抑制剂。
本发明另一个方面提供了本发明所述的药物组合物在制备治疗肿瘤的药物中的用途。
在本发明的技术方案中,所述的rbap48基因抑制剂选自rbap48基因的sirna,优选为如seqidno.1-6任意一项或几项的组合物。
在本发明的技术方案中,所述的抗肿瘤药物选自顺铂、卡铂、尼达铂、奥沙利铂、5-氟尿嘧啶(5fu)、5’-脱氧-5-氟尿苷、5-氟尿苷、2’-脱氧-5-氟尿苷、氟胞嘧啶、5-三氟甲基-2’-脱氧尿苷、阿拉伯糖胞嘧啶、环胞苷、5-氮杂-2’-脱氧胞苷、阿拉伯糖基-5-氮杂胞嘧啶、6-氮杂胞苷、n-膦酰基乙酰基-l-天冬氨酸、吡唑呋喃菌素、6-氮杂尿苷、阿扎利平、3-去氮杂尿苷、长春新碱、长春碱、长春地辛、依托泊甙、索布佐生、多西他赛、紫杉醇、长春瑞滨、氨甲蝶呤、6-巯基嘌呤核苷、巯基嘌呤、5-氟尿嘧啶、替加氟、优福定、去氧氟尿苷、卡莫氟、阿糖胞苷、阿糖胞苷酯、依诺他滨、s-1、吉西他滨或氟达拉滨,放线菌素d、阿霉素、柔红霉素、新制癌菌素、博来霉素、培洛霉素、丝裂霉素c、阿柔比星、吡柔比星、表柔比星、净司他丁斯酯、伊达比星,伊立替康、托泊替康或喜树碱。
在本发明的技术方案中,所述的肿瘤包括起源于大脑、中枢神经系统、肾脏、肝、胆囊、头颈部、口腔、甲状腺、皮肤、黏膜、腺体、血管、骨组织、淋巴结、肺脏、食管、胃、乳腺、胰腺、眼睛、鼻咽部、子宫、卵巢、子宫内膜、子宫颈、前列腺、膀胱、结肠或直肠的原发或转移的癌或肉瘤或癌肉瘤;黑色素瘤、胃癌、肺癌、乳腺癌、肾癌、肝癌、口腔表皮癌、宫颈癌、卵巢癌、胰腺癌、前列腺癌或结肠癌。
在本发明的技术方案中,所述的肿瘤为耐药肿瘤。
本发明另一个方面提供了rbap48基因抑制剂在提高癌细胞对化疗药物的敏感性中的应用。
本发明另一个方面提供了rbap48基因抑制剂在制备肿瘤细胞抑制剂中的应用。
本发明的目的是提供一种抑制rbap48基因的sirna在制备抗肿瘤化疗药物增敏剂中的应用。本发明保护sirbap48的三组序列与抗肿瘤化疗药物的联合使用,来提高肿瘤对化疗药物的敏感性的一种应用。其中sirbap48有三组序列在保护范围,如下:
sirbap48#1:senses5‘caaccaugaaggagaaguadtdt3‘seqidno.1
antisenses:3‘dtdtguugguacuuccucuucau5‘seqidno.2
sirbap48#2:senses5‘cugccaagauaucugauuudtdt3‘seqidno.3
antisenses:3‘dtdtgacgguucuauagacuaaa5‘seqidno.4
sirbap48#3:senses5‘ccaguggcuuccagauguadtdt3‘seqidno.5
antisenses:3‘dtdtggucaccgaaggucuacau5‘seqidno.6
同时与上述的sirbap48联合应用的抗肿瘤化疗药物也在保护范围,包括顺铂和5-fu。以及联合使用sirbap48和抗肿瘤化疗药物在不同肿瘤细胞中的应用也属于保护范围,包括了:联合使用sirbap48和顺铂,在人肺鳞癌sk-mes-1细胞,肺腺癌顺铂耐药株a549/ddp细胞,宫颈癌hela细胞,食管癌ec109和顺铂耐药株ec109/ddp细胞中的应用,以及使用sirbap48和5-fu,在肝癌细胞hepg2和hep3b细胞、胃癌hgc27细胞以及大肠癌ht-29细胞中的应用。
有益效果
本发明通过实验证实抑制rbap48基因表达的sirna能有效地提高肿瘤对化疗药物敏感性的作用。该sirna具有显著提高人肺癌细胞、宫颈癌细胞和食管癌细胞对顺铂的敏感性的作用。sirbap48与顺铂联合应用,在肺癌细胞中,顺铂对肺癌顺铂耐药株a549/ddp细胞的ic50值从40.21±0.71μmol/l下降至17.15±0.53μmol/l(p<0.01),耐药株细胞对顺铂敏感性显著增加;顺铂对肺鳞癌sk-mes-1细胞的ic50值从13.84±2.39μg/ml下降到1.027±0.41μg/ml(p<0.01)。在宫颈癌细胞中,顺铂对hela细胞的ic50值从2.5μg/ml降至1.25μg/ml(p<0.01);而且联合应用sirbap48与顺铂(0.625μg/ml)比单独使用顺铂其起效时间明显前移。在食管癌细胞中,顺铂对ec109细胞的ic50值由2.87±0.14μmol/l下降至0.89±0.02μmol/l(p<0.01),顺铂对ec109/ddp细胞的ic50值由15.58±0.36μmol/l下降至8.26±0.96μmol/l(p<0.01)。该sirna还能提高肝癌细胞、胃癌细胞和大肠癌细胞对5-fu的敏感性的作用。sirbap48与5-fu联合应用,在肝癌细胞中,5-fu作用于hepg2细胞的ic50值为从125.45±3.46μmol/l下降到2.50±1.10μmol/l(p<0.01);5-fu对hep3b细胞的ic50值也从126.40±13.80μmol/l降至12.99±4.23μmol/l(p<0.01)。与单独使用5-fu(10μmol/l)相比,5-fu+sirbap48组的起效时间明显前移。在胃癌细胞中,5-fu对hgc-27细胞的ic50值由1.84±0.04μmol/l下降至0.07±0.02μmol/l(p<0.01)。在大肠癌细胞中,5-fu对ht-29细胞的ic50值从57.42±2.74μmol/l下降至17.80±0.42μmol/l(p<0.01)。以上结果应用calcusyn软件计算sirbap48分别与顺铂或5-fu的药物联合指数ci值,所得药物联合指数ci均小于1,表明sirbap48与顺铂、5-fu联合应用有协同作用。以上结果显示联合使用sirbap48能提高肿瘤细胞对化疗药物敏感性。
附图说明
图1是sirbap48与顺铂联合应用24h后,不同剂量的顺铂对a549/ddp细胞的抑制作用;
图2是sirbap48与顺铂联合应用24h后,不同剂量的顺铂对sk-mes-1细胞的抑制作用;
图3是sirbap48与顺铂联合应用24h后,不同剂量的顺铂对hela细胞的抑制作用;
图4是sirbap48与顺铂(0.625μg/ml)联合应用后,对hela细胞抑制作用的时效关系;
图5是sirbap48与顺铂联合应用72h后,不同剂量的顺铂对ec109细胞的抑制作用;
图6是sirbap48与顺铂联合应用72h后,不同剂量的顺铂对ec109/ddp细胞的抑制作用;
图7是sirbap48与5-fu联合应用48h后,不同剂量的5-fu对hepg2细胞的抑制作用;
图8是sirbap48与5-fu联合应用48h后,不同剂量的5-fu对hep3b细胞的抑制作用;
图9是sirbap48与5-fu(10μmol/l)联合应用后,对hepg2细胞抑制作用的时效关系;
图10是sirbap48与5-fu(10μmol/l)联合应用后,对hep3b细胞抑制作用的时效关系;
图11sirbap48与5-fu联合应用72h后,不同剂量的5-fu对hgc-27细胞的抑制作用;
图12是sirbap48与5-fu联合应用72h后,不同剂量的5-fu对ht-29细胞的抑制作用。
具体实施方式
下面结合具体的实验对本发明作进一步的说明,但并不局限于此。
实验中所用sirna购自广州市锐博生物科技有限公司、顺铂购自sigma公司。
实施例1抑制rbap48基因的sirna在提高人肺癌细胞、肺癌顺铂耐药株细胞、宫颈癌细胞、食管癌细胞、食管癌顺铂耐药株细胞对顺铂敏感性的应用:
1.抑制rbap48基因的sirna提高人肺鳞癌sk-mes-1细胞,人肺腺癌顺铂耐药株a549/ddp细胞对顺铂的敏感性:
1.1mtt法检测联合使用双链sirbap48,不同剂量的顺铂对肺癌顺铂耐药株a549/ddp细胞的增殖抑制作用:
取对数生长期a549/ddp细胞,消化后,用全培稀释成所需密度的单细胞悬液并计数,以每孔6×103个细胞接种到96孔细胞培养板中,每孔加入200μl体积的细胞混悬液。接种完细胞24小时后,分别转染空白、阴性,双链sirbap48#3(seqidno.5和seqidno.6)(50nmol);转染完24h后,弃去原培养基,分别加入含不同浓度顺铂的全培(顺铂的浓度依次为0、10、20、30、40、50、60、70μmol/l每组6个复孔),培养48h后,每孔加入10ulmtt液(5mg/ml),继续培养4h,终止反应,将孔中的液体去除,加200ul二甲基亚砜溶解结晶,用酶联免疫检测仪测定每孔0d值(波长570nm)。mtt法检测细胞生存率:生存率%=(加药组平均od值/空白未加药组平均od值)×100%。
1.2mtt法检测联合使用sirbap48,不同剂量的顺铂对肺鳞癌细胞sk-mes-1的增殖抑制作用:
取对数生长期sk-mes-1细胞,消化后,用全培稀释成所需密度的单细胞悬液并计数,以每孔3×103个细胞接种到96孔细胞培养板中,每孔加入100μl体积的细胞混悬液。接种完细胞24小时后,分别转染空白、阴性,双链sirbap48#1(seqidno.1和seqidno.2)(50nmol);转染完48h后,弃去原培养基,分别加入含不同浓度顺铂的全培(顺铂的浓度依次为0、1.25、5、10、20μg/ml,每组6个复孔),培养24h后,每孔加入10ulmtt液(5mg/ml),继续培养4h,终止反应,将孔中的液体去除,加200ul二甲基亚砜溶解结晶,用酶联免疫检测仪测定每孔0d值(波长570nm)。mtt法检测细胞生存率:生存率%=(加药组平均od值/空白未加药组平均od值)×100%。
实验结果见图1和图2,由图1可知sirbap48与顺铂联合应用24h后,顺铂对a549/ddp细胞的半数致死量从40.21±0.71μmol/l下降至17.15±0.53μmol/l;由图2可知sirbap48与顺铂联合应用24h后,顺铂对sk-mes-1细胞的半数致死量从13.84±2.39μg/ml下降到1.027±0.41μg/ml。
2.抑制rbap48基因的sirna提高宫颈癌细胞hela对顺铂的敏感性
2.1mtt法检测联合使用sirbap48,不同剂量的顺铂对宫颈癌细胞hela的增殖抑制作用:
取对数生长期hela细胞,消化后,用全培稀释成所需密度的单细胞悬液并计数,以每孔3×103个细胞接种到96孔细胞培养板中,每孔加入100μl体积的细胞混悬液。接种完细胞24小时后,分别转染空白、阴性,双链sirbap48#2(seqidno.3和seqidno.4)(50nmol),;转染完24h后,弃去原培养基,分别加入含不同浓度顺铂的全培(顺铂的浓度依次为0、0.0325μg/ml、0.625μg/ml、1.25μg/ml、2.5μg/ml、5μg/ml,每组6个复孔),培养24h后,每孔加入10ulmtt液(5mg/ml),继续培养4h,终止反应,将孔中的液体去除,加200ul二甲基亚砜溶解结晶,用酶联免疫检测仪测定每孔0d值(波长570nm)。mtt法检测细胞生存率:生存率%=(加药组平均od值/空白未加药组平均od值)×100%。
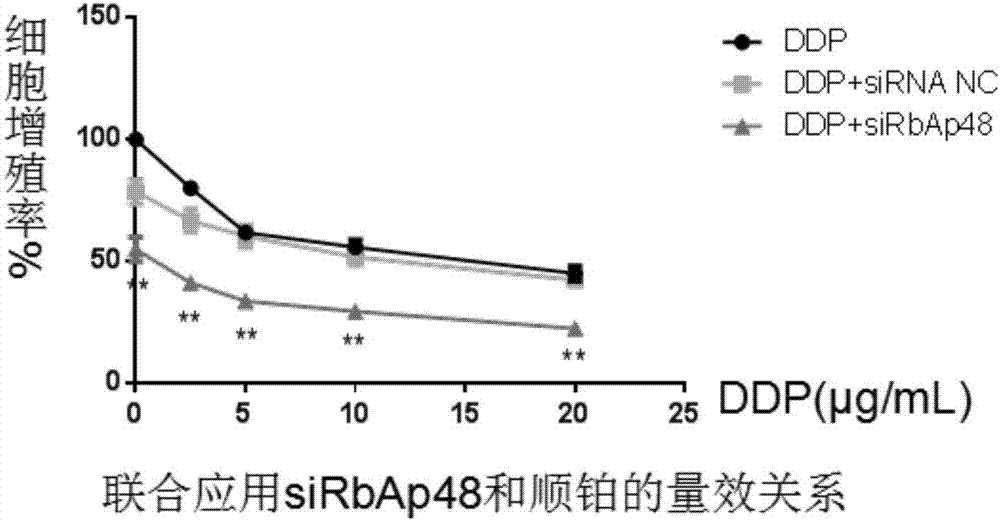
2.2mtt法检测联合使用sirbap48后,顺铂对hela细胞抑制作用的时效关系:
取对数生长期hela细胞,消化后,用全培稀释成所需密度的单细胞悬液并计数,以每孔3×103个细胞接种到96孔细胞培养板中,每孔加入100μl体积的细胞混悬液。接种完细胞24小时后,分别转染空白、阴性,双链sirbap48#2(seqidno.3和seqidno.4)(50nmol);转染完24h后,弃去原培养基,加入顺铂的浓度为0.625μg/ml,培养24h、48h、72h、96h后,每孔加入10ulmtt液(5mg/ml),继续培养4h,终止反应,将孔中的液体去除,加200ul二甲基亚砜溶解结晶,用酶联免疫检测仪测定每孔0d值(波长570nm)。mtt法检测细胞生存率:生存率%=(加药组平均od值/空白未加药组平均od值)×100%。
实验结果见图3和图4,由图3可知sirbap48与顺铂联合应用24h后,顺铂对hela细胞的半数致死量从2.5μg/ml降至1.25μg/ml;由图4可知联合应用sirbap48与顺铂(0.625μg/ml)比单独使用顺铂其起效时间明显前移。
3.抑制rbap48基因的sirna提高食管癌细胞ec109、顺铂耐药株ec109ddp对顺铂的敏感性:
3.1mtt法检测联合使用sirbap48后,顺铂对ec109细胞的抑制作用:
取对数生长期ec109细胞,消化后,用全培稀释成所需密度的单细胞悬液并计数,以每孔2.5×103个细胞接种到96孔细胞培养板中,每孔加入100μl体积的细胞混悬液。接种完细胞24小时后,分别转染空白、阴性,双链sirbap48#1(seqidno.1和seqidno.2)(50nmol);转染完24h后,弃去原培养基,分别加入含不同浓度顺铂的全培,其中作用于ec109细胞的顺铂终浓度分别为0、2、4、6、8、10、12μmol/l(每个浓度6个复孔),培养72小时后mtt法检测每孔加入10ulmtt液(5mg/ml),继续培养4h,终止反应,将孔中的液体去除,加200ul二甲基亚砜溶解结晶,用酶联免疫检测仪测定每孔0d值(波长570nm)。mtt法检测细胞生存率:生存率%=(加药组平均od值/空白未加药组平均od值)×100%。
3.2mtt法检测联合使用sirbap48后,顺铂对顺铂耐药株ec109/ddp的抑制作用:
取对数生长期ec109/ddp细胞,消化后,用全培稀释成所需密度的单细胞悬液并计数,以每孔2.5×103个细胞接种到96孔细胞培养板中,每孔加入100μl体积的细胞混悬液。接种完细胞24小时后,分别转染空白、阴性,双链sirbap48#1(seqidno.1和seqidno.2)(50nmol);转染完24h后,弃去原培养基,分别加入含不同浓度顺铂的全培,作用于ec109/ddp细胞的顺铂终浓度分别为0、6、12、18、24、30、36μmol/l(每个浓度6个复孔),培养72小时后mtt法检测每孔加入10ulmtt液(5mg/ml),继续培养4h,终止反应,将孔中的液体去除,加200ul二甲基亚砜溶解结晶,用酶联免疫检测仪测定每孔0d值(波长570nm)。mtt法检测细胞生存率:生存率%=(加药组平均od值/空白未加药组平均od值)×100%。
实验结果见图5和图6,由图5可知联合运用sirbap48和顺铂72h后,顺铂对ec109顺铂对ec109细胞的ic50值由2.87±0.14μmol/l下降至0.89±0.02μmol/l;由图6可知联合运用sirbap48和顺铂72h后,顺铂对ec109/ddp细胞的ic50值由15.58±0.36μmol/l下降至8.26±0.96μmol/l。
实施例2抑制rbap48基因的sirna在提高人肝癌细胞、胃癌细胞、大肠癌细胞对5-fu敏感性的应用:
1.抑制rbap48基因的sirna提高肝癌细胞hepg2和hep3b对5-fu的敏感性:
1.1mtt法检测联合使用sirbap48后,5-fu对肝癌细胞hepg2和hep3b的抑制作用:
对数生长期hepg2和hep3b细胞,消化后,用全培稀释成所需密度的单细胞悬液并计数,以每孔2.5×103个细胞接种到96孔细胞培养板中,每孔加入100μl体积的细胞混悬液。接种完细胞24小时后,分别转染空白、阴性,rbap48(hepg2细胞应用双链sirbap48#1(seqidno.1和seqidno.2);hep3b细胞应用双链sirbap48#3(seqidno.5和seqidno.6)(50nmol);转染完24h后,弃去原培养基,分别加入含不同浓度5-fu的全培,作用于hepg2和hep3b细胞的5-fu终浓度分别为0、2.5、5、10、20、40、80、160、320μmol/l(每个浓度6个复孔),培养48小时后mtt法检测每孔加入10ulmtt液(5mg/ml),继续培养4h,终止反应,将孔中的液体去除,加200ul二甲基亚砜溶解结晶,用酶联免疫检测仪测定每孔0d值(波长570nm)。mtt法检测细胞生存率:生存率%=(加药组平均od值/空白未加药组平均od值)×100%。
1.2mtt法检测联合使用sirbap48后,5-fu对肝癌细胞hepg2和hep3b的抑制作用的时效关系:
取对数生长期hepg2和hep3b细胞,消化后,用全培稀释成所需密度的单细胞悬液并计数,以每孔2.5×103个细胞接种到96孔细胞培养板中,每孔加入100μl体积的细胞混悬液。接种完细胞24小时后,分别转染空白、阴性,双链sirbap48;hepg2细胞应用rbap48#1(seqidno.1和seqidno.2);hep3b细胞应用双链sirbap48#3(seqidno.5和seqidno.6)(50nmol);转染完24h后,弃去原培养基,分别加入含10μmol/l浓度5-fu的全培,培养24、48、72、96小时后mtt法检测每孔加入10ulmtt液(5mg/ml),继续培养4h,终止反应,将孔中的液体去除,加200ul二甲基亚砜溶解结晶,用酶联免疫检测仪测定每孔0d值(波长570nm)。mtt法检测细胞生存率:生存率%=(加药组平均od值/空白未加药组平均od值)×100%。
实验结果见图7、图8、图9和图10,由图7和图8可知联合应用sirbap48和5-fu,48小时后,5-fu作用于hepg2细胞的ic50为从125.45±3.46μmol/l下降到2.50±1.10μmol/l,hep3b细胞的ic50从126.40±13.80μmol/l降至12.99±4.23μmol/l;由图9和图10可知在hepg2和hep3b细胞中,与单独使用5-fu相比,达到相同的抑制效果时,5-fu+sirbap48组的起效时间明显前移。
2.抑制rbap48基因的sirna提高胃癌细胞hgc-27对5-fu的敏感性:
2.1mtt法检测联合使用sirbap48后,5-fu对胃癌细胞hgc-27的抑制作用:
对数生长期hgc-27细胞,消化后,用全培稀释成所需密度的单细胞悬液并计数,以每孔4×103个细胞接种到96孔细胞培养板中,每孔加入100μl体积的细胞混悬液。接种完细胞24小时后,分别转染空白、阴性,双链sirbap48#3(seqidno.5和seqidno.6)(50nmol);转染完24h后,弃去原培养基,分别加入含不同浓度5-fu的全培,作用于hgc-27细胞的5-fu终浓度分别为0、1、3、9、27、81、243μmol/l(每个浓度6个复孔),培养72小时后mtt法检测每孔加入10ulmtt液(5mg/ml),继续培养4h,终止反应,将孔中的液体去除,加200ul二甲基亚砜溶解结晶,用酶联免疫检测仪测定每孔0d值(波长570nm)。mtt法检测细胞生存率:生存率%=(加药组平均od值/空白未加药组平均od值)×100%。
实验结果见图11,由图11可知联合应用sirbap48和5-fu,72小时后,5-fu对hgc-27细胞的ic50值由1.84±0.04μmol/l下降至0.07±0.02μmol/l,明显提高hgc-27细胞对5-fu的敏感性。
3.抑制rbap48基因的sirna提高大肠癌细胞ht-29对5-fu的敏感性:
3.1mtt法检测联合使用sirbap48后,5-fu对大肠癌细胞ht-29的抑制作用:
对数生长期ht-29细胞,消化后,用全培稀释成所需密度的单细胞悬液并计数,以每孔4×103个细胞接种到96孔细胞培养板中,每孔加入100μl体积的细胞混悬液。接种完细胞24小时后,分别转染空白、阴性,双链sirbap48#1(seqidno.1和seqidno.2)(50nmol);转染完24h后,弃去原培养基,分别加入含不同浓度5-fu的全培,作用于ht-29细胞的5-fu终浓度分别为0、40、80、120、160、200、240μmol/l(每个浓度6个复孔),培养72小时后mtt法检测每孔加入10ulmtt液(5mg/ml),继续培养4h,终止反应,将孔中的液体去除,加200ul二甲基亚砜溶解结晶,用酶联免疫检测仪测定每孔0d值(波长570nm)。mtt法检测细胞生存率:生存率%=(加药组平均od值/空白未加药组平均od值)×100%。
实验结果见图12,由图12可知联合应用sirbap48和5-fu,72小时后,5-fu对ht-29细胞的ic50值从57.42±2.74μmol/l下降至17.80±0.42μmol/l,明显提高ht-29细胞对5-fu的敏感性。
sequencelisting
<110>南方医科大学
<120>一种抑制rbap48基因的sirna及其制备抗肿瘤化疗药物增敏剂中的应用
<130>cp11701195c
<160>6
<170>patentinversion3.3
<210>1
<211>21
<212>dna
<213>人工序列
<220>
<221>modified_base
<222>(20)..(21)
<223>d
<220>
<221>misc_feature
<222>(20)..(21)
<223>t
<400>1
caaccaugaaggagaaguann21
<210>2
<211>21
<212>dna
<213>人工序列
<220>
<221>modified_base
<222>(1)..(2)
<223>d
<220>
<221>misc_feature
<222>(1)..(2)
<223>t
<400>2
nnguugguacuuccucuucau21
<210>3
<211>21
<212>dna
<213>人工序列
<220>
<221>modified_base
<222>(20)..(21)
<223>d
<220>
<221>misc_feature
<222>(20)..(21)
<223>t
<400>3
cugccaagauaucugauuunn21
<210>4
<211>21
<212>dna
<213>人工序列
<220>
<221>modified_base
<222>(1)..(2)
<223>d
<220>
<221>misc_feature
<222>(1)..(2)
<223>t
<400>4
nngacgguucuauagacuaaa21
<210>5
<211>21
<212>dna
<213>人工序列
<220>
<221>modified_base
<222>(20)..(21)
<223>d
<220>
<221>misc_feature
<222>(20)..(21)
<223>t
<400>5
ccaguggcuuccagauguann21
<210>6
<211>21
<212>dna
<213>人工序列
<220>
<221>modified_base
<222>(1)..(2)
<223>d
<220>
<221>misc_feature
<222>(1)..(2)
<223>t
<400>6
nnggucaccgaaggucuacau21
- 还没有人留言评论。精彩留言会获得点赞!