一种淀粉基控缓释载体材料及其制备方法与应用与流程
本发明属于淀粉精深加工领域,具体涉及一种淀粉基控缓释载体材料及其制备方法与应用。特别是涉及淀粉与可溶性酚酸进行接枝改性,并将其作为药物靶向释放、缓慢释放和定量释放载体。
背景技术:
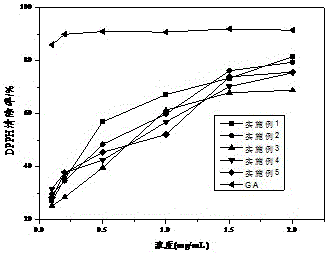
:药物以及食品功能因子等活性物质的吸收是其到人体给药部位通过生物膜进入到血液循环的过程,活性物质只有在服用后与机体有效作用,且在血液中的活性物质浓度达到缓慢释放时才能最大化药物或者功能因子的活性。因此,药物或功能因子的控制释放载体材料研究是药物及功能因子缓释传输系统构建的重要课题。与传统的传输模式相比,小肠、结肠靶向控缓释给药系统载体必须承受肠胃道的极端环境(如胃酸的酸解、小肠和结肠中的酶系、微生物的降解),并在靶向释放位点缓慢或定量释放,控制血药浓度,避免人体发生血药浓度过高而中毒;同时,药物中药物释放过快也会因为血药浓度下降而失去药物的治疗作用。为维持体内的血药或活性因子的浓度,开发天然无毒、安全可靠、来源广泛,并且能达到靶向控缓释的药物或功能因子的传输体系是当前国内外研究人员所关注的热点之一。药物传输体系的释药性能与载体的性质有很大的相关性。载体材料本身必须具备良好的生物相容改性,不引起机体内组织的过敏和应急反应,具有无毒、安全、不致癌等特点,同时也强调药物或功能因子不与户型因子载体发生任何化学反应。开发新型的药物靶向控制释放天然高分子载体是目前药物/功能因子传输系统的热点之一。目前,药物或功能因子的载体包括天然高分子材料和合成高分子材料。天然高分子材料主要有蛋白质类和植物胶类,天然无毒,生物相容性较好,常用的有明胶、海藻酸盐、壳聚糖、蛋白类(胶原、乳清蛋白)等。但由于天然的原料不一定满足产品加工的需要,如纯度较差,易引起免疫反应等,因此常常对载体材料进行物理、化学和生物学性能方面的改性,从而提高天然高分子在载药方面的运用。专利号为CN105343886A公开了“一种抑菌性壳聚糖药物载体及其制备方法”,壳聚糖接上抑菌物质(如没食子酸)赋予壳聚糖更高的抑菌功能,满足载药体系的构建;专利号为CN102824643A公开了“一种淀粉基水凝胶控缓释载体材料及其制备方法和应用”,将淀粉样品进行微波处理,处理完后冷却至50℃以下,制备得到崩解性能良好、具有一定控缓释行为的淀粉基水凝胶控缓释载体材料。另一方面,合成的高分子主要有聚碳酯、聚氨基酸、聚乳酸等,其共同特点为无毒、成膜/球性能好、稳定性高,可用于注射给药。而注射给药在一定程度上给病患者带来心理负担、疼痛感等负面影响,口服给药克服病患者的心理负担,可靶向控制释放药物。淀粉是自然界中资源丰富的天然多糖高分子,不仅为人体提供碳源以及能量,同时因为其良好的生物相容性、可降解再生、无毒等优良特性,常用于靶向控缓释药物的载体。天然的淀粉经过人体肠胃道,遭受到胃酸、淀粉酶、肠道微生物菌群的降解,很容易被消化吸收,故应采用适当的改性方法使其具备较好的抗酶解性能与耐酸、耐微生物发酵酵解的特点,赋予淀粉基药物载体控制释放药物的性能。多酚类化合物是含有一个或多个酚羟基的化合物,广泛存在于植物食品中,由于其大量酚羟基的存在具有较强的吞噬自由基的能力以及抑菌等功效,同时天然存在的部分酚类化合物对淀粉酶、胃蛋白酶、脂肪酶等具有一定的抑制活性。目前,有关酚类化合物抗氧化活性以及抑菌活性的研究较为透彻,在酶活性抑制方面也有较多报道。然而,利用酚类物质对酶的抑制活性研究及公开的方法中多集中在简单的物理混合,忽略了在人体中复杂的肠道内环境对酚类物质的破坏,不足以长时间保护酚类物质的稳定性,局限了产品的应用。本发明通过对淀粉与可溶性酚酸进行接枝改性研究,制备的淀粉基控缓释载体材料可作为药物靶向释放、缓慢释放和定量释放载体,不仅赋予淀粉在体内具有较强清除体内自由基的活性;同时,还提高了酚类物质的稳定性,及长时间作用体内各种消化酶,从而达到小肠、结肠靶向载药体系的构建,有利于健康、稳定的载药体系开发。目前,有关通过酚类物质接枝调控淀粉的消化性能从而调节淀粉基载体材料的控制释放性能的的研究工作,在国内外还未见报道。技术实现要素:本发明的目的在于解决现有技术中的缺陷,针对现有技术生产高效药物运输载体的不足,提供一种淀粉基控缓释载体材料及其制备方法与应用,该淀粉基控缓释载体材料可作为药物靶向释放、缓慢释放和定量释放载体,不仅使淀粉在体内具有较强清除体内自由基的活性;同时,还提高了酚类物质的稳定性,及长时间作用体内各种消化酶,从而完成小肠、结肠靶向载药体系的构建,有利于健康、稳定的载药体系开发。本发明公开的制备方法操作简单、安全无毒,制备出具有稳定且高效的小肠、结肠靶向释药的药物载体,同时赋予清除体内自由基的功能。为实现上述目的,本发明的技术方案为:一种淀粉基控缓释载体材料的制备方法,所述制备方法的具体步骤为:将淀粉配制成淀粉质量分数为5~25%的淀粉乳,进行糊化处理,经充分糊化的淀粉乳冷却至40~60℃,再加入普鲁兰酶进行脱支处理;然后分别加入维生素C、H2O2和可溶性酚酸进行接枝反应,在持续氮气氛围下反应6~24h,反应结束后用乙醇多次洗涤,干燥,粉碎,得到酚酸接枝淀粉;在制备得到酚酸接枝淀粉中加入淀粉质量分数为10~15%的甘油,充分搅拌5~7h,得到淀粉基控缓释载体材料。进一步的,所述的淀粉为普通玉米淀粉、蜡质玉米淀粉、马铃薯淀粉、小麦淀粉中的一种或几种。更进一步的,所述糊化处理的条件为:温度70~140℃,压力2~20MPa。更进一步的,所述脱支处理的条件为:普鲁兰酶用量为5~30U/g,酶解时间为6~12h。更进一步的,所述接枝反应的条件为:加入淀粉质量分数为10~30%的维生素C和1~5mL3MH2O2后,反应30~60min;再加入淀粉质量分数为50~150%的可溶性酚酸。优选的,所述的维生素C为淀粉质量分数的15~25%,可溶性酚酸为淀粉质量分数的70~130%。更进一步的,所述的可溶性酚酸为咖啡酸、没食子酸、原儿茶酸中的一种或几种。一种淀粉基控缓释载体材料,由上述制备方法制备得到;利用淀粉基控缓释载体材料对活性功能成分的微粒、微丸或片剂进行包衣,得到具有不同控制释放性能的淀粉基口服小肠、结肠靶向控缓释给药系统,将该靶向控缓释给药系统用于对功能活性成分的药物靶向释放、药物缓释或定量释放。本发明的原理如下:淀粉基药物载体需要较良好的抗消化性能,但未经改性的原淀粉作为药物载体经过肠胃道的极端环境容易发生消化、降解。多酚作为天然的植物提取成分,安全无毒,能够清除人体内自由基,避免自由基攻击人体、导致人体发生糖尿病、心血管疾病等慢性疾病。其中,部分多酚(酚酸、黄酮等)对淀粉酶、葡萄糖苷酶有活性抑制的作用,结合其酶抑制活性是控制淀粉消化的关键。利用Vc和H2O2把酚酸类接枝到淀粉分子上,反应原理是Vc和H2O2产生的自由基,通过自由基引发酚酸的羧基接枝,反应过程绿色、环保、无毒。同时,用酚酸修饰化的淀粉对酶具有一定的抑制活性,使得修饰化的淀粉能耐受淀粉酶的水解作用,保证淀粉作为淀粉基药物载体在穿过人体消化道时不被酶解,形成较高含量的抗消化淀粉,保证药物的定位/定量释放。本发明的有益效果为:(1)本发明制备的淀粉基药物控释载体实际上是对淀粉进行酚类接枝修饰化改性,从而调控淀粉的消化性能,达到小肠/结肠靶向释药的功能;并且,酚类修饰淀粉体系构建绿色、环保。该方法制备的淀粉基控缓释载体材料具有价廉易得,生物相容性好,本身安全无毒。(2)本发明制备得到的药物载体,同时赋予清楚体内自由基,对于人体预防糖尿病、心血管疾病等慢性疾病具有一定功效。该制备方法是一种绿色环保、实用性能强的淀粉修饰化改性与精深加工方法。(3)本发明制备得到的淀粉基药物载体的抗消化性能在15~50.4%之间,调节酚类修饰量以及包衣过程的包衣量可使淀粉基药物载体材料达到小肠靶向和加长靶向控释效果,其中功能活性物质在体外消化液模拟胃液中的释放量<13%,在人体上消化道内泄漏量小于15%,在小肠以上部位释放量大于85%,具有良好的小肠/结肠靶向释放性能。附图说明图1为实施例1咖啡酸修饰化淀粉与对照组1、2包埋的活性功能因子(BSA)体外模拟释放效果分析对比图;图2为实施例1~5制备的淀粉基控缓释载体材料清除DPPH自由基的能力对比图。具体实施方式下面结合实施例对本发明的技术方案做进一步的说明。实施例1一种淀粉基控缓释载体材料的制备方法,所述制备方法的具体步骤为:以普通玉米淀粉为原料,将普通玉米淀粉配制成淀粉质量分数为5%的淀粉乳,在温度70℃,压力2MPa的条件下,进行糊化处理,经充分糊化的淀粉乳冷却至40℃,再加入5U/g的普鲁兰酶,酶解时间为6h,进行脱支处理;然后加入淀粉质量分数为10%的维生素C和1mL3MH2O2后,反应30min,再加入淀粉质量分数50%的咖啡酸,进行接枝反应,在持续氮气氛围下反应6h,反应结束后用乙醇多次洗涤,干燥,粉碎,得到酚酸接枝淀粉;在制备的酚酸接枝淀粉中加入淀粉质量分数为10%的甘油,充分搅拌5h,得到淀粉基控缓释载体材料。以牛血清白蛋白(BSA)为模型功能组分,将牛血清白蛋白与微晶纤维素充分混合(BSA和微晶纤维素比例为1:3),在基础滚圆机制备微丸,然后在流化床包衣机中用上述制备的淀粉基控缓释载体材料在30℃下进行包衣,包衣增重为20%,得到负载BSA的包衣微丸,并在模拟胃液、小肠液和结肠液中进行体外释放研究,结果如表1所示,说明该淀粉基控缓释载体材料具有口服小肠、结肠靶向控释载药的效果。表1有上可知,利用淀粉基控缓释载体材料对活性功能成分的微粒、微丸或片剂进行包衣,得到具有不同控制释放性能的淀粉基口服小肠、结肠靶向控缓释给药系统,将该靶向控缓释给药系统用于对功能活性成分的药物靶向释放、药物缓释或定量释放。实施例2一种淀粉基控缓释载体材料的制备方法,所述制备方法的具体步骤为:以蜡质玉米淀粉为原料,将蜡质玉米淀粉配制成淀粉质量分数为25%的淀粉乳,在温度140℃,压力20MPa的条件下,进行糊化处理,经充分糊化的淀粉乳冷却至60℃,再加入30U/g的普鲁兰酶,酶解时间为12h,进行脱支处理;然后加入淀粉质量分数30%的维生素C和5mL3MH2O2后,反应60min,再加入淀粉质量分数150%的没食子酸,进行接枝反应,在持续氮气氛围下反应24h,反应结束后用乙醇多次洗涤,干燥,粉碎,得到酚酸接枝淀粉;在制备得到酚酸接枝淀粉中加入淀粉质量分数为15%的甘油,充分搅拌7h,得到淀粉基控缓释载体材料。以牛血清白蛋白(BSA)为模型功能组分,将牛血清白蛋白与微晶纤维素充分混合(BSA和微晶纤维素比例为1:3),在基础滚圆机制备微丸,然后在流化床包衣机中用上述制备的淀粉基控缓释载体材料在30℃下进行包衣,包衣增重为50%,得到负载BSA的包衣微丸,并在模拟胃液、小肠液和结肠液中进行体外释放研究,结果如表2所示,说明该淀粉基控缓释载体材料具有口服小肠、结肠靶向控释载药的效果。表2有上可知,利用淀粉基控缓释载体材料对活性功能成分的微粒、微丸或片剂进行包衣,得到具有不同控制释放性能的淀粉基口服小肠、结肠靶向控缓释给药系统,将该靶向控缓释给药系统用于对功能活性成分的药物靶向释放、药物缓释或定量释放。实施例3一种淀粉基控缓释载体材料的制备方法,所述制备方法的具体步骤为:以马铃薯淀粉为原料,将马铃薯淀粉配制成淀粉质量分数为15%的淀粉乳,在温度为100℃,压力为10MPa的条件下,进行糊化处理,经充分糊化的淀粉乳冷却至50℃,再加入10U/g的普鲁兰酶,酶解时间为8h,进行脱支处理;然后加入淀粉质量分数15%的维生素C和2mL3MH2O2后,反应40min,再加入淀粉质量分数70%的原儿茶酸,进行接枝反应,在持续氮气氛围下反应12h,反应结束后用乙醇多次洗涤,干燥,粉碎,得到酚酸接枝淀粉;在制备得到酚酸接枝淀粉中加入淀粉质量分数为12%的甘油,充分搅拌5h,得到淀粉基控缓释载体材料。以牛血清白蛋白(BSA)为模型功能组分,将牛血清白蛋白与微晶纤维素充分混合(BSA和微晶纤维素比例为1:3),在基础滚圆机制备微丸,然后在流化床包衣机中用上述制备的淀粉基控缓释载体材料在30℃下进行包衣,包衣增重为30%,得到负载BSA的包衣微丸,并在模拟胃液、小肠液和结肠液中进行体外释放研究,结果如表3所示,说明该淀粉基控缓释载体材料具有口服小肠、结肠靶向控释载药的效果。表3有上可知,利用淀粉基控缓释载体材料对活性功能成分的微粒、微丸或片剂进行包衣,得到具有不同控制释放性能的淀粉基口服小肠、结肠靶向控缓释给药系统,将该靶向控缓释给药系统用于对功能活性成分的药物靶向释放、药物缓释或定量释放。实施例4一种淀粉基控缓释载体材料的制备方法,所述制备方法的具体步骤为:以小麦淀粉为原料,将小麦淀粉配制成淀粉质量分数为20%的淀粉乳,在温度为120℃,压力为15MPa的条件下,进行糊化处理,经充分糊化的淀粉乳冷却至60℃,再加入20U/g的普鲁兰酶,酶解时间为10h,进行脱支处理;然后加入淀粉质量分数25%的维生素C和4mL3MH2O2后,反应50min,再加入淀粉质量分数130%的咖啡酸,进行接枝反应,在持续氮气氛围下反应18h,反应结束后用乙醇多次洗涤,干燥,粉碎,得到酚酸接枝淀粉;在制备得到酚酸接枝淀粉中加入淀粉质量分数为14%的甘油,充分搅拌6h,得到淀粉基控缓释载体材料。以牛血清白蛋白(BSA)为模型功能组分,将牛血清白蛋白与微晶纤维素充分混合(BSA和微晶纤维素比例为1:3),在基础滚圆机制备微丸,然后在流化床包衣机中用上述制备的淀粉基控缓释载体材料在30℃下进行包衣,包衣增重为40%,得到负载BSA的包衣微丸,并在模拟胃液、小肠液和结肠液中进行体外释放研究,结果如表4所示,说明该淀粉基控缓释载体材料具有口服小肠、结肠靶向控释载药的效果。表4有上可知,利用淀粉基控缓释载体材料对活性功能成分的微粒、微丸或片剂进行包衣,得到具有不同控制释放性能的淀粉基口服小肠、结肠靶向控缓释给药系统,将该靶向控缓释给药系统用于对功能活性成分的药物靶向释放、药物缓释或定量释放。实施例5一种淀粉基控缓释载体材料的制备方法,所述制备方法的具体步骤为:以蜡质玉米淀粉为原料,将蜡质玉米淀粉配制成淀粉质量分数为20%的淀粉乳,在温度为120℃,压力为15MPa的条件下,进行糊化处理,经充分糊化的淀粉乳冷却至60℃,再加入20U/g的普鲁兰酶,酶解时间为12h,进行脱支处理;然后加入淀粉质量分数30%的维生素C和5mL3MH2O2后,反应60min,再加入淀粉质量分数30%的咖啡酸、淀粉质量分数30%的没食子酸和淀粉质量分数90%的原儿茶酸,进行接枝反应,在持续氮气氛围下反应24h,反应结束后用乙醇多次洗涤,干燥,粉碎,得到酚酸接枝淀粉;在制备得到酚酸接枝淀粉中加入淀粉质量分数为15%的甘油,充分搅拌7h,得到淀粉基控缓释载体材料。以牛血清白蛋白(BSA)为模型功能组分,将牛血清白蛋白与微晶纤维素充分混合(BSA和微晶纤维素比例为1:3),在基础滚圆机制备微丸,然后在流化床包衣机中用上述制备的淀粉基控缓释载体材料在30℃下进行包衣,包衣增重为50%,得到负载BSA的包衣微丸,并在模拟胃液、小肠液和结肠液中进行体外释放研究,结果如表5所示,说明该淀粉基控缓释载体材料具有口服小肠、结肠靶向控释载药的效果。表5有上可知,利用淀粉基控缓释载体材料对活性功能成分的微粒、微丸或片剂进行包衣,得到具有不同控制释放性能的淀粉基口服小肠、结肠靶向控缓释给药系统,将该靶向控缓释给药系统用于对功能活性成分的药物靶向释放、药物缓释或定量释放。实施例6对照组1以普通玉米淀粉为原料,将普通玉米淀粉配制成淀粉质量分数为5%的淀粉乳,在温度为70℃,压力为2MPa的条件下,进行糊化处理,经充分糊化的淀粉乳冷却至40℃,再加入5U/g的普鲁兰酶,酶解时间为6h,进行脱支处理;加入淀粉质量分数为10%的甘油,充分搅拌5h,得到a。对照组2以普通玉米淀粉为原料,将普通玉米淀粉配制成淀粉质量分数为5%的淀粉乳,在温度70℃,压力2MPa的条件下,进行糊化处理,经充分糊化的淀粉乳冷却至40℃,再加入5U/g的普鲁兰酶,酶解时间为6h,进行脱支处理;再加入淀粉质量分数50%的咖啡酸,进行接枝反应,在持续氮气氛围下反应6h,混合结束后加入淀粉质量分数为10%的甘油,充分搅拌5h,得到b。将实施例1、对照组1、对照组2分别进行模拟胃液、小肠液和结肠液中进行体外释放研究:以牛血清白蛋白(BSA)为模型功能组分,将牛血清白蛋白与微晶纤维素充分混合(BSA和微晶纤维素比例为1:3),在基础滚圆机制备微丸,然后在流化床包衣机中分别用将实施例1制备的淀粉基控缓释载体材料、对照组1制备的a、对照组2制备的b在30℃下进行包衣,包衣增重为20%,分别得到负载BSA的包衣微丸,并在模拟胃液、小肠液和结肠液中进行体外释放研究,结果如表6和图1所示。表6有上表可知,本发明制备的淀粉基控缓释载体材料对活性功能成分的微粒、微丸或片剂进行包衣,具有良好靶向控缓释功能因子的功效。与糊化淀粉和酚酸-糊化淀粉包衣体系(对照组1和对照组2)对比,接枝酚酸(实施例1)具有良好的小肠/结肠靶向给药功效,其中对照组1和对照组2中功能因子在上消化道部分的释放量>40%,而本发明的淀粉基缓控释载体包衣的功能因子负载微丸在上消化道部分释放功能因子<15%,说明该靶向控缓释给药系统可用于功能活性因子的药物靶向释放、药物缓释或定量释放。实施例7实施例1~5制备的酚酸接枝淀粉,采用美国谷物化学家协会AOAC991.43标准方法分别测定其抗消化淀粉含量,结果如表7所示。表7项目抗消化淀粉含量实施例129.8%实施例248.6%实施例337.5%实施例442.9%实施例539.1%由上表可知,本发明制备的淀粉基控缓释载体材料的抗消化淀粉含量较高。未接枝酚酸的谷类原淀粉抗消化淀粉含量均<15%,用酚酸类物质修饰化改性后有效提高了抗消化淀粉含量,确保载体材料能耐受上消化道的极端环境到达小肠末端或结肠部位,为靶向控缓释活性功能因子提供保障,证实该靶向控缓释给药系统可用于功能活性因子的药物靶向释放、药物缓释或定量释放。以实施例1~5制备的淀粉基控缓释载体材料和没食子酸为试验对象,采用DPPH法测定实施例1~5制备的淀粉基控缓释载体材料和没食子酸清除DPPH自由基的能力,结果如图2所示。由图2可以看出实施1~5制备的淀粉基控缓释载体材料,具有清除人体自由基的功能,其中实施例1在较低浓度具有较高的清除自由基能力。随着酚酸修饰化淀粉的浓度提高,其清除自由基能力趋于平缓,但所有实施例都显示具有较良好的清除自由基能力。用酚酸修饰化淀粉,赋予修饰化淀粉清除人体内自由基的能力。显然,本发明的上述实施例仅仅是为清楚地说明本发明所作的举例,而并非是对本发明的实施方式的限定;对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动,这里无需也无法对所有的实施方式予以穷举;凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1