脂肪间充质干细胞的培养方法与流程
本发明属于生物技术领域,具体涉及一种脂肪间充质干细胞的培养方法。
背景技术:
间充质干细胞(Mesenchymal Stem Cells,MSCs)最早发现于骨髓,现已被证实存在于机体的多种组织器官中,是一群具有多向分化潜能的多能干细胞。与其他来源MSCs相比,脂肪来源间充质干细胞(adipose derived stromal cells,ADSCs)在分离培养上有很大优势:
(1)取材方便。脂肪组织储备丰富,取材痛苦小。目前一次吸脂术可获得200ml脂肪,分离出约1×106个干细胞,为骨髓分离量的40倍;(2)分离简单。外周脂肪经机械剪切,胶原酶消化和简单梯度离心就可获得ADSCs。
但在目前实际应用过程中,脂肪间充质干细胞的培养存在扩增能力有限、迁移性差等问题。干细胞的迁移性已被证实与干细胞的分化能力和损伤修复能力密切相关,因此,寻找一种新的脂肪间充质干细胞培养方法以促进其增殖、提高其迁移能力是非常有必要的。
技术实现要素:
本发明实施例的目的在于克服现有技术的上述不足,提供一种脂肪间充质干细胞的培养方法,以解决现有脂肪间充质干细胞的培养存在扩增能力有限、迁移性差等技术问题。
为了实现上述发明目的,作为本发明的一方面,提供了一种脂肪间充质干细胞的培养方法。所述脂肪间充质干细胞的培养方法将获取的原代脂肪间充质干细胞接种至干细胞培养基中进行培养处理,其中,所述干细胞培养基中含有干细胞因子和白介素3因子,且所述干细胞因子与白介素3因子的含量比为(5-20μmol/L):(5-20ug/ml)。
与现有技术相比,本发明脂肪间充质干细胞的培养方法通过在干细胞培养基中添加干细胞因子和白介素3因子,并控制两因子含量比,使得两细胞因子产生对脂肪间充质干细胞生长和增殖的协效作用,从而提高脂肪间充质干细胞在培养过程中的扩增能力,并获得较高的迁移能力,有效解决了传统脂肪间充质干细胞培养方法存在的扩增能力有限、迁移性差的问题,为临床应用脂肪间充质干细胞进行组织损伤修复提供了优良的种子。
在干细胞因子和白介素3因子协效作用的基础上,通过在培养方法中增设的含有纤连蛋白包被液的包被处理,使得纤连蛋白与干细胞因子和白介素3因子之间进一步产生协效作用,从而提高脂肪间充质干细胞在培养过程中的的增殖以及迁移能力。
附图说明
下面将结合附图及实施例对本发明作进一步说明,附图中:
图1为实施例1重组质粒pET-30a-rhIL-3酶切鉴定琼脂糖凝胶电泳图;其中,M:DNA ladder;1~3:质粒pET-30a-rhIL-3用Nde I和Xho I进行酶切;
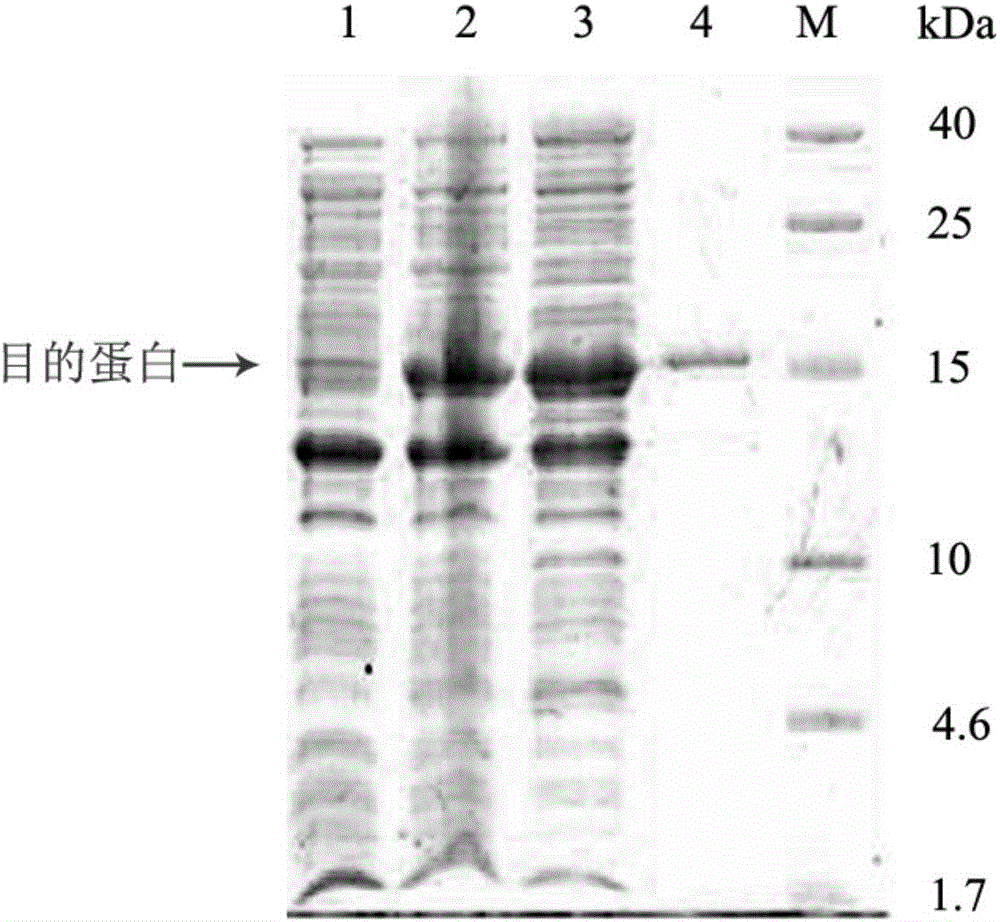
图2为实施例1中rhIL-3在菌株BL21(DE3)pET-30a-rhIL-3中诱导表达结果的SDS-PAGE检测图;其中,1:未经IPTG诱导的BL21(DE3)pET-30a-rhIL-3菌体总蛋白;2:IPTG诱导后的1#BL21(DE3)pET-30a-rhIL-3菌体总蛋白;3:IPTG诱导后的2#BL21(DE3)pET-30a-rhIL-3菌体总蛋白;4:购买的商业化IL-3样本;M:蛋白质Marker;
图3为实施例1中离子交换层析后的目的IL-3重组蛋白的SDS-PAGE检测图;其中,M:蛋白Marker;1:IPTG诱导后的BL21(DE3)pET-30a-rhIL-3菌体总蛋白;2:300mmol NaCl洗脱物1#管;3:300mmol NaCl洗脱物2#管;
图4为实施例1-2和对比实施例1-3各实施例培养的ADSC生长曲线图;
图5为实施例1和对比实施例3培养的ADSC表型流式检测图;其中图5A为间充质干细胞表面抗原表达流式图,图5B为造血细胞标志物表达流式图;
图6为实施例1和对比实施例3培养的ADSC周期的流式检测图;其中图6A为Ctr-ADSC细胞周期的流式检测图;图6B为F/S/I-ADSC细胞周期的流式检测图;图6C为Ctr-ADSC细胞和F/S/I-ADSC细胞周期流式检测结果统计图;
图7为实施例1和对比实施例3培养的ADSC迁移性检测图;其中图7A为Ctr-ADSC细胞迁移轨迹跟踪图;图7B为F/S/I-ADSC细胞迁移轨迹跟踪图;图7C为Ctr-ADSC细胞和F/S/I-ADSC细胞迁移平均速度统计图。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
相关专业词汇说明:
纤连蛋白(Fibronectin,FN):高分子量(~440kDa)的糖蛋白细胞外基质,和细胞膜内称为整合素的受体蛋白结合。
干细胞因子(Stem Cell Factor,SCF):酪氨酸激酶受体c-Kit的配体。
白介素3(Interleukin 3,IL-3):一种多效性的细胞因子,主要由激活了的T细胞、巨噬细胞和骨髓基质干细胞产生,通过与其受体IL-3R结合,诱导JAK-STAT5信号通路的激活,控制DNA合成,调控细胞周期进程。
IPTG:异丙基硫代半乳糖苷,是一种作用极强的诱导剂。
一方面,本发明实施例提供了一种能够有效提高脂肪间充质干细胞增殖和迁移的脂肪间充质干细胞培养方法。本实施例脂肪间充质干细胞培养方法含有如下步骤:
将获取的原代脂肪间充质干细胞接种至干细胞培养基中进行培养处理。
在步骤中,所述干细胞培养基中含有干细胞因子和白介素3因子,且控制所述干细胞因子与白介素3因子的含量比为(5-20μmol/L):(5-20ug/ml)。通过在培养基中添加干细胞因子与白介素3因子,并控制两因子的含量比例,使得两因子在脂肪间充质干细胞的扩增中发挥协效作用,从而提高脂肪间充质干细胞在培养过程中的扩增能力,并获得较高的迁移能力。
在一实施例中,控制干细胞因子在所述干细胞培养基中的浓度为5-20μmol/ml。当然在干细胞因子和白介素3因子含量比例明确的前提下,明确了干细胞因子在所述干细胞培养基中的浓度,也就明确了白介素3在所述干细胞培养基中的浓度。通过优化控制干细胞因子和白介素3在所述干细胞培养基中的浓度,能够进一步提高干细胞因子与白介素3因子的协效作用,从而进一步提高脂肪间充质干细胞的扩增能力和迁移能力。
在上述实施例的基础上,在一实施例中,白介素3因子为重组人IL-3,具体是经优化后的人全长IL-3基因为靶基因进行诱导后的重组人IL-3。其中,人全长IL-3基因序列为GenBank数据库记录的人全长IL-3基因序列,所述优化后的人全长IL-3基因序列是针对GenBank数据库记录的人全长IL-3基因序列进行的优化。在具体实施例中,所述优化后的人全长IL-3基因序列如下:
5'-ATG AGC CGC CTG CCC GTC CTG CTC CTG CTC CAA CTC CTG GTC CGC CCC GGA CTC CAA GCT CCC ATG ACC CAG ACA ACG CCC TTG AAG ACA AGC TGG GTT AAC TGC TCT AAC ATG ATC GAT GAA ATT ATA ACA CAC TTA AAG CAG CCA CCT TTG CCT TTG CTG GAC TTC AAC AAC CTC AAT GGG GAA GAC CAA GAC ATT CTG ATG GAA AAT AAC CTT CGA AGG CCA AAC CTG GAG GCA TTC AAC AGG GCT GTC AAG AGT TTA CAG AAC GCA TCA GCA ATT GAG AGC ATT CTT AAA AAT CTC CTG CCA TGT CTG CCC CTG GCC ACG GCC GCA CCC ACG CGA CAT CCA ATC CAT ATC AAG GAC GGT GAC TGG AAT GAA TTC CGG AGG AAA CTG ACG TTC TAT CTG AAA ACC CTT GAG AAT GCG CAG GCT CAA CAG ACG ACT TTG AGC CTC GCG ATC TTT TGA-3'。——SEQ ID NO 1
其中,上述重组人IL-3的诱导获得方法是以优化后的人全长IL-3基因序列为靶基因进行设计引物和相应的酶切位点,然后按照常规的方法进行转化和表达,具体是将优化后的人全长IL-3基因序列插入到原核表达载体中,获得重组质粒,再转化获得含有优化后的人全长IL-3基因序列的菌株,最后实现重组人IL-3的表达。在具体实施例中,重组人IL-3的获得方法可以但不仅仅如下文实施例1中的重组人IL-3的制备方法制备获得。采用上述重组人IL-3,使得其与干细胞因子之间生产的协效作用更强,从而使得脂肪间充质干细胞的扩增能力和迁移能力更强。
在上述各实施例的基础上,在优选实施例中,上述培养处理是在被包被处理的培养器中进行,所述包被处理的包被液含有纤连蛋白。通过事先采用含有纤连蛋白的包被液对培养器进行包被处理,使得功能因子纤连蛋白分布在培养器的内部中,当将原代脂肪间充质干细胞接种至干细胞培养基中进行培养处理的过程中,该纤连蛋白会发挥作用,具体是其能够参与到干细胞因子和白介素3因子的协效作用中,从而使得三因子产生协效作用,从而提高脂肪间充质干细胞的增殖以及迁移能力。在此基础上,一实施例中,所述纤连蛋白在所述包被液中的浓度为5-20μg/ml。在具体实施例中,包被处理的方法可以但不仅仅为将含有该浓度的纤连蛋白的缓冲溶液加入培养器中,于优选4℃避光过夜。
另外,上述各实施例中的原代脂肪间充质干细胞的获取方法可以按照现有的方法获得。原代脂肪间充质干细胞在干细胞培养基中培养处理的条件,如培养温度可以采用常规的培养温度,如37℃。
为了有效发挥干细胞因子和白介素3因子或者纤连蛋白、干细胞因子和白介素3因子之间的作用,在一实施例中,上述各实施例中的所述培养处理过程中,24小时后更换新的所述干细胞培养基,之后每隔两天更换一次所述干细胞培养基。
另一方面,在上文本发明实施例脂肪间充质干细胞的培养方法的基础上,本实施例还提供了一种脂肪间充质干细胞,具体的,该脂肪间充质干细胞是由上文本发明实施例脂肪间充质干细胞的培养方法培养获得。因此,本发明实施例脂肪间充质干细胞具有高的扩增能力和迁移能力。
下面通过具体实施例对本发明做进一步详细说明。
实施例1
本实施例提供了一种脂肪间充质干细胞的培养方法,包括如下步骤:
1.重组人IL-3(rhIL-3)的制备
1.1 pET-30a-rhIL-3原核表达菌株的构建
对来自GenBank数据库的人全长IL-3基因进行碱基密码子的优化,使其易于在大肠杆菌中表达。优化后的碱基序列如下:
5'-ATG AGC CGC CTG CCC GTC CTG CTC CTG CTC CAA CTC CTG GTC CGC CCC GGA CTC CAA GCT CCC ATG ACC CAG ACA ACG CCC TTG AAG ACA AGC TGG GTT AAC TGC TCT AAC ATG ATC GAT GAA ATT ATA ACA CAC TTA AAG CAG CCA CCT TTG CCT TTG CTG GAC TTC AAC AAC CTC AAT GGG GAA GAC CAA GAC ATT CTG ATG GAA AAT AAC CTT CGA AGG CCA AAC CTG GAG GCA TTC AAC AGG GCT GTC AAG AGT TTA CAG AAC GCA TCA GCA ATT GAG AGC ATT CTT AAA AAT CTC CTG CCA TGT CTG CCC CTG GCC ACG GCC GCA CCC ACG CGA CAT CCA ATC CAT ATC AAG GAC GGT GAC TGG AAT GAA TTC CGG AGG AAA CTG ACG TTC TAT CTG AAA ACC CTT GAG AAT GCG CAG GCT CAA CAG ACG ACT TTG AGC CTC GCG ATC TTT TGA-3'——SEQ ID NO 1
对优化后的rhIL-3全长基因序列进行合成,设计引物和酶切位点(其中5’端酶切位点为Nde I,3’端酶切位点为Xho I),正向引物和反向引物的序列如下:
5'-CGCCATATGATGAGCCGCCTGCCCG-3'——SEQ ID NO 2
5'-CTCGAGCGGTCAAAAGATCGCGAG-3'——SEQ ID NO 3
。将rhIL-3全长基因插入到原核表达载体pET-30a(+)载体中,得到重组质粒pET-30a-rhIL-3,并将其转化进入BL21(DE3)中。在LB板上经过卡那霉素(30μg/ml)抗性筛选后,挑取单菌落到LB培养基中进行培养,提取质粒进行酶切鉴定,将酶切后的产物经琼脂糖凝胶电泳鉴定,鉴定结果如图1所示,由此可知,人工合成的rhIL-3全长序列(459bp)已成功插入原核表达载体pET-30a(+)(5422bp)中,并转化进入BL21(DE3)中,即得到的阳性表达菌株BL21(DE3)pET-30a-rhIL-3。
1.2 IL-3重组蛋白的诱导表达
按照1:50的比例接种BL21(DE3)pET-30a-rhIL-3菌种到LB培养基(含30ug/ml Kan)中,37℃、220-250rpm震荡培养过夜。第二天早上按照1:100的比例接种前一天培养的细菌于LB培养液(含30ug/ml的Kan)中扩大培养,至OD600=0.5-0.6(一般接种培养2-3h),加入IPTG至终浓度为1mM,30℃诱导表达3h,收获菌体,用SDS-PAGE对目的蛋白进行检测,鉴定结果如图2所示。由图2可知,泳道2、3的结果显示,菌株BL21(DE3)pET-30a-rhIL-3在30℃用1mM IPTG进行诱导时能够成功表达rhIL-3。
1.3 IL-3重组蛋白的纯化
将上述收集的菌悬液5000g,4℃离心10min,弃上清,用预冷的裂解缓冲液(50mMPB,5mMEDTA,pH6.5)40-50倍浓缩菌体,置于50ml离心管或50ml烧杯内,进行超声破碎。超声条件:冰水浴,超声4s,间隔5s,4min/次,重复至菌液变澄清为止。将裂解物12000g,4℃离心10min,收集上清,先后用0.8um、0.45μm的滤膜过滤后,利用离子交换层析法进行上样纯化和浓缩,大概流程如下:
(1)用20mM PB洗柱子,随洗脱进行,280nm吸光度值先升高后降低,降至0.000-0.005时换下一洗脱液进行洗脱;
(2)180mM NaCl的20mM PB洗柱子,280nm吸光度值先升高后降低,降至0.000-0.007时换用下一洗脱液;
(3)含300mM NaCl的20mM PB洗脱目的蛋白、分管收集。同时用SDS-PAGE对收集的目的蛋白进行检测;检测的电泳图见图3。从图3的1、2、3泳道可以看出,利用该方法可以获得高纯度的rhIL-3蛋白;
(4)取50ml收集的目的蛋白样品加入100ml不含NaCl的PB缓冲液,在4℃冰箱中进行超滤,当超滤杯内液体剩余20ml左右时停止超滤,在超净台内打开超滤杯,吸出少量样品溶液,检测蛋白浓度,将样品浓缩至1mg/ml,用0.22um的滤器过滤,并分装备用。
2.原代脂肪间充质干细胞的分离培养
2.1 Day 0:
细胞培养瓶的包被:取1个T75培养瓶,加入5ml含10ug/ml FN的DPBS溶液,4℃避光过夜放置。
1#完全培养基的配制:高糖DMEM+2%Ultroser G+10μmol/L SCF+10ug/ml IL-3+1%青链霉素。其中,IL-3为步骤1中获得的重组人IL-3(rh IL-3)。
2.2 Day 1:手术室脂肪抽取后注入225ml离心管,将离心管置于冰盒中,运送至实验室。
2.3用含有0.1%庆大霉素的DPBS冲洗脂肪去除麻醉剂及血液。
2.4将上层脂肪按10ml每管转移至50ml离心管,每管加入0.1%的I型胶原酶20ml,置于37℃恒温水浴摇床中,200rpm震荡60min,期间震荡混匀一次,取出,液面分三层,上层为油脂层,中间为未消化脂肪组织层,下层为脂肪间充质细胞及红细胞混合层。
2.5加入20ml终止培养基(高糖DMEM+10%FBS+1%青链霉素),1500rpm离心15min。
2.6将上两层转移至新的离心管备用,弃下层混合液,剩细胞沉淀,加入20ml DPBS重悬细胞。(若上两层脂肪颗粒较多,可再次加入0.1%的I型胶原酶20ml,重复上述操作)。
2.7重悬后的细胞悬液用100um细胞筛网过滤,1500rpm离心15min后,弃上清,用1#完全培养基重悬后,转入弃去包被液的T75培养瓶中,置于37℃,5%CO2培养箱中培养。
2.8 24h后观察到大量细胞贴壁,更换新鲜的完全培养基,之后每两天换液一次,生长融合至90%时,用0.25%胰酶消化传代培养。1#完全培养基培养获得的细胞标记为F/S/I-ADSC。
实施例2
本实施例提供了一种脂肪间充质干细胞的培养方法,包括如下步骤:
1.重组人IL-3(rhIL-3)的制备,参照实施例1的步骤1;
2.原代脂肪间充质干细胞的分离培养
2.1 Day 0:
细胞培养瓶:取1个T75培养瓶,不进行包被处理。
1#完全培养基的配制:高糖DMEM+2%Ultroser G+10μmol/L SCF+10ug/ml IL-3+1%青链霉素。其中,IL-3为步骤1中获得的重组人IL-3(rh IL-3)。
步骤2.2至步骤2.8参照实施例1的步骤2.2至步骤2.8;培养获得的细胞标记为S/I-ADSC。
对比实施例1
本实施例提供了一种脂肪间充质干细胞的培养方法,包括如下步骤:
1.重组人IL-3(rhIL-3)的制备:参照实施例1中的步骤1。
2.原代脂肪间充质干细胞的分离培养
2.1 Day 0:
细胞培养瓶:取1个T75培养瓶,不进行包被处理。
2#完全培养基的配制:高糖DMEM+2%Ultroser G+10ug/ml IL-3+1%青链霉素。其中,IL-3为步骤1中获得的重组人IL-3(rh IL-3)。
步骤2.2至步骤2.6参照实施例1的步骤2.2至步骤2.6;
2.7重悬后的细胞悬液用100um细胞筛网过滤,1500rpm离心15min后,弃上清,用2#完全培养基重悬后,转入T75培养瓶中,置于37℃,5%CO2培养箱中培养。
2.8 24h后观察到大量细胞贴壁,更换新鲜的完全培养基,之后每两天换液一次,生长融合至90%时,用0.25%胰酶消化传代培养。2#完全培养基培养获得的细胞标记为I-ADSC。
对比实施例2
本实施例提供了一种脂肪间充质干细胞的培养方法,包括如下步骤:
1.原代脂肪间充质干细胞的分离培养
1.1 Day 0:
细胞培养瓶:取1个T75培养瓶,不进行包被处理。
3#完全培养基的配制:高糖DMEM+2%Ultroser G+10μmol/L SCF+1%青链霉素。
步骤1.2至步骤1.6参照实施例1的步骤2.2至步骤2.6;
1.7重悬后的细胞悬液用100um细胞筛网过滤,1500rpm离心15min后,弃上清,用3#完全培养基重悬后,转入T75培养瓶中,置于37℃,5%CO2培养箱中培养。
1.8 24h后观察到大量细胞贴壁,更换新鲜的完全培养基,之后每两天换液一次,生长融合至90%时,用0.25%胰酶消化传代培养。3#完全培养基培养获得的细胞标记为S-ADSC。
对比实施例3
本实施例提供了一种脂肪间充质干细胞的培养方法,包括如下步骤:
1.原代脂肪间充质干细胞的分离培养
1.1 Day 0:
细胞培养瓶:取1个T75培养瓶,不进行包被处理。
4#完全培养基的配制:高糖DMEM+2%Ultroser G+1%青链霉素。
步骤1.2至步骤1.6参照实施例1的步骤2.2至步骤2.6;
1.7重悬后的细胞悬液用100um细胞筛网过滤,1500rpm离心15min后,弃上清,用4#完全培养基重悬后,转入T75培养瓶中,置于37℃,5%CO2培养箱中培养。
1.8 24h后观察到大量细胞贴壁,更换新鲜的完全培养基,之后每两天换液一次,生长融合至90%时,用0.25%胰酶消化传代培养。4#完全培养基培养获得的细胞标记为Ctr-ADSC。
相关实验测试和测试结果
将上述实施例1-2获得的F/S/I-ADSC、S/I-ADSC和对比实施例1-3分别获得的I-ADSC、S-ADSC、Ctr-ADSC分别进行下述相关实验:
1.脂肪间充质干细胞生长曲线绘制
分别取各实施例中P4代后各ADSC细胞,以1×104/孔的密度接种24孔板,每隔两天,取两孔细胞,胰酶消化后收集细胞悬液,用细胞计数板进行细胞计数,取两孔细胞数均值,绘制不同组的细胞生长曲线。经测试得知,实施例1-2获得的ADSC细胞的增殖能力强于对比实施例1-3中所培养的ADSC,其中对比实施例3获得的Ctr-ADSC细胞的增殖能力最弱,具体ADSC的生长曲线如图4所示。由此证明了SCF与重组人IL-3之间、SCF与重组人IL-3和FN三者之间具有对ADSC的增殖和生长的协效作用。
2.脂肪间充质干细胞表型鉴定
2.1消化各实施例中P4代后对数生长期的ADSC细胞,计数;
2.2分别取106个细胞于流式管中,DPBS洗两遍,离心去上清;
2.3 100ul DPBS重悬后,分别单独加入CD90-FITC、CD105-FITC、CD45-PE、CD34-PE抗体,常温避光孵育30min;
2.4 DPBS洗两遍,离心去上清;
2.5 0.5ml DPBS重悬细胞,流式细胞仪检测细胞表型,Cell-Quest软件分析,每个样本至少分析10000个细胞。
经过分别取各实施例中P4代后对数生长期的ADSC细胞,用流式细胞仪检测细胞表面CD90、CD105、CD45、CD34抗原的表达,流式检测结果显示,各实施例中ADSC细胞表面均低表达造血细胞标志物CD34,CD45,高表达间充质干细胞表面抗原CD90,CD105。其中,以实施例1的F/S/I-ADSC细胞和对比实施例3的Ctr-ADSC细胞为例,其各自流式检测结果如图5所示,两组ADSC细胞表面均低表达造血细胞标志物CD34,CD45(<2%),高表达间充质干细胞表面抗原CD90,CD105(>95%)。
3.脂肪间充质干细胞细胞周期检测3.1消化各实施例中P4代后对数生长期的ADSC细胞,计数;
3.2分别取106个细胞于流式管中,DPBS洗两遍,离心去上清;
3.3一边震荡一边向细胞沉淀中加入70%预冷乙醇混匀,4℃固定18h以上;
3.4离心,弃去乙醇上清,加入预冷的DPBS洗沉淀2次,离心去上清;
3.5 0.5ml DPBS重悬细胞,加入5ul的5mg/ml RNA酶(终浓度50ug/ml),37℃下孵育30min;
3.6加入25ul 1mg/ml PI(终浓度50ug/ml),混匀后室温、避光反应30min;
3.7流式细胞仪进行DNA检测,用Modifit软件分析各时相细胞周期的比例。
经过分别取各实施例中P4代后对数生长期的ADSC细胞,用流式细胞仪进行DNA检测,用Modifit软件分析各时相细胞周期的比例,实验结果显示处于G2-M期的实施例1-2培养的F/S/I-ADSC、S/I-ADSC细胞细胞比例远远高于对比实施例1-3中I-ADSC、S-ADSC、Ctr-ADSC,且差异有显著性(P<0.05),进一步证实了SCF与重组人IL-3之间、SCF与重组人IL-3和FN三者之间具有对ADSC的增殖和生长的协效作用,经过SCF和IL-3两因子或SCF、IL-3和FN三因子处理的ADSC细胞的增殖能力要强于传统方法所培养的Ctr-ADSC细胞。以实施例1的F/S/I-ADSC和对比实施例3的Ctr-ADSC为例,实施例1中处于G2-M期的F/S/I-ADSC细胞比例为19.8%,远远高于对比实施例3的Ctr-ADSC细胞G2-M期的细胞比例(6.7%),且两者的差异有显著性(P<0.05),如图6所示。
4.脂肪间充质干细胞迁移能力检测
4.1分别取P4代后Ctr-ADSC细胞和F/S/I-ADSC细胞,以1x105/孔接种至confocal专用chamber,置于37℃、5%CO2培养箱中培养3h以使细胞贴壁;
4.2取出chamber,使用1ml注射器针头,于底面中央进行划线,更换二氧化碳非依赖性的培养基,实验组细胞加入10ug/ml IL-3,对照组加入等量DPBS;
4.3将chamber置于活细胞工作站中对划线处进行连续拍摄观察,10倍物镜下设置每两分钟拍摄一张照片,连续拍摄24h;
4.4所拍摄照片每隔十张挑选一张,使用ImageJ软件处理加工为视频;
4.5于ImageJ中对划线处一端随机选取20个细胞运动轨迹进行跟踪,统计两组细胞运动速率差异。
经过分别统计各实施例中P4代后ADSC细胞运动速率差异,实验结果表明,实施例1-2培养的F/S/I-ADSC、S/I-ADSC细胞迁移性要强于对比实施例1-3中的I-ADSC、S-ADSC、Ctr-ADSC,且差异有显著性(P<0.05),进一步证实了SCF与重组人IL-3之间、SCF与重组人IL-3和FN三者之间具有促进ADSC迁移能力的协效作用,经过SCF和IL-3两因子或SCF、IL-3和FN三因子处理的ADSC细胞的迁移能力要强于传统方法所培养的Ctr-ADSC细胞。以实施例1的F/S/I-ADSC和对比实施例3的Ctr-ADSC为例,实施例1的F/S/I-ADSC迁移能力与对比实施例3的Ctr-ADSC相比,两者的迁移速度有显著性差异(P<0.05),如图7所示。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包括在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!