一种铜绿假单胞菌外膜蛋白疫苗的制备方法及应用与流程
本发明属于生物技术领域,涉及的是一种新型的铜绿假单胞菌外膜蛋白疫苗的制备及应用。
背景技术:
铜绿假单胞菌(pseudomonasaeruginosa)属于假单胞菌科、假单胞菌属,革兰式阴性细菌。其分布广泛,在自然界(土壤、水和空气)、植物表面、人体的皮肤、肠道和呼吸道中均有分布。铜绿假单胞菌能够天然地抵御多种抗生素,而且能够形成生物被膜,使其对抗生素的抗性增高1000倍左右。因此,尽管抗生素的使用浓度越来越高,铜绿假单胞菌的感染依旧很难清除。
疫苗则是对抗铜绿假单胞菌感染的一种替代策略。过去几十年,在铜绿假单胞菌急性和慢性感染的动物模型中,人们已经尝试研制了各种各样的疫苗,包括细菌脂多糖(lps)的o抗原、铜绿假单胞菌的毒力系统——三型分泌系统——的组分pcrv、外膜蛋白oprf、鞭毛以及菌毛等。用这些免疫原进行免疫能够引发宿主产生保护性抗体,介导对细菌的调理吞噬杀伤和毒力抑制。其中,尽管使用lps的o抗原制作的抗体有很好的保护效果,但是由于铜绿假单胞菌不同菌株中o抗原的多样性,临床使用效果并不好。因此,近期的研究聚焦在了保守性表位上。
使用以上抗原制作的多价疫苗进来显示了不错的保护效果。使用oprf-opri或oprf第8表位(oprf311-341)+opri+a型和b型鞭毛蛋白能够引起高水平的保护性igg,并有很好的保护效果。近来也有文章报道,使用针对pcrv蛋白和胞外多糖(psl)的抗体能够在小鼠急性感染模型中起到保护效果。
在针对包外病原菌感染时,除体液免疫外,th-17免疫应答也起到了重要作用。我们之前的结果表明,使用ⅲ型分泌系统组分蛋白popb免疫小鼠,能够引起小鼠的th-17应答,并在急性肺炎模型中对小鼠起到保护作用,而不依赖于抗体的产生。
尽管有少量疫苗已经进入到临床试验阶段,至今尚无有效的铜绿假单胞菌疫苗上市。新型疫苗的发现有助于生产出有效的单价或多价疫苗。大多数有效的疫苗有以下几点特性:高免疫原性、表面暴露、表达量丰富。
oprh是铜绿假单胞菌的一个外膜蛋白,其表达受到phop-phoq双组分系统调控,在mg2+缺乏、与宿主细胞接触及感染过程中,phop-phoq双组分系统均能够被激活,从而导致oprh表达量的升高。在铜绿假单胞菌pao1菌株中,外膜蛋白在体外培养状态下,其平均表达量为核糖体蛋白rpsl的0.0144倍,感染小鼠肺部3h后,其平均表达量升高至rpsl表达量的0.0317倍,而感染后6h外膜蛋白的平均表达量则又回落为rpsl平均表达量的0.0117倍。与此相对,体外培养时oprh表达量水平是核糖体蛋白rpsl表达量水平的6×10-5倍,是外膜蛋白平均表达水平的0.004倍;当感染小鼠肺部3h后,其表达量能够升高到rpsl表达水平的3倍,是外膜蛋白平均表达水平的100倍;当感染小鼠肺部6h后,其表达量仍为rpsl表达水平的3倍,是外膜蛋白平均表达水平的约300倍。在铜绿假单胞菌另一菌株pa14中,外膜蛋白在体外培养状态下,其平均表达量为rpsl的1.8×10-4倍,感染小鼠肺部3h后,其平均表达量为rpsl表达量的1.9×10-4倍,而感染后6h外膜蛋白的平均表达量则升高为rpsl平均表达量的2.5×10-4倍。与此相对,体外培养时oprh表达量水平是核糖体蛋白rpsl表达量水平的0.13倍,是外膜蛋白平均表达水平的722倍;当感染小鼠肺部3h后,其表达量能够升高到rpsl表达水平的2倍,是外膜蛋白平均表达水平的10000倍;当感染小鼠肺部6h后,其表达量仍为rpsl表达水平的一半,是外膜蛋白平均表达水平的约2000倍。这表明oprh的表达量在感染过程中有巨大的提升,且其表达量非常高,是表达量最高的外膜蛋白之一。
技术实现要素:
本发明的目的是制备一种针对多种血清型的铜绿假单胞菌肺部急性感染有良好保护效果的疫苗,通过将该疫苗经鼻腔免疫小鼠后,使用不同血清型的铜绿假单胞菌进行感染,能够对小鼠起到保护作用。
本发明的技术方案
一种铜绿假单胞菌外膜蛋白疫苗的制备方法,在大肠杆菌bl21(de3)菌株中转入pet28b-his-oprh质粒,使其在iptg的诱导下表达his-oprh融合蛋白。将细菌收集后超声破碎,使用ni-nta对融合蛋白进行纯化,并通过分子筛进一步纯化蛋白,去除蛋白中可能混有的细菌脂多糖(lps)。将纯化后的蛋白用1,2-dihexanoyl-sn-glycero-3-phosphocholine(dhpc)包被,最终获得铜绿假单胞菌oprh疫苗。
本发明同时提供了所述方法制备的铜绿假单胞菌oprh疫苗的应用:所述应用是指使用oprh疫苗与浓度为20mg/ml的免疫佐剂curdlan以1:1比例混合后,通过鼻腔免疫小鼠,以一周为间隔进行三次免疫,每次20μl/只,每只小鼠每次免疫蛋白总量为70μg。免疫完成三周后,可进行侵染实验以验证免疫效果。
使用两种不同血清型的菌株pa14和pa103对小鼠进行急性肺炎模型的感染,与只使用免疫佐剂进行免疫的对照组相比,免疫组具有显著的保护效果。对小鼠血清中的抗体进行分析,发现免疫后的小鼠能够产生针对oprh的抗体,并且该抗体能够有效的介导巨噬细胞对铜绿假单胞菌的吞噬作用。因此,该疫苗通过诱导免疫个体产生针对oprh的igg抗体,使被免疫个体能够对抗不同血清型铜绿假单胞菌的感染。
本发明的有益效果:
本发明表达纯化出his-oprh融合蛋白,并用dhpc对融合蛋白进行包被,能够通过诱导小鼠产生针对oprh的igg抗体,介导巨噬细胞吞噬铜绿假单胞菌,有效的对小鼠起到保护效果,并能够抵御不同血清型铜绿假单胞菌的感染。
附图说明
图1.sds-page检测纯化后的his-oprh融合蛋白。
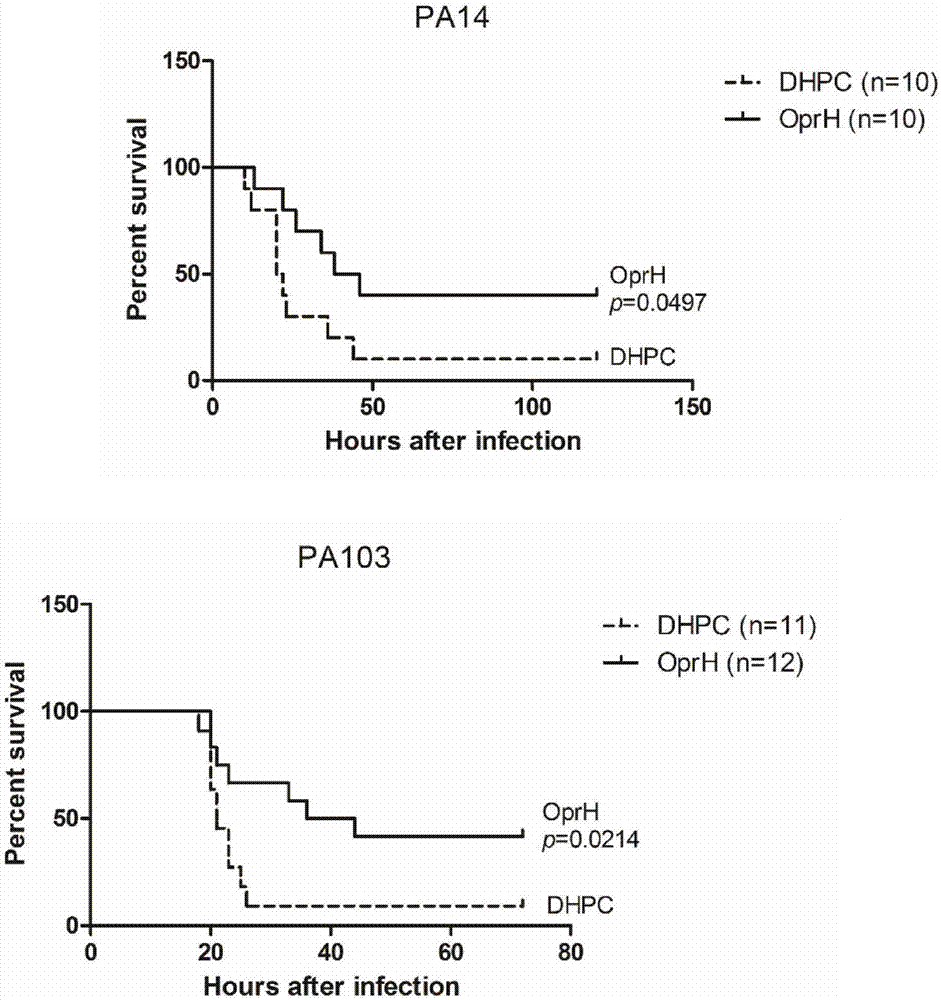
图2.使用pa14和pa103检测包被后的his-oprh免疫小鼠的保护效果。
图3.elisa检测oprh免疫后小鼠血清与对照组小鼠血清对his-oprh蛋白的结合能力。
图4.调理吞噬实验检测oprh免疫后小鼠血清与对照组小鼠血清介导骨髓巨噬细胞对pa14与pa14δoprh的吞噬作用。
图5.荧光检测oprh免疫后小鼠血清与对照组小鼠血清介导骨髓巨噬细胞对pa14与pa14δoprh的吞噬作用。
具体实施方式
本发明使用的菌种和质粒:
野生型铜绿假单胞菌pa14和pa103、大肠杆菌bl21(de3)和dh5α为常见公共菌株。蛋白表达质粒pet28b-his-oprh为本研究构建。
本发明使用的动物:
balb/c雌性小鼠,6-8周,spf级,购自维通利华公司。
本发明使用的试剂:
dnamarker、限制性内切酶、taqdna聚合酶、dntp来自于takara公司;t4dna连接酶为美国promega公司产品。酵母提取物物(yeastextract)和胰蛋白胨(tryptone)购自英国oxoid公司;二甲基亚砜(dmso)、4%甲醛为美国sigma公司产品;琼脂糖购自biowest;琼脂粉(bacto-agar)、精氨酸、咪唑购自鼎国生物公司;卡那霉素、尿素、nacl、na3po4、tris-hcl、edta、kcl、nah2po4、isopropylβ-d-1-thiogalactopyranoside(iptg)购自生工生物工程(上海)股份有限公司;基因组提取试剂盒(easypuregenomicdnaextractionkit)为全式金公司产品;质粒小提试剂盒(plasmidminiprepkit)为美国axygen公司产品;dna纯化试剂盒(dnaclean&concentrator)和dna胶回收试剂盒(zymocleangeldnarecoverykit)为美国zymoresearch公司产品;1,2-dihexanoyl-sn-glycero-3-phosphocholine(dhpc)为美国avanti公司产品;ni-nta琼脂糖颗粒为美国qiagen公司产品;proteinassaydyereagentconcentrate为美国bio-rad公司产品;hrp交联的抗鼠的igg抗体购自普利莱公司;tmb辣根过氧化物酶显色液购自碧云天公司。
his-oprh融合蛋白表达质粒与菌株的构建:
1)以pa14菌株基因组dna为模板,pcr扩增得到不包含起始密码子的oprh基因片段。在0.8%的琼脂糖凝胶中电泳检测pcr产物的大小,并使用dna纯化试剂盒纯化回收dna片段。
2)取上述pcr产物和提取的pet28b质粒,使用ecori和sali进行酶切,在0.8%的琼脂糖凝胶中电泳检测pcr产物的大小,并切胶回收相应的酶切产物。酶切后的pcr产物与质粒进行连接,连接产物转化入dh5α感受态细胞,涂布在含50μg/ml卡那霉素(kana)的lb平板上筛选转化子,pcr和质粒酶切对转化子进行鉴定,得到蛋白表达质粒pet28b-his-oprh。
3)提取保存在大肠杆菌dh5a中的基因敲除质粒pet28b-his-oprh,使用电转化的方法将质粒转化到bl21(de3)感受态细胞中。
his-oprh融合蛋白的纯化:
1)5ml过夜培养的bl21(de3)/pet28b-his-oprh菌株转接至500mllb培养基中,卡那霉素浓度为50μg/ml。37℃200rpm进行培养,当od600达到0.4-0.6时,加入终浓度为1mm的iptg,继续培养5h。4000×g离心20min收集菌体,将收集到的菌体于-20℃冻存过夜。
2)过夜的菌体于冰上融化后,用bufferb(100mmnah2po4,500mmnacl,8m尿素,10mm咪唑,ph7.2)重悬,超声破碎菌体。
3)10,000×g室温离心30分钟以收集细胞碎片。将上清与ni-nta琼脂糖颗粒混合,室温孵育2h。
4)将上清与琼脂糖颗粒倒入底部有滤膜的空柱子中,待液体流净,使用含有25mm咪唑的bufferb洗三次。
5)用含有500mm咪唑的bufferb将蛋白从琼脂糖颗粒上洗脱下来,通过sds-page和westernblotting确定蛋白纯度,并使用proteinassaydyereagentconcentrate测定蛋白浓度。
6)将ni-nta纯化后的蛋白使用分子筛进一步进行纯化,使用含有8m尿素的pbs溶液洗脱蛋白。
7)分子筛纯化后的蛋白溶液使用超速离心进行浓缩,并使用proteinassaydyereagentconcentrate测定蛋白的最终浓度。
dhpc包被融合蛋白:
1)纯化浓缩后的蛋白样品10倍稀释入包被缓冲液(20mmtris-hcl,5mmedta,and0.6ml-arginine,3%dhpc,ph8.5)。37℃孵育72h。
2)使用2l透析缓冲液(20mmtris-hcl,5mmedta,and50mmkcl,ph8.5)透析上述溶液,室温透析20min。
3)使用超滤装置对透析后的溶液进行超滤,同时使用交换缓冲液(25mmna3po4,50mmkcl,ph6.0)对溶液进行交换。最终,dhpc包被的his-oprh溶解在交换缓冲液中,蛋白浓度根据his-oprh的起始浓度进行计算。
小鼠免疫:
1)使用交换缓冲液配制20mg/ml的免疫佐剂curdlan。将配制好的curdlan与dhpc包被的his-oprh进行1:1混合,同时使用交换缓冲液将curdlan稀释为10mg/ml作为对照试剂。
2)6-8周的spf级雌性balb/c小鼠,腹腔注射80μl7.5%的水合氯醛进行麻醉。
3)在麻醉后的小鼠鼻孔缓缓滴加20μl免疫蛋白或对照试剂,每个鼻孔10μl,使小鼠吸入肺部。
4)以一周为间隔,免疫小鼠三次。最后一次免疫完成三周后,可以进行接下来的实验。
小鼠急性肺炎模型的构建:
1)从-80℃冰箱取出冻存的pao1菌种并在固体lb平板上划线,37℃培养10h。从平板上挑取单菌落置于3mllb培养基中培养过夜,1:100转接至3mllb培养基中37℃培养。当转接培养后的菌液od600=0.8-1.0时取出,用pbs洗涤2次,并调整细菌浓度至所需浓度。
2)6-8周的spf级雌性balb/c小鼠,腹腔注射80μl7.5%的水合氯醛进行麻醉。
3)在麻醉后的小鼠鼻孔缓缓滴加20μl细菌液,每个鼻孔10μl,使小鼠吸入肺部。
4)观察感染后小鼠的存活率至120h,记录小鼠的存活情况。
酶联免疫吸附试验(elisa):
1)使用纯化后的his-oprh融合蛋白以1mg/ml浓度溶于pbs,elisa用96孔板每孔加入100μl蛋白溶液,4℃孵育过夜。
2)使用pbst清洗包被后的96孔板,使用200μl含有1%bsa的pbst溶液进行封闭,37℃孵育2h。
3)封闭后,每孔加入100μl稀释后的小鼠血清,37℃孵育1h。
4)每孔用pbst清洗3次,然后加入100μl稀释后的hrp交联的抗鼠的igg抗体,37℃孵育1h。
5)每孔用pbst清洗3次,加入200μltmb辣根过氧化物酶显色液,避光进行显色反应,至孔内颜色变为蓝色,每孔加入50μl2mh2so4终止反应。
6)使用分光光度计测定每孔od450的吸光度。
调理吞噬实验及荧光观察:
1)使用原代骨髓巨噬细胞于24孔板中培养过夜。加入细菌前,使用hbss将细胞清洗两次,并在每孔中加入500μlhbss。
2)过夜培养的菌株1:100稀释至新鲜的lb培养基中,生长至od600为0.8-1.0。细菌用hbss清洗两次,将菌浓调至109/ml,取50μl菌液与20μl灭活补体(56℃孵育20min)后的血清25℃孵育30min。
3)与抗体孵育后,细菌使用hbss清洗两次并用hbss重悬至1ml。向培养骨髓巨噬细胞的24孔板中,每孔加入50μl重悬的菌液,37℃放置40min。
4)每孔用250μg/ml37℃预热的庆大霉素处理10min,用37℃预热的hbss清洗两次,并使用1ml无菌水裂解细胞。
5)将1ml的细胞裂解液进行梯度稀释并滴板,以确定被骨髓巨噬细胞吞入的细菌数量。
6)若要进行荧光观察实验,原代骨髓巨噬细胞于实验前一天培养于处理过的细胞爬片上。使用能够表达荧光蛋白的细菌进行该实验。
7)当使用庆大霉素杀死未被吞噬的细菌后,使用hbss清洗两次,使用4%甲醛固定20min。
8)用蒸馏水清洗3次,将爬片晾干后进行封片,即可使用荧光显微镜进行观察。
数据分析:
小鼠存活数据使用log-ranktest和gehan-breslow-wilcoxontest进行分析。
实施例1.his-oprh疫苗的表达、纯化与包被:
以pa14菌株基因组dna为模板,pcr扩增得到不包含起始密码子的oprh基因片段。上述pcr产物经酶切克隆到质粒pet28b上,构建出蛋白表达质粒pet28b-his-oprh。提取保存在dh5α中的蛋白表达质粒,使用电转化的方法将其转入大肠杆菌bl21(de3)中。使用1mmiptg诱导his-oprh融合蛋白表达,将表达该蛋白的细菌离心收集并进行超声破碎,使用ni-nta纯化his-oprh融合蛋白,并将纯化后的蛋白使用分子筛进一步纯化(图1)。将最终得到的蛋白超速离心浓缩,10倍稀释于含有3%dhpc的包被液,37℃放置72h。将包被后的液体进行透析,并通过超速离心浓缩蛋白并将蛋白溶于交换液中。包被后的his-oprh蛋白终浓度为7mg/ml,于-80℃保存。
实施例2.his-oprh疫苗的免疫效果测定:
将包被后的his-oprh疫苗与20mg/ml的免疫佐剂curdlan悬浊液1:1进行混合,对照样品使用交换缓冲液1:1与curdlan混合。使用7.5%无水氯醛麻醉小鼠后,通过鼻腔对小鼠进行免疫,每个鼻孔滴入10μl疫苗或对照样品,每只小鼠共免疫20μl。以一周为间隔,共免疫三次,最后一次免疫完成三周后,可进行后续实验。
将感染所需菌株培养至对数期,细菌用pbs清洗两次,然后重悬至所需浓度。使用7.5%无水氯醛麻醉小鼠后,通过鼻腔对小鼠进行感染,每个鼻孔滴入10μl,每只小鼠共感染20μl菌液。使用pa14菌株感染时,每只小鼠的感染菌量为2×107;使用pa103菌株感染时,每只小鼠的感染菌量为2×106。感染后观察实验组与对照组小鼠的死亡情况,时间不短于120h。由图2可知,疫苗对于pa14和pa103菌株的感染均有显著的保护效果。
实施例3.检测免疫后小鼠血清中针对oprh的抗体水平:
最后一次免疫后三周,取出oprh免疫组及对照组小鼠血清进行实验。使用溶于pbs浓度为1mg/ml的oprh蛋白4℃过夜包被酶标板,每孔中蛋白液为100μl。包被完成后去掉包被液,加入200μl含有1%bsa的pbst溶液进行封闭,37℃孵育2h。封闭后,每孔加入100μl倍比稀释后的小鼠血清,37℃孵育1h。每孔用pbst清洗3次,然后加入100μl稀释后的hrp交联的抗鼠的igg抗体,37℃孵育1h。再次用pbst清洗3次,加入200μltmb辣根过氧化物酶显色液,避光进行显色反应,至孔内颜色变为蓝色,每孔加入50μl2mh2so4终止反应。使用分光光度计测定每孔od450的吸光度,并绘制曲线图(图3)。相比对照组,使用oprh对小鼠进行免疫后,其血清中抗体对于oprh蛋白的结合力有明显提升,说明小鼠血清中产生了能够结合oprh蛋白的igg。
实施例4.使用免疫后小鼠血清诱导调理吞噬实验:
使用原代骨髓巨噬细胞于24孔板中培养过夜。加入细菌前,使用hbss将细胞清洗两次,并在每孔中加入500μlhbss。过夜培养的pa14及pa14δoprh菌株1:100稀释至新鲜的lb培养基中,生长至od600为0.8-1.0。细菌用hbss清洗两次,将菌浓调至109/ml,使用20μl灭活补体(56℃孵育20min)后的四种血清(未免疫过的小鼠血清、oprh免疫过的小鼠血清、对照组小鼠血清及pa14感染3次后的小鼠血清)与50μl菌液25℃孵育30min。之后,使用hbss清洗细菌两次并用hbss重悬至1ml。向培养骨髓巨噬细胞的24孔板中每孔加入50μl重悬的菌液,37℃放置40min。每孔用250μg/ml37℃预热的庆大霉素处理10min,用37℃预热的hbss清洗两次,并使用1ml无菌水裂解细胞。将1ml的细胞裂解液进行梯度稀释并滴板,以确定被骨髓巨噬细胞吞入的细菌数量(图4)。相对对照组,oprh免疫后的小鼠血清能够显著增强骨髓巨噬细胞对pa14的吞噬,而并不能够增强骨髓巨噬细胞对pa14δoprh菌株的吞噬。表明oprh免疫后的小鼠产生了针对oprh蛋白的抗体,改抗体能够介导吞噬细胞对pa14的吞噬。
实施例5.使用免疫后小鼠血清诱导调理吞噬并进行荧光观察:
将细胞爬片放入6孔板中,原代骨髓巨噬细胞分入6孔板中培养过夜。加入细菌前,使用hbss将细胞清洗两次,并在每孔中加入500μlhbss。过夜培养的pa14/pucp20-gfp及pa14δoprh/pucp20-gfp菌株1:100稀释至新鲜的lb培养基中,生长至od600为0.8-1.0。细菌用hbss清洗两次,将菌浓调至109/ml,使用20μl灭活补体(56℃孵育20min)后的四种血清(未免疫过的小鼠血清、oprh免疫过的小鼠血清、对照组小鼠血清及pa14感染3次后的小鼠血清)与50μl菌液25℃孵育30min。之后,使用hbss清洗细菌两次并用hbss重悬至1ml。向培养骨髓巨噬细胞的24孔板中每孔加入50μl重悬的菌液,37℃放置40min。每孔用250μg/ml37℃预热的庆大霉素处理10min,用37℃预热的hbss清洗两次,4%甲醛固定20min。将细胞爬片用蒸馏水清洗两次后晾干,使用封片液封片,然后使用荧光显微镜进行查看并计算平均每个细胞中吞入的细菌个数(图5)。从荧光图像中可以直观地看到,oprh免疫后的小鼠血清能够介导骨髓巨噬细胞吞噬pa14/pucp20-gfp,其吞噬数量远高于对照组血清;而对于介导pa14δoprh/pucp20-gfp菌株的吞噬,两种血清并无差异。
- 还没有人留言评论。精彩留言会获得点赞!
- 检测水中铜绿假单胞菌和toxA的引物、试剂盒和方法与流程
- 一株可裂解多重耐药铜绿假单胞菌的噬菌体及其治疗感染的应用的制作方法与工艺
- 芪类化合物在抑制铜绿假单胞菌群体感应系统中的应用的制作方法与工艺
- 利用群体感应调控铜绿假单胞菌好氧反硝化以除废水中硝酸盐的方法与流程
- 适用于广泛耐药铜绿假单胞菌的筛查培养基及制备方法与流程
- 一株用于细菌病害防治的假单胞菌及应用的制造方法与工艺
- 一种利用高产鼠李糖脂的铜绿假单胞菌降解石油的方法与流程
- D‑色氨酸在抑制铜绿假单胞菌产弹性蛋白酶中的应用的制造方法与工艺
- 用于RPA快速检测携带喹诺酮类耐药基因的铜绿假单胞菌的引物及其应用的制造方法与工艺
- 铜绿假单胞菌噬菌体裂解酶及应用的制造方法与工艺