结核分枝杆菌的聚合酶链反应引物和探针的制作方法
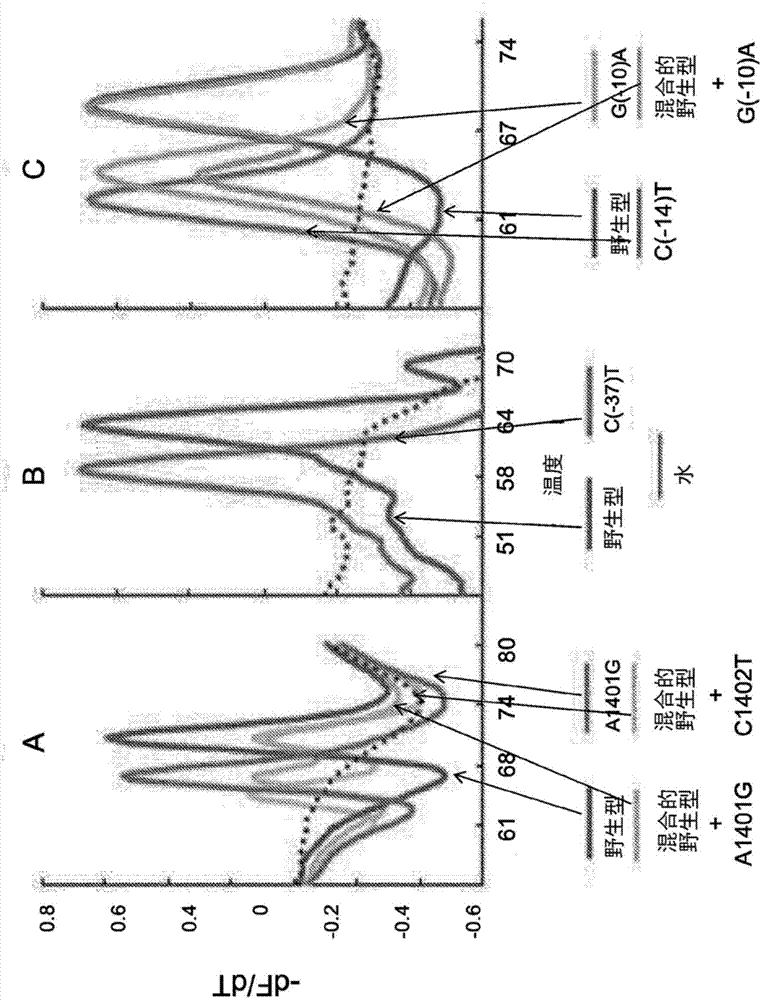
相关申请的交叉引用本申请要求2014年10月10日提交的美国临时专利申请号62/062,351的优先权,其公开内容通过引用并入本文。政府利益本文所披露的发明至少部分在使用来自美国国立卫生研究院的资助号u01ai082174和r01ai080653提供的政府支持下完成。因此,美国政府在本发明中具有一定的权利。发明领域本发明涉及用于扩增和检测结核分枝杆菌(mycobacteriumtuberculosis,m.tb)中不同基因的片段的新型引物和松散分子信标(sloppymolecularbeacon,smb)和分子信标(molecularbeacon,mb)探针,目的是鉴定m.tbdna的存在和鉴定对抗结核药物的耐药性。发明背景结核病(tb)在近二十年前被宣布为全球公共紧急事件(whoglobaltuberculosisreport2013)。尽管全球结核病新发病例有所下降,但到2015年将不可能实现减少50%疾病的千年发展目标(whoglobaltuberculosisreport2013)。多药耐药(mdr)和广泛耐药(xdr)tb的发病率增加是对这些减少目标的严重威胁(whoglobaltuberculosisreport2013)。mdrtb定义为对用至少利福平和异烟肼的治疗有耐药性的tb,xdrtb定义为对用氟喹诺酮类抗生素和可注射药物阿米卡星、卡那霉素和卷曲霉素的治疗有耐药性的mdrtb。耐药tb患者最好尽可快得到鉴定,以便可以迅速启动适当的感染控制和治疗。boehme,c.c.,et.al,2011,lancet377:1495-1505。由于结核分枝杆菌(mycobacteriumtuberculosis,mtb)的生长非常缓慢,传统的表型方法可能需要数周至数月才能完全定义这种细菌的耐药性模式(heifets,l.,etal.,jclinmicrobiol38:1227-1230;kim,s.j.,2005,eurrespirj25:564-569和pt,k.,andk.gp.,1985,publichealthmycobacteriology:aguideforleveliiilaboratory.centerfordiseasecontrol,u.sdepartmentofhealthandhumanservices,atltanta,georgia.)。分子测试给更快速的耐药检测带来了希望。mtb并不天然含有耐药质粒;因此,分子测试针对染色体dna。基因型测定相对容易设计,因为mtb基因组具有非常高的序列保守程度。几乎所有药物敏感的临床mtb分离物在耐药性靶中具有相同的dna序列,除了少数易于鉴定的“天然多态性”之外。因此,耐药靶基因中与野生型序列的任何差异都表明存在对相应药物的耐药性。基因型测定比表型测定更快速和灵敏,因为dna靶可以通过pcr扩增。可以通过早期杀死感染性生物体来减少生物危害。现在已经明确确定了tb中大多数耐药性的遗传靶。实时pcr仍然是检测细菌突变的最灵敏、快速和可靠的方法。几乎所有其他突变检测方法,包括pcr-ms、微阵列、迷你阵列和下一代测序,都需要核酸扩增作为检测过程的第一步。相比之下,实时pcr可以使样品扩增、检测和分析全部在单个孔中进行。管不必打开,不需要复杂的流体。然而,还没有人能开发出一种广泛的耐药性测试方法,该方法足够简单和稳健从而可在参考实验室之外进行。因此,需要用于检测m.tb和m.tb对最常用的第一和第二线药物的耐药性的新型引物和探针。发明概述本发明涉及检测m.tb和m.tb耐药性的引物、探针和相关用途。一方面,本发明提供了用于扩增选自rpob基因、gyra基因、gyrb基因、inha启动子、rrs基因、eis启动子、embb基因、katg基因、dosr基因、is6110基因、is1081基因组成的组的结核分枝杆菌区域的一部分的分离的寡核苷酸组或引物组。所述组包括对该部分特异的一对正向和反向引物,其中每个引物具有与选自从下表1a和1b中列出的寡核苷酸序列基本上相同的序列。因此,每个引物具有与选自所述表中列出的寡核苷酸序列的互补序列基本互补的序列。在一些实施方案中,引物的序列与选自表1a和1b中列出的寡核苷酸序列相同。第二方面,本发明提供了具有与选自从表2中列出的那些序列的一个基本上相同的序列的分离的核酸。在一些实施方案中,所述核酸包括选自表2所列的序列的序列。所述核酸可以在其两端分别用例如荧光团和猝灭剂进行标记,或者用与探针中的内部核苷酸连接的荧光团进行标记。荧光团的实例包括荧光素、花青5或德克萨斯红和tamra。猝灭剂的实例包括bhq1、bhq2和dabcyl。本发明提供了含有一种或多种上述寡核苷酸组和核酸的试剂盒。所述试剂盒还可以包括dna聚合酶、延伸核苷酸和缓冲液。第三方面,本发明的特征在于用于检测结核分枝杆菌耐药性的方法。该方法包括以第一引物对扩增第一核酸靶序列以产生第一扩增子的步骤,其中(i)第一引物对对于选自由rpob基因、gyra基因、gyrb基因、inha启动子、rrs基因、eis启动子、embb基因和katg基因组成的组的区域的一部分是特异性的,和(ii)每个引物具有与选自表1a和1b中列出的寡核苷酸序列基本上相同的序列,并检测第一扩增子中的突变。突变的存在指示了耐药性。在该方法中,检测步骤可以通过本领域已知的各种核酸检测技术进行,包括例如基于测序的技术和基于核酸或肽核酸探针杂交的技术。在一个实施方案中,检测步骤通过以下方法进行,该方法包括:(i)在有利于形成探针-靶杂交体的杂交条件下使第一扩增子与特异于突变的第一探针接触;(ii)进行熔解温度(tm)分析以确定探针-靶杂交体的测试tm值;和(iii)将测试tm值与预先确定的参考tm值进行比较。如果与预先确定的tm值不同,则测试tm值表示存在突变。例如,测试tm值具有远离参考tm值的至少3(例如3、4或5)个标准偏差的偏移表示存在突变。相反,测试tm值远离参考tm值小于3个标准偏差的的偏移表示不存在突变。如本文所公开的,预先确定的参考tm值可以是平均野生型tm值。在一个实例中,如果测试tm值低于预先确定的参考tm值,例如至少3个标准偏差,则表示存在突变。否则,如果不低于预先确定的参考tm值例如3个标准偏差,则测试tm值表示不存在突变。该方法还可以包括用第二引物对扩增第二核酸靶序列以产生第二扩增子,第二引物对对于选自由rpob基因、gyra基因、gyrb基因、inha启动子、rrs基因、eis启动子、embb基因和katg基因组成的组的第二区域的一部分是特异性的。在一些实施方案中,第一区域是rrs基因或eis启动子。例如,第一区域可以是rrs基因,第二区域可以是eis启动子。两个区域可以独立扩增或使用例如巢式pcr的技术在相同的反应体系中扩增。在这种情况下,突变可以是rrs基因中的a1401g或c1402t突变。突变可以位于由eis引物序列探询的eis启动子区内。上述方法可以检测针对选自由异烟肼、利福平、阿米卡星、卡那霉素、卷曲霉素、乙胺丁醇和氟喹诺酮类药物组成的组的药物的耐药性。引物对可以是选自表1a和1b中列出的引物对之一。探针可以具有与选自表2中列出的那些序列的一个基本上相同或完全相同的序列。第四方面,本发明提供了一种用于检测例如来自受试者的测试样品中结核分枝杆菌的存在的方法。该方法包括在有利于扩增反应的条件下使测试样品与第一引物对接触以产生第一扩增子,并检测扩增子的存在从而检测测试样品中结核分枝杆菌的存在。第一引物对可以是用于扩增选自由gyrb基因、inha启动子、eis启动子、embb基因、katg基因、dosr基因、is6110基因、is1081基因组成的组的结核分枝杆菌区域的一部分的寡核苷酸组。第一引物对的每个引物具有与选自表1b中列出的寡核苷酸序列基本上相同的序列。该方法还可包括在有利于扩增反应的条件下使测试样品或由第一引物对产生的扩增子与第二引物对接触以产生第二扩增子,并检测第二扩增子的存在。在这种情况下,第一扩增子和第二扩增子两者均存在时表示在测试样品中存在结核分枝杆菌。第五方面,本发明提供了用于检测测试样品中结核分枝杆菌的存在的另一种方法。该方法包括在有利于杂交反应的条件下将测试样品与第一分子信标探针接触以产生探针-靶杂交体,并检测探针-靶杂交体的存在,从而检测测试样品中结核分枝杆菌的存在。在该方法中,第一分子信标探针具有与从表2中列出的那些选择的序列基本上相同的序列。在实例中,第一分子信标探针选自由以下组成的组:is1081、dosr2和is6110探针(seqidno.67-69)。在下面的描述中阐述了本发明的一个或多个实施方案的细节。本发明的其它特征、目的和优点将从说明书和权利要求书中变得显而易见。附图简要说明图1是显示使用smb探针产生的三点tm谱在603个临床dna样品中检测amk和/或kan耐药性的图。在多重pcr反应中针对所有m.tbdna样品测试了三种测定smb中的每一种。每个样品的结果显示为x轴上的三点tm图,每个smb的tm值在y轴上表示。分离物从左到右排列为表型敏感的,然后为耐药的。在每个耐药分离物中可以看到来自三个探针中至少一个的不同的tm位移。图2a、2b和2c是显示三个smb探针的一阶导数熔解峰曲线的图。rrs-1400smb探针(2a)、eis1smb探针(2b)和eis2smb探针(2c)显示了野生型、突变体和混合dna样品的熔解峰曲线。每条熔解曲线代表个体株。图3是显示rrs和eis突变体和野生型株的mic值的图。显示rrs和eis突变体和野生型株对amk和kan的平均mic值。误差条表示mic值的±1个标准偏差。eis-p表示eis基因启动子。发明详述本发明是(至少部分地)基于用于扩增m.tb中11个不同基因的片段的新型引物、smb探针和mb探针的意想不到的发现,用于鉴定m.tbdna的存在和对抗结核病的药物如异烟肼、利福平、阿米卡星、卡那霉素、卷曲霉素、乙胺丁醇和氟喹诺酮类药物的耐药性。引物和探针这里描述了扩增rpob、gyra、gyrb、inha启动子区域、rrs、eis启动子区域、embb和katg基因的引物,可以实现m.tb.中耐药诱导的突变热点的灵敏扩增。相应的smb探针靶向并鉴别导致对最常用的一线和二线药物的耐药性的这些突变。这些引物可以在对称和不对称pcr测定中以非常高的效率使用。这里所述的引物和探针序列已经被本发明人用于开发用于m.tb的快速和准确的分子药物敏感性测试试验。除了它们在m.tb的分子诊断测定中的显著效用,这些引物还可用于对靶基因测序以在监测测定中鉴定诱导耐药性的突变和任何其他基于探针的测定,其旨在特异且灵敏鉴定m.tb中常见的诱导耐药的突变。扩增dosr、is6110和is1081基因的引物序列可以以高灵敏度和特异性鉴定m.tb,并且可以用于目的在于高特异性和灵敏度分子诊断结核分枝杆菌的任何pcr测定形式。下表中列出了本发明的示例性引物和探针。表1a表1b表2表2中的一个或多个探针序列可以以各种检测形式制备,例如双重标记探针,包括线性探针、taqman探针、分子信标探针和松散分子信标探针。“松散”探针是指具有错配容限的探针。在测定中的检测温度下,错配容限的探针与多于一个靶序列杂交并产生可检测的信号,并且如此形成的各种杂交体将具有不同的熔解点。线性或无规卷曲的单链探针通常是具有错配容限的。此类探针的实例是具有内部荧光部分的发夹或线性探针,其荧光水平在与一个或另一个目标链杂交时增加。参见例如美国专利号7662550和5925517。us20130095479。优选地,松散探针是双标记的发夹探针或分子信标探针,描述于美国专利号7662550和5925517中。这些发夹探针含有侧接彼此互补的一对臂的靶结合序列。它们可以是dna、rna或pna,或所有三种核酸的组合。此外,它们可以含有修饰的核苷酸和修饰的核苷酸连接。它们可以在一个臂上具有第一荧光团,而在另一个臂上可以具有第二荧光团,其中第二荧光团的吸收光谱基本上与第一荧光团的发射光谱重叠。最优选地,这种发夹探针是在一个臂上具有荧光团并且在另一个臂上具有猝灭剂的“分子信标探针”,从而在游离于溶液中时所述探针是黑暗的。它们也可以是波长位移的分子信标探针,例如一个臂上具有多个荧光团,其通过荧光共振能量转移(fret)相互作用,另一个臂上具有猝灭剂。靶结合序列可以是例如长度为12至50或25至50个核苷酸,并且杂交臂的长度可为4至10或4至6(例如5或6个)核苷酸。分子信标探针可以结合于引物,如美国专利号7662550和5925517和wo01/31062所述。因此,松散分子信标探针是指这样一类荧光标记的发夹寡核苷酸杂交探针。这样的探针在均一的测定中产生可检测的信号,也就是说,不需要分离与靶杂交的探针和未结合的探针。由于其能够结合给定靶序列的多于一个变体,所述探针可用于测定中以从目的核酸序列片段的许多可能的变体中检测一个变体的存在,或者甚至检测两种或更多种变体的存在。因此,探针可以在同一测定中以两种或更多种组合使用。因为它们的靶结合序列不同,它们对于不同变体的相对亲和力是不同的。例如,第一探针可以强烈结合野生型序列,中度结合第一等位基因,弱结合第二等位基因,而完全不结合第三等位基因;而第二探针可能弱结合野生型序列和第一变体,并中度结合第二变体和第三变体。其他松散探针由于不同的靶结合序列而将显示出不同的结合模式。因此,来自混合松散探针的组合的荧光发射光谱定义了不同的微生物株或种以及基因的等位变体/突变。由于在与不同dna序列结合后松散探针可重复发出不同强度的荧光,所以组合可用于在单个反应容器中识别多种病原体或变体的简单、快速和灵敏的核酸扩增反应测定(例如,基于pcr的测定)。但是应当理解,该测定也可以用在怀疑含有直接可检测量的未扩增靶核酸的样品上。该鉴定测定是基于分析一组部分杂交的松散信号传导探针的光谱,例如松散分子信标探针,其每个标记有发射不同最佳波长的光的荧光团,以产生种特异性或变体特异性dna序列的“特征谱”。使用探针,可以实现多重化,例如通过为每个靶设计区别等位基因的不同分子信标探针并对每个探针进行不同标记。(参见例如美国专利号7662550和5925517,wo01/31062和tyagietal.(2000)naturebiotechnology18:1191-1196)。区别等位基因的探针的混合物(每个探针包含多种颜色的等分试样)扩大了探针特征的数量。为此,具有独特熔解温度的每个分子信标-靶杂交体将在定义的温度以及探针和扩增子浓度下具有对应的唯一信号强度。因此,有限数量的松散探针可以用作在实时pcr反应中鉴定许多不同的可能靶序列的探针。可以在扩增之前、期间或之后将探针加入到扩增反应混合物中。参见美国专利号7662550。本发明还提供了含有用于进行上述方法(包括pcr和/或探针-靶杂交反应)的试剂的试剂盒。为此,本文公开的方法中的一种或多种反应组分,例如pcr引物、聚合酶和探针,可以以试剂盒的形式提供使用。在此类试剂盒中,在一个或多个容器中提供适量的一种或多种反应组分或将其保持在基材上。该试剂盒还含有用于实施上述方法的其他材料。在一些实施方案中,试剂盒含有用于实施使用本发明引物和/或探针的方法的试剂、材料中的一些或全部。试剂盒的一些或全部组分可以提供在与含有本发明的引物和/或探针的容器分开的容器中。试剂盒的其它组分的实例包括但不限于一种或多种不同的聚合酶、一种或多种对照试剂(例如探针或pcr引物或对照模板)和用于反应的缓冲液(1x或浓缩形式)。试剂盒还可以包括一种或多种以下组分:载体、终止、修饰或消化试剂、渗透剂和用于检测的装置。所使用的反应组分可以以各种形式提供。例如,组分(例如酶、探针和/或引物)可以悬浮在水溶液中,或为冷冻干燥或冻干的粉末、丸粒或珠粒。在后一种情况下,组分在重构时形成用于测定的组分的完全混合物。本发明的试剂盒可以在任何合适的温度下提供。例如,为了储存在液体中含有蛋白质组分(例如酶)的试剂盒,优选将其提供并保持在低于0℃,优选在-20℃或低于-20℃,或以其他方式处于冷冻状态。本发明的试剂盒或系统可以含有足以用于至少一种测定的量的本文所述组分的任何组合。在一些应用中,一个或多个反应组分可以以预先测量的单次使用量在单独的(通常为一次性的)管或相当的容器中提供。通过这样的配置,可以通过将靶核酸或含有靶核酸的样品/细胞直接添加到各个管中来进行pcr反应。试剂盒中提供的组分的量可以是任何适当的量,并且可能取决于产品所针对的目标市场。供应组分的容器可以是能够保持供应形式的任何常规容器,例如微量离心管、安瓿、瓶或一体式测试装置,例如流体装置、筒、侧向流或其他类似设备。试剂盒还可以包括用于容纳容器或容器组合的包装材料。用于此类试剂盒和系统的典型包装材料包括将反应组分或检测探针保持在各种构型中(例如,在小瓶、微量滴定板、微阵列等中)的固体基材(例如,玻璃、塑料、纸、箔、微粒等)。试剂盒还可以包括用于组分的使用的有形形式记录的说明书。定义核酸是指dna分子(例如但不限于cdna或基因组dna)、rna分子(例如但不限于mrna)或dna或rna类似物。dna或rna类似物可以从核苷酸类似物合成。核酸分子可以是单链或双链的。“分离的”核酸是这样的核酸,其结构与任何天然存在的核酸或天然存在的基因组核酸的任何片段的结构不同。因此,该术语涵盖例如(a)dna,其具有天然存在的基因组dna分子的一部分的序列,但没有侧接在天然存在所述分子的部分的生物体基因组中侧接其的两个编码序列;(b)核酸,其被以某种方式引入到载体或原核生物或真核生物的基因组dna中从而使所得分子与任何天然存在的载体或基因组dna不同;(c)分开的分子,如cdna、基因组片段、通过pcr产生的片段或限制性片段;和(d)重组核苷酸序列,其作为杂交基因(即编码融合蛋白的基因)的一部分。如本文所用,术语“靶核酸”或“靶”是指含有目的靶核酸序列的核酸。靶核酸可以是单链或双链的,并且通常是双链dna。“靶核酸序列”、“靶序列”或“靶区域”是指包含单链核酸的全部或部分序列的特异性序列。靶序列可以在核酸模板内或细胞的基因组内,其可以是任何形式的单链或双链核酸。模板可以是纯化的或分离的核酸,或可以是非纯化的或非分离的。如本文所使用的“互补”序列可以包括watson-crick碱基对(例如,at/u和cg)、非watson-crick碱基对和/或从非天然和修饰的核苷酸形成的碱基对,或完全由其形成,只要满足上述关于其杂交能力的要求。完全互补可能表示核酸分子的核苷酸或核苷酸类似物之间的100%(完全)互补或基本上互补的碱基配对。“基本上互补”是指核酸或寡核苷酸具有至少10个连续碱基的序列,其相对靶核酸序列中至少10个连续碱基至少80%(例如85%、90%、95%、96%、97%、98%、99%和100%),使得该核酸或寡核苷酸可以在例如pcr反应的退火条件或探针-靶杂交条件下与该靶核酸序列杂交或退火。序列之间的互补性可以表示为在所比较的每组至少10个连续碱基中的碱基错配数量。术语“基本上相同”是指第一核酸与第二核酸至少80%(例如85%、90%、95%、96%、97%、98%、99%和100%)互补,使得第一核酸在pcr退火或探针-靶杂交条件下基本上与第二核酸的互补物互补并且能够杂交。“杂交”或“退火”是指完全或部分互补的核酸链在指定的杂交条件下以平行或优选反向平行取向一起形成稳定的双链结构或区域(有时称为“杂交体”或“双链体”或“茎”),两个组成链在其中通过氢键连接。虽然氢键通常在腺嘌呤和胸腺嘧啶或尿嘧啶(a和t或u)或胞嘧啶和鸟嘌呤(c和g)之间形成,但其他碱基对也可能形成(例如adamsetal.,thebiochemistryofthenucleicacids,11thed.,1992)。“核酸双链体”、“双链体”、“茎”、“核酸杂交体”或“杂交体”是指包含双链、氢键合区域的稳定核酸结构,例如rna:rna、rna:dna和dna:dna双链体分子及其类似物。这样的结构可以通过任何已知的手段来检测,例如通过使用标记的探针、对其表面质量变化敏感的光学活性探针包被的基质(美国专利号6,060,237)或结合剂(美国专利号5,994,056)。如本文所用,术语“扩增”及其变体包括用于产生多核苷酸的至少一部分的多个拷贝或互补序列的任何方法,所述多核苷酸通常称为“模板”。模板多核苷酸可以是单链或双链的。模板可以是纯化的或分离的核酸,或可以是非纯化的或非分离的。给定模板的扩增可导致产生一组多核苷酸扩增产物,统称为“扩增子”。扩增子的多核苷酸可以是单链或双链的,或两者的混合物。通常,模板将包括靶序列,并且所得扩增子将包括具有与靶序列基本上相同或基本上互补的序列的多核苷酸。在一些实施方案中,特定扩增子的多核苷酸彼此基本上相同或基本互补;或者,在一些实施方案中,给定扩增子内的多核苷酸可以具有彼此不同的核苷酸序列。扩增可以以线性或指数方式进行,并且可以包括给定模板的重复复制和连续复制以形成两个或多个扩增产物。一些典型的扩增反应包括连续且重复个循环的基于模板的核酸合成,导致形成多个子多聚核苷酸,所述子多聚核苷酸含有模板核苷酸序列的至少一部分并与模板具有至少一定程度的核苷酸序列同一性(或互补性)。在一些实施方案中,核酸合成的每个过程(可被称为扩增的一个“循环”)包括产生游离的3’末端(例如,通过切割dsdna的一条链),从而产生引物和引物延伸步骤;任选地,还可以包括另外的变性步骤,其中模板部分或完全变性。在一些实施方案中,一轮扩增包括单个扩增周期的给定数量的重复。例如,一轮扩增可以包括特定周期的5、10、15、20、25、30、35、40、50次或更多次重复。在一个示例性实施方案中,扩增包括其中特定多核苷酸模板经受两个连续循环的核酸合成的任何反应。合成可以包括模板依赖性核酸合成。本发明的扩增还可以包括等温扩增。术语“等温”是指在基本恒定的温度下进行反应,即不改变发生核酸聚合反应的反应温度。等温扩增反应的等温温度取决于反应中使用的链置换核酸聚合酶。通常,等温温度低于主要反应产物的熔解温度(tm;混合物中潜在双链分子的一半处于单链、变性状态的温度),即一般为90℃或低于90℃,通常为约20℃~75℃,并且优选为约30℃~60℃,更优选为约37℃。术语“引物”或“引物寡核苷酸”是指这样的核酸链或寡核苷酸链的,其能够与模板核酸杂交,并且根据模板核酸的组成掺入延伸核苷酸用于核酸合成的起始点。“延伸核苷酸”是指在扩增期间能够掺入延伸产物的任何核苷酸(例如dntp)及其类似物,即dna、rna或dna或rna的衍生物,其可包含标记。如本文所用,术语“寡核苷酸”是指短多核苷酸,通常长度小于或等于300个核苷酸(例如,长度在5和150个核苷酸的范围内,优选在10至100个核苷酸的范围内,更优选在15至50个核苷酸的范围内)。然而,如本文所用,该术语还旨在涵盖更长或更短的多核苷酸链。“寡核苷酸”可以与其它多核苷酸杂交,因此用作多核苷酸检测的探针,或用于多核苷酸链延伸的引物。本文使用的术语“探针”是指能够通过一种或多种类型的化学键,通常通过互补碱基配对,通常通过形成氢键,而与互补序列的靶核酸结合的寡核苷酸。根据杂交条件的严格性,探针可以结合与探针序列不完全互补的靶序列。可能存在任何数量的碱基对错配,其将影响本文所述的靶序列与单链核酸之间的杂交。然而,如果突变的数量如此之大而使得即便在最不严格的杂交条件下也不会发生杂交,则该序列不是互补靶序列。探针可以是单链或部分单链和部分双链。探针的链的形式由靶序列的结构、组成和性质决定。探针可以用标记物直接标记或间接标记,例如用可能随后结合链霉亲和素复合物的生物素标记。术语“检测探针”是指具有这样序列的寡核苷酸,该序列与其靶序列的互补性足以在严格杂交条件下形成稳定用于检测的探针:靶杂交体。探针通常是合成寡聚物,其可以包括与目标区域外的序列互补的碱基,其不会在严格的杂交条件下阻止与靶核酸杂交。与靶不互补的序列可以是均聚物段(tract)(例如,多聚a或多聚t)、启动子序列、限制性内切核酸酶识别序列或赋予所需二级或三级结构的序列(例如,催化位点或发夹结构)或可以促进检测和/或扩增的标签区域。“稳定”或“稳定用于检测”是指反应混合物的温度比混合物中所含核酸双链体的熔解温度(tm)低至少2℃,更优选比tm低至少5℃,甚至更优选比tm低至少10℃。“标记”或“报道分子”是用于标记核酸(包括单个核苷酸)、多核苷酸、寡核苷酸或蛋白质配体(例如氨基酸或抗体)的化学或生物化学部分。实例包括荧光剂、化学发光剂、显色剂、猝灭剂、放射性核苷酸、酶、底物、辅因子、抑制剂、磁性颗粒和本领域已知的其它部分。标记或报道分子能够产生可测量的信号,并且可以共价或非共价连接到寡核苷酸或核苷酸(例如,非天然核苷酸)或配体。如本文所用,术语“接触”及其变体当用于任何组分的组时,包括将待接触的组分混合到同一混合物中的任何过程(例如,加入到相同的隔室或溶液中)并且不一定需要所述组分之间的实际物理接触。所述组分可以以任何顺序或任何组合(或亚组合)接触,并且可以包括其中一个或一些所述组分随后从混合物中除去的情况,任选地在添加其它所述组分之前。例如,“将a与b和c接触”包括以下任何一种或全部情况:(i)a与c混合,然后将b加入混合物中;(ii)将a和b混合成混合物;从混合物中除去b,然后将c加入到混合物中;和(iii)将a加入到b和c的混合物中。将靶核酸或细胞与一种或多种反应组分如聚合酶、引物组或探针接触包括任何或全部以下情况:(i)使靶或细胞与反应混合物的第一组分接触以产生混合物;然后将该反应混合物的其它组分以任何顺序或组合加入混合物中;和(ii)在与靶或细胞混合前完全形成反应混合物。本文所用的术语“混合物”是指元素(element)的组合,其是散布的且没有任何特定顺序。混合物是异质的,并且不能在空间上分离成其不同的成分。元素的混合物的实例包括溶解在同一水溶液中的许多不同元素,或随机地或以不以特定顺序连接到固体支持物上的许多不同元素,其中所述不同的元素在空间上是不同的。换句话说,混合物是不可寻址的。如本文所用,术语“受试者”是指具有基因组的任何生物体,优选活体动物(例如哺乳动物),其已经是诊断、治疗、观察或实验的对象。受试者的实例可以是人、牲畜(肉牛和奶牛、绵羊、家禽、猪等)或伴侣动物(狗、猫、马等)。本文所用的“样品”是指从生物体(例如患者)获得的或从生物体的组分(例如血液)获得的任何生物流体或组织。样品可以是任何生物组织、细胞或液体的样品。样品可以是来自受试者的“临床样品”,例如来自人类患者或兽医学的受试者。有用的生物样品包括但不限于患者或受试者的全血、唾液、尿液、滑液、骨髓、脑脊液、阴道粘液、宫颈粘液、鼻分泌物、痰液、精液、羊水、支气管肺泡灌洗液和其他细胞渗出液。此类样品还可用盐水、缓冲液或生理上可接受的稀释剂稀释。或者,通过常规方法浓缩此类样品。生物样品还可以包括组织切片,例如用于组织学目的的冷冻切片。生物样品也可以称为“患者样品”。生物样品还可以包括基本上纯化或分离的蛋白质、膜制备物或细胞培养物。术语“确定”、“测量”、“评估”和“测定”可互换使用,包括定量和定性测量,并且包括确定特性、性状或特征是否存在。评估可以是相对的或绝对的。评估靶的存在包括确定存在的靶的数量,以及确定其是否存在或不存在。如本文所用,术语“参考”值是指当与测定结果相比时在统计学上与特定结果相关的值。在优选实施方案中,参考值可以通过检查野生型值的平均值的统计分析来确定。参考值可以是阈值分数值或截断分数值。通常,参考值将是这样一个阈值:一个结果更可能比其高(或低),且一个替代结果更可能比其低。如本文所公开的,值的差异表示病原体(例如结核分枝杆菌)或突变的存在或不存在。短语水平或值的“差异”是指与对照或参考水平或值相比,样品中的分析物(例如,探针-靶杂交体)的变量(例如,tm)的差异。在一个实施方案中,值或水平的差异可能是与对照相比样品中存在的分析物的量之间的统计学显著性差异。例如,如果测量的分析物水平落在任何对照组或参照组平均值的约1.0、2.0、3.0、4.0或5.0个标准偏差之外,则差异是统计学显著的。如本文所公开的,提供了许多值的范围。应当理解,除非上下文另有明确规定,否则也具体披露了在该范围的上限和下限之间的每个中间值(至该下限单位的十分之一)。在所述范围内的任何所述值或中间值和在该范围内的任何其它所述或中间值之间的每个较小范围包含在本发明内。这些较小范围的上限和下限可以独立地包括或排除在该范围内,并且两个限中的任一个都包括或两个限都不包括或两个限都包括在较小范围内的的每个范围也包括在本发明内,在所述范围中可以任何特定排除限制。在所述范围包括两个限之一或二者的情况下,排除这些所包括的限之任一或二者的范围也包括在本发明中。术语“约”通常是指所示数字的正负10%。例如,“约10%”可能表示9%至11%的范围,“约20”可能意味着从18-22。“约”的其他含义可以从上下文中显而易见,例如四舍五入,因此,例如“约1”也可以是0.5至1.4。用途最近描述了两种独立的smb测定,其快速可靠地鉴定了主要负责利福平和氟喹诺酮(fq)耐药性的m.tb突变(chakravorty,s.,b.etal.,2011,jclinmicrobiol49:932-940;chakravorty,s.,h.,etal.,2012,jclinmicrobiol50:2194-2202)。本文公开的测定具有采取实时pcr形式的优点,使得它们易于使用且不受扩增子交叉污染的影响。此外,突变检测已被证明是稳健的,并且适合高通量测试。以下实施例提供了一种smbtb耐药检测测定系统,增加了能够检测对amk和kan的耐药性的测定。还探讨了本文公开的测定与表型敏感性测试方法之间不一致的原因。结果表明,一些最常用的表型方法可以错过了具有赋予耐药性的突变的m.tb分离物,如果这些突变仅中度地增加对kan的最小抑制浓度(mic)。还发现了whib7中与低水平kan耐药性相关的新突变。如本文所公开的,多重的smbpcr和熔解测定准确地鉴定了与对amk和/或kan的耐药性相关的rrs基因和eis启动子中的突变。当针对ntm、革兰氏阳性和革兰氏阴性细菌进行测试时,该测定不产生假耐药性结果。当存在异耐药性(hetero-resistance)时,通过测定也检测到大多数异耐药性情况。与mtbdrsl平台不同,该测定可以在封闭的实时pcr系统中进行,并且可以容易地适应于高通量测试,因为所有测定步骤都在384孔板中进行。smb测定还避免了与替代突变检测方法相关的潜在问题。高分辨率熔解曲线分析需要能够检测熔解曲线的微小变化(yadav,r.,s.,etal.,2012,japplmicrobiol113:856-862)。其他基于pcr后熔解的分子测定必须通过解码复杂的荧光轮廓来检测突变(rice,j.e.,etal.,2012.nucleicacidsres40:e164.)相比之下,smb测定产生清晰易鉴别的tm峰和明确的tm移位以鉴定目的突变。单个tm值也可用于具有相同基因型的聚类样品。如本文所公开的,在603个临床样品的组中进行测试,所述样品代表两种新的tb病例以及未解决的再治疗病例,并评估了靶向突变与临床分离物的敏感谱图的关系。观察到100%具有rrsa1401g突变的分离物与对amk和kan两者的高水平耐药性具有强相关性。然而,eis启动子突变仅导致中等至低水平的kan耐药性以及对amk无耐药性,这与以前的研究一致(campbell,p.j.,etal,2011,antimicrobagentschemother55:2032-2041;zaunbrecher,m.a.,etal.,2009,procnatlacadsciusa106:20004-20009)。这里的研究还表明,用于敏感性测试的lj绝对浓度法不能适当地检测中等至低水平的kan耐药性。事实上,近三分之二的具有eis启动子突变的样品在lj培养基中被检测为kan敏感的。然而,通过mgit方法,具有eis启动子突变的所有样品除了一个之外都被检测为抗kan抗体。两个这样的分离物含有eisc(-12)t突变。当通过mycotb进行测试时,这些突变体对kan也具有耐药性,其显示出5μg/ml的kanmic。以前的研究表明,具有c(-12)t突变的临床分离物与kan耐药性不相关(zaunbrecher(2009)或相关性较差(campbell,2011;hoshide,m.,l.etal.,2014,jclinmicrobiol52:1322-1329.)。因为用于确定表型敏感性的测试方法,这些研究可能错过了这种突变与低水平kan耐药性之间的关系。这些结果表明,mgit或mycotb方法应优选用于测试对kan的表型耐药性。他们还强调了基因型耐药性测试的能力,例如本文所公开的,用于检测导致低水平耐药性并且仅通过表型检验可能错过的突变(rigouts,l.,m.etal.,2013,jclinmicrobiol51:2641-2645;sirgel,f.a.,etal.,2012,microbdrugresist18:193-197和vandeun,a.,etal.,2013,jclinmicrobiol51:2633-2640)。这里的研究设置包括一个样本,它是rrs野生型和rrsc1402t突变体的混合物。该样品在lj培养基中对amk和kan二者是敏感的。据报道具有c1402t突变的分离物对amk敏感,但对kan有耐药性(maus,c.e.,etal.,2005,antimicrobagentschemother49:3192-3197)。在这种特定情况下,使用lj培养基的重复敏感性测试显示对kan的敏感性,可能是因为样品的异质耐药性。在这里,分子测定比表型测定更好地预测潜在出现的耐药性,因为smb测定清楚地检测到野生型和突变型dna类型两者的存在。具有amk或kan耐药性的临床株中rrs1484突变的发生率非常低(georghiou,s.b.,etal.,2012,plosone7:e33275),这使其临床意义存在争议。针对rrs1484密码子的单独版本的测定在研究中没有检测到603个分离物以及额外的来自newjersy-newyork地区的259个分离物(其中包括33个amk和kan耐药性分离物)中任一个中的任何突变。通过sanger测序证实,在这个扩大的研究组中缺乏任何rrs1484突变(数据未显示)。鉴于rrs1484突变的非常低的流行率,该密码子在预测氨基糖苷耐药性方面不太可能提供很大的价值。因此,推荐氨基糖苷类耐药性的分子检测仅靶向rrs基因中的1401-1402个密码子。发现22个amk或kan耐药性样品在rrs基因和eis启动子区域具有野生型序列。最近的一项研究通过在具有不明原因的kan耐药性的单个临床株中鉴定出5’utrwhib7突变,显示了whib7的5’utr突变和kan耐药性之间的可能关联(reeves,a.z.,etal.,2013,antimicrobagentschemother57:1857-1865)。还描述了与kan耐药性相关的几种新的5’utrwhib7突变以及缺失。在具有野生型rrs、eis启动子区域的其余15-20%的临床株中,没有鉴定到可以解释kan和amk耐药性的合适的通用生物标志物。含有野生型rrs基因和eis启动子区dna并混合了来自kan或amk耐药性亚群的痕量突变体靶的样品也可以说明在本文公开的表型耐药性测试和smb测定之间的剩下的不一致。然而,昂贵的异质耐药性研究超出了本研究的范围。一些最近的研究表明,ppe60和rv3168基因可能参与不明原因的kan耐药性(farhat,m.r.,etal.,2013.natgenet45:1183-1189;zhang,h.,etal.,2013,natgenet45:1255-1260),尽管这在临床环境中仍有待验证。总之,开发了一种灵敏且特异的检测方法,用于检测m.tb中的amk和kan耐药性,并在具有高mdr和xdrtb流行率的临床分离物中得到验证。结果表明,rrsa1401g突变编码对amk和kan两者的高水平的交叉耐药性,并且eis启动子突变编码中等至低水平的kan耐药性,这与以前的功能基因组学研究一致(zaunbrecher2009)。将本文公开的测定方法与固体和液体培养基中的三种不同表型敏感性测试方法的性能进行比较,显示由eis启动子突变引起的低至中等水平的kan耐药性在很大程度上被基于lj的敏感性测试所错过。这些结果引起了对基因型测试检测氨基糖苷类耐药性的价值产生强烈争议,并且结果表明本文公开的基于smb的测定的具体用途。实施例实施例1该实施例描述了在以下实施例2-7中使用的材料与方法。dna样品m.tb测试样品由分离自韩国昌源马山国家医院(nationalmasanhospital,changwon,republicofkorea)的mdr结核病自然历史研究(clinicaltrials.gov的nct00341601)中参与的503名患者培养的603个顺序m.tb分离物的dna组成。两个队列进行了测试。队列a由未经治疗的新怀疑的结核病例(treatmentnewlysuspectedtbcases)组成(158个样品)和队列b由再治疗的tb病例组成(445个样品)。在治疗开始时从每个患者收集新鲜的痰样品,并培养m.tb。在一个患者子集中,在治疗的第1个月、第4个月和第6个月收集重复痰样品,并也培养m.tb。如前所述(chakravorty,s.,2012.jclinmicrobiol50:2194-2202),非结核分枝杆菌(ntm)和革兰氏阳性菌和革兰氏阴性细菌测试样品取自newjerseymedicalschool(njms)dna储存库。表型药物敏感性测试在韩国国家结核病研究中心(ternationaltuberculosisresearchcenter(itrc),southkorea),在lj培养基上通过绝对浓度法对所有603个分离物进行表型药物敏感性测试,以确定对amk和kan的敏感性(对两种抗生素使用40μg/ml的临界浓度(2012年分离物测试时使用的标准浓度)(jnawali,hn,2013,diagnmicrobiolinfectdis76:187-196))。如前所述(lee,j.,2014,antimicrobagentschemother58:11-18),还使用trekmycotbmic板(“mycotb”;trekdiagnosticsystems,cleveland,ohio,usa)来评估173/603个样品对amk和kan的mic。对于560/603个样品,还使用分枝杆菌生长指示管(mgit)系统(bectondickinson,franklinlakes,nj,usa)以2.5μg/ml的临界浓度评估对kan的耐药性。对于表型敏感性测试结果与目标基因的sanger测序结果不一致的样品,重复表型敏感性测试以确认初步发现。在mgit和lj敏感性测试结果显示不一致的情况下,重复两种测定以确认或纠正初始发现。dna制备和测序通过在0.1%的tritonx100存在下在200μl的instagenematrix树脂(bio-radlaboratories,herculescalifornia,usa)中将一接种环量培养物煮沸10-15分钟,从培养的分离物中制备用于smb测试和sanger测序二者的dna。离心后回收上清液,并使用nanodrop微体积分光光度计(thermofisherscientific,waltham,massachusetts,usa)进行定量。对于sanger测序,使用0.5μm的正向和反向引物、1xpcr缓冲液、250mmdntp、2.5mmmgcl2和0.03u/μl的amplitaqgolddna聚合酶(appliedbiosystems,fostercity,california,usa),根据以下参数:初始在95℃变性10分钟,随后40个循环的95℃10s、58-60℃30s和72℃10-30s(取决于扩增子大小),扩增rrs基因的两个不同片段(核苷酸420-980和1293-1537)和eis编码区上游部分整个eis启动子。如前所述(10、33),扩增eis启动子区域和rrs基因片段。对于一个样品子集,使用引物whib7f5’aaacgcgcaggtcagaaaat3’和whib7r5’cagtgtcttggctacctcga3’(seqidno:70和71)扩增来自whib7基因的538bp片段,包括5’非翻译区的412bp和来自orf的126bp。另外,还使用引物whib7-ingene-f5’gtcggtactgacagtcccc3’和whib7-ingene-r5’atgcaacagcatccttgcg3’(seqidno:72和73)扩增了来自whib7基因的275bp片段(包含几乎整个whib7orf)。根据制造商的说明书,使用bigdyeterminator,3.1版循环测序试剂盒(appliedbiosystems),在3130xlgeneticanalyzer(appliedbio-systems,fostercity,california,usa)中使用基因特异性正向和反向引物对pcr产物进行双向测序。测定分子信标和引物smb测定靶向rrs基因的密码子1401和1402中的m.tb突变和沿eis基因的启动子区域的突变。使用引物amg-f(5’-gctagtaatcgcagatcagcaacgctgc-3’,seqidno:51)和amg-r(5’-cctcccgagggttaggccact-3’,seqidno:52)从rrs基因扩增113bp片段(核苷酸1335-1451),并且使用引物eis-f(5’-cacagggtcacagtcacagaatc-3’,seqidno:18)和eis-r(5’-gcatcgcgtgatcctttgccagac-3’,seqidno:53)扩增包含eis基因的启动子区和初始五个密码子的98bp片段(核苷酸-81至17)。rrs引物设计为特异针对分枝杆菌属,并且eis引物设计为特异针对m.tb复合体。一个smb探针rrs-1400(5’-6羧基荧光素-cacgaccgcccgtcacgtcatgaaagtcggtcgtg-bhq1-3’,seqidno:59)和两个smb探针eis-1(5’-花青5-caggcggtcgtaatattcacgtgcacctggccgccgcctg-bhq2-3’,seqidno:16)和eis-2(5’-德克萨斯红-ctcgcggcatatgccacagtcggattctctgacgcgag-bhq2-3’,seqidno:61)(其中加下划线的序列表示smb的茎部分,bhq表示黑洞猝灭剂)分别靶向针对rrs基因和eis启动子区。rrs探针设计为与反义链互补,而eis探针设计为与有义链互补。使用位于http://mfold.rna.albany.edu/?q_mfold/dna-folding-form的计算机(insilico)dna折叠程序设计smb,位于http://mfold.rna.albany.edu/?q_dinamelt/two-state-melting的探针靶混合体折叠程序用于预测可能的探针-靶杂交体结构和熔解温度(tm)。设计探针以在其各自的靶区域中产生野生型和突变体序列之间的最大tm差异,以使得能够毫无疑义地鉴定突变。引物获得自sigmaaldrich(st.louis,missouri,usa),而smb探针获得自biosearchtechnologies(novato,california,usa)。测定步骤所有样品均独立编码并随机分布,以确保以盲法方式进行测定验证。该测定在韩国马山itrc(itrc,masan,southkore)和新泽西医学院(newjerseymedicalschool(njms),rutgers,newark,newjersey)的两个地方进行了测试。一旦完成了整个603个样品集的测试,对样品进行了解码,并将pcr结果与相应的测序和表型药物敏感性测试结果进行比较。还比较了每个地点获得的结果。测定结果没有报告给治疗医师,并且没有用来指导任何治疗决定。使用rochelightcycler480ii实时pcr系统(rochediagnosticsco.,indianapolis,indiana,usa)在384孔板中在含有用于rrs基因的100nm正向引物和1μm反向引物和用于eis启动子区的1μm正向引物和50nm反向引物、1ng/μl的rrs-1400和eis-1探针和0.8ng/μl的eis-2探针、4mmmgcl2、250mm脱氧核苷三磷酸(dntp)、1xpcr缓冲液、8%甘油、0.06u/μl的tfiexo(-)dna聚合酶(lifetechnologies,grandisland,newyork,usa)和2至5ng的样品dna或等量的水的20μl反应体积中进行pcr。按如下步骤进行pcr:酶在95℃下活化2分钟,然后进行50个循环:在95℃变性10秒以及在67℃下进行退火和延伸30秒。pcr循环后,通过在95℃变性2分钟、然后冷却至45℃、然后逐渐加热至85℃进行pcr后-tm分析,在该过程中以1个数据采集/摄氏度的速率连续监测荧光。使用tm调用软件(lightcycler480软件)在反应结束时鉴定tm值。然而,每个tm还由训练有素的观察者进行验证,之后完成tm值的最终鉴定。对应于野生型和突变体tm的任何探针显示不同双峰的样品被认为是指示异质耐药性(hetero-resistance)。在每个测定板中还包括使用无菌水代替dna作为模板的无模板对照被用作dna阴性对照,以及使用来自m.tbh37rv的1ng基因组dna作为模板的dna阳性对照。人类受试者批准本研究由nationalmasanhospital,niaid和rutgers(以前的umdnj)机构审查委员会批准,并且所有受试者都提供书面知情同意书(rutgersirb协议号0120090104)。实施例2.鉴定与野生型和突变体序列相关的tm值本文公开的基于smb的测定通过寻找已知与耐药性相关的m.tbrrs基因和eis启动子中的突变来检测对amk和kan的耐药性。该测定由在存在与rrs和eis靶扩增子的部分互补的smb探针的情况下进行的pcr步骤以及随后的tm分析组成。本发明人首先评估了测定试验用于鉴定人工寡核苷酸以及来自所选野生型和突变体m.tb株的测序dna模板上的靶突变的能力(数据未显示)。通过野生型靶的已知平均值的1℃内的tm值的存在,来鉴定野生型序列。通过距离野生型平均tm值至少五个标准偏差的tm值的偏移,来鉴定突变体序列。然后在临床dna样品上评估测定试验检测与amk和kan耐药性相关的最常见突变的能力。在一组603个临床样品(由测定靶中具有野生型序列的487个样品和具有突变的116个样品组成)进行测试。这些样品中的5个具有在sanger测序中检测到的野生型dna和突变体dna二者的混合物。smb测定将115/116个(99%)突变体或混合样品(含有突变体和野生型dna的异质样品)正确鉴定为突变体或混合型,并且将487/487个(100%)野生型样品正确鉴定为纯野生型。通过本文公开的测定将单一混合样品(如sanger测序所示)鉴定为野生型样品。在野生型或突变体靶的设置中,每个smb探针产生的tm值是高度可重复的。对于野生型靶,rrs-1400、eis-1和eis-2的平均tm值分别为70.1±0.15℃、63.9±0.19℃和69±0.23℃(表3)。对于突变体tm靶(a1401g和c1402t),突变导致探针rrs-1400的tm值分别降低3.9℃(±0.17)和5.6℃(±0.21)(表3)。类似地,eis-1和eis-2探针通过突变体tm值与野生型预期的tm值相比降低4.3℃至6.5℃,而稳健地将eis启动子区域中的一系列突变检测为突变(表3)。对于检测为野生型和突变体以及混合物的所有样品,在rutgers和itrc的两个不同实验室进行的pcr测定完全一致。测定结果使我们能够将603个样品根据其各自的三点tm模式清楚地分为野生型和突变体tm簇类型(图1)。该测定正确地鉴定了仅含有a1401g突变的所有75个样品中的突变(表3、图2的图a)。基于双tm峰的存在,还将含有a1401g和野生型序列的混合物的四个样品中的三个检测为野生型/突变体混合。还通过双重tm峰的存在,将鉴定了含有c1402t突变和野生型dna的混合物的单个样品与具有c1402t突变特异性突变tm的样品(表3、图2的图a)。具有eis启动子区突变的32个样品包括五个不同的多态性(位置-8、-10、-12、-14和-37)。所有这些突变都被eissmb中的任一个成功地检测到(表3、图2的图b和c)。在rrs基因和eis启动子区二者中具有突变的四个样品也被正确检测为双突变体(表3)。rrs基因的测序没有鉴定出任何具有密码子1484突变的样品,而不管其药物敏感性模式如何。实施例3.阿米卡星耐药性鉴定在该实施例中,进行测定以评估分子测定相对于表型药物敏感测试结果的性能。基因型药物敏感性测试的表观表现可以根据选择用于包含在测试中的突变和用作金标准的表型测定而变化(kim,s.j.2005eurrespirj25:564-569;rigouts,l.,etal.,2013,jclinmicrobiol51:2641-2645;以及vandeun,a.,etal.,2013,jclinmicrobiol51:2633-2640)。考虑到基于lj的药物敏感性测试方法作为金标准(对所有603个研究样品进行),a1401g突变的rrssmbtm特征将82/90个amk耐药性样品归类为有耐药性(敏感性为91.1%;95%ci,82.8%至96.8%)。野生型tm将512/513个amk敏感样品归类为敏感型。由于存在由rrssmb探针产生的清晰的双峰(对应于野生型tm和具体的c1402t突变体tm),通过本文公开的smb测定,将513个amk敏感分离物中的单个分离物鉴定为野生型和c1402t突变体dna的混合物(图2的图a)。这也通过sanger测序证实。由于以前的研究已经表明c1402t突变不编码amk耐药性(24),因此与c1402t突变相对应的具体tm可考虑为amk敏感性的指标。该考虑导致本文公开的测定正确检测513/513个amk敏感样品,导致特异性为100%(95%ci,99至100%)。在分析中包括eis启动子区域突变的tm值特征没有提高amk耐药性检测的灵敏度,但是将特异性从100%降低到93.8%(95%ci,91.2至95.6%)。这些结果与以前的报告一致,其表明eis启动子突变与lj药物敏感性测试定义的amk耐药性无关(campbell2011和zaunbrecher2009)。实施例4.卡那霉素耐药性鉴定针对所有603个样品,还使用基于lj的药物敏感性测试作为金标准来评估检测kan耐药性测定试验的性能。使用由本文公开的rrssmb产生的典型地针对a1401g或c1402t突变的tm值定义耐药性,该测定检测到82/106个样品为kan耐药性(灵敏度为77.4%;95%ci为68.0至84.7%)。相反,使用野生型靶标的rrssmbtm特征来定义敏感性,将496/497个kan敏感样品鉴定为敏感的(表4)(特异性99.8%;95%ci,98.7至100%)。将eis启动子区域突变的两个eissmb的tm值特征添加到耐药性定义中,这将检测kan耐药性的灵敏度从77.4%提高到87.7%(95%ci,79.5至93%),11个额外的kan耐药性样品被分类为耐药性。然而,由于具有eis启动子突变的21个kan敏感样品现在被“错误地”检测为kan耐药性,因此特异性从99.8%降至95.6%(95%ci,93.3至97.1%)(表4)。然后使用基于mgit的药物敏感性测试结果作为金标准,对可获得mgit结果的560个样品进行类似的分析。该子集包括仅包含eis启动子突变的所有样品。该测定结果与基于mgit的金标准的比较有助于澄清在lj培养基中具有不一致kan耐药性的eis突变体。使用作为金标准的mgit和a1401g或c1402t突变的rrssmbtm值特征来定义kan耐药性,通过smb测定,63/113个kan耐药性样品被鉴定为耐药性(敏感性为55.8%;95%ci为46.1至65%)。相反,使用野生型靶标的rrssmbtm特征来定义敏感性,445/447个样品被鉴定为kan敏感的(特异性为99.8%;95%ci为98.5至100%;表4)。与基于lj的敏感性测试的情况不同,在这种情况下包括eis启动子突变的tm值特征将耐药性测试的灵敏度从55.8%提高到82.3%,kan耐药性测定的特异性仍然保持非常高为99.5%(95%ci,98.2~100%)。因此,在基于mgit的敏感性测试的基础上,eis测定允许检测29个额外的kan耐药性样品而不影响特异性(表4)。实施例5.通过所述测定和mic检测到的突变之间的关系由本文公开的测定定义的耐药性与由本文公开的两种表型敏感性测试方法定义的耐药性之间的不一致性主要涉及具有eis启动子突变的分离物。以前的研究已经表明,eis启动子突变引起相对较低的kan耐药性水平,而rrs基因突变导致对amk、kan和cap的高水平耐药性(campbell2011;du,q.,etal.,2013,diagnmicrobiolinfectdis77:138-142;georghiou2012以及zaunbrecher2009)。结果中的另一个发现是lj与基于mgit的敏感性测试结果之间的不一致。进行mic测试以更仔细地探索rrs和eis启动子突变之间的关系,以及它们在lj和mgit系统中的差异敏感性谱图。对amk和kan二者都敏感(和在两个靶区域都是野生型)的样品,或者被选择以代表两个靶基因中最常见的突变类型(rrsa1401g和eisg(-10)a、c(-14)t和g(-37)t)的样品通过mycotb方法进行测试以确定它们的mic。作为对照,还测试了两个测定靶中已知为野生型的其他分离物。观察到仅具有eis启动子突变(无rrs突变)的分离物的amkmic在0.25μg/ml至2μg/ml,大多数样品显示mic为0.5μg/ml至1μg/ml(图3)。只有一个eis启动子突变体的amkmic为4μg/ml。没有eis启动子或rrs突变的对照分离物具有0.25μg/ml至0.5μg/ml的mic。因此,具有野生型或突变体eis启动子序列的分离物的amkmic基本上重叠。相比之下,大多数相同的eis启动子突变体的kanmic为5μg/ml至20μg/ml,一个分离物显示40μg/ml的mic(图3)。只有两个eis启动子突变体具有2.5μg/ml的低mic。具有野生型eis启动子序列的分离物显示0.6μg/ml至2.5μg/ml的mic,为eis启动子突变体的平均mic的二分之一至三十分之一(图3)。因此,与amk的情况相反,野生型分离物的kanmic与eis启动子突变体的kanmic重叠很少。这些结果强烈地表明,即使在基于lj或甚至基于mgit的敏感性测试中未检测到耐药性,也应将eis启动子突变体视为具有低至中等水平的kan耐药性。实施例6.对除m.tb以外的细菌的测定特异性。针对一组从atcc保藏中心(manassas,virginia,usa)获得的18种非结核分枝杆菌(ntm),代表26个种的121个临床ntm株和18个种革兰氏阳性和革兰氏阴性菌,测试了该测定的分析特异性。这里测定靶向的rrs区域在不同的ntm种中是高度保守的。因此,如基于序列同源性的预期,rrs测定对于所有测试ntm产生的tm都为70℃(与在野生型m.tbdna存在下产生的tm相同),除了m.xenopi,其不产生任何tm。预计产生与氨基糖苷类敏感性m.tb相同的tm值的ntm种不会导致引起假耐药性测试结果。当来自rrs突变体amk和kan耐药性株的m.tbdna与10至20倍过量的ntmdna混合时,测定产生了独特的双tm峰,这对应于来自m.tb靶的突变体tm值和来自ntm序列的野生型tm值(数据未显示),表明即使在存在大量背景ntmdna的情况下,测定也可以在m.tb中检测到耐药性相关的rrs突变。即使将107个基因组当量的dna加入到pcr检测中,在测试的任何ntm物种存在下,eis探针也不产生可见的熔解曲线。革兰氏阳性或革兰氏阴性菌都不产生任何rrs或eissmb的tm值;因此,它们没有引起测定产生任何假耐药性结果。实施例7.amk和kan耐药性的其他遗传原因在本实施例中的研究包括对amk和/或kan具有耐药性但是具有野生型rrs基因和eis启动子序列的22个样品。最近的研究已经表明,whib7基因的5’非翻译区(utr)中的突变可能导致m.tb中的氨基糖苷类耐药性(27)。为了确定whib7突变是否可能导致一些表型耐药性但测定敏感的分离物,所有22个样品都在whib7基因起始位点上游的412bp区域加上一部分whib7开放阅读框进行测序。作为对照组,还对30个随机选择的敏感病毒分离物进行了测序。在22个不一致的分离物中,6个来自3个患者的分离物在whib75’utr区域中显示突变。一个样品在5’utr位置+138处具有胞嘧啶缺失,一个患者的两个样品在位置+237中含有a至g突变,而来自单个患者的其余三个样品在位置+273处显示a至c突变(表5),其中将转录起始位点视为+1(reeves,a.z.,2013,57:1857-1865)。尽管阳性pcr对照正常,来自单个患者的三个样品在反复pcr尝试后未能从5’utr产生任何扩增。这表明在5’utr区域存在大的缺失,因为275bp片段可以容易地从所有三个样品的whib7orf内扩增。所有具有whib7突变的样品仅对kan具有耐药性,这与通过上调eis基因推定的whib7作用机制(reeves2013)是一致的。这些分离物的kanmic值也低至5μg/ml,与eis启动子突变体所观察到的相似。对氨基糖苷类敏感的30个对照样品中没有一个在whib7基因的5’utr中有任何突变。需要进一步的研究以确定whib7基因的这些突变和5’utr的缺失与氨基糖苷类耐药性的关系。然而,在敏感株中没有这样的突变意味着它们可能在氨基糖苷类耐药性中起一定作用,未来的测定可以针对这些突变以提高检测低水平kan耐药性的灵敏度。表3:针对具有野生型序列和突变体序列的临床dna所测试的rrs和eis探针的熔解温度(tm)值sd表示针对不同临床样品,每个探针的tm值的+/-标准偏差,dtm表示针对每个探针,野生型序列与突变体序列的tm差异。sd:标准偏差,dtm:δtm探针编号1、2和3分别对应于rrs-1400、eis-1和eis-2探针。表4:通过lj和mgit方法测定的临床株对amk和kan的敏感性及其与rrs基因和eis启动子区域中存在的突变的关系lj和mgit分别表示lj比例和mgit方法的敏感性测试。表5:临床株对amk和kan以及whib7基因5’非翻译区的突变的敏感性分离物#患者#amk(lj)kan(lj)kan(mgit)whib75’utr#11ssrnm#22ssrnm#33ssrnm#43ssrnm#54srrnm#65srr+273-a->c#75srnd+273-a->c#85srr+273-a->c#96rrrnm#106ssrnm#116rrndnm分离物#患者#amk(lj)kan(lj)kan(mgit)whib75’utr#127ssr+138-c缺失#138ssrnm#149ssr在utr中的可能缺失#159ssr在utr中的可能缺失#169ssr在utr中的可能缺失#1710rrrnm#1811ssrnm#1912rrsnm#2013srr+237-a->g#2113srr+237-a->g#2214rrrnmlj和mgit分别表示lj比例和mgit方法的敏感性测试。nd:不确定,nm:无突变,r:耐药性,s:敏感。上述实施例和优选实施方案的描述应被视为说明性的而不是限制权利要求所限定的本发明。如将容易理解的是,可以利用上述特征的许多变化和组合,而不脱离权利要求中阐述的本发明。这些变化不被认为是偏离本发明的范围,并且所有这些变化都意图包括在所附权利要求的范围内。本文引用的所有参考文献通过引用整体并入。序列表<110>d·阿兰s·查克拉沃尔提<120>结核分枝杆菌的聚合酶链反应引物和探针<130>096747.00312/s2015-028<150>us62/062,351<151>2014-10-10<160>73<170>patentinversion3.5<210>1<211>19<212>dna<213>人工序列<220><223>合成的寡聚物<400>1ccggtcggttgccgagacc19<210>2<211>22<212>dna<213>人工序列<220><223>合成的寡聚物<400>2cggtcggttgccgagaccatgg22<210>3<211>22<212>dna<213>人工序列<220><223>合成的寡聚物<400>3gtcggttgccgagaccatgggc22<210>4<211>21<212>dna<213>人工序列<220><223>合成的寡聚物<400>4agcgggtagcgcagcgaccag21<210>5<211>22<212>dna<213>人工序列<220><223>合成的寡聚物<400>5cgggtagcgcagcgaccagggc22<210>6<211>23<212>dna<213>人工序列<220><223>合成的寡聚物<400>6ccagcgggtagcgcagcgaccag23<210>7<211>20<212>dna<213>人工序列<220><223>合成的寡聚物<400>7gctggagcagatgggcttgg20<210>8<211>22<212>dna<213>人工序列<220><223>合成的寡聚物<400>8ccgctggagcagatgggcttgg22<210>9<211>25<212>dna<213>人工序列<220><223>合成的寡聚物<400>9ggctggaagagctcgtatggcaccg25<210>10<211>26<212>dna<213>人工序列<220><223>合成的寡聚物<400>10gtcccatttcgtcggggtgttcgtcc26<210>11<211>27<212>dna<213>人工序列<220><223>合成的寡聚物<400>11ccatttcgtcggggtgttcgtccatac27<210>12<211>23<212>dna<213>人工序列<220><223>合成的寡聚物<400>12cgtcgcggacctccagcccggca23<210>13<211>21<212>dna<213>人工序列<220><223>合成的寡聚物<400>13tcacgtgacagaccgccgggc21<210>14<211>23<212>dna<213>人工序列<220><223>合成的寡聚物<400>14gctcacgtgacagaccgccgggc23<210>15<211>28<212>dna<213>人工序列<220><223>合成的寡聚物<400>15gctagtaatcgcagatcagcaacgctgc28<210>16<211>23<212>dna<213>人工序列<220><223>合成的寡聚物<400>16cctcccgagggttaggccactgg23<210>17<211>20<212>dna<213>人工序列<220><223>合成的寡聚物<400>17ggttaggccactggcttcgg20<210>18<211>23<212>dna<213>人工序列<220><223>合成的寡聚物<400>18cacagggtcacagtcacagaatc23<210>19<211>23<212>dna<213>人工序列<220><223>合成的寡聚物<400>19cgtcctcggtcgggctacacagg23<210>20<211>25<212>dna<213>人工序列<220><223>合成的寡聚物<400>20cggtcgggctacacagggtcacagt25<210>21<211>23<212>dna<213>人工序列<220><223>合成的寡聚物<400>21cacagggtcacagtcacagaatc23<210>22<211>25<212>dna<213>人工序列<220><223>合成的寡聚物<400>22gcatcgcgtgatcctttgccagaca25<210>23<211>24<212>dna<213>人工序列<220><223>合成的寡聚物<400>23ctcgccggtgccagcggatatgtc24<210>24<211>24<212>dna<213>人工序列<220><223>合成的寡聚物<400>24cgaccgtccagcgcccacatcttt24<210>25<211>21<212>dna<213>人工序列<220><223>合成的寡聚物<400>25ccgcgagggccccgatggttt21<210>26<211>23<212>dna<213>人工序列<220><223>合成的寡聚物<400>26ggctgggctcccggttgatgtgg23<210>27<211>24<212>dna<213>人工序列<220><223>合成的寡聚物<400>27ggctcccggttgatgtggtcgtag24<210>28<211>22<212>dna<213>人工序列<220><223>合成的寡聚物<400>28tggggcgatcggcacacccagc22<210>29<211>24<212>dna<213>人工序列<220><223>合成的寡聚物<400>29atcggtggattgcccggcaagctg24<210>30<211>23<212>dna<213>人工序列<220><223>合成的寡聚物<400>30cgttccacggatccgcgcaagtc23<210>31<211>22<212>dna<213>人工序列<220><223>合成的寡聚物<400>31gctggccgattgccgttccacg22<210>32<211>23<212>dna<213>人工序列<220><223>合成的寡聚物<400>32gatcatcaatgtggagaaagcgc23<210>33<211>25<212>dna<213>人工序列<220><223>合成的寡聚物<400>33ctggaacatcgaatcgcgaccgctt25<210>34<211>22<212>dna<213>人工序列<220><223>合成的寡聚物<400>34atcgcgaccgctttttgcagaa22<210>35<211>21<212>dna<213>人工序列<220><223>合成的寡聚物<400>35ctgaccgacgccgtggtgata21<210>36<211>27<212>dna<213>人工序列<220><223>合成的寡聚物<400>36ggaaatagttggacatgtagccggcgt27<210>37<211>25<212>dna<213>人工序列<220><223>合成的寡聚物<400>37cgattcgatgttccaggcgatactt25<210>38<211>25<212>dna<213>人工序列<220><223>合成的寡聚物<400>38gcgcggcaagatcatcaatgtggag25<210>39<211>23<212>dna<213>人工序列<220><223>合成的寡聚物<400>39gatcatcaatgtggagaaagcgc23<210>40<211>22<212>dna<213>人工序列<220><223>合成的寡聚物<400>40gtggatcccggtgcccagcgcc22<210>41<211>22<212>dna<213>人工序列<220><223>合成的寡聚物<400>41ggtgcccagcgccgtgatgatc22<210>42<211>28<212>dna<213>人工序列<220><223>合成的寡聚物<400>42cgttacgctcgtggacataccgatttcg28<210>43<211>28<212>dna<213>人工序列<220><223>合成的寡聚物<400>43ttacgctcgtggacataccgatttcggc28<210>44<211>24<212>dna<213>人工序列<220><223>合成的寡聚物<400>44ggactgaacgggatacgaatgggg24<210>45<211>24<212>dna<213>人工序列<220><223>合成的寡聚物<400>45gtttggccccttcagtggctgtgg24<210>46<211>24<212>dna<213>人工序列<220><223>合成的寡聚物<400>46cagcccgacgccgaatcagttgtt24<210>47<211>21<212>dna<213>人工序列<220><223>合成的寡聚物<400>47ggtgcgggcggtgtcgaggtg21<210>48<211>21<212>dna<213>人工序列<220><223>合成的寡聚物<400>48gccaccgcggggagtttgtcg21<210>49<211>24<212>dna<213>人工序列<220><223>合成的寡聚物<400>49atcaacatccggccggtggtcgcc24<210>50<211>24<212>dna<213>人工序列<220><223>合成的寡聚物<400>50agctccagcccggcacgctcacgt24<210>51<211>28<212>dna<213>人工序列<220><223>合成的寡聚物<400>51gctagtaatcgcagatcagcaacgctgc28<210>52<211>21<212>dna<213>人工序列<220><223>合成的寡聚物<400>52cctcccgagggttaggccact21<210>53<211>24<212>dna<213>人工序列<220><223>合成的寡聚物<400>53gcatcgcgtgatcctttgccagac24<210>54<211>40<212>dna<213>人工序列<220><223>合成的寡聚物<400>54cctgcgcgcaccagggtgccctagatcgacgcgtcgcagg40<210>55<211>38<212>dna<213>人工序列<220><223>合成的寡聚物<400>55ccaggggtgucgtagatcgacgcgtcgccgcgccctgg38<210>56<211>38<212>dna<213>人工序列<220><223>合成的寡聚物<400>56ccggcgacatcaatggtgctggtgatcgcgtccgccgg38<210>57<211>43<212>dna<213>人工序列<220><223>合成的寡聚物<400>57cgcggccgacagttggcgcttgtgggttaaccccgacgccgcg43<210>58<211>41<212>dna<213>人工序列<220><223>合成的寡聚物<400>58cgcgcgccgggccccagcaccaacagtcggagcttcgcgcg41<210>59<211>35<212>dna<213>人工序列<220><223>合成的寡聚物<400>59cacgaccgcccgtcacgtcatgaaagtcggtcgtg35<210>60<211>39<212>dna<213>人工序列<220><223>合成的寡聚物<400>60agcggtcgtaatattcacgtgcacctggccgcggccgct39<210>61<211>38<212>dna<213>人工序列<220><223>合成的寡聚物<400>61ctcgcggcatatgccacagtcggattctctgacgcgag38<210>62<211>40<212>dna<213>人工序列<220><223>合成的寡聚物<400>62caggcggtcgtaatattcacgtgcacctggccgccgcctg40<210>63<211>38<212>dna<213>人工序列<220><223>合成的寡聚物<400>63cgagcgtatgtagtagaaggtgactcggccggcgctcg38<210>64<211>43<212>dna<213>人工序列<220><223>合成的寡聚物<400>64acctgccgcggcgagacgataggutgtaggggtgacggcaggt43<210>65<211>53<212>dna<213>人工序列<220><223>合成的寡聚物<400>65ccgagctgatcguctgaacttcggcgtuctttagcacccggtugatagctcgg53<210>66<211>38<212>dna<213>人工序列<220><223>合成的寡聚物<400>66caccggcgactcgggccacgtccaggatgtagccggtg38<210>67<211>34<212>dna<213>人工序列<220><223>合成的寡聚物<400>67cgcgcaccaatatgatcgggtactcgactgcgcg34<210>68<211>36<212>dna<213>人工序列<220><223>合成的寡聚物<400>68tcggccatcaagggaatggagttggcgcgcggccga36<210>69<211>39<212>dna<213>人工序列<220><223>合成的寡聚物<400>69ccgcgtgggtgtcgagtcgatctgcacacagctacgcgg39<210>70<211>20<212>dna<213>人工序列<220><223>合成的寡聚物<400>70aaacgcgcaggtcagaaaat20<210>71<211>20<212>dna<213>人工序列<220><223>合成的寡聚物<400>71cagtgtcttggctacctcga20<210>72<211>19<212>dna<213>人工序列<220><223>合成的寡聚物<400>72gtcggtactgacagtcccc19<210>73<211>19<212>dna<213>人工序列<220><223>合成的寡聚物<400>73atgcaacagcatccttgcg19当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 一种敲除c‑di‑AMP分解酶的重组耻垢分枝杆菌株及其应用的制造方法与工艺
- 检测结核分枝杆菌感染的抗原多肽池及其应用的制造方法与工艺
- 一种猕猴桃分枝定位器的制造方法与工艺
- 一种xanthone类化合物及其单晶的制备方法与作为抗海分枝杆菌药物的应用与制造工艺
- 一种糖肽类抗生素耐药基因检测试剂盒的制造方法与工艺
- 分枝杆菌快速分离培养方法与制造工艺
- 一种用于检测潜在结核的特异性标志物及其应用的制造方法与工艺
- 结核分枝杆菌抗原蛋白Rv2941及其T细胞表位肽的应用的制造方法与工艺
- 一种微流控芯片上基于荧光量子点磁性富集并分离结核分枝杆菌TB的方法及装置与制造工艺
- 二肽meso‑DAP‑D‑Ala和/或四肽L‑Ala‑D‑Glu‑L‑Lys‑D‑Ala的新用途的制造方法与工艺
- 一种快速区分prv中国型、欧美型及疫苗株的双色荧光检测方法、引物及探针的制作方法
- 实时荧光pcr技术定量检测myd88基因l265p突变的方法、引物和探针的制作方法
- 用于定性检测白血病融合基因的引物、探针、试剂盒及方法
- 在体外检测或/及定量乙型肝炎病毒的方法及其所使用的引物、探针的制作方法
- 用于检测多种呼吸道病毒的pcr引物组、探针组及试剂盒的制作方法
- 一种检测人类met基因14外显子剪接突变的引物、探针及试剂盒的制作方法
- 使用重叠引物和熔解探针检测单核苷酸多态性的制作方法
- 用于检测多种呼吸道病毒的pcr引物组、探针组及试剂盒的制作方法
- 一种检测人类met基因14外显子剪接突变的引物、探针及试剂盒的制作方法
- 使用重叠引物和熔解探针检测单核苷酸多态性的制作方法