一种FXR基因表达载体的构建方法及其应用与流程
本发明属于生物工程技术领域,涉及一种FXR基因表达载体的构建方法及其应用。
背景技术:
法尼酯衍生物X受体(farnesoid X receptor,FXR)又称为胆汁酸受体,为核受体超家族的成员之一。其配体为胆汁酸,FXR作为其细胞内的传感器,在维持胆酸代谢平衡中发挥着重要作用。FXR可和视黄酸X受体(retinoid X receptor,RXR)形成异二聚体结合于靶基因启动子相应区域,从而参与多种基因转录表达的调控。FXR的激活可使体内甘油三酯水平整体性地降低,还参与糖代谢的调节。在胆汁酸负反馈调节和糖脂代谢中发挥重要作用(Reschly,E.J.,et al.,Evolution of the bile salt nuclear receptor FXR in vertebrates.J Lipid Res,2008.49(7):p.1577-87)。FXR为胆盐合成过程中主要的转录调节因子,部分通过控制胆盐合成过程中的限速酶实现。FXR在维持心血管系统、免疫系统、生殖系统、内分泌胰腺、肾脏及中枢神经系统的正常功能中也发挥着关键作用。作为核受体,FXR可作为药物研发的很有前途的治疗靶点。这些药物可被应用到预防或治疗动脉粥样硬化、心血管疾病、胆固醇结石病、非酒精性脂肪肝炎、胆汁淤积症以及其他代谢综合征中(Kalaany,N.Y.and D.J.Mangelsdorf,LXRS and FXR:the yin and yang of cholesterol and fat metabolism.Annu Rev Physiol,2006.68:p.159-91)。FXR不仅在肝脏和肠道中高表达,而且在肾脏和肾上腺中表达水平也很高。而在心脏、肺、胃、脂肪、胸腺、脾、卵巢、精巢和血管组织中检测到低水平表达的FXR。
斑马鱼已经成为药物表型筛选的一种高效的工具(Patton,E.E.and L.I.Zon,The art and design of genetic screens:zebrafish.Nat Rev Genet,2001.2(12):p.956-66)。斑马鱼的基因组和横剖面图和其他的脊椎动物很相似,但其胚胎透明且体外发育,研究人员可直接对其生理状况和细胞发育进行实时观察。利用斑马鱼模式生物,结合革新的荧光标记、生理测量或分子报告基因等光学方法,研究者可以同时在多个器官系统中和完全天然的环境下对其进行综合性的生物学观察(Guyon,J.R.,et al.,Modeling human muscle disease in zebrafish.Biochim Biophys Acta,2007.1772(2):p.205-15)。当其基因组发生改变或受化学物质的毒性侵扰时,其解剖结构和生理过程的变化都可以很方便的观察到。目前很多斑马鱼疾病模型也已经建立起来(Lieschke,G.J.and P.D.Currie,Animal models of human disease:zebrafish swim into view.Nat Rev Genet,2007.8(5):p.353-67)。通过多个领域的研究,强有力的证据表明斑马鱼无论在生理学、遗传学方面,还是在药理学方面,都和人类惊人的相似(Peterson,R.T.and C.A.Macrae,Systematic approaches to toxicology in the zebrafish.Annu Rev Pharmacol Toxicol,2012.52:p.433-53)。
FXR是一种多功能的核受体,在胆酸代谢、脂类代谢、糖代谢、肝脏功能保护和肠道微生物生长等过程中发挥重要作用,因此FXR可作为治疗肥胖、糖尿病和肝脏功能损伤等的药物靶点。
技术实现要素:
本发明为解决在斑马鱼中有效监测FXR表达的技术难题,提供了一种高效显示斑马鱼FXR转录情况的载体,并将载体导入到斑马鱼受精卵中,根据EGFP的表达情况可有效反映体内FXR的表达特征,从而特异高效地标记FXR基因的表达。
为解决上述技术难题,本发明采用以下技术方案:
一种FXR基因表达载体的构建方法,其步骤如下:
(1)人工合成携带有目的序列的PUC57载体,所述目的序列两端加有BamH I和EcoR I酶切位点的五个串联的FXR结合位点和c-fos的基础启动子,目的序列如SEQ ID NO:1所示;
(2)用限制性内切酶Not I和限制性内切酶Xho I分别双酶切pEGFP-N1载体和PUC19载体,胶回收后,将酶切得到的EGFP片段与酶切后的PUC19载体连接、转化、筛选、摇菌并提取质粒,验证后得到改造后的PUC19载体;
(3)把步骤(1)中人工合成的PUC57载体进行转化并提取质粒;
(4)用限制性内切酶BamH I和限制性内切酶EcoR I分别双酶切PUC57载体和PUC19载体,胶回收后,将酶切得到的目的序列与酶切后的PUC19载体连接、转化、筛选、摇菌并提取质粒,验证后得到FXR基因表达载体。
一种FXR基因表达载体导入斑马鱼后得到高效标记斑马鱼FXR转录情况的转基因鱼在鱼类生物工程中的应用。
所述表达载体在鱼类生物工程中应用的具体步骤如下:
(1)通过显微注射法将FXR基因表达载体注射到斑马鱼1-2个细胞期的受精卵中;
(2)在注射过的鱼卵里面用荧光显微镜挑选出EGFP表达的F0代小鱼,培育至成年,成年F0代的斑马鱼与野生型成年斑马鱼杂交,在后代中挑选稳定EGFP表达的小鱼,即为F1代;
(3)F1代自交,筛选稳定表达的F2代,即得用于监测FXR基因表达的转基因斑马鱼品系。
所述步骤(1)中显微注射12h前,将一对AB系斑马鱼置于产卵缸中,并用隔板隔开,显微注射20min-30min前,取走隔板,促其产卵,10-20min后收集鱼卵,并进行显微注射。
所述显微注射的步骤为:将40ng/μL FXR基因表达载体的质粒和1unit/μL的I-SceI,共注射到1-2细胞期的受精卵中,然后置于装有卵水的培养皿中,于28℃温箱中孵养。
本发明的有益效果在于:
(1)本发明构建了稳定的转基因斑马鱼品系;本发明构建的转基因载体包括五个串联的FXR结合位点和c-fos的基础启动子,其后连接EGFP作为报告基因,并在两端连接I-SCE1大范围核酸酶内切酶位点以提高转基因效率。
(2)本发明第一次提供可实时显示和高效标记斑马鱼FXR转录情况的载体,成功导入斑马鱼受精卵中后,筛选获得稳定遗传的可高效标记斑马鱼FXR转录情况的转基因鱼,此方法简单易行,操作简便。
(3)本发明构建的筛选系统,高通量获得调控FXR基因表达的小分子药物,较好的得到这种药物的体内毒性数据及药物对整个生命系统的作用,与目前常用的细胞体外实验相比,具有很大的进步。此外,本发明的应用,可进行长至数天对药物作用的实时观察,并可比较生命各个不同阶段对药物的反应,这也是细胞体外实验所缺乏的,此转基因鱼可为筛选调控FXR活性的小分子药物提供很好的易操作的平台。
附图说明
图1为FXR载体结构示意图。
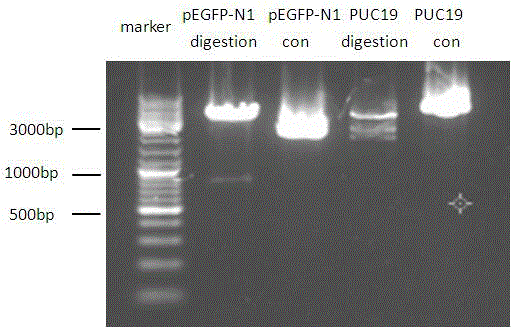
图2为pEGFP-N1质粒和PUC19质粒的双酶切电泳检测图。
图3为改造后的PUC19质粒电泳检测图。
图4为PUC57质粒和改造后的PUC19质粒双酶切电泳检测图。
图5为FXR转基因表达载体的电泳检测图。
图6为FXR转基因品系的荧光表达情况,左图为对照转基因鱼,右图为用FXR的激动剂GW4064处理后的转基因鱼荧光表达情况。
具体实施方式
一种FXR基因表达载体的构建方法,其步骤如下:
(1)人工合成携带有目的序列的PUC57载体,所述目的序列两端加有BamH I和EcoR I酶切位点的五个串联的FXR结合位点和c-fos的基础启动子,目的序列如SEQ ID NO:1所示;
(2)用限制性内切酶Not I和限制性内切酶Xho I分别双酶切pEGFP-N1载体和PUC19载体,胶回收后,将酶切得到的EGFP片段与酶切后的PUC19载体连接、转化、筛选、摇菌并提取质粒,验证后得到改造后的PUC19载体;
(3)把步骤(1)中人工合成的PUC57载体进行转化并提取质粒;
(4)用限制性内切酶BamH I和限制性内切酶EcoR I分别双酶切人工合成的PUC57载体和改造后的PUC19载体,胶回收后,将酶切得到的目的序列与酶切后改造后的PUC19载体连接、转化、筛选、摇菌并提取质粒,验证后得到FXR基因表达载体。
一种FXR基因表达载体导入斑马鱼后得到高效标记斑马鱼FXR转录情况的转基因鱼在鱼类生物工程中的应用。
所述表达载体在鱼类生物工程中应用的具体步骤如下:
(1)通过显微注射法将FXR基因表达载体注射到斑马鱼1-2个细胞期的受精卵中;
(2)在注射过的鱼卵里面用荧光显微镜挑选出EGFP表达的F0代小鱼,培育至成年,成年F0代的斑马鱼与野生型成年斑马鱼杂交,在后代中挑选稳定EGFP表达的小鱼,即为F1代;
(3)F1代自交,筛选稳定表达的F2代,即得用于监测FXR基因表达的转基因斑马鱼品系。
所述步骤(1)中显微注射12h前,将一对AB系斑马鱼置于产卵缸中,并用隔板隔开,显微注射20min-30min前,取走隔板,促其产卵,10-20min后收集鱼卵,并进行显微注射。
所述显微注射的步骤为:将40ng/μL FXR基因表达载体的质粒和1unit/μL的I-SceI,共注射到1-2细胞期的受精卵中,然后置于装有卵水的培养皿中,于28℃温箱中孵养。
下面结合具体实施方式对本发明做进一步的解释说明:
1、人工合成携带有目的序列的PUC57载体,所述目的序列两端加有BamH I和EcoR I酶切位点的五个串联的FXR结合位点和c-fos的基础启动子,目的序列如SEQ ID NO:1所示,由北京唯尚立德生物科技有限公司全基因合成。
2、为了提高转基因筛选的效率,用双酶切法将pEGFP-N1中的EGFP片段连接至PUC19载体上(Takara生物技术公司),后者两端带有I-SceI的大范围核酸酶的位点(Soroldoni,D.,B.M.Hogan,and A.C.Oates,Simple and efficient transgenesis with meganuclease constructs in zebrafish.Methods Mol Biol,2009.546:p.117-30)。
pEGFP-N1质粒的双酶切体系(50μL)如下:
PUC19载体的的双酶切体系(50μL)如下:
然后置于37℃水浴锅中消化3h,琼脂糖凝胶电泳检测如图2所示,经胶回收步骤如下:
(1)把切下来的含有DNA的琼脂糖凝胶块置于2mL离心管中,加入350μL binding缓冲液;
(2)放置于65度的水浴锅中7min,每隔2-3min把离心管摇晃几次,直至胶块完全溶解;
(3)把管子中的所有液体加入到结合DNA的回收柱中(回收柱置于收集管中),室温10000g离心1min;
(4)弃废液,再加入300μL的binding缓冲液,室温10000g离心1min,清洗柱子;
(5)弃废液,再加入700μL的SPW洗涤缓冲液(乙醇稀释过的),室温10000g离心1min;
(6)弃废液,最大转速离心2min;
(7)打开回收柱的盖子,室温静置10min,挥发乙醇;
(8)丢掉回收管,将收集管置于1.5mL的干净离心管中,加入30μL的洗脱缓冲液,静置1min后,最大转速离心1min。
再将回收完的pEGFP-N1中的EGFP片段和PUC19载体进行连接反应,反应体系如下:
Solution1 5μL
EGFP片段 4.8μL
pUC19载体 0.2μL
放置于16℃中1h。
然后进行转化,具体步骤如下:
(1)取一管感受态细胞(感受态细胞储存于负80度)放于冰上10min;
(2)加入5μL的连接产物,混匀后再放于冰上30min;
(3)放于42度的水浴锅中热击90sec后,马上置于冰上3min;
(4)加入800μL的无抗性LB溶液,放于37度摇床中,180转/min;
(5)50min后进行涂板:将感受态细胞短暂离心后,吸掉700μL的上清,再用枪吸打,重悬菌液,将菌液加入到对应抗性的LB固体平板上,涂匀后置于37度温箱,倒置培养约12-16h。
再进行筛选、摇菌和质粒的提取。质粒提取步骤如下:
(1)取摇好的菌液到2mL离心管中,10000g 1min离心,弃上清,再加入菌液离心至菌液离心完;
(2)弃上清,向离心管中加入250μL的solutionI,并用枪彻底悬浮细菌;
(3)再加入250μL的solutionII,温和翻转离心管2min,不超过5min,至液体清亮粘稠;
(4)再加入350μL的solution III,然后立即混匀,上下翻转8次后,会出现白色絮状沉淀,最大转速离心10min;
(5)取上清加入到装有收集管的DNA回收柱中,10000g 1min离心;
(6)弃废液,加入500μL的buffer HB对回收柱进行清洗,10000g 1min离心,除去残留蛋白质;
(7)加入700μL的DNA wash buffer(已加入乙醇稀释的),10000g 1min离心,进行洗柱;
(8)弃废液,空柱最大转速离心2min;
(9)打开回收柱的盖子,室温静置10min,挥发乙醇;
(10)丢掉收集管,把回收柱置于1.5mL干净的离心管中,加入80μL的洗脱缓冲液,静置1min后,最大转速离心1min。
然后取提取好的质粒7μL去测序,经过BLAST,挑选出正确的质粒,至此,我们成功得到改造后的PUC19质粒,验证检测如图3所示。
3、把公司交付的连有目的序列的PUC57质粒进行转化、摇菌和质粒的提取,以获得足量的后续实验所用的质粒。
4、用双酶切法将PUC57质粒中的上述的220bp序列连接到2中改造后的PUC19质粒中。
PUC57质粒的双酶切体系(50μL)如下:
改造后的PUC19载体的的双酶切体系(50μL)如下:
然后置于37℃水浴锅中酶切3h,琼脂糖凝胶电泳检测如图4所示,然后进行胶回收,连接、转化、筛选、摇菌和提质粒,测序验证后得到最终用于显微注射的目的转基因载体,此即可监测FXR基因表达的转基因载体,验证检测如图5所示。
5、通过显微注射仪用显微注射法将目的载体注射到斑马鱼1-2细胞期的受精卵中。具体方法如下:于显微注射12h前,将一对AB系的野生型斑马鱼放置于产卵的缸中,并用隔板隔开,以方便控制产卵时间。显微注射20min-30min前,取出隔板,使斑马鱼交配产卵。15min后收集鱼卵,开始显微注射。
将转基因质粒40ng/μL和1unit/μL的I-SceI大范围核酸酶(R0694S,New England Biolabs,USA)一起共注射到1-2细胞期的受精卵中。然后置于卵水培养液中,28℃温箱中孵养。
6、转基因鱼的筛选
用荧光显微镜(SZX16Olympus)筛选注射过的鱼卵,挑选出EGFP阳性的F0代小鱼,并将其养到成年。将成年的F0代的鱼分别和野生型的成年斑马鱼杂交,在后代中挑选出有EGFP表达的小鱼,即F1代。将有EGFP表达的F1代养到成年,使其自交,筛选出稳定EGFP表达的F2代。
7、验证
推测FXR在胚胎期的表达量较低或是启动子元件不足以驱动FXR的高效表达,本发明得到的,监测FXR基因表达的有稳定EGFP表达的F2代转基因斑马鱼品系,胚胎期的荧光较暗;采用FXR的激动剂GW4064来处理胚胎期的转基因品系,观察到其可增强EGFP的表达,在肝脏、肠道和鳔中看到荧光的增强表达,如图6所示。这一结果可以证明本发明所构建的品系可真实地反映FXR的活性。
FXR可作为治疗肥胖、糖尿病和肝脏功能损伤等的药物靶点。本发明的这一体内筛选系统,可高通量获得调控FXR基因表达的小分子药物,因为是体内脊椎动物实验模型,可很好的得到这种药物的体内毒性数据和药物对整个生命系统的作用。此外,本发明构建的系统可进行长至数天对药物的作用进行实时观察,并可比较生命各个不同阶段对药物的反应。此转基因鱼可为筛选调控FXR活性的小分子药物提供很好的易操作的平台。
- 还没有人留言评论。精彩留言会获得点赞!