核酸的等位基因特异性扩增的制作方法
本申请是国际申请日为2010年12月10日、国际申请号为pct/ep2010/007560、进入国家阶段的申请号为201080055770.6、发明名称为“核酸的等位基因特异性扩增”的pct申请的分案申请。
本发明涉及核酸扩增领域,并且具体地涉及等位基因特异性扩增领域。
背景技术:
核酸的等位基因特异性扩增允许靶序列的同时扩增和分析。当靶核酸在其序列中具有一个或多个变异(多态性)时,通常使用等位基因特异性扩增。核酸多态性用于dna概况分析(法医学、亲权认定、用于器官移植的组织分型)、遗传作图、区分微生物的致病菌株以及罕见突变的检测,例如在癌细胞中出现、在具有正常dna的细胞背景中存在的那些。
在成功的等位基因特异性扩增中,扩增靶核酸的所需变体,同时不扩增其他变体,至少不扩增至可检测水平。一般的等位基因特异性扩增测定涉及用这样设计的至少一种等位基因特异性引物的聚合酶链反应(pcr),从而使得引物延伸仅在引物与靶序列的所需变体形成杂交体(hybrid)时发生。当引物与靶序列的不希望有的变体杂交时,引物延伸被抑制。
已提出了增强引物的等位基因特异性的许多方法。然而,对于缺乏pcr特异性的许多临床相关的核酸靶仍是问题。因此,完全需要设计等位基因特异性引物的新方法。
技术实现要素:
在第一个方面,本发明涉及靶序列变体的等位基因特异性扩增的方法,所述靶以几个变体序列的形式存在,该方法包括
(a)使第一种和第二种寡核苷酸与靶序列的至少一个变体杂交;其中第一种寡核苷酸与靶序列的一个或多个变体至少部分互补,并且第二种寡核苷酸与靶序列的一个或多个变体至少部分互补,并且具有与靶序列的仅一个变体互补的至少一个内部选择性核苷酸;
(b)用核酸聚合酶延伸第二种寡核苷酸,其中所述聚合酶能够在所述选择性核苷酸与靶形成碱基对时优先延伸所述第二种寡核苷酸,并且在所述选择性核苷酸不与靶形成碱基对时基本上更少。
在第二个方面,本发明涉及检测靶序列变体的方法,所述靶以几个变体序列的形式存在,该方法包括
(a)使第一种和第二种寡核苷酸与靶序列的至少一个变体杂交;其中所述第一种寡核苷酸与靶序列的一个或多个变体至少部分互补,并且所述第二种寡核苷酸与靶序列的一个或多个变体至少部分互补,并且具有与靶序列的仅一个变体互补的至少一个内部选择性核苷酸;
(b)用核酸聚合酶延伸第二种寡核苷酸;其中所述聚合酶能够在所述选择性核苷酸与靶形成碱基对时优先延伸所述第二种寡核苷酸,并且在所述选择性核苷酸不与靶形成碱基对时基本上更少;和
(c)检测所述寡核苷酸延伸的产物,其中延伸表示寡核苷酸对其具有互补选择性核苷酸的靶序列变体的存在。
在第三个方面,本发明涉及用于靶序列的等位基因特异性扩增的试剂盒,所述靶以几个变体序列的形式存在,该试剂盒包括
(a)与靶序列的一个或多个变体至少部分互补的第一种寡核苷酸;和
(b)具有与靶序列的仅一个变体互补的至少一个内部选择性核苷酸、与靶序列的一个或多个变体至少部分互补的第二种寡核苷酸。
在第四个方面,本发明涉及用于执行靶序列的等位基因特异性扩增的寡核苷酸,所述靶以几个变体序列的形式存在,该寡核苷酸包括
(a)与所述靶序列的一个或多个变体的部分至少部分互补的序列;
(b)与靶序列的仅一个变体互补的至少一个内部选择性核苷酸。
在第五个方面,本发明涉及用于靶序列的等位基因特异性扩增的反应混合物,所述靶以几个变体序列的形式存在,该混合物包括
(a)与靶序列的一个或多个变体至少部分互补的第一种寡核苷酸;和
(b)与靶序列的一个或多个变体至少部分互补,但具有与靶序列的仅一个变体互补的至少一个内部选择性核苷酸的第二种寡核苷酸。
附图说明
图1显示了根据本发明使用各种核酸聚合酶和具有内部选择性核苷酸的引物的等位基因特异性扩增结果。
图2显示了使用各种核酸聚合酶和具有3’选择性核苷酸作为对照的各种引物的等位基因特异性扩增结果。
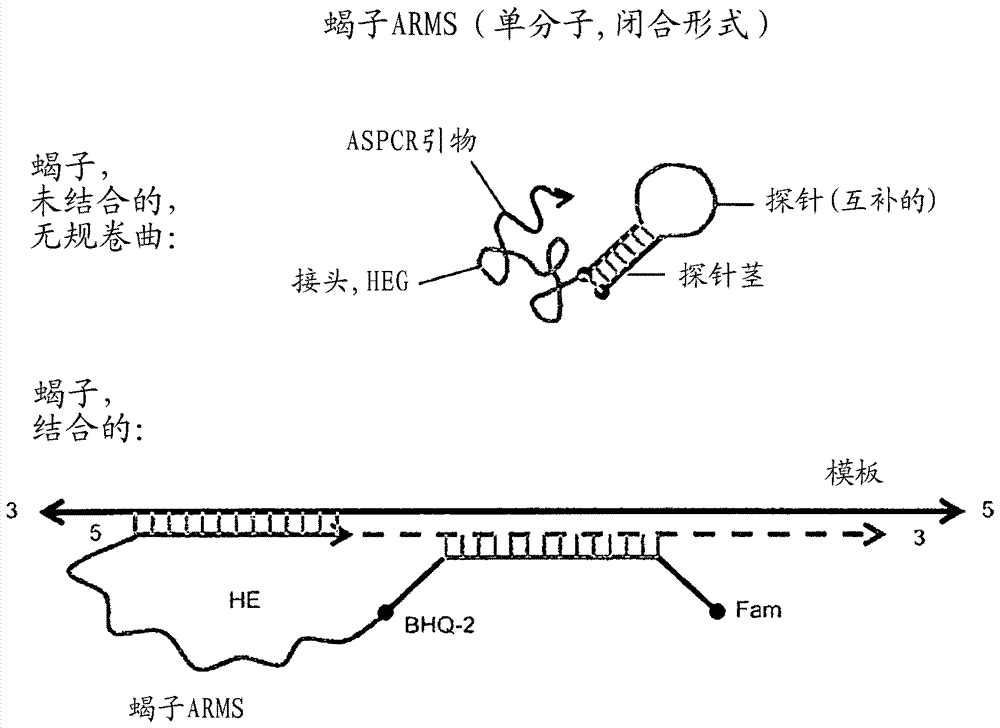
图3显示了根据本发明使用各种核酸聚合酶和具有内部选择性核苷酸的各种引物的等位基因特异性扩增结果,包括具有蝎子arms形式的引物。
图4显示了可以根据本发明使用的蝎子arms形式的结构的示意图示。
具体实施方式
定义
除非另有定义,本文使用的所有技术和科学术语具有与本发明所属领域普通技术人员通常理解相同的含义。在描述和请求保护本发明中,将使用下述定义。
术语“核酸”指核苷酸(例如核糖核苷酸、脱氧核糖核苷酸、核苷酸类似物等)的聚合物,并且包含脱氧核糖核酸(dna)、核糖核酸(rna)、dna-rna杂交体、寡核苷酸、多核苷酸、适体、肽核酸(pnas)、pna-dna缀合物、pna-rna缀合物等,其包含以线性或分支形式共价连接在一起的核苷酸。核酸一般是单链或双链的,并且一般将含有磷酸二酯键,尽管在一些情况下,包括可以具有可替代主链的核酸类似物,包括例如磷酰胺(beaucage等人(1993)tetrahedron49(10):1925);硫代磷酸酯(mag等人(1991)nucleicacidsres.19:1437;和美国专利号5,644,048)、二硫代磷酸酯(briu等人(1989)j.am.chem.soc.111:2321)、o-甲基亚磷酰胺(o-methylphophoroamidite)连接(参见eckstein,oligonucleotidesandanalogues:apracticalapproach,oxforduniversitypress(1992))、和肽核酸主链和连接(参见egholm(1992)j.am.chem.soc.114:1895)。可以进行核糖磷酸主链的这些修饰,以促进另外部分例如标记的添加,或改变此种分子在生理学环境中的稳定性和半衰期。
除在核酸中一般发现的天然存在的杂环碱基(例如腺嘌呤、鸟嘌呤、胸腺嘧啶、胞嘧啶和尿嘧啶)外,核苷酸类似物还可以包括非天然存在的杂环碱基,例如在例如seela等人(1999)helv.chim.acta82:1640中描述的那些。在核苷酸类似物中使用的特定碱基充当解链温度(tm)改性剂。例如,这些中的一些包括7-脱氮嘌呤(例如7-脱氮鸟嘌呤、7-脱氮腺嘌呤等)、吡唑[3,4-d]嘧啶、丙炔基-dn(例如,丙炔基-du、丙炔基-dc等)等。参见例如,美国专利号5,990,303。其他代表性杂环碱基包括例如次黄嘌呤、肌苷、黄嘌呤;2-氨基嘌呤、2,6-二氨基嘌呤、2-氨基-6-氯嘌呤、次黄嘌呤、肌苷和黄嘌呤的8-氮杂衍生物;腺嘌呤、鸟嘌呤、2-氨基嘌呤、2,6-二氨基嘌呤、2-氨基-6-氯嘌呤、次黄嘌呤、肌苷和黄嘌呤的7-脱氮-8-氮杂衍生物;6-氮杂胞苷;5-氟胞苷;5-氯胞苷;5-碘胞苷;5-溴胞苷;5-甲基胞苷;5-丙炔基胞苷;5-溴乙烯基尿嘧啶;5-氟尿嘧啶;5-氯尿嘧啶;5-碘尿嘧啶;5-溴尿嘧啶;5-三氟甲基尿嘧啶;5-甲氧基甲基尿嘧啶;5-乙炔基尿嘧啶;5-丙炔基尿嘧啶等。
“模板核酸”、“模板”或“靶”指在合适条件下引物可以与之杂交且延伸的目的核酸。在核酸扩增的背景中,“靶”优选是核酸的区域,由与至少2种引物序列至少部分互补的序列和间插序列组成。(如果靶是单链核酸,那么它由与一种引物至少部分互补的序列和与第二种引物至少部分等同的序列组成。)模板核酸可以作为分离的核酸片段存在或可以是更大核酸片段的部分。靶核酸可以衍生自或分离自基本上任何来源,例如培养的微生物、未培养的微生物、复杂生物学混合物、组织、血清、古代或保存的组织或样品、环境分离物等。进一步地,模板核酸任选包括或衍生自cdna、rna、基因组dna、克隆的基因组dna、基因组dna文库、酶促断裂的dna或rna、化学断裂的dna或rna、物理断裂的dna或rna等。模板核酸还可以是使用本领域已知的技术化学合成的。
“寡核苷酸”指核酸聚合物,其包括至少2个,但一般为5-50个核苷酸,且更一般为15-35个核苷酸。寡核苷酸可以通过本领域已知的任何合适方法进行制备,包括例如合适序列的克隆和限制酶切消化、或通过下述方法的直接化学合成,例如narang等人(1979)meth.enzymol.68:90-99的磷酸三酯法;brown等人(1979)meth.enzymol.68:109-151的磷酸二酯法;beaucage等人(1981)tetrahedronlett.22:1859-1862的二乙基亚磷酰胺法;matteucci等人(1981)j.am.chem.soc.103:3185-3191的三酯法;自动化合成法;美国专利号4,458,066的固相支持体法或本领域已知的任何其他化学方法。
“引物”是可以与模板核酸杂交且允许使用核苷酸聚合酶的链延伸或延长的寡核苷酸。尽管有时利用其他引物长度,但引物一般范围为15-35个核苷酸。短引物一般在更冷的温度下与模板核酸形成足够稳定的杂交体。引物无需与模板核酸完全互补用于延伸发生。与模板核酸至少部分互补的引物一般能够与模板核酸杂交用于延伸发生。如果需要的话,引物核酸可以通过掺入标记进行标记,所述标记可通过放射学、光谱、光化学、生物化学、免疫化学或化学技术检测。
“等位基因特异性引物”是这样的引物,其可以与模板核酸的几个变体杂交,但当与模板核酸的仅仅一些变体杂交时,允许通过聚合酶的延长。对于模板核酸的其他变体,引物-模板杂交体可以不延伸或通过聚合酶更不有效地延伸。
当另外的核苷酸例如通过掺入核苷酸的生物催化剂在核酸的3'末端掺入核酸内时,核酸是“延伸的”或“延长的”。
如果扩增测定获得一种产物超过其他可能产物的优势(即大多数但少于100%),那么它是“选择性的”或“等位基因选择性的”。测定描述为“等位基因选择性的”,只要靶序列的不希望有的(错配的)变体的扩增是可检测的。如果唯一地形成可能产物之一,那么使用就扩增测定而言的术语“特异性的”或“等位基因特异性的”。其中不希望有的靶的扩增是不可检测的测定称为“等位基因特异性的”。然而,应当理解随着检测法变得更灵敏,先前已知是等位基因特异性的一些测定原来是等位基因选择性的,即靶的不希望有的变体的一些扩增变得可检测。因此,在本发明的背景中,术语“等位基因特异性的”意欲包含严格地等位基因特异性的,以及等位基因选择性的扩增。
“基因型”指细胞或受试者或细胞或受试者组的遗传组成的全部或部分。例如,基因型包括在给定基因座上存在或在基因组中分布的特定突变和/或等位基因(例如多态性,例如单核苷酸多态性(snps)等)。
“核酸聚合酶”指催化核苷酸掺入核酸内的酶。示例性核酸聚合酶包括dna聚合酶、rna聚合酶、末端转移酶、逆转录酶、端粒酶等。
“热稳定酶”指当经历升高的温度达选择的时间段时,稳定(即抵抗分解或变性)且保留足够的催化活性的酶。例如,当经历升高的温度达变性双链核酸所需的时间时,热稳定聚合酶保留实现后续引物延伸反应的足够活性。核酸变性所需的加热条件是本领域众所周知的,并且在美国专利号4,683,202和4,683,195中例示。如本文使用的,热稳定聚合酶一般适合于在温度循环条件例如聚合酶链反应(“pcr”)中使用。热稳定核酸聚合酶的例子包括水生栖热菌(thermusaquaticus)taqdna聚合酶、栖热菌属物种(thermussp.)z05聚合酶、黄栖热菌(thermusflavus)聚合酶、海栖热袍菌(thermotogamaritima)聚合酶例如tma-25和tma-30聚合酶、tthdna聚合酶等。
“修饰的”酶指包含氨基酸聚合物的酶,其中至少一个单体不同于参考序列,例如天然或野生形式的酶。示例性修饰包括单体插入、缺失和取代。修饰的酶还包括嵌合酶,其具有衍生自2种或更多种亲本酶的可鉴定的组分序列(例如结构或功能结构域等)。在修饰的酶的定义内还包括的是包含参考序列的化学修饰的那些。修饰的聚合酶的例子包括g46ee678gcs5dna聚合酶、g46el329ae678gcs5dna聚合酶、g46el329ad640gs671fcs5dna聚合酶、g46el329ad640gs671fe678gcs5dna聚合酶、g46ee678gcs6dna聚合酶、δz05聚合酶、δz05-gold聚合酶、δz05r聚合酶、e615gtaqdna聚合酶、e678gtma-25聚合酶、e678gtma-30聚合酶等。
术语“5'至3'核酸酶活性”或“5’-3’核酸酶活性”指一般与核酸链合成相关的核酸聚合酶的活性,由此从核酸链的5'末端去除核苷酸,例如大肠杆菌(e.coli)dna聚合酶i具有这个活性,而克列诺(klenow)片段则没有。
术语“3'至5'核酸酶活性”或“3’-5’核酸酶活性”或“校正活性”指核酸聚合酶的活性,由此从核酸链的3'末端去除核苷酸,例如大肠杆菌dna聚合酶iii具有这个活性,而水生栖热菌(taq)dna聚合酶则没有。
“标记”指附着(共价或非共价)至分子且能够提供关于分子的信息的部分。示例性标记包括荧光标记、比色标记、化学发光标记、生物发光标记、放射性标记、质量修饰基团、抗体、抗原、生物素、半抗原和酶(包括过氧化物酶、磷酸酶等)。
“保真性”或“复制保真性”是在模板依赖性聚合作用过程中核酸聚合酶掺入正确核苷酸的能力。在复制保真性的背景中,在新生核苷酸链上的“正确核苷酸”是经由标准沃森-克里克碱基配对与模板核苷酸配对的核苷酸。特定聚合酶的复制保真性起因于经由聚合酶的3’-5’核酸酶活性从新生核苷酸链的3'末端掺入正确核苷酸和去除不正确核苷酸的组合。测量核苷酸聚合酶的保真性的各种方法在tindall等人(1988)fidelityofdnasynthesisbythethermusaquaticusdnapolymerase.biochemistry,27:6008-6013中综述。一般地,具有3’-5’核酸酶(校正)能力的聚合酶比不含校正活性的聚合酶具有更高的保真性。
在核酸扩增反应的背景中,“热启动”指这样的规程,其中在温度足够升高以提供一种或多种引物的必需杂交特异性以前不让反应混合物得到至少一种关键试剂(或如果存在于反应混合物中,那么试剂保持失活)。“热启动酶”是能够在热启动规程中充当“制止(withheld)”或失活试剂的酶,一般为核酸聚合酶。
“选择性核苷酸”是在等位基因特异性引物中对引物赋予等位基因选择性的核苷酸。选择性核苷酸与靶核酸的所需变体中的相应核苷酸互补,但与靶核酸的不希望有的变体中的相应核苷酸不互补。在引物中,超过一个核苷酸可以与靶核酸的所需变体中的核苷酸互补,但与靶核酸的不希望有的变体中的相应核苷酸不互补。然而,选择性核苷酸定位于在引物内影响引物特异性的位置上。选择性核苷酸允许靶核酸的有效或无效扩增,这取决于在靶核酸中是否发现或未发现互补配偶体。引物可以含有超过一个选择性核苷酸。
“沃森-克里克碱基配对”或简单地“碱基配对”指在双链核酸分子内的“常规”氢键合。沃森-克里克碱基配对是在互补碱基之间的氢键合,例如在腺嘌呤和胸腺嘧啶之间、在鸟嘌呤和胞嘧啶之间、在腺嘌呤和尿嘧啶之间、和在这些碱基的类似物之间的氢键合。
如本文使用的,术语“蝎子”、“蝎子样”或“蝎子arms样”指示单分子引物-探针组合,如whitcombe等人,(1999).detectionofpcrproductsusingself-probingampliconsandfluorescence,naturebiotech.17:804-807中所述。在本发明的含义内的蝎子或蝎子样引物掺入蝎子的一般元件,即探针部分、茎环部分和引物部分。“蝎子”或“蝎子样”单分子引物-探针形式的例子在图4中举例说明。
如本文使用的,例如在表达“与靶序列的一个或多个变体至少部分互补,但具有与靶序列的仅一个变体互补的至少一个内部选择性核苷酸的第二种寡核苷酸”中的术语“内部的”,指示除3'末端外的任何核苷酸,例如3'末端内部地1–5个核苷酸。
表达“其中所述聚合酶能够在所述选择性核苷酸与靶形成碱基对时优先延伸所述第二种寡核苷酸,并且在所述选择性核苷酸不与靶形成碱基对时基本上更少”意指当选择性核苷酸与靶形成碱基对时,通过聚合酶的第二种寡核苷酸的延伸比当所述选择性核苷酸不与靶形成碱基对时更有效。这可以例如用实施例1中所述的材料和方法进行测量或定量,其结果显示于图1上。
本发明教导了新等位基因特异性扩增引物、设计此种引物的方法、在等位基因特异性扩增中使用引物的方法、包括该引物的反应混合物和试剂盒。设计引物的方法可以单独或与设计等位基因特异性引物的现有方法结合使用。一般的等位基因特异性引物设计为与靶序列的多态性区域杂交且含有至少一个选择性核苷酸,即与靶中的多态性核苷酸的所需变体互补且与靶的不希望有的变体不互补的核苷酸。传统上,认为必须将选择性核苷酸置于引物的3'末端上,这是因为末端错配被认为是等位基因特异性扩增的必需先决条件。参见newton等人(1989)analysisofanypointmutationindna.theamplificationrefractorymutationsystem(arms).nucl.acidsres.17:2503-2516。
本发明人已发现选择性核苷酸的内部放置足以确保引物的等位基因特异性。末端错配不是对引物赋予特异性必需的。单独的内部错配足以抑制通过核苷酸聚合酶的错配引物的延伸。根据本发明,将选择性核苷酸放置于引物的3'末端内部,在3'末端内部地1–5个核苷酸之间。当内部核苷酸是错配的时,不希望有的、错配的模板不扩增或更不有效地扩增,而所需、匹配的模板有效扩增。
在一个实施方案中,本发明是用于在等位基因特异性pcr中使用的寡核苷酸(引物)。本发明的引物包含10-50、更优选15-35个核苷酸,其中大多数与靶序列的超过一个变体中的序列互补。引物还含有与靶序列的仅一个变体互补的至少一个内部选择性核苷酸。
在一些实施方案中,等位基因特异性引物进一步含有具有化学修饰的一个或多个核苷酸,所述化学修饰进一步增加其特异性。例如,在核碱基(nucleobase)的环外胺上的修饰已在美国专利号6,001,611中描述。根据本发明的等位基因特异性引物可以具有在一种或多种核碱基的环外胺上的修饰。在一些实施方案中,修饰的碱基核苷酸在3'末端核苷酸上游的1–5个核苷酸之间、但优选3个核苷酸处出现。在其他实施方案中,修饰的碱基核苷酸是3'末端核苷酸。在一些实施方案中,修饰的碱基核苷酸在3'末端核苷酸以及寡核苷酸引物内其他地方出现。在另外其他实施方案中,修饰可以置于等位基因特异性引物内的选择性核苷酸上。
根据本发明,环外氨基的合适修饰可以基于下述特性的存在进行选择:(1)该修饰干扰但不阻止修饰的碱基与双链核酸中的互补碱基的沃森-克里克碱基配对;(2)该修饰干扰但不阻止含有修饰的碱基的引物通过核酸聚合酶的延伸;(3)该修饰允许与掺入修饰的碱基的链互补的链的合成;和(4)该修饰增加掺入修饰的引物的选择性。
环外氨基的例子包括在腺苷的6-位置、鸟苷的2-位置和胞苷的4-位置中的氨基。参与与互补核酸链的碱基配对的环外氨基还可以在核苷酸中的各个非常规含氮碱基中出现。具有非常规碱基的核苷的例子包括但不限于3-甲基腺苷、7-甲基鸟苷、3-甲基鸟苷、5-甲基胞苷和5-羟甲基胞苷。此种非常规碱基的环外氨基的合适修饰还可以根据本发明的经验方法加以选择。
分别含有修饰的腺嘌呤、鸟嘌呤和胞嘧啶碱基的修饰的核苷酸的结构显示于下文,
其中s代表糖部分,并且r代表改性剂基团。想象了多种改性剂基团,其具有上文概述的4个特性。在特定实施方案中,改性剂基团具有结构:
其中r1和r2独立地选自氢、烷基、烷氧基、未取代或取代的芳基和苯氧基。
烷基可以是分支或未分支的
烷基可以是c1-c20烷基,特别是c1-c10烷基。
烷氧基可以是c1-c20烷氧基,特别是c1-c10烷氧基。
芳基可以是未取代或取代的苯基或萘基(naphtyl)。
在一个实施方案中,r是苄基或取代的苄基。在特定实施方案中,取代的苄基可以具有下述结构:
其中r3代表c1-c6分支或未分支的烷基,更优选c1-c4分支或未分支的烷基,烷氧基或硝基。优选地,r3附着在对位中。
在一些实施方案中,改性剂基团由下文显示的结构代表:
一般而言,来自本文描述的化合物类别的特定合适改性剂基团的经验选择可以由本领域技术人员照常规进行,基于上文列出的4个特性的存在。优选地,通过在等位基因特异性扩增反应中使用具有修饰的核苷酸的引物凭经验测定特定基团的适合性。当与具有未修饰的引物的等同反应相比较时,通过利用具有碱基修饰的引物的反应的选择性增加指示修饰的适合性。
在引物和模板之间的另外错配进一步使引物和靶序列的不希望有的变体之间的杂交体去稳定。用于最佳化等位基因特异性引物设计的方法可以在newton等人(1989)同上中找到。
本发明的等位基因特异性引物可以掺入本领域已知的引物设计的各个方面。例如,引物可以采取单分子引物-探针组合的形式,其称为“蝎子”且在whitcombe等人,(1999)detectionofpcrproductsusingself-probingampliconsandfluorescence,naturebiotech.17:804-807中描述。根据本发明设计的蝎子引物掺入蝎子的一般元件,即探针部分、茎环部分和引物部分。进一步地,在根据本发明设计的蝎子中,引物部分含有内部放置的选择性核苷酸。任选地,在根据本发明设计的蝎子中的引物部分可以含有一个或多个化学修饰的核苷酸。
总之,本发明的等位基因特异性引物最低限度具有下述4个特征:1)5'部分,与靶序列的所需和不希望有的变体至少部分互补;2)内部选择性核苷酸,仅与靶序列的所需变体互补且位于3'部分内;3)3'部分,与靶序列的所需和不希望有的变体至少部分互补;和4)与靶序列的所需和不希望有的形式互补的3'末端核苷酸。5'部分和3'部分可以含有另外的选择性核苷酸,其仅与靶序列的所需形式互补,只要引物的3'末端核苷酸与靶序列的所需和不希望有的形式互补。
等位基因特异性引物的合适5'部分和3'部分的凭经验选择可以通过本领域技术人员照常规执行。具体地,5'部分和3'部分的长度、互补性程度以及在引物的5'部分和3'部分中核苷酸的化学修饰可以改变,只要引物具有上文阐述的4个特征。优选地,通过在等位基因特异性扩增中使用引物凭经验测定特定等位基因特异性引物的适合性。引物的适合性通过利用引物的扩增的选择性指示。
在另一个方面,本发明是靶核酸的等位基因特异性扩增的方法。扩增涉及具有选择性核苷酸的等位基因特异性引物的使用,所述选择性核苷酸放置于引物的3'末端内部,例如在3'末端内部地1–5个核苷酸之间。
在一个实施方案中,本发明是靶序列变体的等位基因特异性扩增的方法,所述靶序列以几个变体序列的形式存在,该方法包括:提供可能含有靶序列的至少一个变体的样品;提供与靶序列的一个或多个变体至少部分互补的第一种寡核苷酸;提供与靶序列的一个或多个变体至少部分互补,但具有与靶序列的仅一个变体互补的至少一个内部选择性核苷酸的第二种寡核苷酸;提供适合于所述第一种和第二种寡核苷酸与靶序列的至少一个变体杂交的条件;提供适合于通过核酸聚合酶的寡核苷酸延伸的条件;其中在第二种寡核苷酸与它对于其具有所述互补内部选择性核苷酸的靶序列变体杂交时,所述聚合酶能够延伸所述第二种寡核苷酸,并且在所述第二种寡核苷酸与它对于其具有非互补内部选择性核苷酸的靶序列变体杂交时,基本上更少;并且重复杂交和延伸步骤顺序多次。
在本发明的一些实施方案中,扩增涉及聚合酶链反应,即模板变性、寡核苷酸引物与模板的退火(杂交)、和引物通过核酸聚合酶的延伸的反复循环。在一些实施方案中,退火和延伸在相同温度步骤发生。
在一些实施方案中,扩增反应涉及热启动规程。在等位基因特异性扩增的背景中,就错配靶而言的等位基因特异性引物的选择性可以通过使用热启动规程得到增强。许多热启动规程是本领域已知的,例如蜡的使用、关键试剂与反应混合物的其余部分的分离(美国专利号5,411,876)、通过抗体可逆地灭活的核酸聚合酶的使用(美国专利号5,338,671)、通过设计为特异性结合其活性位点的寡核苷酸可逆地灭活的核酸聚合酶(美国专利号5,840,867)、或具有可逆化学修饰的核酸聚合酶的使用,如例如在美国专利号5,677,152和5,773,528中所述的。
在本发明的一些实施方案中,等位基因特异性扩增测定是实时pcr测定。在实时pcr测定中,扩增的量度是“阈循环”或ct值。在等位基因特异性实时pcr测定的背景中,在匹配和错配模板之间在ct值中的差异是在测定的等位基因或选择性之间的区分的量度。更大的差异指示在错配模板扩增中的更大延迟,并且因此指示在等位基因之间的更大区分。经常错配模板以比匹配模板大得多的量存在。例如,在组织样品中,仅小部分的细胞可以是恶性的且携带通过等位基因特异性扩增测定靶向的突变(“匹配模板”)。正常细胞中存在的错配模板可以更不有效地扩增,但占优势的正常细胞将克服在扩增中的任何延迟且消除突变体模板的任何优点。为了检测在野生型模板的存在下的罕见突变,等位基因特异性扩增测定的特异性是关键的。
本发明的等位基因特异性扩增测定可以采用本领域已知的任何合适的核酸聚合酶。对于本发明的等位基因特异性pcr测定,可以使用任何热稳定的核酸聚合酶。还可以使用修饰的、工程改造的或嵌合聚合酶。有时希望使用不含校正(3’-5’外切核酸酶)活性的酶,例如taqdna聚合酶。还可能希望使用基本上或完全缺乏5’-3’核酸酶活性的酶,例如在美国专利号5,795,762中描述的。此种酶的一个例子是δz05聚合酶。有时可能希望具有含“热启动”能力的酶,例如在美国专利号5,677,152和5,773,528中所述的可逆地修饰的酶。热启动酶的一个例子是δz05-gold聚合酶。一般已知等位基因特异性引物的特异性在不同酶中可能稍微不同。参见newton等人(1989)analysisofanypointmutationindna.theamplificationrefractorymutationsystem(arms).nucl.acidsres.17:2503-2516。基于newton(上文)中所述的规程,普通技术人员将将能够最佳化反应参数,例如通过改变盐浓度和温度概况,以达到关于每种酶的最大限度特异性且选择最佳的酶用于特定测定。
本发明的等位基因特异性pcr的特殊优点是使用具有校正3’-5’核酸酶活性的聚合酶的能力。此种酶的例子可以在us7,148,049中发现。此种酶包含例如海栖热袍菌。这些酶一般比不含校正活性的酶具有更高的保真性(即在最终产物中更少错掺入的核苷酸)。例如,关于taqdna聚合酶(其不具有校正功能)的错误率是约10-4。tindall等人(1988)fidelityofdnasynthesisbythethermusaquaticusdnapolymerase.biochemistry,27:6008-6013。相比之下,校正热稳定pfudna聚合酶的错误率是约10-6。andre等人(1997)fidelityandmutationalspectrumofpfudnapolymeraseonahumanmitochondrialdnasequence,genomeres.7:843-852。在本发明前,高保真性校正聚合酶不能与等位基因特异性pcr一起使用。参见美国专利号5,639,611。酶的核酸酶活性将去除来自引物3'末端的错配的选择性核苷酸,从而消除引物的等位基因特异性。在本发明中,等位基因特异性引物具有不在3'末端而在内部的选择性核苷酸。内部错配是关于校正酶的外切核酸酶活性的无效底物。已观察到当错配定位远离3'末端时,外切核酸酶去除错配核苷酸的能力急剧下降。fidalgo-dasilva等人(2007)dnapolymeraseproofreading:activesiteswitchingcatalyzedbythebacteriophaget4dnapolymerase,nucl.acidsres.35:5452-5463。3个核苷酸的去除率比2个核苷酸低得多。reddy等人(1992)processiveproofreadingisintrinsictot4dnapolymerase.j.biol.chem.267:14157-14166。因此,本发明的具有内部选择性核苷酸的引物可以与校正核苷酸聚合酶一起使用。本领域技术人员将认识到如何最佳化反应条件,例如通过改变反应缓冲液的组成和核酸前体的浓度,以使酶的外切核酸酶活性降到最低,而不损害等位基因特异性扩增。关于有利于聚合作用的条件和有利于各种核酸聚合酶的核酸酶消化活性的条件,参见例如,goodman等人(1993)biochemicalbasisofdnareplicationfidelity,crit.rev.biochem.mol.biol.28:83-126。
在该方法的一些实施方案中,扩增产物可以通过本领域已知的任何技术进行检测,包括但不限于标记的引物和探针以及各种核酸结合染料的使用。检测方法可以是对于靶序列的一个变体特异性的,或可以是对于靶序列的所有变体或甚至对于所有双链dna一般的。
扩增产物可以在扩增已完成后检测,例如通过未标记产物的凝胶电泳和用核酸结合染料的凝胶染色。可替代地,扩增产物可以携带放射性或化学标记,借助于在合成过程中的掺入或借助于作为标记的引物的延伸产物。在电泳后或在电泳过程中,标记的扩增产物可以用本领域已知的合适放射性或化学工具进行检测。在电泳后,产物还可以用通过本领域已知的任何一种方法标记的靶特异性探针进行检测。标记的探针还可以应用于靶而无需电泳,即在“斑点印迹”测定等中。
在其他实施方案中,扩增产物的存在可以在均质测定中进行检测,即其中新生产物在扩增循环过程中检测的测定,或至少在相同未打开的管中,并且不需要扩增后处理。均质扩增测定已例如在美国专利号5,210,015中描述。使用核酸-嵌入染料的均质扩增测定已例如在美国专利号5,871,908和6,569,627中描述。均质测定还可以采用由2种相互作用荧光团标记的荧光探针,例如“分子信标(molecularbeacon)”探针(tyagi等人,(1996)nat.biotechnol.,14:303-308)或荧光标记的核酸酶探针(livak等人,(1995)pcrmeth.appl.,4:357-362)。扩增产物还可以使用称为“蝎子”的单分子探针-引物组合进行检测。whitcombe等人,(1999)detectionofpcrproductsusingself-probingampliconsandfluorescence,naturebiotech.17:804-807。蝎子寡核苷酸的引物部分可以是根据本发明设计的等位基因特异性引物。
在本发明的方法的特定变体中,扩增产物还可以借助于其独特的解链温度进行鉴定,参见美国专利号5,871,908和6,569,627。
在另一个实施方案中,本发明提供了用于选择性扩增靶序列的所需变体的反应混合物,所述靶序列以几个变体序列的形式存在,该混合物包括与靶序列的一个或多个变体至少部分互补的第一种寡核苷酸;和与靶序列的一个或多个变体至少部分互补,但具有与靶序列的仅一个变体互补的至少一个内部选择性核苷酸的第二种寡核苷酸。反应混合物还可以含有核酸聚合酶,在第二种寡核苷酸与它对于其具有所述互补内部选择性核苷酸的靶序列变体杂交时,所述核酸聚合酶能够延伸所述第二种寡核苷酸,并且在所述第二种寡核苷酸与它对于其具有非互补内部选择性核苷酸的靶序列变体杂交时,基本上更少。在一些实施方案中,反应混合物进一步包含核酸扩增一般必需的试剂和溶液,包括核酸前体,即三磷酸核苷,以及适合于支持核苷酸聚合酶活性的有机和无机离子。
在另一个实施方案中,本发明提供了用于根据本发明执行等位基因特异性扩增的试剂盒。该试剂盒一般包括测定特异性组分以及执行核酸扩增一般必需的组分。作为测定特异性组分,本发明的等位基因特异性扩增试剂盒含有与靶序列的一个或多个变体至少部分互补的第一种寡核苷酸;与靶序列的一个或多个变体至少部分互补,但具有与靶序列的仅一个变体互补的至少一个内部选择性核苷酸的第二种寡核苷酸;和任选地,与试剂盒中装入的寡核苷酸至少部分互补的包含一定量的靶序列的至少一个变体的对照核酸序列。在一些实施方案中,可以装入对照核酸序列的超过一个变体。作为核酸扩增一般必需的组分,本发明的试剂盒可以包括一种或多种核酸聚合酶、核酸前体例如三磷酸核苷三磷酸脱氧核糖核苷或三磷酸核糖核苷、用于使核酸的焦磷酸解作用降到最低的焦磷酸酶、用于保护不受扩增反应的遗留污染的尿嘧啶n-糖基化酶(ung)、扩增反应和检测所需的预先制备的试剂和缓冲液、和用于执行根据本发明的等位基因特异性扩增的一组说明书。
提供了下述实施例和附图以帮助理解本发明,其真实范围在附加权利要求中阐述。应当理解可以在不背离本发明的精神的情况下在阐述的程序中做出修饰。
实施例
在下文实施例中,使用模板序列的2个变体:具有与等位基因特异性引物中的选择性核苷酸互补的序列的匹配变体,和具有与等位基因特异性引物中的选择性核苷酸非互补的序列的错配变体。
作为匹配靶,实施例利用人braf基因(genebank参考文献)的v600e突变。匹配变体是具有掺入brafv600e突变序列(seqidno:19)的插入片段的质粒dna,而错配变体是具有braf野生型序列(seqidno:20)的相同质粒。
seqidno:19(brafv600e突变序列片段)
seqidno:20(braf野生型序列片段)
这个突变是氨基酸600的缬氨酸至谷氨酸改变,这起因于在braf基因的核苷酸1799上的胸腺嘧啶(t)至腺嘌呤(a)转换。该突变在许多癌症中发现且被认为有助于癌症进展,这是因为它导致mapk途径的组成型活化。在肿瘤细胞群体中这个单核苷酸变化的检测具有在人癌症诊断和治疗中的效用。
突变靶是“匹配的”,即与等位基因特异性引物各自的选择性核苷酸形成a-t沃森-克里克对(表a)。错配的靶是野生型braf序列。错配的靶与等位基因特异性引物各自的选择性核苷酸形成错配。
表a
引物
*选择性核苷酸是有下划线的
x–n6-苄基-da
y–n6-对叔丁基苄基-da
z–n6-对叔丁基苄基-dc。
实施例1
使用具有内部选择性核苷酸的引物的等位基因特异性扩增
在这个实施例中,使用模板序列的2个变体:具有与等位基因特异性引物中的选择性核苷酸互补的序列的匹配变体,和具有与等位基因特异性引物中的选择性核苷酸非互补的序列的错配变体。匹配变体是具有代表含v600e突变的braf序列的插入片段的质粒dna。错配变体是具有braf野生型序列的相同质粒。正向引物(seqidno:1-4)和反向引物(seqidno:11)显示于表a中。用在n-2位置上的3'末端内部的选择性核苷酸设计正向等位基因特异性引物。一些引物含有指出的化学修饰。
每个50µl反应含有任一靶的105拷贝、8%甘油、50mmn-[2-羟-1,1-二羟甲基乙基]甘氨酸(tricine)(ph7.7)、45mm乙酸钾(ph7.5)、200µm每种datp、dctp和dgtp、400µmdutp、0.1µm正向引物、0.7µm反向引物、2µmsyto-13嵌入染料、1%dmso、2单位尿嘧啶-n-糖基化酶(ung)、50单位δz05-golddna聚合酶和3mm乙酸镁。扩增和分析使用rochelightcycler480仪器完成。对反应实施下述温度概况:50℃5分钟(ung步骤),95℃10分钟,随后为95℃15秒和59℃40秒的60-70个循环。在每个59℃步骤结束时在495-525nm处收集荧光数据。
结果显示于图1和表1上。扩增的选择性通过在匹配和错配靶之间在ct值中的差异(δct)进行测量。关于每个实验的δct在每个图上指出。数据显示靶的匹配(突变型)变体选择性扩增超过错配(野生型)变体。选择性通过引物中核苷酸的化学修饰得到增强。在这个表中,位置n指示相对于3'末端的核苷酸位置。
表1
*y–n6-对叔丁基苄基-da
x–n6-苄基-da。
实施例2:
使用具有内部选择性核苷酸的引物和不同核酸聚合酶的等位基因特异性扩增
在这个实施例中,使用表a中所示的引物扩增与实施例1中相同的匹配(突变型)和错配(野生型)靶。在z05、δz05或δz05-gold聚合酶的存在下执行扩增。
所有反应一式三份进行,在15µl体积中含有任一靶的105拷贝、200µm每种datp、dctp和dgtp、400µmdutp、0.1µm正向引物、0.7µm反向引物、2µmsyto-13嵌入染料、1%dmso、0.04u/µl尿嘧啶-n-糖基化酶(ung)和3mm乙酸镁。z05反应含有3u聚合酶、130mm乙酸钾(ph7.5)、5%甘油和50mmn-[2-羟-1,1-二羟甲基乙基]甘氨酸(ph8.3)。δz05反应含有3u聚合酶、25mm乙酸钾(ph7.5)、5%甘油和50mmn-[2-羟-1,1-二羟甲基乙基]甘氨酸(ph8.3)。δz05-gold反应含有15u聚合酶、45mm乙酸钾(ph7.5)、8%甘油和50mmn-[2-羟-1,1-二羟甲基乙基]甘氨酸(ph7.7)。
扩增和分析使用rochelightcycler480仪器完成。对反应实施下述温度概况:50℃5分钟(ung步骤),95℃10分钟,随后为95℃15秒和59℃40秒的99个循环。在每个59℃步骤结束时在465-510nm处收集荧光数据。
结果显示于表2上。扩增的选择性通过在匹配和错配靶之间在ct值中的差异(δct)进行测量。关于每个实验的δct在表2中指出。数据显示靶的匹配(突变型)变体选择性扩增超过错配(野生型)变体。选择性通过引物中核苷酸的烷基修饰得到增强。在这个表中,位置n指示相对于3'末端的核苷酸位置。
表2
n/a–无数据。
实施例3:
使用具有内部碱基修饰和/或内部选择性核苷酸的蝎子arms样引物的等位基因特异性扩增
表3
x–n6-苄基-da
y–n6-对叔丁基苄基-da
f–cx-fam供体荧光团
q–bhq-2“黑洞(blackhole)”猝灭剂
j-heg
p–3’-磷酸
*等位基因选择性核苷酸是有下划线的(距离3'末端n或n-1位置)。
在这个实施例中,模板序列的2个变体以等量存在,与引物序列互补的匹配变体,和错配变体。匹配变体是具有代表brafv600e突变序列(seqidno:1)的插入片段的质粒dna,而错配变体是具有braf野生型序列(seqidno:2)的相同质粒。正向引物(seqidno:6、9、12-17)和反向引物(seqidno:11)如表3中所述。用在或接近3'末端位置的snp设计正向aspcr引物,含或不含一个或多个n6-对叔丁基苄基-da修饰。aspcr引物与下游检测探针(seqid:18)配对或与闭合蝎子arms样形式的探针互补体连接。
每个50µl反应含有任一靶的105拷贝、5%甘油、50mmn-[2-羟-1,1-二羟甲基乙基]甘氨酸(ph8.3)、150mm乙酸钾(ph7.5)、200µm每种datp、dctp和dgtp、400µmdutp、0.4µm正向引物、0.4µm反向引物、1%dmso、2单位尿嘧啶-n-糖基化酶(ung)、10单位z05聚合酶和3mm乙酸镁。将0.2um检测探针添加到含有引物6、9、12和14的反应中,其中探针互补体不与正向引物连接。
扩增和分析使用rochelightcycler480仪器完成。对反应实施下述温度概况:50℃5分钟(ung步骤),随后为95℃15秒和59℃40秒的95个循环。在每个59℃退火/延伸步骤结束时在495-525nm范围处收集荧光数据。
结果显示于图2和表4上。扩增的选择性通过在匹配和错配靶之间在ct值中的差异(δct)进行测量。关于每个实验的δct在每个图上指出且概括于表4中。数据显示使用个别引物和探针或以闭合蝎子arms样形式连接的引物和探针,靶的匹配(突变型)变体选择性扩增超过错配(野生型)变体。无论选择性核苷酸在3'末端还是内部都达到区分。另外,扩增的选择性通过添加一个或多个烷基修饰得到增强。
表4
虽然本发明已就具体例子而言详细描述,但对于本领域技术人员显而易见的是,可以在本发明的范围内做出各种修饰。因此,本发明的范围不应受本文描述的任何例子限制,而是受下文呈现的权利要求限制。
序列表
<110>f.hoffmann-larocheag
rochediagnosticsgmbh
<120>核酸的等位基因特异性扩增
<130>26248wo-koe
<150>us61/285,690
<151>2009-12-11
<160>20
<170>patentinversion3.5
<210>1
<211>33
<212>dna
<213>人工序列
<220>
<223>人工序列描述:合成的引物
<400>1
taaaaataggtgattttggtctagctacagaga33
<210>2
<211>33
<212>dna
<213>人工序列
<220>
<223>人工序列描述:合成的引物
<220>
<221>modified_base
<222>(29)..(29)
<223>n6-对叔丁基苄基-da
<400>2
taaaaataggtgattttggtctagctacagaga33
<210>3
<211>33
<212>dna
<213>人工序列
<220>
<223>人工序列描述:合成的引物
<220>
<221>modified_base
<222>(31)..(31)
<223>n6-对叔丁基苄基-da
<400>3
taaaaataggtgattttggtctagctacagaga33
<210>4
<211>33
<212>dna
<213>人工序列
<220>
<223>人工序列描述:合成的引物
<220>
<221>modified_base
<222>(33)..(33)
<223>n6-苄基-da
<400>4
taaaaataggtgattttggtctagctacagaga33
<210>5
<211>33
<212>dna
<213>人工序列
<220>
<223>人工序列描述:合成的引物
<220>
<221>modified_base
<222>(29)..(29)
<223>n6-对叔丁基苄基-da
<220>
<221>modified_base
<222>(33)..(33)
<223>n6-对叔丁基苄基-da
<400>5
taaaaataggtgattttggtctagctacagaga33
<210>6
<211>33
<212>dna
<213>人工序列
<220>
<223>人工序列描述:合成的引物
<400>6
gtaaaaataggtgattttggtctagctacagag33
<210>7
<211>33
<212>dna
<213>人工序列
<220>
<223>人工序列描述:合成的引物
<220>
<221>modified_base
<222>(32)..(32)
<223>n6-对叔丁基苄基-da
<400>7
gtaaaaataggtgattttggtctagctacagag33
<210>8
<211>33
<212>dna
<213>人工序列
<220>
<223>人工序列描述:合成的引物
<220>
<221>modified_base
<222>(30)..(30)
<223>n6-对叔丁基苄基-da
<400>8
gtaaaaataggtgattttggtctagctacagag33
<210>9
<211>33
<212>dna
<213>人工序列
<220>
<223>人工序列描述:合成的引物
<220>
<221>modified_base
<222>(30)..(30)
<223>n6-对叔丁基苄基-da
<220>
<221>modified_base
<222>(32)..(32)
<223>n6-对叔丁基苄基-da
<400>9
gtaaaaataggtgattttggtctagctacagag33
<210>10
<211>33
<212>dna
<213>人工序列
<220>
<223>人工序列描述:合成的引物
<220>
<221>modified_base
<222>(29)..(29)
<223>n6-对叔丁基苄基-dc
<220>
<221>modified_base
<222>(32)..(32)
<223>n6-对叔丁基苄基-da
<400>10
gtaaaaataggtgattttggtctagctacagag33
<210>11
<211>25
<212>dna
<213>人工序列
<220>
<223>人工序列描述:合成的引物
<220>
<221>modified_base
<222>(25)..(25)
<223>n6-苄基-da
<400>11
tagcctcaattcttaccatccacaa25
<210>12
<211>33
<212>dna
<213>人工序列
<220>
<223>人工序列描述:合成的引物
<400>12
agtaaaaataggtgattttggtctagctacaga33
<210>13
<211>65
<212>dna
<213>人工序列
<220>
<223>人工序列描述:合成的引物-探针
<400>13
cccgcgcggacccactccatcgagagcgcgggagtaaaaataggtgattttggtctagct60
acaga65
<210>14
<211>33
<212>dna
<213>人工序列
<220>
<223>人工序列描述:合成的引物
<220>
<221>modified_base
<222>(31)..(31)
<223>n6-对叔丁基苄基-da
<400>14
agtaaaaataggtgattttggtctagctacaga33
<210>15
<211>65
<212>dna
<213>人工序列
<220>
<223>人工序列描述:合成的引物-探针
<220>
<221>modified_base
<222>(63)..(63)
<223>n6-对叔丁基苄基-da
<400>15
cccgcgcggacccactccatcgagagcgcgggagtaaaaataggtgattttggtctagct60
acaga65
<210>16
<211>65
<212>dna
<213>人工序列
<220>
<223>人工序列描述:合成的引物-探针
<400>16
cccgcgcggacccactccatcgagagcgcggggtaaaaataggtgattttggtctagcta60
cagag65
<210>17
<211>65
<212>dna
<213>人工序列
<220>
<223>人工序列描述:合成的引物-探针
<220>
<221>modified_base
<222>(62)..(62)
<223>n6-对叔丁基苄基-da
<220>
<221>modified_base
<222>(64)..(64)
<223>n6-对叔丁基苄基-da
<400>17
cccgcgcggacccactccatcgagagcgcggggtaaaaataggtgattttggtctagcta60
cagag65
<210>18
<211>18
<212>dna
<213>人工序列
<220>
<223>人工序列描述:合成的探针
<400>18
tctcgatggagtgggtcc18
<210>19
<211>110
<212>dna
<213>智人(homosapiens)
<400>19
agtaaaaataggtgattttggtctagctacagagaaatctcgatggagtgggtcccatca60
gtttgaacagttgtctggatccattttgtggatggtaagaattgaggcta110
<210>20
<211>110
<212>dna
<213>智人(homosapiens)
<400>20
agtaaaaataggtgattttggtctagctacagtgaaatctcgatggagtgggtcccatca60
gtttgaacagttgtctggatccattttgtggatggtaagaattgaggcta110
- 还没有人留言评论。精彩留言会获得点赞!
- 一种检测水稻粒宽等位基因的特异性PCR分子标记和方法与流程
- 丝状真菌中多个基因拷贝的同时位点特异性整合的制造方法与工艺
- 一种特异性敲减人BRCC3基因慢病毒的构建及在肺癌中的应用的制造方法与工艺
- 烟粉虱MED隐种高温耐受相关基因特异性探针及其应用的制造方法与工艺
- CRISPR/SaCas9特异性敲除人CXCR4基因的方法与流程
- 玉米低镁条件下特异性转运镁离子基因ZmMGT10及其应用的制造方法与工艺
- CRISPR‑Cas9特异性敲除猪SLA‑3基因的方法及用于特异性靶向SLA‑3基因的sgRNA与制造工艺
- 构建在海马体区域特异性敲除IKKα基因的小鼠模型的方法及打靶载体和试剂盒与制造工艺
- 使用重叠非等位基因特异性引物和等位基因特异性阻断剂寡核苷酸的组合物进行等位基因特异性扩增的制造方法与工艺
- 用于检测烟草对tmv抗性的n基因特异性引物对、检测方法及试剂盒的制作方法
- 一种基于短链核酸探针和双链特异性核酸内切酶的高特异性microRNA荧光检测方法与流程
- IL‑1‑α和‑β双特异性双重可变结构域免疫球蛋白及其用途的制造方法与工艺
- 一种特异性标记家蚕微孢子虫的核酸探针及其原位荧光杂交检测方法与流程
- 核酸的等位基因特异性扩增的制造方法与工艺
- 一种特异性检测弓形虫核酸的荧光PCR方法和试剂盒与流程
- 一种特异性检测人类微小病毒B19核酸的荧光PCR方法和试剂盒与流程
- 一种特异性结合新城疫病毒的核酸适配体及其筛选方法和应用与流程
- 球形核酸纳米颗粒缀合物的序列特异性细胞摄取的制造方法与工艺
- 一种鸭特异性CpG寡脱氧核苷酸及其应用的制造方法与工艺
- 一种IgE特异性核酸适配子、其应用及适配子药物的制造方法与工艺
- 核酸的等位基因特异性扩增的制造方法与工艺
- 一种特异性检测弓形虫核酸的荧光PCR方法和试剂盒与流程
- 一种特异性检测人类微小病毒B19核酸的荧光PCR方法和试剂盒与流程
- 一种特异性结合新城疫病毒的核酸适配体及其筛选方法和应用与流程
- 球形核酸纳米颗粒缀合物的序列特异性细胞摄取的制造方法与工艺
- 一种IgE特异性核酸适配子、其应用及适配子药物的制造方法与工艺
- 基于核酸适配体特异性检测磺胺嘧啶的生物传感探针试剂盒及其应用的制造方法与工艺
- 一种特异性结合CD3的核酸适配体及其筛选方法和应用与流程
- 一种特异性结合GPC3的核酸适配体及其应用的制造方法与工艺
- 基于高特异性核酸适体荧光探针INS1胰岛素试剂盒及其检测方法与制造工艺