葡萄抗病相关基因VvPUB21及其植物表达载体和应用的制作方法
本发明涉及一种葡萄抗病相关基因VvPUB21的应用,同时还涉及包含VvPUB21基因的表达载体及其应用,属于植物基因工程领域。
背景技术:
近年来的研究发现,蛋白质泛素化广泛地参与植物防御调节,蛋白泛素化修饰过程的关键酶是泛素连接酶E3,它决定了底物蛋白的特异性识别,涉及植物-病原菌互作,包括早期的防御反应、基因对基因的互作和诱导性抗病。U-box蛋白是一种新型的E3蛋白,具有E3活性。研究发现U-box蛋白广泛存在于真菌、植物、动物中,在目前已鉴定出的真核生物U-box蛋白中,植物U-box(plant U-box protein,PUB)蛋白的数目远远多于其他生物。目前在拟南芥中已经发现六十多个PUB蛋白,并证实了有的PUB蛋白与植物防御病原物的侵染反应有关,如拟南芥中PUB22、PUB23和PUB24等3个U-box型E3连接酶的表达能被flg22型PAMP(Pathogen-associated molecular pattern)所诱导(Trujillo M等,2008,Current Biology 18(18):1396-1401)。在病原菌的侵袭下,PUB 22/23/24三突变体活性氧的产生比野生型明显提高,也能明显抑制病原菌的生长。与此相一致的是,活性氧产生相关基因在三突变体材料中也明显受诱导。在三突变体材料中,其他的PAMP,如elf18和几丁质等也能引起活性氧迸发。这些结果表明,植物中PUB22、PUB23和PUB24等E3连接酶是PAMPs激活PTI(PAMP-triggered immunity)下游信号因子所必需,证明了PUB22、PUB23和PUB24是植物抵抗病原菌侵入的抗病相关基因。
然而,目前泛素连接酶基因尤其是大多数新型的U-box蛋白基因在植物抗病反应中作用仍不是很清楚。本发明涉及的VvPUB21基因是葡萄单亚基U-box家族泛素连接酶家族成员之一。通过对葡萄U-box基因家族进行筛选和鉴定,验证了VvPUB21基因受葡萄多种病原菌的诱导表达。因此,对葡萄VvPUB21基因的开发是研究植物抗病的新途径,通过遗传转化相关基因改良葡萄抗病性弱的品种及其他植物品种,将进一步增强植物的抗病性,拓宽植物的抗谱,对于培育植物抗病新品种具有重要意义。
技术实现要素:
本发明的目的是提供一种葡萄抗病相关基因VvPUB21在增强植物抗病性中的应用。
本发明的第二个目的是提供一种植物超量表达载体。
本发明的第三个目的是提供一种植物超量表达载体在增强植物抗病性中的应用。
为了实现以上目的,本发明所采用的技术方案是:
一种葡萄抗病相关基因VvPUB21在增强植物抗病性中的应用,该基因的核苷酸序列如SEQ ID NO.1所示,长度1820bp,开放阅读框(ORF)从第108~1442位碱基,它所编码的蛋白质的氨基酸序列如SEQ ID NO.2所示(终止密码子不翻译),该蛋白质的分子量为50.27,等电点为8.92,在C末端含有一个U-box保守结构域。
具体的,葡萄抗病相关基因VvPUB21在增强植物抗病性中的应用,包括以下步骤:
1)将葡萄抗病相关基因VvPUB21连接到表达载体中,构建植物超量表达载体;
2)取植物超量表达载体转染农杆菌,再转入植物细胞中,即可。
一种植物超量表达载体,该表达载体含有如SEQ ID NO:1所示的葡萄抗病相关基因VvPUB21的开放阅读框。
具体的,所述表达载体为pCAMBIA3301-VvPUB21,其制备步骤如下:
(1)以葡萄cDNA为模板,P1、P2为引物,PCR扩增得到VvPUB21基因的开放阅读框,将扩增片段连接到pMD19-T克隆载体上,筛选得到阳性质粒pMD19-T-VvPUB21;
正向引物P1:5’-GGGAGATCTATGATTTCTTCTTGGAGAAGGCGGAG-3’,
反向引物P2:5’-GGGGGTGACCTCAAAAAGGCCTTTTGAGATCCTTG-3’;
P1下划线处为酶切位点Bgl II,P2下划线处为酶切位点BstE II;
(2)用Bgl II、BstE II分别双酶切阳性质粒pMD19-T-VvPUB21和植物表达载体pCAMBIA3301,回收目标片段与线性化载体,连接、转化后筛选、验证,即得。
上述植物超量表达载体(即含有如SEQ ID NO:1所示葡萄抗病相关基因VvPUB21的开放阅读框的表达载体)在增强植株抗病性中的应用。
本发明的有益效果:
本发明为增强植物对病原菌的抗性提供了一种新的基因VvPUB21。通过分离克隆葡萄叶片中VvPUB21基因的DNA片段,与能够超量表达该目标基因的载体连接,转化入植物细胞,通过超量表达VvPUB21基因改良植物对病原菌的抗性,控制病害的发生,减少或避免植物病害所带来的损失。同时,本发明开发的VvPUB21基因也为植物抗病拓宽了植物的抗谱,克服了传统育种不能植物种间转移抗病相关基因的问题。
附图说明
图1为葡萄叶片接种白粉菌后不同时间VvPUB21基因的表达量变化;
图2为VvPUB21基因转化拟南芥植株抗病性的鉴定;
图3为VvPUB21基因瞬时转化葡萄叶片后抗病性的鉴定。
具体实施方式
下面结合具体实施方式对本发明作进一步的说明。
实施例1
葡萄抗病相关基因VvPUB21的分离克隆,具体方法如下:
1)采用SDS/酚法提取葡萄叶片总RNA,操作如下:
准备提取液:向2.0mL离心管中加入850μL提取缓冲液(140mM LiCl,10mM EDTA,10mM Tris,5%(w/v)SDS,2%(w/v)PVP)与30μLβ-巯基乙醇,充分混匀,待用。
用液氮预冷研钵,取0.2g葡萄幼嫩叶片于研钵中,加适量液氮充分研磨后,分装至含有预先准备提取液的2.0mL离心管中,充分涡旋混匀,4℃条件下12000rpm离心5min;吸取上清液至另一2.0mL离心管中,加入等体积的氯仿-异戊醇(24:1),充分涡旋混匀,4℃条件下12000rpm离心15min;吸取上清液至另一2.0mL离心管中,加入1/3体积5M的KAc(pH4.8),充分涡旋混匀,4℃条件下12000rpm离心10min;吸取上清液至另一2.0mL离心管中,加入等体积的氯仿-异戊醇(24:1),充分涡旋混匀,4℃条件下12000rpm离心10min;吸取上清液至另一1.5mL离心管中,加入1/3体积8M LiCl,充分涡旋混匀,-20℃放置2h以上,然后4℃条件下12000rpm离心15min;轻轻地除去上清液,用800μL 75%乙醇洗涤沉淀两次(4℃条件下12000rpm离心8min);空气中干燥10min,待乙醇充分挥发,加入30μL DEPC-H2O溶解沉淀,即得葡萄叶片总RNA。
2)纯化总RNA
在1.5mL离心管中加入:总RNA 100μg,DNase I 10U,10×DNase buffer 10μL,RNasin 100U,DEPC-H2O补齐至100μL,充分混匀,37℃温育30min;加入等体积的酚-氯仿-异戊醇(25:24:1),充分涡旋混匀,4℃条件下12000rpm离心10min;吸取上清液至另一1.5mL离心管中,加入等体积的氯仿-异戊醇(24:1),充分涡旋混匀,4℃条件下12000rpm离心10min;吸取上清液至另一2ml离心管中,加入1/10体积3M NaAC(pH 5.2),2.5倍体积无水乙醇,-20℃放置2h以上;然后4℃条件下12000rpm离心15min;轻轻地除去上清液,用800μL 75%乙醇洗涤沉淀两次(4℃条件下12000rpm离心8min);空气中干燥10min待乙醇充分挥发,加入20μL DEPC-H2O溶解沉淀,即完成RNA纯化。
3)以RNA为模板反转录合成cDNA第一链
在PCR管中加入:Random 6mers(50μM)1μL,dNTP Mixture(10mM each)1μL,Total RNA 2μg,RNase free dH2O补齐至10μL,充分混匀,瞬时离心使溶液至PCR管底部。在PCR仪上65℃反应5min,冰上急冷;在PCR管中加入: Buffer 4μL,RNase Inhibitor(40U/μL)0.5μL, RTase(200U/μL)1μL,RNase Free dH2O补齐至20μL。在PCR仪上进行下述反应:30℃,10min;42℃,60min;95℃,5min;4℃,保存;反转录完成后即得cDNA第一链;-40℃保存备用。
4)以cDNA为模板进行PCR扩增
PCR克隆VvPUB21基因的PCR反应体系为:cDNA模板1μL,正、反向引物P3、P4各2μL,PCR Buffer 5μL,dNTP Mix 2.5μL,DNA Polymerase 1.0μL,PCR-Grade Water补齐至50μL,PCR反应程序为:94℃30sec,94℃30sec,56℃30sec,72℃3min,30cycles,72℃10min,4℃Forever;
正向引物P3:5’-GGGGATCATCAGTTTATTCAATTGTTG-3’(SEQ ID NO.3);
反向引物P4:5’-TCGGCCTCAACATGACACAGATTGAT-3’(SEQ ID NO:4)。
5)检测与回收
将PCR扩增的产物进行1%的琼脂糖凝胶电泳,回收目标片段,连接至pMD19-T载体,连接反应体系为:pMD19-T载体0.5μl,Solution I 2.5μL,目标片段2.0μL,充分混匀,在16℃条件下反应2h转化,将连接产物转化感受态TOP10细胞,在附加100mg/L Amp培养基上进行蓝白斑筛选,挑取阳性克隆接种至LB液体培养基摇菌培养,提取质粒得阳性质粒pMD19-T-VvPUB21,送公司测序检测,VvPUB21基因序列如SEQ ID NO:1所示。
实施例2
葡萄抗病相关基因VvPUB21超量表达载体的构建,具体方法如下:
以葡萄叶片cDNA为模板,以P1、P2为引物,P1下划线处为酶切位点Bgl II,P2下划线处为酶切位点BstE II。PCR扩增得到VvPUB21基因片段,连接至pMD19-T载体;连接反应体系为:pMD19-T载体0.5μL,Solution I 2.5μL,目标片段2.0μL,充分混匀,在16℃条件下反应2h;将连接产物转化TOP10感受态细胞,在附加Amp的LB培养基上进行蓝白斑筛选,挑取阳性克隆接种至LB液体培养基摇菌培养,提取质粒得阳性质粒pMD19-T-VvPUB21,送公司测序检测。将正确序列进行双酶切,双酶切反应体系为:质粒4μL,Bgl II内切酶0.5μL,BstE II内切酶0.5μL,ddH2O 15μL,充分混匀,37℃条件下反应2h;酶切产物经琼脂糖凝胶电泳检测。
正向引物P1:5’-GGGAGATCTATGATTTCTTCTTGGAGAAGGCGGAG-3’(SEQ ID NO:5);
反向引物P2:5’-GGGGGTGACCTCAAAAAGGCCTTTTGAGATCCTTG-3’(SEQ ID NO:6)。
用Bgl II、BstE II双酶切阳性质粒pMD19-T-VvPUB21与植物表达载体pCAMBIA3301,回收目标片段与线性化载体进行连接;连接反应体系为:pCAMBIA3301线性化载体5μL,Solution I 10μL,目标片段5μL,充分混匀,16℃条件下反应2h;连接产物转化TOP10感受态细胞,在附加卡那霉素的LB培养基上进行筛选,挑取阳性克隆接种至LB液体培养基(含100mg/L的卡那霉素)中摇菌培养,提取质粒,送公司测序检测,序列正确的质粒命名为pCAMBIA3301-VvPUB21。将正确序列进行双酶切,酶切反应体系为:质粒4μL,Bgl II内切酶0.5μL、BstE II内切酶0.5μL,ddH2O 15μL,充分混匀,在37℃条件下反应2h;酶切产物经琼脂糖凝胶电泳检测。
实施例3
植物超量表达载体pCAMBIA3301-VvPUB21转化农杆菌,具体方法如下:
电击杯置于紫外灯下处理20min;取出农杆菌GV3101感受态细胞,置于冰上融化,融化后转移至电击杯中,并加入10μL质粒,充分混匀,置于冰上5min;电击杯转移至电击仪中进行电击处理;处理后将电击杯中的转化液取出至1.5mL的离心管中,加入1mL LB培养基,28℃条件下培养1h;离心机中瞬时离心15s,去除部分上清液,悬浮后涂布在含有抗生素(60mg/L的庆大霉素,100mg/L的卡那霉素)的平板上,置于28℃培养。挑取单克隆接种至有抗生素(60mg/L的庆大霉素,100mg/L的卡那霉素)的液体LB培养基中,28℃条件下培养24h,经菌液PCR检测,得到阳性克隆。
实施例4
植物超量表达载体pCAMBIA3301-VvPUB21转化入植物,包括以下操作:
1)物超量表达载体pCAMBIA3301-VvPUB21转化入拟南芥
将转化植物表达载体pCAMBIA3301-VvPUB21的农杆菌接种至10mL LB液体培养基(含60mg/L的庆大霉素,100mg/L的卡那霉素)中,28℃培养24h;取5mL菌液转移至50mL新鲜的LB液体培养基(含60mg/L的庆大霉素和100mg/L的卡那霉素),28℃继续培养,至菌液OD600达到0.6左右;将菌液转移至离心瓶或离心管中,室温条件下,转速为4000rpm离心10min,去除上清液,收集菌体;重悬于渗透缓冲液(0.5×MS,5%蔗糖,0.03%Silwet L-77),调OD600至0.8;将拟南芥花序上已有的果荚去掉,花序完全浸入渗透液中20s(10~30s均可,或者用移液器直接将渗透液滴在花序上),立即去掉拟南芥叶或茎秆上的渗透液,将植株平放在托盘中,用塑料薄膜覆盖托盘,24h后取下薄膜,于温室中继续培养;为提高转化效率,7天之后用同样方法再次侵染;经过转化的拟南芥植株进行正常管理,待果荚现白色时收获种子;将收获的转基因种子用0.2%的TritonX-100浸泡10min;再用10%的次氯酸钠表面消毒12min;灭菌水洗涤五次,每次2min;少量水将种子混合均匀,用蓝色枪头(去尖)将种子铺在含除草剂(Basta,20mg/L)的MS(0.5×MS,1%蔗糖,1%琼脂,pH 5.7)平板上,4℃黑暗培养两天;然后转移至22℃,光照16h培养。经除草剂(Basta,20mg/L)筛选后仍然长势良好,真叶叶片及生长点呈深绿色且根部伸扎入培养基的幼苗即可初步确定为转基因植株,移栽至营养钵中继续培养。
2)植物超量表达载体pCAMBIA3301-VvPUB21转化入葡萄
将转化植物表达载体pCAMBIA3301-VvPUB21的农杆菌接种至10mL LB液体培养基(含60mg/L的庆大霉素,100mg/L的卡那霉素)中,28℃培养24h;取5mL菌液转移至50mL新鲜的LB液体培养基(含60mg/L的庆大霉素和100mg/L的卡那霉素),28℃继续培养,至菌液OD600达到0.6左右;将菌液转移至离心瓶或离心管中,室温条件下,转速为4000rpm离心10min,去除上清液收集菌体;加入相同体积的渗透缓冲液(10mM MES pH5.6,10mM MgCl2,2%(w/v)sucrose and 150mM acetosyringone)重悬;将葡萄叶片置于适量的重悬液中,置于水式真空循环泵中进行抽真空处理,当真空泵压强指针为0.085MPa时开始计时,30min后缓慢释放气体;将处理好的葡萄叶片取出,用灭过菌的滤纸除去叶片表面的菌液,将叶片远轴面朝上置于托盘中,叶柄用脱脂棉保湿,托盘用保鲜膜覆盖,置于培养箱中培养。
试验例
1、葡萄抗病相关基因VvPUB21在葡萄中的表达模式分析
为了证实VvPUB21基因参与抗病反应的调控,采用荧光定量PCR(Real-time PCR)技术分析VvPUB21基因在葡萄叶片接种白粉菌后的表达模式。接种方法按照Wang的方法(Wang Y等,Vitis34:159-164),SDS/酚法提取接种白粉菌后不同时间(0,12,24,36,48,60,72h)葡萄叶片的总RNA,按PrimeScriptTMRT-PCR Kit说明书(购自TAKARA公司)进行反转录,7个不同时间的反转录产物作为Real-time PCR模板,检测葡萄VvPUB21基因对葡萄叶片接种白粉菌后的响应。Real-time PCR采用SYBR Premix Ex TMTaq II试剂盒(购自TAKARA公司),并按照试剂盒说明书,在iCycler iQ5Real-time PCR仪(美国Bio-Rad公司)上进行实时定量PCR反应。反应体系为:模板1μL,SYBR Mix 12.5μL,正、反向引物各1μL,灭菌蒸馏水补齐至25μL;反应程序为:95℃5min,95℃30s,68℃30s,72℃30s,30个循环,72℃5min,4℃10min。P5、P6为VvPUB21基因扩增的正、反向引物,VvActin为内参基因,P7、P8为VvActin基因扩增的正、反向引物。
正向引物P5:5’-TGCTCTAACCATGCCTGTTC-3’(SEQ ID NO:7);
反向引物P6:5’-CATTTTTGCTGAGCTTCCAA-3’(SEQ ID NO:8)。
正向引物P7:5’-TCCTGTGGACAATGGATGGA-3’(SEQ ID NO:9);
反向引物P8:5’-CTTGCATCCCTCAGCACCTT-3’(SEQ ID NO:10)。
Thresh值按PCR仪默认为30,分别记录每个反应荧光信号由本底进入指数增长阶段的拐点所对应的循环数(threshold cycle,Ct),然后用2-△△Ct法以未接种白粉菌的叶片为对照,对不同时间点VvPUB21基因的相对表达量进行规一化。结果显示,VvPUB21基因在接种病原菌后12h表达量急剧增加,24h时表达量达到高峰,36~48h时表达量持续下降,48h表达量最低,随后表达量又急剧增加,在60h时又达到高峰,随后又呈下降趋势(见图1)。这说明VvPUB21基因是受葡萄白粉菌诱导表达的。
2、葡萄抗病相关基因VvPUB21抗病性的鉴定
1)葡萄抗病相关基因VvPUB21在拟南芥中抗病性鉴定
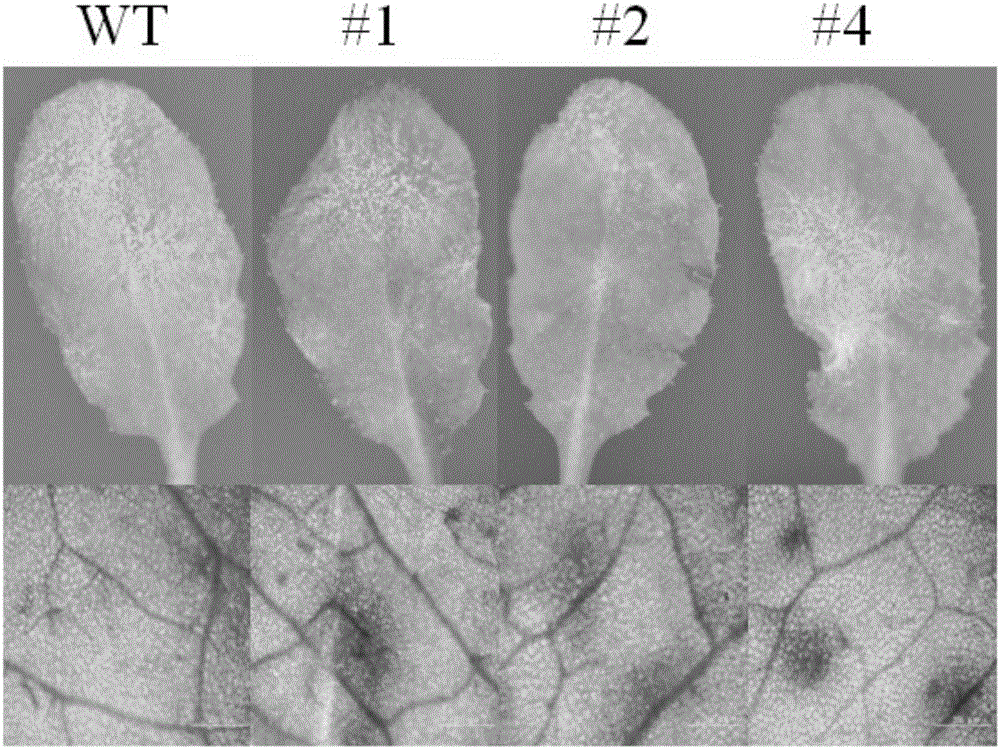
转化的拟南芥T3代转基因植株生长60天后进行抗病性鉴定。拟南芥白粉菌(Golovinomyces cichoracearum UCSC1)接种在pad4突变体植株上进行保存。选择生长一致的转基因植株,按照Wang的方法(WangW等,2007,Molecular Plant-Microbe Interactions20:966-976)接种白粉菌。接种6天后检测转基因植株与野生型植株对白粉病的抗病性,采用Trypan blue染色法检测细胞程序性死亡,结果如图2所示,3个转基因系相对于野生型更抗病,显示较轻的感病症状;3个转基因系植株叶片产生超敏反应,野生型植株没有或者产生轻微的超敏反应;以上结果说明超量表达VvPUB21基因导致拟南芥植株抗病性增强。图2中WT为野生型,#1、#2、#4为3个转基因系。
2)葡萄抗病相关基因VvPUB21在葡萄中抗病性鉴定
验证葡萄抗病相关基因VvSTS、VvPR1、VvPR10、VvNPR1在VvPUB21基因转化入葡萄叶片后的表达情况。VvPUB21基因瞬时转化葡萄叶片24h后,按照Wang的方法(Wang Y等,1995,Vitis34:159-164)接种白粉菌,接种完成后继续培养24h。以对葡萄叶片喷水处理作为对照,提取转化VvPUB21基因组与对照组葡萄叶片总RNA,用Real-time PCR技术检测葡萄抗病相关基因VvSTS、VvPR1、VvPR10和VvNPR1的表达。以P9、P10为VvSTS基因扩增的正、反向引物,P11、P12为VvPR1基因扩增的正、反向引物,P13、P14为VvPR10基因扩增的正、反向引物,P15、P16为VvNPR1基因扩增的正、反向引物,内参VvActin基因扩增的引物与试验例1中相同。
正向引物P9:5'-GAAACGCTCAACGTGCCAAGG-3’(SEQ ID NO:11);
反向引物P10:5'-GTAACCATAGGAATGCTATGTAGC-3'(SEQ ID NO:12)。
正向引物P11:5'-GGAGTCCATTAGCACTCCTTTG-3’(SEQ ID NO:13);
反向引物P12:5'-CATAATTCTGGGCGTAGGCAG-3’(SEQ ID NO:14)。
正向引物P13:5'-CCAACCAATCCTCCTCCTCTTC-3’(SEQ ID NO:15);
反向引物P14:5'-CATCTCCGTCAACCACAGTGTA-3’(SEQ ID NO:16)。
正向引物P15:5'-TCTCCGATTCCAACGACTTCAG-3’(SEQ ID NO:17);
反向引物P16:5'-CATCATCAACGCACGCACAA-3’(SEQ ID NO:18)。
PCR反应在iCycler iQ5Real-time PCR仪(美国Bio-Rad公司)上进行。以2-△△Ct法计算基因的相对表达量。结果如图3所示,在接种白粉菌后,转化的葡萄叶片中抗病相关基因VvSTS、VvPR1、VvPR10、VvNPR1相对于未转化的葡萄叶片其表达量显著增加(见图3),说明转化VvPUB21基因后葡萄叶片抗病相关基因表达量的上升,增强了转化植株的抗病性。
序列表
SEQUENCE LISTING
<110> 河南科技大学
<120> 葡萄抗病相关基因VvPUB21及其植物表达载体和应用
<170> PatentIn version 3.5
<211> 1820
<212> DNA
<213> 序列
<221> 葡萄抗病相关基因VvPUB21
<222> (1)..(1820)
<400> 1
GGGGATCATC AGTTTATTCA ATTGTTGAAC GCAAACCCAA CACCACAACT TGTAGATTTC 60
CTTCGTTTCC GAACTAATTA CCTAAATTTT CATACCGGTT ATTGGCAATG ATTTCTTCTT 120
GGAGAAGGCG GAGAGCTGGG CGGAGGGCAG CCAAGCTGCA GCAACACGCA GAAGATGATA 180
TTGGAAGCAT GGAATTGACT ACTCCTAATC ATTTTCGGTG TCCGATATCT CTGGACTTGA 240
TGAAAGATCC GGTTACATTG TCCACAGGGA TCACATATGA TCGTGAGAGC ATCGAGATGT 300
GGATTGAAGC CGGAAACCGG ACTTGCCCCA TTACCAACCA GGTGTTGAGG AGTCTGGAGC 360
CGATACCCAA TCACACAATT CGGAAGATGA TACAGGATTG GTGTGTCGAG AACCGGTCTT 420
TTGGGATTGA GAGGATCCCA ACGCCTCGAA TTCCTTTGAG TTCTGTCGAG GTTACAGATA 480
TACTTTCCAA GCTTAAGATG GCTTATCGGC GAGAGGATGA AGCTGGGTGC CGGGAGTTGG 540
TGGCAAAGAT GAAGTCAAAG GGGAAGGAAA GCGAGCGCAA CAAGCGATGC ATTGTTTCCA 600
ATGGGGCTGC TGGTGTTTTA TCAGCTGCAT TTGAAGCATT TCTCGAGCGC CCCTTTTCGA 660
TAAATATGTT GCAGTCTTGG AGGATATCTT GGCGGCTCTC CCTTGGATGT CTCCTCTTGA 720
TGGAAAAACC AAATCTTACC TTACCTCACC CGCCTCTTTT AAATTGTTTG GGATGGCTTT 780
TGAAGTTCTG GAAATTTGTC AGCCAAAAGG GAACCCTTTT TTCGACATTG AAAGAGCTAC 840
TTTCTTCAGA TAAACGAAAG GTGTATGCTT TGTCTGAGAT AGAAGGAGCG AAAGAAGCGT 900
TGGTGAAGCT CGTCAAAGAG CCCATTTGCC CTACTGCAAC AAAAACTTCA TTGGTGGTCA 960
TCTTCCATAT GGTTTCATCA TCTCCTTCAA ATGAAGATAC CAAAGTAAGG TTTGTCGAGA 1020
TGGGGTTAGT GGAGCTGCTC CTAGAACTAC TGGTGGACTC TGAGAAAAGC GTATGCGAGA 1080
AGGCATTGGG TGTTCTTGAT GGCATTTGCG GCTGCGAGGA AGGGAGGGAA AAGGCCTACG 1140
GCCATGCTCT AACCATGCCT GTTCTGGTTA AGAAGTTATT GCGCGTTTCT GATTTGGCTA 1200
CCGAGTTCTC AGTTTCCATC CTTTGGAAGC TCAGCAAAAA TGAGAAGAGG GAAGATGGAA 1260
GCGTCCTTGT TGAAGCTCTT CAAGTGGGTG CTTTTCAGAA GCTCTTGTTG CTCTTACAGG 1320
TTGGATGCTC TGACCGAACA AAGGAGAAGG CGACTGAGTT GTTGAAATTG TTGAACATTC 1380
ATAGGGAGAG GTTGGAGTGC ATTGACTCGA TGGATTTCAA GGATCTCAAA AGGCCTTTTT 1440
GATCAATCCA ATACCCAAAA TCAGTAGTTT TAGAGAGAAG TTTAAAGGGT ATTTCTCATG 1500
ATTTACAGTT CAATGTACAA AATACGAAAC ATACTTAGGA TAAATGCCAT TGAAATTCTT 1560
ACAAATAATT CTCTGCAAGA AGGCCCAAAG GTCTATTATG TGATTTCGAA GTTCTCTTGG 1620
TTTGCGACGA GTGCTTGATA TATATGTTTC AGTTAAACTG GTTTTGATCT TAATTTGAGA 1680
AATTGTACCA CCGATAATAA ATCATTGCCA AAGATATGTC ATTTTACATA TTTCTTTTAA 1740
ATGATGGCCT AGCTCAAGGA CGCTGTTATT AGAGAAATAT CATCTTGTCC TCCGATCAAT 1800
CTGTGTCATG TTGAGGCCGA 1820
<211> 444
<212> PRT
<213> 序列
<221> 葡萄抗病相关基因VvPUB21编码的蛋白质
<222> (1)..(444)
<400> 2
MISSWRRRRA GRRAAKLQQH AEDDIGSMEL TTPNHFRCPI SLDLMKDPVT LSTGITYDRE 60
SIEMWIEAGN RTCPITNQVL RSLEPIPNHT IRKMIQDWCV ENRSFGIERI PTPRIPLSSV 120
EVTDILSKLK MAYRREDEAG CRELVAKMKS KGKESERNKR CIVSNGAAGV LSAAFEAFLE 180
RPFSINMLQS WRISWRLSLG CLLLMEKPNL TLPHPPLLNC LGWLLKFWKF VSQKGTLFST 240
LKELLSSDKR KVYALSEIEG AKEALVKLVK EPICPTATKT SLVVIFHMVS SSPSNEDTKV 300
RFVEMGLVEL LLELLVDSEK SVCEKALGVL DGICGCEEGR EKAYGHALTM PVLVKKLLRV 360
SDLATEFSVS ILWKLSKNEK REDGSVLVEA LQVGAFQKLL LLLQVGCSDR TKEKATELLK 420
LLNIHRERLE CIDSMDFKDL KRPF 444
<211> 27
<212> DNA
<213> 序列
<221> 正向引物P3
<222> (1)..(27)
<400> 3
GGGGATCATC AGTTTATTCA ATTGTTG 27
<211> 26
<212> DNA
<213> 序列
<221> 反向引物P4
<222> (1)..(26)
<400> 4
TCGGCCTCAA CATGACACAG ATTGAT 26
<211> 35
<212> DNA
<213> 序列
<221> 正向引物P1
<222> (1)..(35)
<400> 5
GGGAGATCTA TGATTTCTTC TTGGAGAAGG CGGAG 35
<211> 35
<212> DNA
<213> 序列
<221> 反向引物P2
<222> (1)..(35)
<400> 6
GGGGGTGACC TCAAAAAGGC CTTTTGAGAT CCTTG 35
<211> 20
<212> DNA
<213> 序列
<221> 正向引物P5
<222> (1)..(20)
<400> 7
TGCTCTAACC ATGCCTGTTC 20
<211> 20
<212> DNA
<213> 序列
<221> 反向引物P6
<222> (1)..(20)
<400> 8
CATTTTTGCT GAGCTTCCAA 20
<211> 20
<212> DNA
<213> 序列
<221> 正向引物P7
<222> (1)..(20)
<400> 9
TCCTGTGGAC AATGGATGGA 20
<211> 20
<212> DNA
<213> 序列
<221> 反向引物P8
<222> (1)..(20)
<400> 10
CTTGCATCCC TCAGCACCTT 20
<211> 21
<212> DNA
<213> 序列
<221> 正向引物P9
<222> (1)..(21)
<400> 11
GAAACGCTCA ACGTGCCAAG G 21
<211> 24
<212> DNA
<213> 序列
<221> 反向引物P10
<222> (1)..(24)
<400> 12
GTAACCATAG GAATGCTATG TAGC 24
<211> 22
<212> DNA
<213> 序列
<221> 正向引物P11
<222> (1)..(22)
<400> 13
GGAGTCCATT AGCACTCCTT TG 22
<211> 21
<212> DNA
<213> 序列
<221> 反向引物P12
<222> (1)..(21)
<400> 14
CATAATTCTG GGCGTAGGCA G 21
<211> 22
<212> DNA
<213> 序列
<221> 正向引物P13
<222> (1)..(22)
<400> 15
CCAACCAATC CTCCTCCTCT TC 22
<211> 22
<212> DNA
<213> 序列
<221> 反向引物P14
<222> (1)..(22)
<400> 16
CATCTCCGTC AACCACAGTG TA 22
<211> 22
<212> DNA
<213> 序列
<221> 正向引物P15
<222> (1)..(22)
<400> 17
TCTCCGATTC CAACGACTTC AG 22
<211> 20
<212> DNA
<213> 序列
<221> 反向引物P16
<222> (1)..(20)
<400> 18
CATCATCAAC GCACGCACAA 20
- 还没有人留言评论。精彩留言会获得点赞!